一株高产乙酸乙酯酵母的鉴定及产酯条件的研究
钟姝霞,万世旅,边名鸿*,刘茗铭,杨贇,颜超
(1.四川理工学院生物工程学院,四川自贡643000;2.酿酒生物技术及应用四川省重点实验室,四川自贡643000;3.四川威斯特分析测试有限公司,四川成都610101)
一株高产乙酸乙酯酵母的鉴定及产酯条件的研究
钟姝霞1,2,万世旅3,边名鸿1,2*,刘茗铭1,杨贇1,颜超1
(1.四川理工学院生物工程学院,四川自贡643000;2.酿酒生物技术及应用四川省重点实验室,四川自贡643000;3.四川威斯特分析测试有限公司,四川成都610101)
以不同酒曲中筛选出的一株产乙酸乙酯能力较强的酵母Y2为研究对象,利用磷脂脂肪酸分析和分子生物学方法对其进行鉴定,通过单因素试验分别考察培养方式、发酵时间、发酵温度和糖化液糖度4个因素对酵母Y2产酯能力的影响,采用正交试验和验证试验对酵母Y2的产酯条件进行优化。结果表明,酵母Y2为异常毕赤酵母(Pichia anomala),其脂肪酸成分以18∶1ω9c为主;发酵温度和发酵时间对酵母菌株Y2产酯量具有显著性影响(P<0.05),优化后的产酯条件为:发酵温度28℃,高粱糖化液糖度12°Bx,静置培养5 d;在此最优条件下,酵母Y2产乙酸乙酯的量可达到3.47 g/L。
酒曲;鉴定;异常毕赤酵母;乙酸乙酯;优化
酯类物质在白酒香气形成过程中起到重要的作用,它既是香气的组成成分,又是区别白酒与其他蒸馏酒不同的地方。产酯酵母是可生成较多量酯类物质的酵母的通称[1-2],具有不同程度的酯化能力[3]。近几年,对产酯酵母的研究愈加成熟[4-6],余伟民等[4]采用在入窖前的糟醅中添加生香酵母的方法,考察添加后的酒体中总酯、四大乙酯等成分变化,其总酯、四大乙酯等均有较大的增幅,特香型白酒酒体风格不变,酒体变得醇厚,酒质得到了提高。
乙酸乙酯是我国白酒中含量较多的香味物质之一,对白酒的风格及成型具有重要的作用。乙酸乙酯是浓香型白酒四大骨架酯之一,也是清香型白酒的主体呈香呈味物质[7]。但关于产酯酵母的代谢机理尚不清楚,相关报道较少。普遍认为乙酸乙酯是在酵母细胞内合成的,而不是在培养基中由酯化作用生成的,因此酵母菌健壮与否对酯的生成有着密切的关系。本试验以西南各地区的酒曲样品中筛选出的一株高产乙酸乙酯酵母菌株Y2为研究对象,利用磷脂脂肪酸(phospholipid fatty acid,PLFA)分析和分子生物学方法对其进行鉴定,并通过单因素和正交试验优化其产酯条件,以期能为小曲的制曲提供优良的菌种,提高和稳定小曲酒的风味,改善酒质,提高优酒率。同时,促进小曲酒的发展,提高小曲酒生产企业的经济效益和市场竞争力。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
从不同酒曲中筛选出的一株产乙酸乙酯能力较强的酵母Y2。
1.1.2 主要试剂
醋酸钠、氯化钾、无水乙醇、酚酞、氯仿、异戊醇、浓硫酸、浓盐酸、氯化钠、氢氧化钠(均为分析纯):成都市科龙化工试剂厂;糖化酶(50000U/g)、淀粉酶(50000U/g)、蛋白胨、酵母浸膏(均为生化试剂):北京奥博星生物技术有限责任公司;甲醇(色谱纯):德国Darmstadt公司;正己烷(色谱纯):美国Fisher Scientific公司;甲基叔丁醚(色谱纯):瑞典Telia公司;琼脂糖:北京索莱宝科技有限公司;dNTPs、Taq DNA polymerase、TaKaRaTaqTM、DL2000TMDNA Marker:宝生物工程(大连)有限公司;真菌26S rDNA通用引物ITS1:TCCGTAGGAACCTGCGG和ITS4:TCCTCCGCTTATTGATATGC:英潍捷基生物技术上海公司合成;十六烷基三甲基溴化铵(cetyl trimethyl ammonium bromide,CTAB)、Tris-饱和酚、十二烷基硫酸钠(sodium dodecyl sulfate,SDS):美国Sigma-Aldrich公司。
1.1.3 培养基
菌种活化培养基:葡萄糖2%,酵母膏1%,蛋白胨2%,pH自然。
沙氏葡萄糖琼脂培养基:蛋白胨10.0 g/L,葡萄糖40.0 g/L,琼脂15 g/L,pH值5.6±0.2。
发酵产酯培养基[8]:取150g高梁粉于2L烧杯中,加入少量自来水,搅成糊状,再加80℃左右热水600mL,搅匀。用体积分数20%硫酸溶液调节pH值至6.0~6.5,加入80U/g α-淀粉酶于高粱液中,搅匀,置于75℃恒温水浴锅中液化30min,补足水至1200mL。将烧杯中的糖化液转移到三角瓶中,高压灭菌,待压力升至0.1MPa后,保压1 h,取出冷却至60℃,用体积分数20%硫酸溶液调节pH值至4.5,加入150 U/g糖化酶于高梁液中,然后放入60℃恒温水浴锅保温糖化1h,煮沸5min。取出,室温条件下5000r/min离心10min,取上清液备用。
1.2 仪器与设备
E100生物显微成像系统:日本NIKON公司;6890N气相色谱仪:美国Agilent科技有限公司;Sherlock 6.0微生物鉴定系统:美国MIDI公司;DM3000正置生物显微镜:德国徕卡公司;HT300A固相微萃取仪:意大利HTA公司。
1.3 试验方法
1.3.1 产酯酵母的磷脂脂肪酸分析
将活化好的酵母以四区划线法接种于沙氏葡萄糖琼脂培养基上,在28℃条件下培养24h后提取磷脂脂肪酸。主要步骤为:挑取第三区的单菌落(约40mg)于有螺旋盖的试管底部,加入1 mL皂化试剂(45 g氢氧化钠溶于300mL体积分数为50%的甲醇溶液),拧紧螺盖沸水浴5min,取出振荡5~10 s,再度拧紧螺盖,继续沸水浴25 min;待样品管冷却后,加入2mL甲基化试剂(97.5mL浓盐酸、137.5mL甲醇溶于65 mL蒸馏水),盖严振荡,(80±1)℃水浴10 min,冷水浴冷却至25℃(温度与时间要严格控制,以免羟基酸和环式脂肪酸受到破坏);在冷却的样品管中加入1.25 mL甲基叔丁基醚,快速振荡10 min,弃去下层水相;在剩余有机相中加入3 mL碱洗涤液(0.3 mol/L NaOH溶液),快速振荡5 min,加3~4滴饱和氯化钠溶液,取2/3上层有机相至气相色谱样品瓶中备用,用于气相检测。将待检样品于气相色谱仪上机进样鉴定,气相色谱各参数由MIDI Sherlock程序设置调用,将所得的磷脂脂肪酸信息与MIDI Sherlock中的YST28 3.80库进行比对,鉴定样品中微生物的种类[9]。
1.3.2 产酯酵母的分子鉴定
采用改良的CTAB法[10]提取酵母Y2菌株DNA。
将提取的DNA送往上海杰李生物用真菌26S rDNA通用引物ITS1和ITS4进行聚合酶链反应(polymerase chain reaction,PCR)扩增并鉴定。
PCR扩增体系(50μL):ddH2O33.5μL,10×buffer5μL,dNTP 4 μL,引物各1 μL,模板5 μL,Taq0.5 μL。
PCR扩增程序:94℃预变性5.0 min;94℃变性0.5 min,55℃退火0.5 min,72℃延伸1.0 min);30个循环72℃延伸7.0 min。
1.3.3 产酯条件单因素试验设计
酵母Y2种子液制备:在无菌条件下挑取纯菌种至100 mL菌种活化培养基,30℃、100 r/min培养72 h,得到酵母Y2种子液。
用高粱糖化液作为发酵培养基,将活化好的酵母种子液按10%(V/V)的接种量于发酵产酯培养基中,考察高粱糖化液糖度(6°Bx、8°Bx、10°Bx、12°Bx、14°Bx)、发酵温度(22℃、25℃、28℃、31℃、34℃)、培养时间(2d、3d、4d、5d、6 d)和培养方式(摇床转速50 r/min、100 r/min、150 r/min、静置)4个因素对酵母菌株Y2产乙酸乙酯量的影响,确定较优的产酯条件。
1.3.4 正交试验设计
在单因素试验基础上,按L9(33)进行正交试验设计[11],考察发酵温度、发酵时间、高粱糖化液糖度3个因素对酵母菌株Y2产乙酸乙酯量的影响,确定最佳产酯条件。正交试验因素与水平见表1。

表1 酵母Y2发酵产酯条件优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for esterproducing conditions optimization of yeast Y2
1.3.5 乙酸乙酯含量的测定[12-14]
将发酵液用定性滤纸过滤除去菌体和沉淀,收集滤液后用0.45 μm微孔滤膜过滤,准确量取过滤后的发酵液100 mL于蒸馏瓶中,并加入50 mL水蒸馏,收集100 mL馏出液,按GB/T 10345—2007《白酒分析方法》中规定的方法测定馏出液中乙酸乙酯的含量。
1.3.6 数据分析
利用SPSS 19.0软件对数据进行方差分析(采用一般线性模型单因素Duncan法),检测结果用平均值±标准差表示,所得数据在Origin 8.0中编辑作图。
2 结果与分析
2.1 产酯酵母的磷脂脂肪酸分析
脂类物质是构成生物细胞膜的主要成分,且在细胞中含量稳定[15-16],约占细胞干质量的5%[17]。通常这些脂类物质的组成和含量在同一种微生物中是稳定的和可遗传的[18]。磷脂是一类含有磷酸的脂类物质。磷脂脂肪酸即为甲基化脂类物质并提取磷脂成分后,所得到的脂肪酸产物,它具有属的特异性,通过磷脂脂肪酸的组成和含量的差异可对纯种培养的微生物进行快速鉴定。酵母Y2的磷脂脂肪酸分析和鉴定结果分别见表2、表3。由表2可知,酵母Y2的脂肪酸以长链不饱和脂肪酸为主,其中含量最多的为18∶1ω9c(41.89%),该脂肪酸为真菌的一种标志脂肪酸。由表3可知,通过与酵母库YST28 3.80比对发现酵母Y2与第一选择毕赤酵母(Pichia)相似值为0.331,与第二选择Candida castrensis的相似值为0.214,说明酵母Y2可能为Pichia的一种非典型菌种[9]。

表2 酵母Y2的脂肪酸组成Table 2 Fatty acids composition of yeast Y2
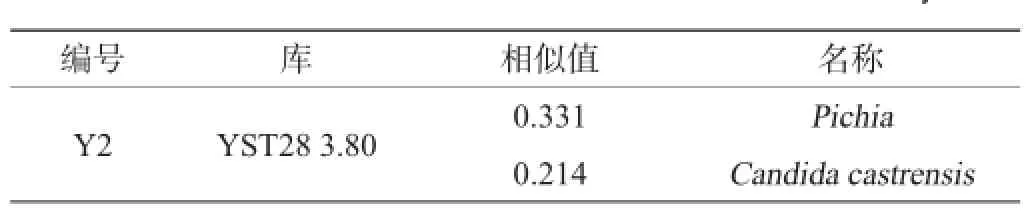
表3 MIDI微生物鉴定系统鉴定结果Table 3 Identification results of MIDI microbial identification system
2.2 产酯酵母的分子鉴定
为进一步确定酵母菌株Y2的种属,利用引物ITS1和ITS4对酵母菌株Y2的26S rDNA-ITS序列进行PCR扩增,并对扩增序列测序,用BLAST将测序结果与GenBank数据库中的序列进行比较并构建系统发育树见图1。由图1可知,酵母菌株Y2与异常毕赤酵母(Pichia anomala)聚在一簇的相似度为100%,表明酵母菌株Y2属于Pichia anomala。
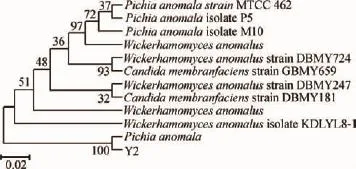
图1 菌株Y2的26S rDNA-ITS序列系统发育树Fig.1 Phylogenetic tree of 26S rDNA-ITS sequence of yeast Y2
2.3 单因素试验结果
2.3.1 不同培养方式对酵母菌株Y2产酯的影响
考察培养方式对酵母菌株Y2产乙酸乙酯含量的影响,结果如图2所示。
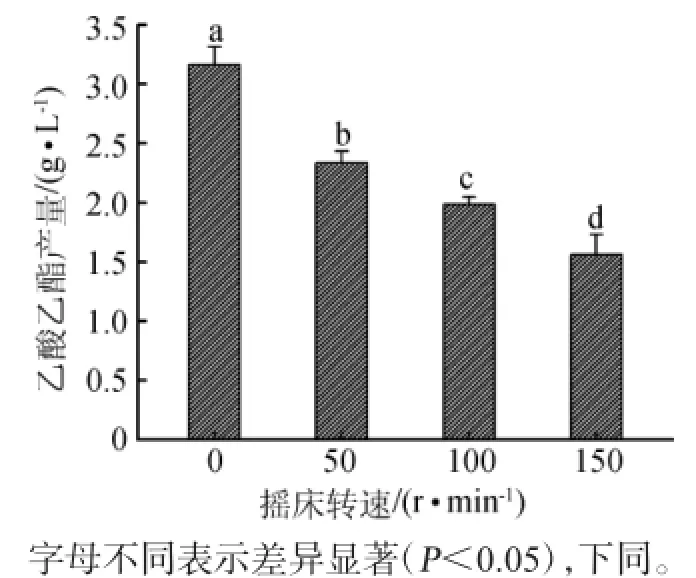
图2 不同摇床转速对酵母Y2产乙酸乙酯的影响Fig.2 Effects of different shaking table revolution on ethyl acetate production by yeast Y2
由图2可知,随着转速的增加,乙酸乙酯产量呈明显地下降趋势(P<0.05),而静置培养的产酯能力明显高于摇床培养,在此培养方式下,乙酸乙酯产量达到3.16 g/L,原因可能是由于通气量过大使酵母呼吸旺盛,加速了乙酸乙酯的分解[1]。同时在空气充足的条件下,酵母以生长繁殖为主。由此可知,虽然产酯酵母产酯需要一定量的空气,但不宜过多。因此,对酵母菌株Y2采用静置培养。
2.3.2 高粱糖化液糖度对酵母菌株Y2产酯的影响
考察高粱糖化液糖度对酵母菌株Y2产乙酸乙酯的影响,结果如图3所示。
由图3可知,随着糖化液糖度的增加,酵母Y2产乙酸乙酯量呈先增加后减少的趋势,在糖化液糖度为10°Bx时产乙酸乙酯效果最佳,达到3.42 g/L。这说明一定范围内糖度增加对产酯有一定的促进作用,但过后随着糖度增加,其渗透压增大,产酯量随之下降。同时,高粱糖化液糖度为8°Bx、10°Bx和12°Bx时,其差异不显著,因此选择这三个糖度进行后续试验。
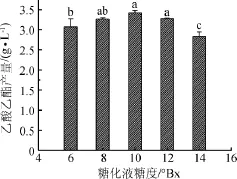
图3 糖化液糖度对酵母Y2产乙酸乙酯的影响Fig.3 Effect of saccharification liquid sugar content on ethyl acetate production by yeast Y2
2.3.3 发酵温度对产酯的影响
考察发酵温度对酵母菌株Y2产乙酸乙酯的影响,结果如图4所示。

图4 发酵温度对酵母Y2产乙酸乙酯的影响Fig.4 Effect of fermentation temperature on ethyl acetate production by yeast Y2
由图4可知,随着发酵温度的升高,酵母菌株Y2产乙酸乙酯酯量呈先增加后降低,在发酵温度为28℃时,乙酸乙酯产量最高,达3.34 g/L。酵母酯化酶活力对温度具有较高的依赖性,温度的变化对酯化酶的作用有很大的影响。因此,选择25℃、28℃和31℃进行后面的正交试验。
2.3.4 发酵时间对产酯的影响
考察发酵时间对酵母菌株Y2产乙酸乙酯的影响,结果如图5所示。
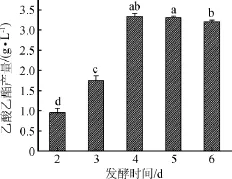
图5 发酵时间对酵母Y2产乙酸乙酯的影响Fig.5 Effect of fermentation time on ethyl acetate production by yeast Y2
由图5可知,酵母菌株Y2产乙酸乙酯的量随着发酵时间的增加呈先增加后稍微降低的趋势。在发酵初期,酵母正处在生长繁殖的高峰,乙酸乙酯合成量较少。随后酯的合成旺盛,酯迅速积累,当发酵时间为4 d时,乙酸乙酯的产量达到最大值,为3.34 g/L;到第4天后趋于稳定。其原因是酯的生成和分解是同时进行的,4 d过后酯的分解速度加快。因此,选择发酵时间4 d为宜。
2.4 酵母菌株Y2产酯工艺的优化
根据单因素试验结果,设计L9(33)正交试验进行产酯发酵条件优化,以乙酸乙酯的产量为评价指标,选择发酵温度、发酵时间和高粱糖化液糖度3个因素,研究其对酵母菌株Y2产酯的影响,确定最佳的产酯工艺条件,正交试验结果与分析见表4,方差分析结果见表5。
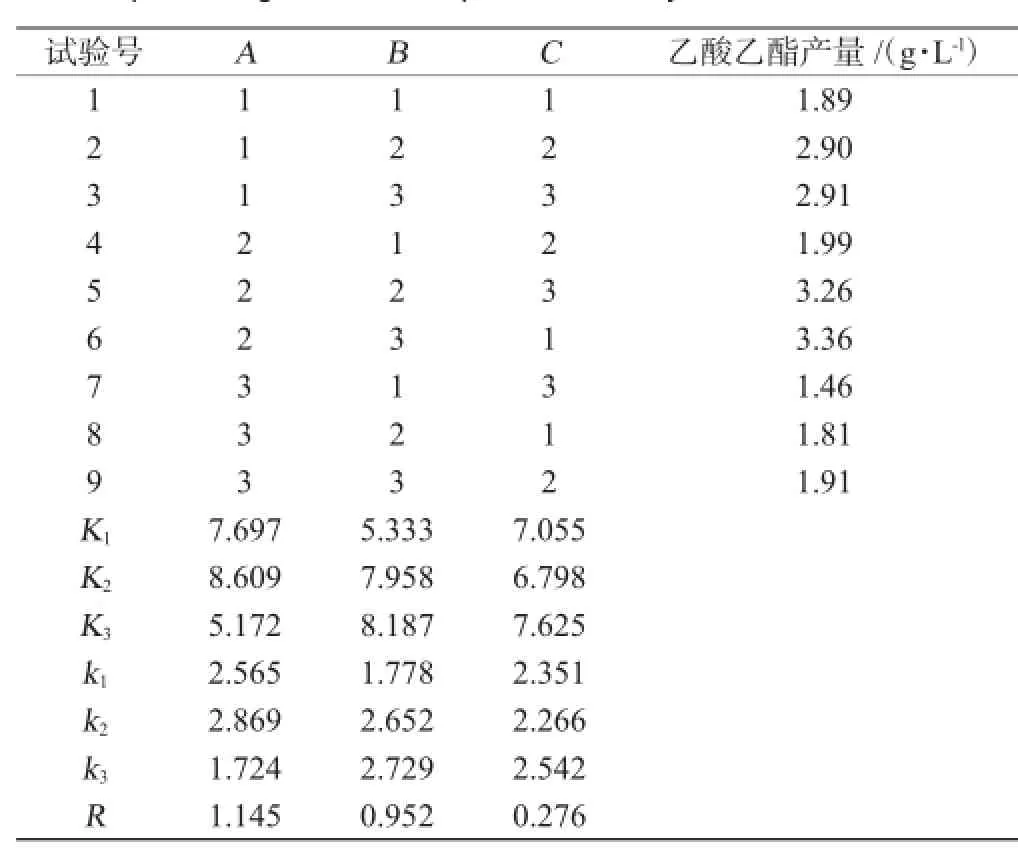
表4 酵母Y2发酵产酯条件优化正交试验结果与分析Table 4 Results and analysis of orthogonal experiments for esterproducing conditions optimization of yeast Y2
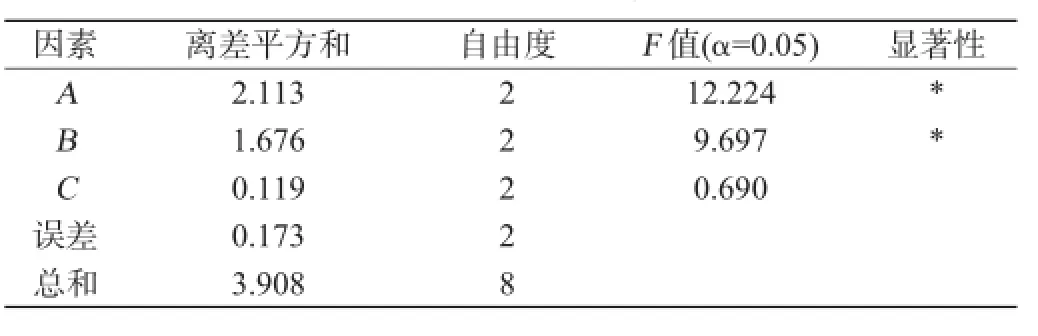
表5 正交试验结果方差分析Table 5 Variance analysis of orthogonal tests results
由表4可知,各影响因素对酵母Y2产酯的影响程度为RA>RB>RC,即发酵温度>发酵时间>高粱糖化液糖度。综合分析得到产酯最佳方案为A2B3C3,即发酵温度28℃,发酵时间5 d,高粱糖化液糖度12°Bx。
由表5可知,发酵温度和发酵时间对酵母菌株Y2产酯具有显著性影响(P<0.05),高粱糖化液糖度对酵母菌株Y2产酯的影响不显著(P>0.05)。
2.5 验证试验
通过单因素试验和正交试验获得酵母菌株Y2产酯的最佳工艺条件为:发酵温度28℃,高粱糖化液糖度12°Bx,静置培养5 d。在该优化产酯条件下,通过3次验证试验,得到酵母菌株Y2产乙酸乙酯的量为3.47 g/L。
3 结论
本研究以酒曲中筛选得到一株高产乙酸乙酯的酵母菌株Y2为研究对象,经PLFA和分子生物学对其进行鉴定。结果表明,酵母菌株Y2为异常毕赤酵母(Pichia anomala),并采用单因素试验和正交试验对酵母菌株Y2产乙酸乙酯发酵条件进行了优化,确定了酵母菌株Y2最佳的产酯条件为发酵温度28℃,高粱糖化液糖度12°Bx,静置培养5 d。在此最优产酯条件下,酵母菌株Y2产乙酸乙酯的量可达到3.47 g/L。在今后的研究中,可利用基因工程技术、原生质体融合技术、诱变育种技术等高新技术来提高酵母的产酯能力,协调各香味物质的比例,以达到理想的产香效果。
[1]刘源才,郭圣祥,李锐利,等.高产乙酸乙酯酵母的产酯条件研究[J].食品与发酵科技,2011,47(2):22-24.
[2]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,1998:117-121.
[3]范广璞.生香酵母的培养方法及在白酒生产中的应用[J].江苏食品与发酵,2008(1):23-25.
[4]余伟民,徐小明,林培,等.生香酵母对特香型白酒风味风格的影响研究[J].酿酒科技,2012(1):24-27.
[5]万世旅,李光辉,钟姝霞,等.酒曲中产酯酵母的分离筛选[J].四川理工学院学报:自然科学版,2015,28(6):16-19.
[6]王益姝,钱超,黄卫宁,等.梅兰春酒醅中生香酵母的分离鉴定及其发酵面包香气成分分析[J].食品与发酵工业,2016,42(9):45-51.
[7]王涛,李谨萌,游玲,等.浓香型白酒酿造相关酵母与发酵糟醅中乙酸乙酯和乙酸的相关性[J].食品工业科技,2014,35(8):184-187.
[8]WU Q,XU Y,CHEN L.Diversity of yeast species during fermentative process contributing to Chinese Maotai-flavour liquor making[J].Soc Appl Microbiol,2012(55):301-307.
[9]刘波.微生物脂肪酸生态学[M].北京:中国农业科学技术出版社,2011:28-37.
[10]LIPTHAY J R D,ENZINGER C,JOHNSEN K,et al.Impact of DNA extraction method on bacterial community composition measured by denaturing gradient gel electrophoresis[J].Soil Biol Biochem.2004,36 (10):1607-1614.
[11]宋韡,吕利华,赵良启.异常汉逊酵母发酵乙酸乙酯条件优化和代谢研究[J].中国酿造,2011,30(1):116-119.
[12]中华人民共和国国家质量监督检验检疫总局.GB/T 10345—2007白酒分析方法[S].北京:中国标准出版社,2007.
[13]胡家俊,李锐利,陈茂彬,等.高产乙酸乙酯酵母的菌种选育[J].食品与发酵科技,2010,46(6):81-83.
[14]廖永红,沈晗,石文娟,等.产香酵母碳源利用及发酵产香特性初步研究[J].食品与发酵工业,2010,36(2):1-7.
[15]FROSTEG□RD□,TUNLID A,B□□TH E.Use and misuse of PLFA measurements in soils[J].Soil Biol Biochem,2011,43(8):1621-1625. [16]HWANG H H,WU E T,LIU S Y,et al.Characterization and host range of five tumorigenicAgrobacterium tumefaciensstrains and possible application in plant transient transformation assays[J].Plant Pathol, 2013,62(6):1384-1397.
[17]张秋芳,刘波,林营志,等.土壤微生物群落磷脂脂肪酸PLFA生物标记多样性[J].生态学报,2009,29(8):4127-4137.
[18]刘琨毅,卢中明,郑佳,等.浓香型白酒窖泥微生物群落PLFA指纹图谱方法[J].应用与环境生物学报,2012(5):831-837.
Identification and ester-producing conditions of a high ethyl acetate-producing yeast
ZHONG Shuxia1,2,WAN Shilv3,BIAN Minghong1,2*,LIU Mingming1,YANG Yun1,YAN Chao1
(1.School of Biotechnology Engineering,Sichuan University of Science&Engineering,Zigong 643000,China;2.Liquor Making Bio-Technology&Application of Key Laboratory of Sichuan Province,Zigong 643000,China;3.Sichuan Swat Analyze and Test Limited Company,Chengdu 610101,China)
Using a high ethyl acetate-producing yeast strain Y2 screened from differentJiuquas research object,the yeast Y2 was identified by phospholipid fatty acid analysis and molecular biology methods.The effects of culture mode,fermentation time,fermentation temperature,and saccharification liquid sugar content on ester-producing ability of yeast Y2 were investigated by single factor experiment.The ester-producing conditions of yeast Y2 were optimized by orthogonal experiments and verification experiments.Results indicated that yeast Y2 wasPichia anomala, the main fatty acid composition was 18∶1ω9c,fermentation temperature and time had significant effect on ester yield of yeast Y2(P<0.05).The optimum ester-producing conditions were as follows:fermentation temperature 28℃,sugar content of sorghum saccharification liquid 12°Bx,static culture for 5 d,in the optimum conditions,the ethyl acetate yield of yeast Y2 could reach 3.47 g/L.
Jiuqu;identification;Pichia anomala;ethyl acetate;optimization
TS261.1
0254-5071(2017)02-0075-05
10.11882/j.issn.0254-5071.2017.02.016
2016-09-01
酿酒生物技术及应用四川省重点实验室开放基金项目(NJ2013-03)
钟姝霞(1990-),女,硕士研究生,研究方向为发酵工程。
*通讯作者:边名鸿(1979-),女,副教授,硕士,研究方向为发酵工程。

