酱香型大曲中产蛋白酶放线菌的分离及产酶条件研究
于华,黄丹*,陈卓,唐姣,毛祥,邓玲,刘丹,吕开斌
(四川理工学院生物工程学院,四川自贡643000)
酱香型大曲中产蛋白酶放线菌的分离及产酶条件研究
于华,黄丹*,陈卓,唐姣,毛祥,邓玲,刘丹,吕开斌
(四川理工学院生物工程学院,四川自贡643000)
对酱香型大曲中高产蛋白酶的放线菌进行分离鉴定,并对其产酶特性进行研究。通过稀释涂布划线法和平皿生化反应法对目的菌株进行分离纯化,并运用形态学特征和遗传学特征对目的菌株进行鉴定。并对目的菌株的产酶条件进行优化。结果显示,分离出的菌株经分子生物学鉴定为娄彻氏链霉菌(Streptomyces rochei),经单因素与正交试验优化得出的最佳发酵条件为pH值9.0,发酵温度35℃,转速180 r/min,此时酶活力最高为28.62 U/mL。
酱香型;蛋白酶;放线菌;大曲
酱香型白酒亦称茅台香型白酒,以茅台酒为代表。其生产工艺独特,其中最重要的一点就是用曲量大,占酿酒原料的85%~95%,因此大曲质量与酒的风味密切相关[1]。酱香型大曲是采用富含蛋白质的谷物为主要原料,以开放式培养的制曲工艺制成,形成独特的微生物群落体系,并产生糖化酶、液化酶、蛋白酶、脂肪酶等酶系[2-3]。这些酶系不仅仅影响到白酒酿造过程中微生物的代谢,同时也和白酒中风味物质的生成和风格特征的形成有着密不可分的联系[4]。其中,蛋白酶可将蛋白质原料进行降解,转化为一些小分子物质(如氨基酸等),这些物质是酱香型白酒风格中特殊香型的前体[5]。
酱香型大曲中的微生物主要包括细菌、酵母菌、霉菌和放线菌四大类[6],其中放线菌可产生淀粉酶、蛋白酶等多种酶,此外,由于放线菌具有强大的产活性物质的能力,使得固态发酵过程中放线菌的次生代谢产物种类具有多样性,这些代谢产物对白酒酿造环境中其他微生物的生长代谢及白酒质量都有较大的影响。因此对产蛋白酶放线菌的研究就显得十分必要。本研究从酱香型大曲中筛选出产蛋白酶能力强的放线菌,并进行分子生物学鉴定,通过探讨产酶的影响因素,得到最优产酶条件,分析其代谢产物,以期为白酒酿造过程中风味物质的形成提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
酱香型成品高温大曲:四川某厂取样。
硫酸镁、葡萄糖、柠檬酸、乙酸钠、磷酸氢二钾、氯化钠、邻苯二甲酸氢钾、L-酪氨酸、干酪素、三氯乙酸、磷酸氢二钠、硫酸亚铁、无水氯化钙、磷酸:成都市科龙化工试剂厂;硫酸锰:重庆吉元化学有限公司;盐酸:重庆川东化工集团有限公司。以上药品均为分析纯。
1.1.2 培养基
酪蛋白培养基(分离培养基):Na2HPO4·7H2O 1.07 g,KH2PO40.36 g,酪蛋白4 g,ZnCl20.014 g,NaCl 1.2 g,CaCl20.002 g,MgSO4·7H2O 0.5 g,FeSO40.02 g,琼脂20 g,蒸馏水1 000 mL,121℃灭菌20 min。
牛肉膏蛋白胨琼脂培养基:蛋白胨10 g,牛肉膏3 g,氯化钠5 g,琼脂20 g,蒸馏水1 000 mL,121℃灭菌20 min。
发酵培养基:用干磨机将小麦皮打破,然后按小麦∶麸皮∶水=4∶1∶40的比例于沸水浴2 h,121℃灭菌20 min。
1.2 仪器与设备
250HL恒温恒湿培养箱:金坛市医疗仪器厂;SW-CJIFD单人单面净化工作台:苏州净化设备有限公司;SYQ-DSX-280B立式自动压力蒸汽灭菌锅:上海申安医疗器械厂;TW3-2000电炉:四川成都市聚森电器厂;CP214电子天平:奥豪斯仪器(上海)有限公司;VG-3涡旋振荡器:德国IKA集团;DZKW-4电子恒温水浴锅、DHG-9070A电热恒温鼓风干燥箱:北京中兴伟业仪器有限公司;HF1500酶标仪:美国Thermo公司;Universal 32R高速冷冻离心机:德国Hettich科学仪器公司;DYY-III8电泳仪:北京六一仪器厂;ChemiDocXRS+化学发光成像系统、C1000 Touch PCR仪:美国Bio-Rad公司;7890A气相色谱-5975C质谱联用仪:美国Agilent公司。
1.3 方法
1.3.1 产蛋白酶放线菌的分离纯化
将酱香型大曲粉碎,取25 g于盛有225 mL无菌生理盐水的500 mL三角瓶中振荡混匀,得到10-1浓度的菌悬液。并以10倍浓度梯度稀释至10-2、10-3、10-4、10-5,取10-3、10-4、10-5浓度的菌悬液于分离培养基上进行平板涂布,37℃条件下培养,每天观察并记录各平板中菌落形态以及培养基上透明圈的大小等,从不同平板上挑取长势良好、透明圈较大的单菌落进行进一步的纯化。
1.3.2 分离菌株复筛
将分离纯化的各菌株接种于发酵培养基中,120 r/min、37℃条件下培养4 d,以蛋白酶活力为评价指标,测定各菌株的产蛋白酶能力,并最终筛选出产蛋白酶能力较强的菌株。
1.3.3 分离菌株的鉴定
(1)菌株形态特征的鉴定
将筛选出的高产蛋白酶菌株接种于酪蛋白培养基中培养,观察其菌落形态及透明圈大小,并进行革兰氏染色,观察其个体形态。
(2)16S rDNA同源序列分析
使用冻融法[7]提取分离菌株的基因组DNA,并以细菌的基因组DNA为模板,用细菌16S rDNA通用引物进行PCR扩增,引物序列如下:正向引物27F:5'-AGAGTTTGA TCCTGGCTCAG-3';反向引物1492R:5'-TACGGCTACCTTGTTACGACTT-3'。最后将扩增出的PCR产物送往上海美吉生物医药科技有限公司进行测序。
1.3.4 分离菌株的生长特性及产酶特性研究
(1)分离菌株生长曲线测定
将分离菌株接种于发酵培养基中,在120 r/min、37℃条件下培养,每隔12h取出一瓶发酵液过滤,收集菌体,清洗,然后于80℃烘箱内干燥至质量恒定,记录菌丝干质量[8]。
(2)蛋白酶活力的测定
酪氨酸标准曲线的绘制:取16支25 mL的比色管分成6组(空白组1支,平行每组3支),编号,并按表1所示加入各试剂,混匀后,放入40℃水浴保温20 min,于波长680 nm处进行比色测定,以酪氨酸的含量为横坐标,吸光度值为纵坐标,绘制标准曲线[9]。

表1 标准样液的配制Table 1 Preparation of standard sample solution
蛋白酶活测定[10]:取4支25 mL比色管,每管加入1 mL待测酶液于40℃恒温水浴锅中保温2 min,在空白组1支比色管中加入2 mL三氯乙酸溶液,实验组3支比色管中加入1 mL经40℃预热5 min的酪蛋白溶液,摇匀,40℃保温10 min。然后,在空白组中加入1 mL经40℃预热5 min的酪蛋白溶液,实验组中加入2 mL三氯乙酸溶液,摇匀,静置10min,过滤。分别取1mL滤液加入5mL碳酸钠溶液,再加入1mLFolin-酚试剂,混匀,放入40℃水浴保温20min,于波长680 nm处测定其吸光度值。
蛋白酶活单位定义:在上述条件下,1 min水解酪蛋白产生1 μg酪氨酸的酶量为1活力单位,以U/mL表示[11]。蛋白酶活力计算公式如下:
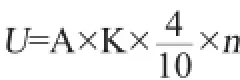
式中:U为蛋白酶活力,U/mL;A为样品平行试验的平均吸光度值;K为吸光常数,由标准曲线得出,数值上等于OD680nm为1时所相当酪氨酸微克数;n为待测酶液稀释倍数;4为反应液的总体积,mL;10为反应时间,min。
产蛋白酶曲线的测定:接种2 mL种子液于盛有100 mL无菌发酵培养基的250 mL三角瓶中。120 r/min、37℃条件下进行培养。每隔12 h取出一瓶发酵液,测定其蛋白酶活力,并绘制产蛋白酶曲线。以确定后续试验测定蛋白酶活力的培养时间。
1.3.5 发酵条件对分离菌株产蛋白酶的影响
(1)单因素试验
接种2 mL种子液于不同初始pH值(5、6、7、8、9、10)的100mL无菌发酵培养基中,分别在不同转速条件(0、60r/min、120 r/min、180 r/min、240 r/min)、不同温度条件下(30℃、35℃、40℃、45℃、50℃)培养4 d,取发酵液于4 000 r/min条件下离心10 min,再取上清液测定酶活力的大小,考察初始pH值、转速、培养温度对分离菌株产蛋白酶能力的影响。
(2)分离菌株发酵产蛋白酶条件正交试验优化
根据单因素试验结果,采用L9(34)正交表,分别以培养基初始pH值、转速、培养温度作为3个参考因素,选取3个水平进行试验。按表2的正交因素水平设计L9(33)正交试验。

表2 培养条件优化正交试验因素与水平Table 2 Factors and levels of orthogonal experiments for culture conditions optimization
2 结果与分析
2.1 分离菌株鉴定
2.1.1 产蛋白酶菌株的分离与初筛
在酪蛋白平板培养基上涂布10-3、10-4、10-5浓度的大曲菌悬液,37℃条件下培养4 d,观察并记录每个平板上的菌落形态和透明圈的大小,选取有透明圈产生,生长缓慢,菌落紧密而不蔓延,表面干燥,菌体不易挑动与培养基紧密结合的菌落,再进行多次划线分离后,其平板形态见图1。

图1 初筛菌落透明圈Fig.1 Transparent circle of screening colony
2.1.2 分离菌株复筛
将各分离菌株接种到发酵培养基中,120 r/min、37℃条件下培养4d,取发酵液测定其蛋白酶活力,结果见图2。由图2可知,产蛋白酶量较大的菌株依次序分别是菌株F3、F4、F1,其中菌株F3的酶活最大为20.98U/mL。故选定菌株F3进行后续试验。
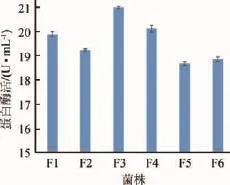
图26 株分离菌的产蛋白酶结果Fig.2 Protease-producing results of six isolated strains
2.1.3 分离菌株形态学鉴定
将分离菌株F3进行革兰氏染色,并在显微镜下观察,得出细胞形态,如图3所示。由图3可知,该菌染色结果为紫色,是革兰氏阳性菌。该菌的基内菌丝不断裂,气生菌丝发育良好,且有较长的轮生孢子丝。
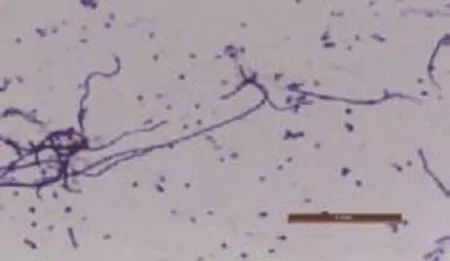
图3 分离菌株F3的形态Fig.3 Morphology of isolated strain F3
2.1.4 分离菌株16SrDNA同源序列分析及系统发育树构建
以菌株F3的总DNA为模板,采用通用引物进行扩增,经琼脂糖电泳检测,出现唯一条带,大约为1400bp的特异性扩增产物,如图4所示。

图4 菌株F3的PCR扩增产物电泳图Fig.4 Electrophoretogram of PCR amplified products of strain F3
将测出的序列在NCBI上进行BLAST比对,下载与此序列同源性高的序列,经MEGA6.0软件采用邻接(Neighbor-Joining,NJ)法将测定的序列与在GenBank中下载的序列进行分析,构建系统发育树,获取目的菌的分类地位,结果见图5。由图5系统发育树可知,分离菌株F3鉴定为娄彻氏链霉菌(Streptomycesrochei)。

图5 菌株F3的系统发育树Fig.5 Phylogenetic tree of strain F3
2.2 分离菌株F3的生长特性及产酶特性研究
2.2.1 分离菌株F3生长曲线测定
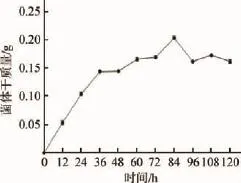
图6 菌株F3生长曲线Fig.6 Growth curve of strain F3
将分离菌株F3接种于盛有100mL发酵培养基的250mL三角瓶中,120r/min、37℃恒温培养,每隔12 h测定其菌体干质量,结果如图6所示。在0~84 h内,该菌菌体干质量一直增加,前36 h生长较为旺盛,36~84 h相对缓慢,生长主要表现在菌丝尖端的伸长和出现分支、断裂等,此时期的菌体呼吸强度达到高峰,有的开始积累代谢产物。在84 h后,菌体干质量开始下降,大多数次级代谢产物在此期合成,大多数细胞都出现大的空泡。有些菌丝体还会发生自溶,这与菌种和培养条件有关。
2.2.2 酪氨酸标准曲线的制作
以酪氨酸含量(x)为横坐标,不同含量的酪氨酸对应的吸光度值(y)为纵坐标,得到酪氨酸的标准曲线方程为:y=0.009 2x+0.006 8,其相关系数R为0.999 7,并在0~100 μg/mL范围内与吸光度值的线性关系良好。
2.2.3 分离菌株产蛋白酶曲线测定
以蛋白酶活力为纵坐标,时间为横坐标,绘制该菌株的产蛋白酶曲线。如图7所示,该菌株在培养的前96 h中,蛋白酶酶活一直在增加,但在96 h后呈现降低的趋势。因此,在后续试验中都选择恒温培养96 h时测定蛋白酶活力。

图7 菌株F3的产蛋白酶曲线Fig.7 Protease production curve of strain F3
2.2.4 培养基初始pH对分离菌株产蛋白酶的影响
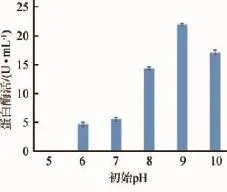
图8 不同初始pH对菌株F3产蛋白酶的影响Fig.8 Effects of different initial pH on the protease production of strain F3
发酵液pH值会引起微生物细胞膜电位的变化,导致其对微生物营养物质的吸收能力产生变化[12-13]。每种微生物都有其生长的最佳pH值,过酸或者过碱,微生物的生长能力都会受阻,菌体死亡率增加,引起产酶能力的下降。培养基初始pH对菌株产蛋白酶的影响见图8。由图8可知,该菌株在pH值为5~9时产蛋白酶量逐渐增加,pH值为9~10时产蛋白酶量逐渐减少,其最适产蛋白酶pH值为9,酶活力达到21.88 U/mL,且碱性条件下产酶能力明显高于中性和酸性条件。
2.2.5 转速对分离菌株产蛋白酶的影响
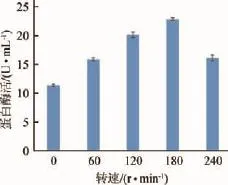
图9 转速对菌株F3产蛋白酶的影响Fig.9 Effects of rotate speed on the protease production of strain F3
由图9可知,当摇床转速在0~180 r/min时该菌株的产蛋白酶量逐渐增加,转速180~240 r/min时菌株的产酶能力下降,可能是由于转速过高,会对菌体细胞造成严重的破坏,导致菌株的产酶能力下降[14]。即转速为180 r/min时产蛋白酶能力最大,达到22.88 U/mL。
2.2.6 发酵温度对分离菌株产蛋白酶的影响

图10 发酵温度对菌株F3产蛋白酶的影响Fig.10 Effects of culture temperature on the protease production of strain F3
由图10可知,该菌株在30~35℃时产蛋白酶量逐渐增加,35~50℃时产蛋白酶量逐渐减少,由于过高的温度会使菌体的生长速度变慢,代谢能力下降,进而影响菌株的产酶,所以在40℃过后,产酶能力大幅下降,但并没有完全消失,可能是由于该菌是从酱香型高温大曲分离得到,对高温环境已经具有一定的适应能力[15]。故其最适发酵温度为35℃,产蛋白酶能力最大,达到28.62 U/mL。
2.2.7 分离菌株产蛋白酶条件优化正交试验
根据单因素试验结果,按表2设计正交试验,对结果进行分析,以确定最佳条件。正交试验结果与分析见表3。
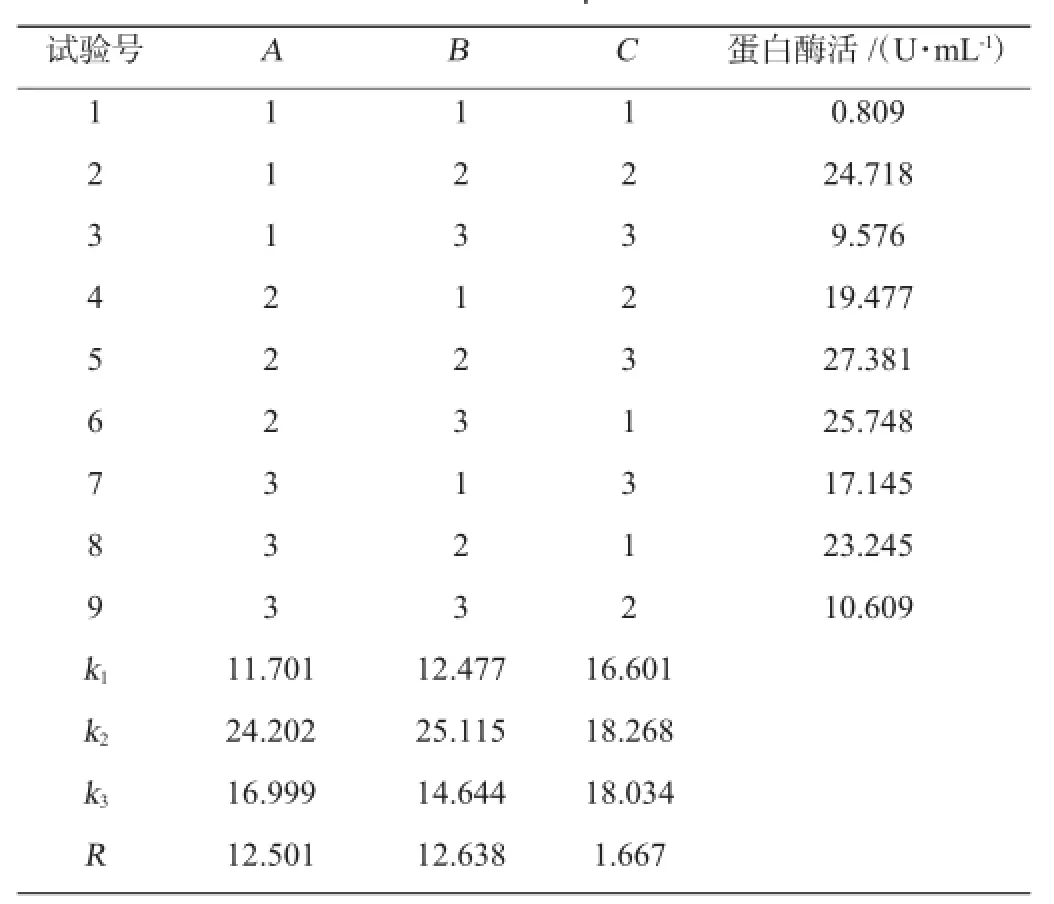
表3 发酵条件优化正交试验结果与分析Table 3 Results and analysis of orthogonal experiments for fermentation conditions optimization of strain F3
由正交试验表3中得出的最佳组合为A2B2C2,与直观结果A2B2C3相比,得到A2B2C2组合产酶量更高,即最佳发酵条件为初始pH值为9,转速180 r/min,培养温度35℃,此时发酵液的酶活力大小为28.62 U/mL。
3 结论
本研究对酱香型大曲中高产蛋白酶放线菌进行了分离鉴定,并对其发酵特性进行了研究。采用稀释涂布和平板划线法对酱香型大曲中的产蛋白酶放线菌进行分离纯化,以蛋白酶活为指标,筛选出了一株产蛋白酶能力较强的菌株,并通过16S rDNA同源序列分析对该菌株进行遗传学鉴定,确定该株菌为娄彻氏链霉菌(Streptomycesrochei)。以不同的初始pH、转速、培养温度做单因素试验研究其产蛋白酶能力,并在单因素试验的基础上,通过正交试验,获得该株菌最优产酶条件为培养温度35℃,转速180r/min,培养基初始pH9,此最佳条件下其蛋白酶活力为28.62U/mL。
[1]袁先铃,黄丹,刘达玉等.酱香型大曲中蛋白酶产生菌的分离鉴定及产酶条件研究[J].中国酿造,2012,31(6):34-37.
[2]CHEN B,WU Q,XU Y.Filamentous fungal diversity and community structure associated with the solid state fermentation of Chinese Maotai-flavor liquor[J].Int J Food Microbiol,2014,179:80-84.
[3]LI X R,MA E B,YAN L Z,et al.Bacterial and fungal diversity in the traditional Chinese liquor fermentation process[J].Int J Food Microbiol, 2011,146:31-37.
[4]王晓丹,班世栋,胥思霞,等.浓香型大曲中酶系与白酒品质的关系研究[J].中国酿造,2014,33(1):44-47.
[5]王婧,王晓丹,罗晓叶,等.酱香大曲中高产蛋白酶功能细菌的筛选及鉴定[J].中国酿造,2015,34(10):43-46.
[6]卫春会,黄治国,黄丹,等.高温大曲高产蛋白酶菌株的分离鉴定及其产酶性能研究[J].食品与机械,2014,30(4):24-29.
[7]黄丹,梁源,左勇,等.酱油发酵酱醅中耐盐乳酸菌的分离筛选及产酸特性[J].食品与生物技术学报,2014,33(6):652-656.
[8]张红丹,杜茜,张正坤,等.放线菌769抑菌谱及液体培养生长曲线的测定[J].中国植保导刊,2010,30(7):5-9.
[9]上海市酿造科学研究所.SB/T10317-1999蛋白酶活力测定法[S].北京:国家国内贸易局,1999.
[10]李婵娟,王婧,杨洁.蛋白酶产生菌的筛选、鉴定及酶学性质研究[J].湖北农业科学,2015,54(19):4794-4797.
[11]KHAN F.New microbial proteases in leather and detergent industries [J].Inn Res Chem,2013,1:1-6.
[12]孙倩,陈复生,丁长河,等.地衣芽孢杆菌产碱性蛋白酶发酵条件优化力[J].食品工业科技,2012,33(13):174-178.
[13]刘新风,牛春华,刘香英,等.枯草芽孢杆菌BSG1产蛋白酶发酵条件优化[J].食品工业,2013(7):1-4.
[14]张智,滕婷婷,王淼,等.溶氧对发酵的影响及控制[J].科学咨询,2008,21:63-64.
[15]范宜晓.微生物发酵法生产3-羟基丁酮[D].济南:齐鲁工业大学,2013.
Isolation of protease-producing actinomycetes from sauce-flavorDaquand its proteaseproducing conditions
YU Hua,HUANG Dan*,CHEN Zhuo,TANG Jiao,MAO Xiang,DENG Ling,LIU Dan,LYU Kaibin
(College of Bioengineering,Sichuan University of Science and Engineering,Zigong 643000,China)
A strain of actinomycetes with high yield protease was isolated and identified,and its protease-producing characteristic was researched.The objective strain was separated and purified through spread plate and biochemical reaction method,and the target strain was identified by morphological characteristics and genetic characteristics.The enzyme producing conditions of the target strains were optimized by single factor and orthogonal tests.The results showed that the strain was identified asStreptomyces rocheiby molecular biological identification,and the optimum fermentation conditions through single factor and orthogonal tests were:pH 9.0,fermentation temperature 35℃,rotation speed 180 r/min,the enzyme production capacity could reach the maximum of 28.62 U/ml.
sauce-flavor;protease;actinomycetes;Daqu
TS261.1
0254-5071(2017)02-0064-05
10.11882/j.issn.0254-5071.2017.02.014
2016-10-02
酿酒生物技术及应用四川省重点实验室项目(NJ2013-02);泸州老窖科研奖学金项目(15ljzk02);四川理工学院大学生创新创业训练计划项目(201610622010)
于华(1991-),男,硕士研究生,研究方向为固态酿造功能微生物。
*通讯作者:黄丹(1968-),女,教授,本科,研究方向为微生物及应用。

