重组毕赤酵母表达蛋清溶菌酶发酵条件的优化
孙玮遥,宋增健,王向东,林剑*
(1.烟台大学生命科学学院,山东烟台264005;2.山东大学医学院,山东济南250100)
重组毕赤酵母表达蛋清溶菌酶发酵条件的优化
孙玮遥1,宋增健1,王向东2,林剑1*
(1.烟台大学生命科学学院,山东烟台264005;2.山东大学医学院,山东济南250100)
该研究以甲醇诱导型重组毕赤酵母(Pichia pastoris)NCY-2为研究菌株,在摇瓶水平上首先考察了诱导时间、甲醇含量、诱导pH及诱导温度对蛋清溶菌酶表达的影响,然后通过正交试验设计优化出了该菌株的最佳发酵条件,并进一步研究了摇瓶发酵过程中的菌体生长和酶活力随时间的变化规律。研究结果表明,蛋清溶菌酶的最适诱导时间为96 h,甲醇含量为2%,诱导pH值为3.5,诱导温度为20℃;在此条件下发酵液的蛋清溶菌酶酶活力达到775 U/mL,是优化前的2.2倍。
蛋清溶菌酶;毕赤酵母;发酵条件;优化
抗生素滥用给人体健康和环境造成了极大的危害,尤其是用作饲料添加剂造成的畜禽亚健康问题,加剧了抗性质粒的传播速度,对人类自身造成了极大的安全隐患。因此,开发绿色、安全、高效的抗生素替代品引起了社会各界的广泛关注。溶菌酶是一种天然存在的酶,具有抗菌、消炎、抗病毒等作用,且对人畜本身无任何毒副作用,现已逐渐应用于畜禽生产领域,成为传统抗生素的替代品[1]。
溶菌酶是一种能够水解微生物细胞壁的碱性酶,主要抑菌机理是切断细胞壁肽聚糖中N-乙酰葡萄糖胺和N-乙酰胞壁酸之间的β-1,4糖苷键,使菌体裂解死亡[2]。目前,从鸡蛋清中提取溶菌酶[3]已达到工业化生产水平,市售溶菌酶大多由该方法制得,但价格昂贵,因而限制了低附加值畜禽产业的应用。毕赤酵母表达系统是近年来发展起来的真核表达系统,具有基因操作简单、稳定性好、外源蛋白表达量高等优点,被广泛应用于溶菌酶的异源表达[4]。
目前,国内已公开报道的用重组毕赤酵母表达蛋清溶菌酶(egg white lysozyme,EWL)在反应器水平上的最高产量仅为10 mg/L[5],与已报道的400 mg/L差距非常大[6],且尚未实现工业化生产。因此,如何提高溶菌酶在该系统中的表达量有着重要的理论和现实意义。现阶段关于蛋清溶菌酶的研究报道多集中于毕赤酵母表达系统的构建方面[7-8],对发酵条件的优化缺乏系统的研究。尽管利用毕赤酵母表达系统表达其他目的产物(如植酸酶、水蛭素等),已得到了相对成熟的发酵工艺,但是相同表达载体因插入的外源基因不同,其目的产物的表达条件必定会有一定的差异,因此深入研究蛋清溶菌酶在重组毕赤酵母表达系统中的发酵工艺条件对于提高其表达量具有重要意义。
本研究采用山东大学构建的一株甲醇诱导型重组毕赤酵母发酵表达蛋清溶菌酶,在摇瓶水平上首先考察了诱导时间、甲醇含量、诱导pH及诱导温度对蛋清溶菌酶表达的影响,然后通过正交试验设计优化出了该菌株的最佳发酵条件,并进一步研究了摇瓶发酵过程中的菌体浓度和酶活力随时间的变化规律,为实现生物反应器水平的高密度发酵提供了参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
甲醇诱导型重组毕赤酵母菌株(Pichiapastoris)NCY-2:山东大学应用生命科学研究中心构建。
1.1.2 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:1%酵母浸粉,2%胰蛋白胨,2%葡萄糖。
BMGY培养基:1%酵母浸粉,2%胰蛋白胨,1.34%无氨基酵母氮源(yeast nitrogen base without amino acids,YNB),4×10-5%生物素,0.1 mol/L磷酸钾缓冲液(pH6.0)100 mL,1%甘油。
BMMY培养基:1%酵母浸粉,2%胰蛋白胨,1.34% YNB,4×10-5%生物素,0.1 mol/L磷酸钾缓冲液(pH6.0)100 mL,0.5%甲醇。
1.1.3 化学试剂
酵母浸粉:安琪酵母股份有限公司;胰蛋白胨:国药集团化学试剂有限公司;无氨基酵母氮源、生物素:北京索莱宝科技有限公司;溶菌酶检测试剂盒:南京建成生物工程研究所;其余试剂均为国产分析纯。
1.2 仪器与设备
AR1530电子天平:奥豪斯仪器(上海)有限公司;Anke TKL-5-A离心机:上海标仪仪器有限公司;ZWY-2102恒温培养振荡器:上海智诚分析仪器制造有限公司;G180TW全制动高压灭菌锅:致微仪器有限公司;DK-98-11多功能万用炉:天津泰斯仪器有限公司;LRH-250生化培养箱:上海一恒科学仪器有限公司;SW-CJ-2FD超净工作台:苏洁净化设备有限公司。
1.3 方法
1.3.1 种子培养
配制YPD培养基于300 mL锥形瓶中,装液量为10%,灭菌冷却至30℃左右接种,于30℃、200 r/min的恒温振荡器中连续培养20 h。
1.3.2 单因素试验
取1 mLYPD种子液接种于装有100 mL灭菌BMGY培养基的500mL锥形瓶中,30℃、200r/min恒温振荡培养24h。之后,室温无菌条件下3 000 r/min离心10 min,弃上清液,收集菌体,用100 mL灭菌的BMMY培养基重悬,开始甲醇诱导培养。此阶段对诱导时间、甲醇含量、诱导pH以及诱导温度四个发酵条件进行优化,以提高蛋清溶菌酶的表达量(甲醇采用间歇流加的方式,每24 h添加一次无水甲醇,添加量占发酵液初始体积的0.5%(V/V);培养基pH由H3PO4和KOH调节)。
诱导时间的优化:保持BMMY培养基的初始pH值为6,甲醇含量为0.5%,30℃恒温振荡培养,分别于24 h、48 h、72 h、96 h、120 h、144 h时取样检测蛋清溶菌酶活性。
甲醇含量的优化:保持BMMY培养基的初始pH值为6,依次改变甲醇含量为0.25%、0.5%、1.0%、1.5%、2.0%、2.5%、3.0%,30℃恒温振荡培养96 h,分别取样检测蛋清溶菌酶活性。
诱导pH值的优化:依次调节BMMY培养基的初始pH值为3、4、5、6、7,甲醇含量为2.5%,30℃恒温振荡培养96h,分别取样检测蛋清溶菌酶活性。
诱导温度的优化:保持BMMY培养基的初始pH值为6,甲醇含量为2.5%,依次置于20℃、24℃、26℃、30℃的恒温振荡器中培养,每隔24 h分别取样检测HEWL的活性。
1.3.3 正交试验
根据单因素试验结果,以蛋清溶菌酶活性为考察指标,进行L9(34)正交试验,正交试验因素与水平如表1所示。每个试验设置3次重复。

表1 蛋清溶菌酶活性表达条件优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for expression of egg white lysozyme activity fermentation conditions optimization
1.3.4 测定方法
溶菌酶活性的测定:收集发酵液上清,利用溶菌酶测定试剂盒(南京建成生物工程研究所)测定上清中溶菌酶含量。试剂盒操作中以溶壁微球菌为底物,37℃水浴中反应15 min,于波长530 nm处测定透光度的变化值,以空白为对照,以溶菌酶标准品(200 U/mL)为参考,通过透光度的高低计算样品的酶活力。
2 结果与分析
2.1 诱导时间对蛋清溶菌酶表达的影响

图1 诱导时间对蛋清溶菌酶活性的影响Fig.1 Affect of induction time on egg white lysozyme activity
对于甲醇诱导型重组毕赤酵母而言,发酵诱导时间直接影响菌体的生长代谢活力以及外源蛋白表达量的高低。诱导时间过短,目的蛋白表达量低;诱导时间过长,菌体的代谢活力减弱,且发酵液中蛋白酶的积累易造成目的蛋白的大量水解,发酵时间的延长也会增加生产成本。因此,优化诱导时间对于提高生产效率、降低成本具有重要意义。蛋清溶菌酶的表达活性随诱导时间的变化(图1)可知,从生长期进入甲醇诱导期后,菌体开始利用诱导剂甲醇表达外源蛋白。随着甲醇含量的增加,蛋清溶菌酶的表达活性逐渐增高,连续诱导96 h之后,由于菌体的衰亡以及蛋白酶等物质的积累,蛋清溶菌酶活性开始持续下降,此时应及时停止发酵,避免造成生产成本的浪费。因此,选择甲醇诱导时间为96 h。
2.2 甲醇含量对蛋清溶菌酶表达的影响
菌体生长到稳定期达到最大数量后,需要流加甲醇进行诱导。一方面,甲醇在启动子AOX基因编码的醇氧化酶的催化下分解,调控表达目的蛋白[11];另一方面,甲醇用作碳源,维持菌体的正常生长代谢。因此,甲醇含量是发酵表达外源蛋白的关键条件。不同甲醇含量对蛋清溶菌酶表达活性的影响见图2。
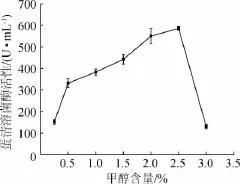
图2 甲醇含量对蛋清溶菌酶活性的影响Fig.2 Effect of methanol concentration on egg white lysozyme activity
一般认为,毕赤酵母表达体系的发酵液中,当甲醇含量>3%时会对细胞产生毒害作用[12],所以本试验研究了<3%的甲醇含量梯度对蛋清溶菌酶表达活性的影响。由图2可以看出,当甲醇含量从0.25%增加至2.5%时,蛋清溶菌酶活性呈逐渐增大趋势,而>2.5%后,过量的甲醇对细胞产生了毒害作用,导致蛋清溶菌酶的表达量大幅度下降。因此,选择每24 h流加的甲醇含量为2.5%。
2.3 诱导pH值对蛋清溶菌酶表达的影响
pH作为发酵过程中重要的化学参数,对发酵液的物理性质、细胞膜的电荷状态及参与细胞反应的酶活性等有重要影响,因而影响目的蛋白质的表达。据研究报道,pH值在3.0~7.0的范围内毕赤酵母均可以正常生长,pH<2.2时细胞生长会受到抑制[13]。研究3.0~7.0范围内的pH值变化对蛋清溶菌酶表达量的影响,结果见图3。
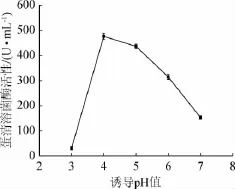
图3 诱导pH值对蛋清溶菌酶活性的影响Fig.3 Effect of induction pH on egg white lysozyme activity
由图3可知,当诱导pH值<4时,蛋清溶菌酶的表达量极低,由此可以看出发酵液酸性较强时会明显抑制毕赤酵母的生长及代谢;当诱导初始pH值为4时,蛋清溶菌酶的表达量最高;当pH值>4后,随着发酵液pH值的增大,蛋白表达量逐渐降低,主要原因可能是发酵液中中性蛋白酶的逐渐积累造成了蛋白的水解[14];因此,调节诱导期发酵液pH值为4时最有利于蛋清溶菌酶的表达和积累。
2.4 诱导温度对蛋清溶菌酶表达的影响
温度对菌体的生长以及外源蛋白的表达都有重要影响。因此,选择合适的发酵温度极其重要。毕赤酵母的最适生长温度是30℃,而诱导表达的温度则因外源蛋白的不同存在差异,但一般都不超过32℃,因为较高温度条件下外源蛋白表达量显著下降,细胞衰亡速率增加。同时,不少研究者指出,低温更有利于诱导外源蛋白的合成[15-16]。因此,本试验选择了20~30℃的温度范围。不同温度条件下蛋清溶菌酶的表达量随时间的变化见图4。

图4 诱导温度对蛋清溶菌酶活性的影响Fig.4 Effect of induction temperature on egg white lysozyme ectivity
由图4可知,随着诱导时间的延长,不同温度条件下的蛋清溶菌酶表达量逐渐增加,均在第96 h时达到最大值(与2.1.1结论一致)。不同温度条件下蛋清溶菌酶的表达量差异较大,从第72 h开始,30℃条件下蛋清溶菌酶的活性最低,随着温度的降低,蛋清溶菌酶的表达活性增加,且20℃条件下蛋清溶菌酶活性的增加幅度最大,最高表达量是30℃条件下的1.86倍。主要原因可能是低温增强了重组毕赤酵母细胞的物质及能量代谢,提高了细胞存活率,同时降低了胞外蛋白酶的作用效果,减少了蛋清溶菌酶的降解,并有利于蛋清溶菌酶构象的正确折叠,从而提高了蛋清溶菌酶的表达量[17]。因此,选择诱导温度为20℃进行后续试验。
2.5 正交试验结果
蛋清溶菌酶活性表达发酵条件优化正交试验结果与分析见表2,方差分析见表3。

表2 蛋清溶菌酶活性表达发酵条件优化正交试验结果与分析Table 2 Results and analysis of orthogonal experiments for expression of egg white lysozyme activity fermentation conditions optimization
由表2可知,影响蛋清溶菌酶表达量的4个因素主次关系为D(甲醇含量)>A(诱导时间)>B(诱导温度)>C(诱导pH)。最优方案为A2B2C1D1,即诱导时间96 h,诱导温度20℃,诱导pH 3.5,甲醇含量2%。对正交试验所确定的最优工艺条件进行验证,结果表明,在最优方案条件下蛋清溶菌酶活性的平均值为775 U/mL,高于试验5所得的结果。是优化前(349 U/mL)的2.2倍。

表3 正交试验结果方差分析Table 3 Variance analysis of orthogonal experiments results
由表3可知,甲醇含量对蛋清溶菌酶活性的影响最大,其次是诱导时间、诱导温度和诱导pH。且4个因素对蛋清溶菌酶活性的影响均达到高度显著(P<0.01)。
3 结论
通过单因素试验和正交试验,得到了影响蛋清溶菌酶表达量的4个因素的最优条件:甲醇含量2%,诱导时间96 h,诱导温度20℃,诱导pH 3.5。在此优化条件下蛋清溶菌酶的摇瓶表达量达到了775 U/mL。
[1]陈忠琼.溶菌酶在畜禽生产中的应用进展[J].饲料博览,2014(8):32-35.
[2]CALLEWAERT L,MICHIELS C W.Lysozymes in the animal kingdom [J].J Bioscience,2010,35(1):127-160.
[3]傅冰,季秀玲,俞汇颖,等.鸡蛋清中溶菌酶的分离提取[J].浙江农业学报,2013,25(6):1364-1367.
[4]POTVIN G,AHMAD A,ZHANG Z.Bioprocess engineering aspects of heterologous protein production inPichia pastoris:A review[J].Biochem Eng J,2012,64(19):91-105.
[5]权志中,张丞斌,余荣,等.鸡蛋清溶菌酶基因的克隆及其在毕赤酵母中的表达研究[J].饲料工业,2007,28(24):18-22.
[6]MASUDA T,UENO Y,KITABATAKE N.High yield secretion of the sweet-tasting protein lysozyme from the yeastPichia pastoris[J].Protein Express Purif,2005,39(1):35-42.
[7]黄继荣,傅正伟,李浙烽,等.一种高活性鸡溶菌酶的基因克隆、表达与应用:CN 101050467A[P].2007-10-10.
[8]勾连军,徐雪松,宋海泉,等.一种鸡蛋清溶菌酶基因(RJM)的克隆及其酵母表达方法:CN104946675A[P].2015-09-30.
[9]CELIK E,CALIK P.Production of recombinant proteins by microbes and higher organisms[J].Biotechnol Adv,2009,27(3):297-306.
[10]ZHANG W,INAN M,MEAGHER M M.Fermentation strategies for recombinant protein expression in the methylotrophic yeastPichia pastoris[J].Biotechnol Bioprocess Eng,2012,5(4):275-287.
[11]苟万晓,卫红伟,胡元森,等.毕赤酵母发酵生产甲醇蛋白工艺条件的优化[J].中国酿造,2014,33(7):78-82.
[12]JAHIC M,GUSTAVSSON M,JANSEN AK,et al.Analysis and control of proteolysis of a fusion protein inPichia pastorisfed-batch processes [J].J Biotechnol,2003,102(1):45-53.
[13]ZHOU X,YING Y,TAO J,et al.Production of LYZL6,a novel human c-type lysozyme,in recombinantPichia pastoris,employing high cell density fed-batch fermentation[J].J Bioscience Bioeng,2014,118(4):420-425.
[14]JIN H,LIU G,DAI K,et al.Improvement of porcine interferon-α production by recombinantPichia pastorisvia induction at low methanol concentration and low temperature[J].Appl Biochem Biotechnol,2011, 165(2):559-71.
[15]廖锡豪,陈明祥,谢万勇,等.低温诱导对毕赤酵母表达重组外源蛋白的影响[J].中国酿造,2013,32(2):9-12.
[16]COS O,RAM□N R,MONTESINOS J L,et al.Operational strategies, monitoring and control of heterologous protein production in the methylotrophic yeastPichia pastoris,under different promoters:A review[J].Microbial Cell Fact,2006,5(1):382-391.
[17]LIM H K,CHOI S J,KIM K Y,et al.Dissolved-oxygen-stat controlling two variables for methanol induction of rGuamerin inPichia pastoris and its application to repeated fed-batch[J].Appl Microbiol Biotechnol,2003,62(4):342-348.
Optimization of fermentation conditions for expression of egg white lysozyme by recombination
Pichia pastoris SUN Weiyao1,SONG Zengjian1,WANG Xiangdong2,LIN Jian1*
(1.College of Life Science,Yantai University,Yantai 264005,China;2.School of Medicine,Shandong University,Jinan 250100,China)
Using methanol inducible recombinantPichia pastorisNCY-2 which produces egg-white lysozyme(EWL)as experimental strain,the effect of induction time,methanol concentration,induction pH and temperature on the expression of EWL were investigated by single factor experiments in shake flasks and the optimum fermentation conditions were obtained through orthogonal experiment design.The variation of cell growth and EWL activity with time in shake flask fermentation was further studied.The results showed that the optimal conditions were induction time 96 h,methanol concentration 2%,induction pH 3.5 and temperature 20℃.The EWL activity reached 775 U/ml under the optimized conditions,which was 2.2 times compared with that before optimization.
egg white lysozyme;Pichia pastoris;fermentation conditions;optimization
Q815
0254-5071(2017)02-0054-04
10.11882/j.issn.0254-5071.2017.02.012
2016-11-02
国家自然科学基金(81370881);烟台大学研究生科技创新基金重点项目(YDZD1610)
孙玮遥(1992-),女,硕士研究生,研究方向为微生物发酵。
*通讯作者:林剑(1963-),男,副教授,本科,研究方向为微生物发酵。

