QuEChERS-超高效液相色谱法-串联质谱法同时检测猪组织中赛庚啶及可乐定残留量
李丹妮,严凤,周悦榕,沈伟强,陶军,张婧(.上海市动物疫病预防控制中心,上海 00;.上海市松江区动物疫病预防控制中心,上海 060;.上海市嘉定区农业技术推广服务中心,上海 0800)
QuEChERS-超高效液相色谱法-串联质谱法同时检测猪组织中赛庚啶及可乐定残留量
李丹妮1,严凤1,周悦榕1,沈伟强2,陶军3,张婧1
(1.上海市动物疫病预防控制中心,上海 201103;2.上海市松江区动物疫病预防控制中心,上海 201620;3.上海市嘉定区农业技术推广服务中心,上海 201800)
建立了QuEChERS前处理结合超高效液相色谱-串联质谱同时检测猪组织中赛庚啶和可乐定残留量的方法。猪肉样品添加0.5 g C18粉,猪肝和猪肾样品添加3.0 g硫酸镁和2.0 g氯化钠,再分别加入10 mL 0.1%甲酸乙腈进行提取,提取液经浓缩后采用LC-MS/MS进行检测,内标法定量。该方法线性关系良好,猪肉、猪肝和猪肾中赛庚啶和可乐定在1~50 μg/kg浓度范围内加标回收率分别为62%~112%和106%~121%,相对标准偏差均<10%,方法检出限为0.5 μg/kg。方法灵敏度高,选择性好,可作为猪组织中赛庚啶和可乐定残留量检测的确证方法。
赛庚啶;可乐定;液相色谱-串联质谱;猪组织
赛庚啶(Cyproheptadine, CYP),是一种组胺H1受体拮抗药[1],作为人用药可用于荨麻疹、湿疹、过敏性和接触性皮炎等疾病。赛庚啶可以通过结合下丘脑的5-羟色胺位点阻断其活性[2],兴奋摄食中枢,从而达到增加动物体重和促进采食的作用。可乐定(Clonidine,CLO)是一种中枢神经系统肾上腺素能α2-受体激动剂[3],属于咪唑啉衍生物,近年来开始将可乐定用于促进动物生长和改善酮体组成的研究[4]。因此,出现了将可乐定和赛庚啶两种药物在动物养殖过程中进行非法使用的情况,消费者在食用含有药物残留的生猪产品后会产生严重的食品安全隐患。赛庚啶和可乐定作为新型非法添加物已被写入农业部1519号公告《禁止在饲料和动物饮水中使用的物质》,明确禁止使用。目前已有开展关于饲料[5]、猪尿[6]、动物饮水[7]、血液[8]、食品[9]及动物组织[10-11]基质中可乐定及赛庚啶含量的相关检测方法,研究组织中的赛庚啶和可乐定残留量检测有十分重要的意义。
1 材料与方法
1.1 仪器与试剂 Waters超高效液相色谱串联质谱系统(Waters®UPLC-TQ MS,Masslynx®工作软件);PL202-L感量为0.01 g电子天平(梅特勒-托利多仪器(上海)有限公司);AB135-S感量为0.00001 g电子天平(梅特勒-托利多仪器(上海)有限公司);漩涡混合器(美国 Talboys公司); TARGIN VX-Ш多管涡旋振荡器(北京踏棉科技有限公司)。AllegraTMX-22R Centrifuge高速冷冻离心机(美国BECKMAN COULTER公司); N-EVAP112 氮吹仪(美国 Orangaomation公司);Milli-Q A10 超纯水机(美国Millipore); 0.22 μm 亲水PTFE过滤膜(上海安谱科学仪器有限公司)。Sk7210HP 超声波清洗器(上海科导公司);C18粉(美国Agilent公司);乙腈、甲酸(分析纯,上海凌峰化学试剂有限公司);甲醇、乙腈(色谱纯,美国Merck公司);无水硫酸镁、无水氯化钠(化学纯,上海凌峰化学试剂有限公司)。
标准品: 盐酸赛庚啶(纯度98%),盐酸可乐定(纯度98%),盐酸二苯拉林(纯度98%),以上均购自美国sigma公司。盐酸可乐定-D4(纯度98%),来源CDN,含量大于98%。
标准储备液的配制:精密称取盐酸赛庚啶(以赛庚啶计)、盐酸可乐定(以可乐定计)、盐酸二苯拉林(以二苯拉林计)和盐酸可乐定-D4(以可乐定-D4计)对照品各10.0 mg,分别于10 mL容量瓶中,用甲醇溶解并定容,配制成浓度均为1 mg/mL的盐酸赛庚啶、盐酸可乐定、盐酸二苯拉林和盐酸可乐定-D4标准贮备液。
混合标准工作液和混合内标工作液的配制:分别精密量取盐酸赛庚啶和盐酸可乐定贮备液各1 mL,置于100 mL容量瓶中,用甲醇溶解并定容,配制成浓度为10 μg/mL的盐酸赛庚啶和盐酸可乐定标准储备液。分别精密量取1 mg/mL盐酸二苯拉林贮备液100 μL和1 mg/mL盐酸可乐定-D4贮备液1 mL,于100 mL容量瓶中,用甲醇溶解并定容,配制成盐酸二苯拉林的浓度为1 μg/mL和盐酸可乐定-D4的浓度为10 μg/mL的混合内标工作液。
混合标准工作曲线配制:精密量取混合标准工作液和混合内标工作液适量,用乙腈-0.1%甲酸溶液稀释成赛庚啶和可乐定浓度为0.5、1、10、50、100 μg/L系列混合标准工作液,其中含盐酸二苯拉林的浓度和盐酸可乐定-D4的浓度分别为5 μg/L和50 μg/L,临用现配。
1.2 仪器条件
1.2.1 液相色谱条件 色谱柱:Agilent C18(100 mm×2.1 mm,粒径1.8 μm),柱温30 ℃;进样量10 μL;流速0.3 mL/min;流动相 A为乙腈;B为0.1%甲酸溶液;梯度洗脱程序:0~4 min,20~60% A;4~4.5 min,60~95% A;4.5~6.5 min,95% A;6.5~8.0 min,95~20% A;8.0~10 min,20% A。
1.2.2 质谱条件 电离模式:正离子电喷雾电离(ESI+);质谱检测模式:多反应监测(MRM);毛细管电压:3.0 kV;离子源温度:150 ℃;脱溶剂气流量:800 L/h;脱溶剂温度:500 ℃;孔流速:50 L/h;碰撞气(Ar)流速:0.3 mL/min。分析中以保留时间和离子对丰度比作为定性分析依据,经过试验优化后的质谱参数如表1所示。

表1 可乐定、赛庚啶及其内标化合物的MRM参数
在定量离子的选择过程中,避免选择干扰较大的100以内的离子通道。
1.2.3 样品前处理 称取试料(2.00±0.02)g于50 mL离心管中,加入50 μL混合内标工作液后,猪肉样品加入0.5 g C18粉,猪肝和猪肾样品加入3.0 g硫酸镁和2.0 g氯化钠,振荡混匀,加0.1%甲酸乙腈10 mL,充分振荡,于8000 r/min离心5 min,取上清液,于离心管中,于50 ℃水浴氮气吹干,用1.0 mL 0.1%甲酸/乙腈(80/20)溶液溶解,经0.22 μm滤膜过滤后进样测定。
2 结果与分析
2.1 线性范围 可乐定和赛庚啶的混合标准对照工作液用流动相配制,线形范围为0.5~100 ng/mL。用液相色谱-串联质谱测定工作液,获得内标法标准曲线A赛庚啶=0.9721+0.1346C,线性相关系数r=0.9959,A可乐定=0.7702C+0.1782,线性相关系数r=0.9928。
2.2 方法回收率与精密度 选择空白猪肝、猪肉、猪肾样品作为测试对象,进行加标回收率实验,在猪组织中添加可乐定和赛庚啶浓度为1、2、10、50 μg/kg的样品进行加标回收实验,考察方法的准确性和精密度。每批次内同一浓度做6次平行实验,共重复3批次,结果见表2~表4,猪肉中添加回收图谱见图1。猪组织中可乐定回收率达到106%~121%,赛庚啶回收率达到62%~112%,相对标准偏差均<10%。
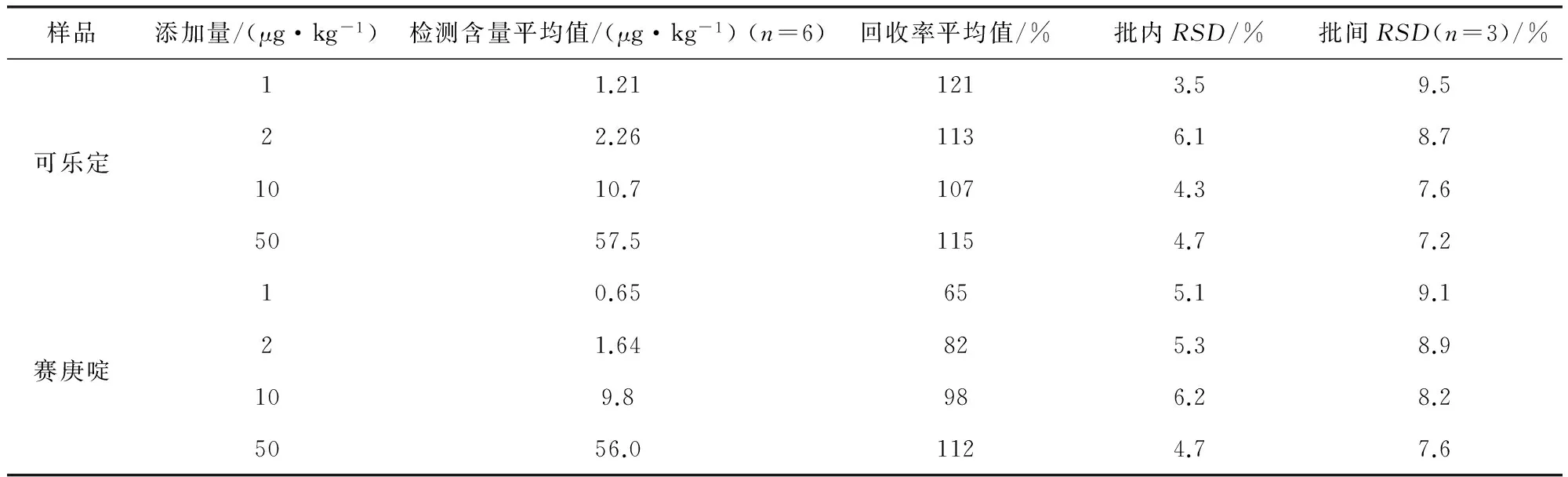
表2 猪肉中添加可乐定和赛庚啶回收率试验结果
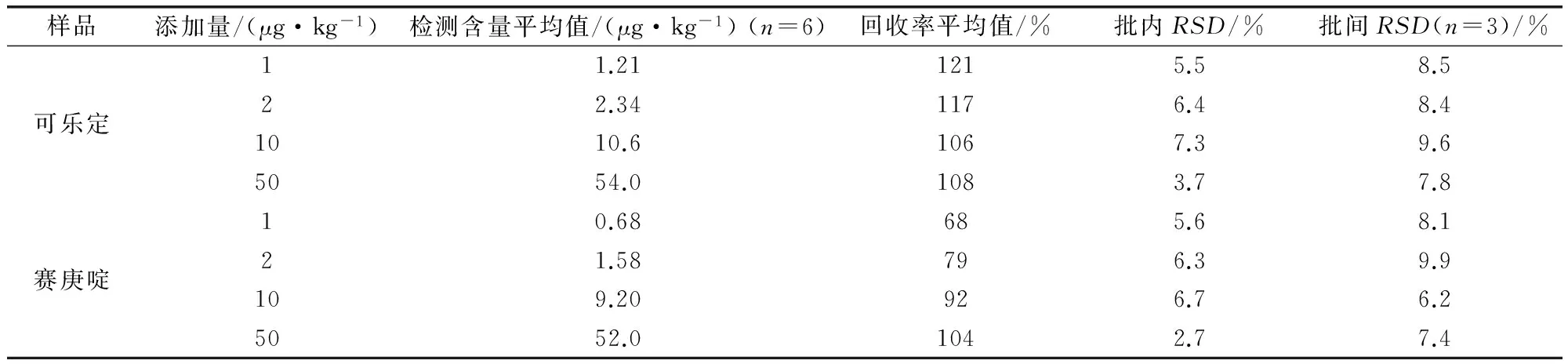
表3 猪肝中添加可乐定和赛庚啶回收率试验结果
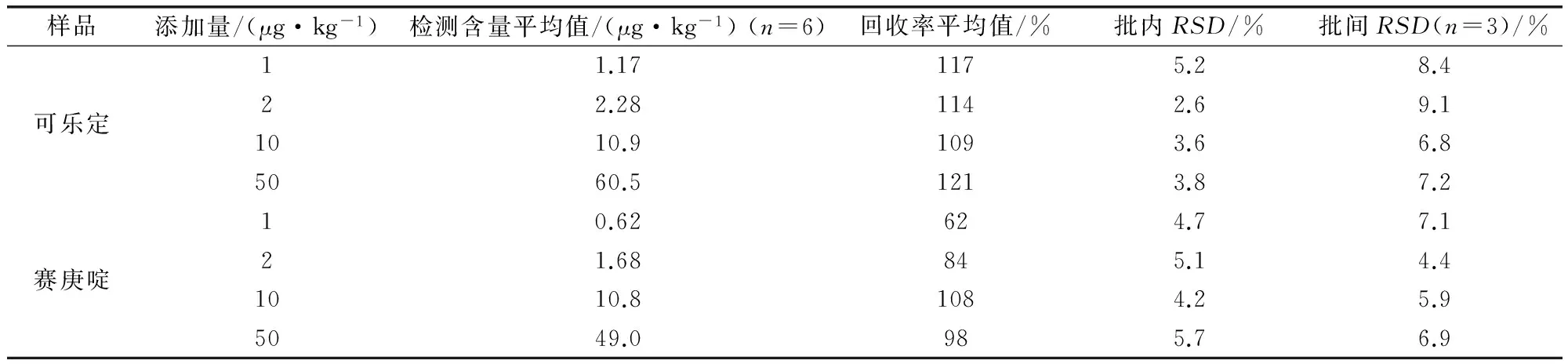
表4 猪肾中添加可乐定和赛庚啶回收率试验结果
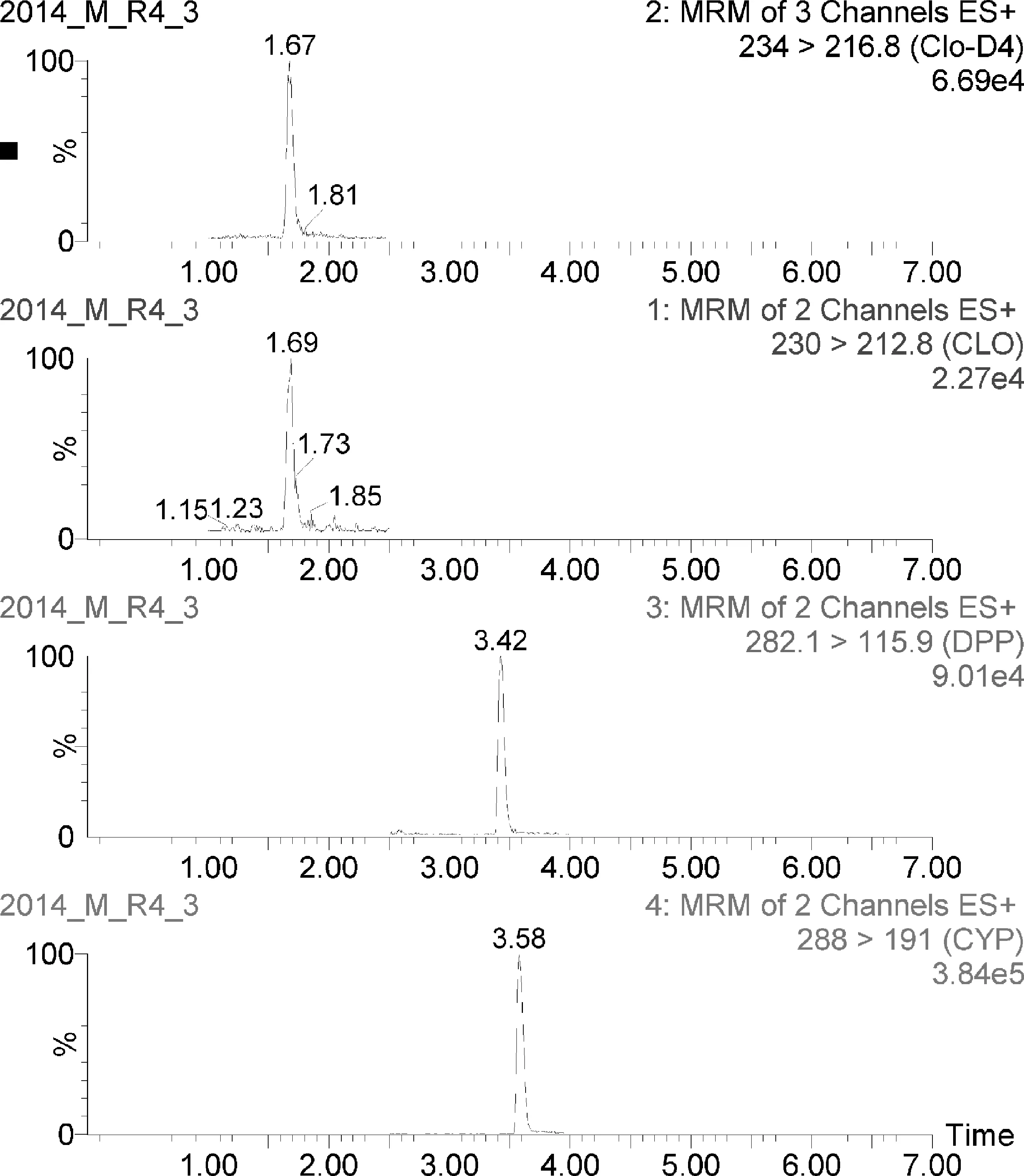
图1 猪肉中可乐定和赛庚啶添加回收率MRM图(添加浓度10 μg/kg)
2.3 检测限和定量限 猪肾、猪肝、猪肉样品中可乐定和赛庚啶方法最低检测限为0.5 μg/kg,信噪比S/N(Peak to Peak)>3。方法最低定量限为1.0 μg/kg,信噪比S/N(Peak to Peak)>10。
3 讨论与小结
3.1 定量方法的确定 药物分析一般均采用外标法,体内药物分析因提取步骤烦琐,其回收率会受到较大影响,故尽量采用内标法进行校正。本研究选择可乐定-D4可作为可乐定的内标物质。二苯拉林(Diphenylpyraline, DPP)的分子结构式和理化性质与赛庚啶相似(图2~图3),且二苯拉林并不存在于自然环境中,因此在目前尚未合成赛庚啶同位素化合物的情况下可以作为检测赛庚啶的良好的内标物质[12]。
图2 赛庚啶和二苯拉林分子结构式
图3 可乐定和可乐定-D4分子结构式
3.2 基质效应的考察 本研究通过基质效应实验进一步探索二苯拉林作为赛庚啶内标的适宜性。将猪肉、猪肝、猪肾空白样品按1.2.3项所述前处
理步骤进行前处理,得到相应的空白基质溶液,用此基质溶液添加标准溶液及内标溶液,配置为含盐酸二苯拉林的浓度和盐酸可乐定-D4的浓度分别为5 ng/mL和50 ng/mL,可乐定和赛庚啶浓度范围为0.5、1.0、5.0、10.0、50.0、100 ng/mL的基质标准溶液,进样后得到基质标准曲线线性相关系数如表5,可知选择盐酸二苯拉林和盐酸可乐定-D4作为赛庚啶和可乐定的内标物质,基质效应影响效果趋势一致,因此可以充分达到校正基质效应校准结果的目的。

表5 基质标准曲线线性相关系数
3.3 QuEChERS方法的优化 QuEChERS技术因高通量、快速、成本低的特点,近年由农药残留检测领域逐步被引入到兽药残留检测领域,并发表了大量的相关研究文章[13-15]。本研究在比较固相萃取与QuEChERS方法后,选择了QuEChERS方法作为前处理方法开发的主要方向,基于市售QuEChERS方法对除水剂、净化吸附剂进行了优化。根据猪肉、猪肝、猪肾样品不同的含水量及基质特点,在含水量较高的猪肾和猪肝样品前处理中选择了无水硫酸镁和氯化钠作为除水剂,分别比较了不同量的无水硫酸镁和氯化钠对实验结果的影响(表6~表7),结果发现当无水硫酸镁为3.0 g、氯化钠为2.0 g时,除水效果和回收率情况最理想。在含水量较少的猪肉前处理过程中仅选择了C18粉作为吸附剂,C18可有效去除脂类、糖类等亲脂型杂质,但过量的C18吸附剂也会吸附目标化合物而使回收率降低,经比较发现,0.5 g C18已经能满足检测灵敏度、净化效果和回收率的要求,同时可达到简化前处理步骤的效果。
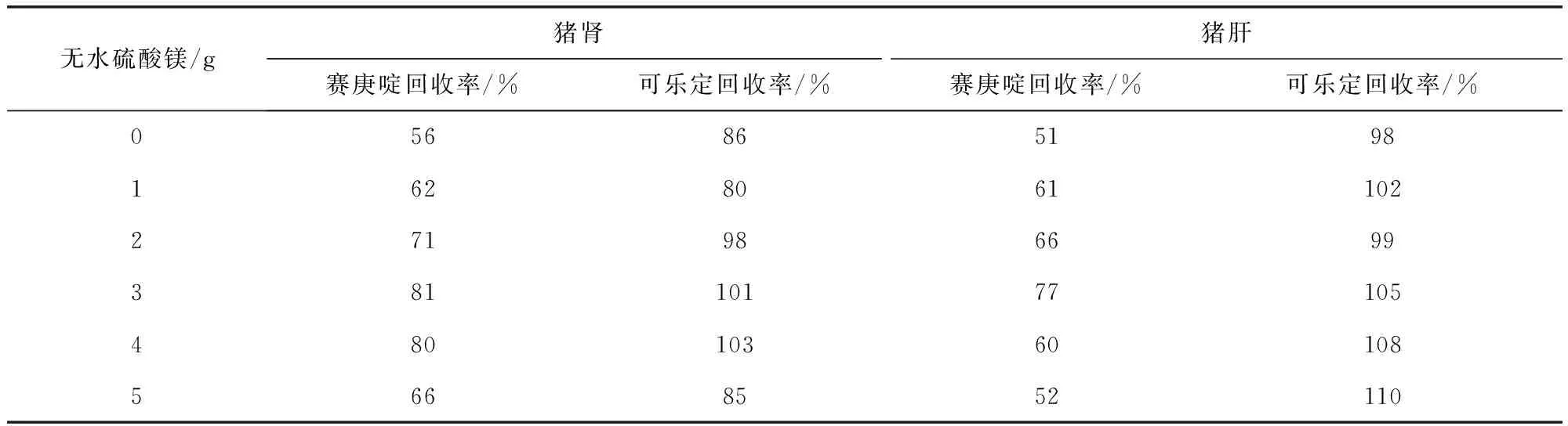
表6 无水硫酸镁加入量对回收率的影响

表7 氯化钠加入量对回收率的影响
本方法应用优化的QuEChERS技术结合超高效液相色谱-串联质谱建立了猪肉、猪肝和猪肾中可乐定和赛庚啶的残留检测方法。与现有的检测方法相比,采用QuEChERS净化技术,可实现更好的基质净化效果,操作简便,提升了检测效率。该方法对猪肉、猪肝和猪肾中赛庚啶和可乐定在1~50 μg/kg添加浓度范围内,回收率分别为62%~112%和106%~121%,相对标准偏差均<10%,方法检出限达到0.5 μg/kg,能够满足对猪可食组织猪肉、猪肝、猪肾中可乐定和赛庚啶残留量的测定。
[1] 张庆柱,耿金荣. 赛庚啶的药理与临床研究进展[J]. 中级医刊,1996,3:47-49.
[2] 张加力,岳云光. 赛庚啶治疗食欲不振70例[J]. 医学理论与实践,1994,3:29-30.
[3] 余涛,何玲. α2-肾上腺素受体激动剂在中枢神经系统疾病治疗中的应用研究进展[J]. 临床合理用药杂志,2012,14:166-167.
[4] 王雷杰,占秀安,许梓荣,等.可乐定对生长猪胴体组成的影响及其作用机理探讨[J]. 浙江大学学报(农业与生命科学版),2005,5:654-658.
[5] 曹莹,蒋音,张文刚. 高效液相色谱法分析饲料中的赛庚啶[J]. 中国饲料,2011,2:39-40.
[6] 曲斌,陆桂萍,蒋天梅,等.固相萃取-超高效液相色谱串联质谱法快速测定猪尿中的赛庚啶[J]. 中国兽药杂志,2013,1:28-31.
[7] 杨建文,刘雅红,王宗楠,等.赛庚啶-分子印迹聚合物的制备及其固相萃取研究[J]. 分析化学,2014,6:878-884.
[8] 孙成文,王汉斌,李嘉琳,等.中毒患者血液中可乐定液相色谱-质谱检测方法的研究[J]. 毒理学杂志,2014,5:360-363.
[9] 孟娟,张晶,邵兵. 液相色谱-串联质谱法快速测定食品中的可乐定[J]. 食品安全质量检测学报,2013,3:655-659.
[10]万宇平,罗晓琴,郝小妹,等.动物组织中赛庚啶竞争酶联免疫法的建立[J]. 中国酿造,2014,10:130-132.
[11]陈其煌. 高效液相色谱—串联质谱法测定猪肝中可乐定和赛庚啶[J]. 浙江农业学报,2013,3:623-629.
[12]吴剑平,张鑫,顾欣,等.超高效液相色谱-串联质谱法检测猪尿中盐酸赛庚啶残留量-内标法[J]. 中国饲料,2013,6:15-18.
[13]卜明楠,石志红,康 健,等. QuEChERS结合LC-MS/MS同时测定虾肉中72种兽药残留[J]. 分析测试学报,2012,5:552-558.
[14]冯楠,路勇,姜洁,等. QuEChERs-超高效液相色谱串联质谱法快速筛查食品中73种有毒有害物质[J]. 食品科学,2013,16:214-220.
[15]郭海霞,肖桂英,张禧庆,等. QuEChERS-超高效液相色谱-串联质谱法同时检测猪肉中121种兽药[J]. 色谱,2015,12:1242-1250.
(编辑:侯向辉)
Simulaneous Determination of Cyproheptadine and Clonidine in Pig Issues by QuEChERS and Ultra Performance Liquid Chromatography-tandem Mass Spectrometry
LI Dan-ni1, YAN Feng1, ZHOU Yue-rong1, SHEN Wei-qiang2, TAO Jun3, ZHANG Jing1(1.ShanghaiAnimalDiseaseControlCenter,Shanghai201103,China;2.ShanghaiSongjiangAnimalDiseaseControlCenter,Shanghai201620,China;3.ShanghaiJiadingAgriculturalTechnologyExtensionServiceCenter,Shanghai201800,China)
A method has been developed for the simultaneous determination of the cyproheptadine and clonidine residuals in pig issues using QuEChERS method coupled with ultra performance liquid chromatography-tandem mass spectrometry(UPLC-MS/MS). The drugs were extracted with sufficiently acidic acetonitrile. Anhydrous magnesium sulfate and anhydrous sodium chloride were used for the salting-out process. C18 powder was used for the clean-up process. The drugs were analyzed by UPLC-MS/MS in multiple reaction monitoring(MRM) mode via electrospray ionization. Cyproheptadine and clonidine were quantified by internal standard method. The calibration curves of the drugs were linear in the range of 0.5~100 ng/mL with the correlation coefficients more than 0.99. The LOD of cyproheptadine and clonidine in pig issues were 0.5 μg/kg. Add in the blank pig issues 1~50 μg/kg level, an average recovery of 62%~112% for cyproheptadine, and 106%~121% for clonidine with the relative standard deviation was <10%. The method is simple, rapid and high recovery and good reproducibility for quantitative and confirmatory analysis in cyproheptadine and clonidine residues.
cyproheptadine; clonidine; LC/MS/MS; pig issues
2016-08-26
A
1002-1280 (2017) 02-0029-06
S859.84
上海市科技兴农重点攻关项目 [沪农科攻字(2014)第3-3号];国家公益性行业(农业)科研专项(201203023)
李丹妮,高级畜牧师,从事兽药残留检测与方法开发。E-mail: yure@yeah.net
——猪肝泥

