液相色谱-串联质谱法检测猪肉、鸡肉组织中维吉尼霉素M1残留量的研究
岳秀英,孙吉,吴晓岚,陆强,李然, 葛荣(四川省兽药监察所,成都 610041 )
液相色谱-串联质谱法检测猪肉、鸡肉组织中维吉尼霉素M1残留量的研究
岳秀英,孙吉,吴晓岚,陆强,李然, 葛荣*
(四川省兽药监察所,成都 610041 )
为了建立可同时检测猪肉、鸡肉组织中维吉尼霉素M1药物残留的液相色谱-串联质谱分析方法,样品选用0.2%甲酸的乙腈/水(80∶20,V/V)溶液为提取液,经Oasis PRiME HLB固相萃取小柱净化,在液相色谱-串联质谱仪上进行检测。结果表明,维吉尼霉素M1在0.25~200 ng/mL浓度范围内呈现良好的线性关系,相关系数(R2)大于0.999。猪肉、鸡肉组织中维吉尼霉素M1的检测限为0.5 μg/kg,定量限为2.0 μg/kg。在2~200 μg/kg (2MRL)添加浓度水平上,回收率范围为80% ~100%,批内、批间RSD均小于8.0%。该方法具有简便快捷、灵敏度高、定性准确等特点。
猪肉;鸡肉;维吉尼霉素M1;兽药残留;液相色谱-串联质谱法
维吉尼霉素药物又名弗吉尼亚霉素、肥大霉素,是维吉尼链霉素产生的一种环状多肽类抗生素。维吉尼霉素杀菌作用机理是通过干扰细菌的核糖体,进而抑制其蛋白质的合成[1],因此常用于猪、鸡等畜禽疾病的预防和治疗[2-3],尤其对鸡的产蛋性能有所提高[4-5]。但维吉尼霉素可能降低某些药物的药效,例如普那霉素,用于对耐万古霉素屎肠球菌(VREF)引起危及生命的严重感染的治疗,以及由甲氧西林敏感葡萄球菌(MSSA)和化脓性链球菌引起的复杂性皮肤和皮肤软组织感染的治疗[6]。欧盟从1999年开始禁止包括维吉尼霉素在内的抗生素作为饲料添加剂[7]。日本、美国和中国等也均对动物性食品中的残留限量作出严格的限定。日本规定牛奶和鸡蛋中维吉尼霉素的最高残留量为100 μg/kg[8]。我国农业部第235号公告[9]中规定维吉尼霉素在畜禽组织最高残留限量为:肌肉100 μg/kg、肝脏300 μg/kg、肾脏400 ~500 μg/kg。
由于维吉尼霉素是主要由M1和S1组分组成[10],M1组分约占维吉尼霉素总量的70%,因而检测目标多以维吉尼霉素M1为主[11]。目前,国内外对维吉尼霉素的检测方法的前处理方法都是采取传统的净化方法,而本文采用混合溶剂提取,新型的反相保留固相萃取小柱净化,节省了样品前处理时间。本研究旨在建立一种操作步骤简单、灵敏度高、准确性强的动物产品中维吉尼霉素M1的残留分析方法。
1 材料与方法
1.1 仪器 Agilent 1290-6460液相色谱-串联质谱仪,Agilent公司;TB-215D电子天平,赛多利斯科仪器公司;Sigma 3K30高速冷冻离心机,Thermo公司;MS3涡旋混合器,IKA公司;Oasis PRiME HLB(3cc,60 mg)固相萃取小柱,Waters公司。
1.2 药品和试剂 维吉尼霉素M1,纯度95%,TRC公司;甲醇、乙腈为色谱纯,美国Fisher公司;甲酸铵为分析纯,成都金山化学试剂有限公司;所用水为超纯水,Millipore超纯水仪制备。
1.3 标准溶液的配制 精密称取维吉尼霉素M110 mg,用甲醇溶解制成1 mg/mL的标准贮备液。量取标准储备液适量,用甲醇稀释成10 ug/mg标准工作液,再用0.01 mol/L甲酸铵溶液稀释成0.25~200 ng/mL系列标准工作液。
1.4 测定方法
1.4.1 色谱条件 色谱柱:C18柱(2.1 mm×50 mm,1.8 μm);流速0.3 mL/min;柱温30 ℃;进样量2.5 μL;流动相:A相为甲醇/乙腈溶液(50∶50,V/V),B相为0.003 mol/L甲酸铵缓冲液,等度洗脱,A∶B(50∶50,V/V)。
1.4.2 质谱条件 离子源:ESI+;检测方式:MRM;电离电压3.5 KV;源温125 ℃;雾化温度350 ℃;锥孔气流速10 L/min;雾化气流速5 L/min。定性、定量离子对及碎裂电压见表1。

表1 维吉尼霉素M1的质谱参数
1.4.3 样品的提取 称取试样(2.5±0.01)g,置于50 mL离心管中,加入10 mL 0.2%甲酸乙腈/水溶液(80∶20,v/v)涡旋30 s,高速振荡30 min,12000 r/min离心5 min,取上清液备用。
1.4.4 样品的净化 取5.0 mL备用样液过固相萃取柱,收集全部滤过液,取4.0 mL滤过液40 ℃下氮吹至小于0.5 mL,用流动相定容到1.0 mL,涡动混匀,0.22 μm滤膜过滤,供液相色谱-串联质谱仪测定。
1.4.5 标准曲线绘制 准确配制0.25、0.5、2、10、50、100、200 ng/mL的标准工作液,依次从低浓度到高浓度按液相色谱串联条件进行分析,每一浓度进样三次,按其所得三次峰面积的平均值与相应的标准工作液浓度作标准曲线,并计算回归方程及相关系数。
1.4.6 方法灵敏度 确定将适量维吉尼霉素M1标准工作液加入到空白试样,经上述方法进行前处理后,供液相色谱-串联质谱仪检测,观察药物征离子质量色谱峰信噪比(S/N)和对应药物浓度,S/N>3者定其为方法的检测限;S/N>10者定其为方法的定量限。
1.4.7 准确度和精密度的测定 采用标准添加法,在空白样品中添加2、10、100、200 μg/kg四个不同浓度药物进行回收率试验,各浓度进行5个样品平行试样,重复3次,求批内、批间RSD。
2 结 果
2.1 标准曲线 按照上述系列标准溶液浓度进行线性回归,得到的回归方程及变异系数见表2。

表2 维吉尼霉素M1线性回归情况
从表2中可以看出维吉尼霉素M1在0.25~200 ng/mL浓度范围内呈现良好的线性关系,R2>0.999。
2.2 方法的灵敏度 按照上述方法进行处理添加浓度为2.0 μg/kg时,测得维吉尼霉素M1的S/N>10,说明方法的定量限为2.0 μg/kg。当添加浓度为0.5 μg/kg时,测得维吉尼霉素M1的S/N>3,说明方法的检测限为0.5 μg/kg。10μg/kg添加猪肉组织样品中维吉尼霉素M1特征离子质量图谱见图1。
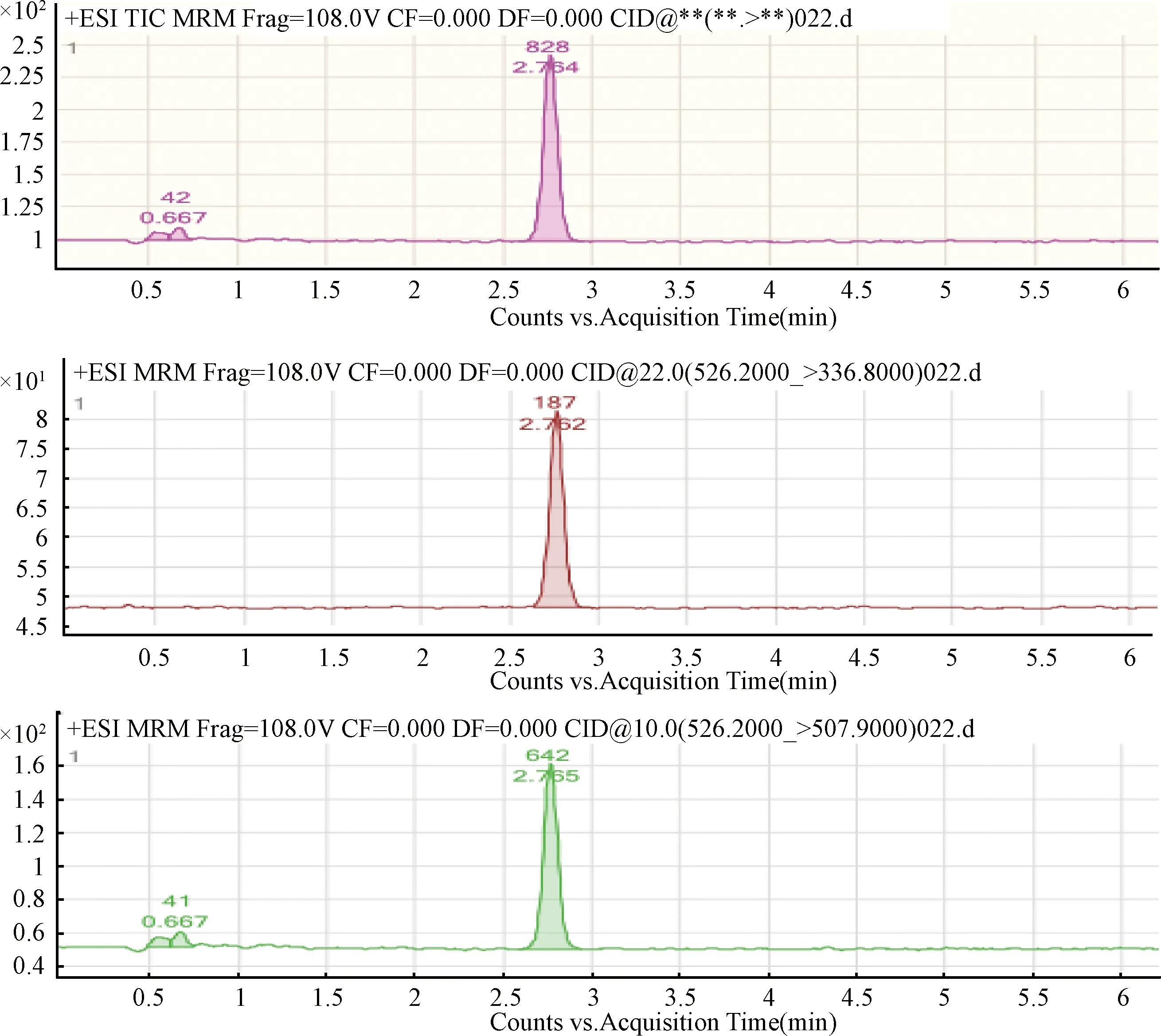
图1 10 μg/kg添加猪肉组织样品中维吉尼霉素M1特征离子质量色谱图
2.3 方法的精确度 在空白试样中添加2、10、100、200 μg/kg四个不同浓度的维吉尼霉素M1进行回收试验,结果汇总见表3。可以看出猪肉、鸡肉组织中维吉尼霉素M1平均回收率为80%~100%,批内RSD小于7.5%,批间RSD小于7.9%。
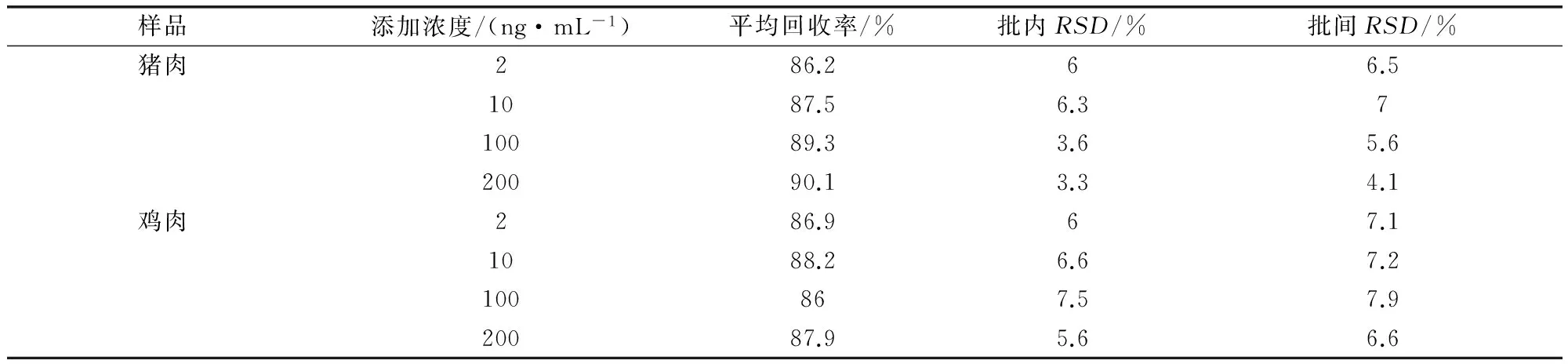
表3 维吉尼霉素M1添加回收率试验结果(n=5)
3 讨论与小结
3.1 提取溶剂的选择 根据维吉尼霉素不溶于非极性溶剂的特点[12],现有方法多使用甲醇、乙腈等极性有机溶剂对维吉尼霉素M1药物进行萃取。魏计云等[13]通过对乙腈、乙酸乙酯、乙酸乙酯-0.2 mol/L磷酸二氢铵3种提取溶剂的提取效果进行对比,发现采用混合溶剂的提取效果较好。国家标准GB/T 20765-2006《猪肝脏、肾脏、肌肉组织中维吉尼霉素M1残留量的测定液相色谱-串联质谱法》[14]中规定样品用甲醇-乙腈溶液提取,磷酸二氢铵缓冲液对提取液稀释。林维宜等[15]对比了甲醇-0.1%甲酸溶液和甲醇-磷酸二氢铵溶液的提取效果,发现磷酸盐会对维吉尼霉素等多肽类抗生素的质谱检测产生干扰,降低回收率。本实验为提高维吉尼霉素M1的提取效率,对国家标准方法中使用的提取溶剂进行优化,选择了0.2%甲酸-乙腈/水溶液作为样品提取液。
3.2 固相萃取柱的选择 现有方法多使用C18固相萃取小柱对样品提取液进行净化,但C18固相萃取柱的填料主要以硅胶为基质,同时在其表面键合非极性的十八烷基官能团,仅对脂肪的净化程度较好,不能净化磷脂;并且C18固相萃取柱填料硅胶基质在抽干时会产生疏水塌陷,对目标化合物的保留降低,二者皆会对试验结果造成影响。因此本试验选择了Oasis PRiME HLB反相保留固相萃取小柱,该小柱弥补了C18固相萃取柱不足之处。同时该小柱在净化样品提取液之前不用活化平衡,仅需样液直接过柱就可实现目标物的保留、清洗和洗脱,并且样品净化程度更高,去除了蛋白、盐和磷脂等95%以上的基质干扰物。这种新型小柱的使用减少了对前处理中样品的洗涤次数,对维吉尼霉素M1残留量造成的损失很小,提高了方法的回收率,同时也缩短了样品的前处理时间。
试验简化了猪肉、鸡肉组织中维吉尼霉素M1残留的检测方法的前处理步骤,较大程度提高了检测工作效率。通过对方法的线性关系、灵敏度、回收率和精密度等技术参数的考察,发现结果均能满足残留检测方法的要求。该方法具有快速简便、灵敏度高、抗干扰强等特点,为猪肉、鸡肉组织中维吉尼霉素M1残留检测提供了一个针对性强和更加简便快捷的方法,可作为常规方法进行日常批量分析检测。
[1] Dang J, Metzger R P, Brownlee R T C,etal. The conformational flexibility of the antibiotic virginiamycin M1 [J]. European Biophysics Journal, 2005, 34(5): 383-388.
[2] Stewart L L, Kim B G, Gramm B R,etal. Effect of virginiamycin on the apparent ileal digestibility of amino acids by growing pigs [J]. Journal of Animal Science, 2010, 88(5): 1718-1724.
[3] Shojadoost B, Peighambari S M, Nikpiran H. Effects of virginiamycin against experimentally induced necrotic enteritis in broiler chickens vaccinated or not with an attenuated coccidial vaccine [J]. Journal of Applied Poultry Research, 2013, 22(2): 160-167.
[4] Dibner J J, Richards J D. Antibiotic growth promoters in agriculture: history and mode of action [J]. Poultry Science, 2005, 84(4): 634-643.
[5] 陈燕军, 王权, 龚鹏飞. 维吉尼霉素用于提高蛋鸡的生产性能试验 [J]. 中国禽业导刊, 2004, (17): 63-64.
[6] 张乐乐, 许激扬, 陈代杰. 链阳菌素的作用机制与细菌耐药性 [J]. 世界临床药物, 2009, 30(11).
[7] Acar J, Casewell M, Freeman J,etal. Avoparcin and virginiamycin as animal growth promoters: a plea for science in decision-making [J]. Clinical Microbiology & Infection the Official Publication of the European Society of Clinical Microbiology & Infectious Diseases, 2000, 6(9): 477-482.
[8] 陈小霞, 岳振峰, 叶卫翔,等. 液相色谱串联质谱法快速测定牛奶与鸡蛋中的维吉霉素M1残留量[J]. 分析测试学报, 2009, 28(11):1328-1331.
[9] 中华人民共和国农业部. 中华人民共和国农业部公告第235号. 动物性食品中最高残留限量[EB/OL]
[10]陈小霞, 岳振峰, 叶卫翔, 等. 液相色谱三级四极杆质谱法快速测定动物组织中维吉霉素M1残留量 [J]. 食品与发酵工业, 2010, (04): 175-178.
[11]Situ C, Elliott C T. Simultaneous and rapid detection of five banned antibiotic growth promoters by immunoassay [J]. Analytica Chimica Acta, 2005, 529(1-2): 89-96.
[12]钱卓真, 罗冬莲, 罗方方,等. 高效液相色谱-串联质谱法测定养殖环境沉积物中多肽类抗生素残留量 [J]. 分析化学, 2016, 44(6).
[13]魏云计, 冯民, 刘艳,等. 液相色谱-电喷雾电离三重四级杆质谱测定畜禽肝脏中维吉尼亚霉素M1的残留量[J]. 分析试验室, 2012(4):50-53.
[14]GB/T 20765-2006猪肝脏、肾脏、肌肉组织中维吉尼霉素M1残留量测定液相色谱-串联质谱[S].
[15]林维宣, 孙兴权, 田苗,等. 动物组织中粘杆菌素、杆菌肽及维吉尼霉素残留量的液相色谱-串联质谱检测 [J]. 分析测试学报, 2009, 37(03): 212-215.
(编辑:陈希)
Determination of Virginamycin M1Resedues in Pork and Chicken by LC-MS/MS
YUE Xiu-ying,SUN Ji,WU Xiao-lan,LU Qiang,LI Ran,GE Rong*
(SichuanInstituteofVeterinaryDrugControl,Chengdu610041,China)
A LC-MS/MS method was established for the determination of virginamycin M1resedues in pork and chicken .The samples were extracted by 0.2%formate of acetonitrile-water solution (80∶20,V/V),then purified and concentrated on an Oasis PRiME HLB cartridge ,and then determined by LC-MS/MS.The results showed the good linearity in the rage of 0.25~200 ng/mL with correlation coefficients(R2) above 0.999,The limit of detection of the method was 0.5 μg/kg,and the limit of quantification was 2.0 μg/kg,The average recoveries at 2~200 μg/kg (2MRL) were 80%~100%,and intra-and inter-batchRSDwere﹤8.0%.The method is simple,rapid,sensitive and accurate.
pork;chicken;virginamycin M1;veterinary residue;LC-MS/MS
岳秀英,博士,高级兽医师,从事兽药残留分析方面研究。
葛荣。E-mail:sunji_0@163.com
2016-08-04
A
1002-1280 (2017) 02-0040-04
S859.84

