Ilk对LPS诱导小鼠乳腺上皮细胞分泌炎性因子的影响
王玉坤,杨航,冯将,魏玉好,易琼,王鲁*(1.贵州大学动物科学学院,贵阳 55005;.贵州省生化工程中心,贵阳 55005;.河南金泰生物技术股份有限公司,郑州 450000)
Ilk对LPS诱导小鼠乳腺上皮细胞分泌炎性因子的影响
王玉坤1,2,杨航3,冯将1,2,魏玉好1,2,易琼2,王鲁2*
(1.贵州大学动物科学学院,贵阳 550025;2.贵州省生化工程中心,贵阳 550025;3.河南金泰生物技术股份有限公司,郑州 450000)
为探究Ilk对LPS诱导小鼠乳腺上皮细胞(MECs)分泌炎性因子IL-8、TNF-α的影响,采用siRNA技术筛选最佳转染条件,qPCR法和ELISA法检测siRNA转染后下游蛋白Akt1的表达来评价Ilk沉默,ELISA法检测Ilk沉默后对小鼠MECs分泌炎性因子IL-8、TNF-α的影响。结果显示:选用Ilk-mus-595片段的20 nM转染组可极显著抑制Ilk的mRNA表达(P<0.01),转染效率最好,达84.83%;Ilk转染后可显著减少LPS介导的Akt1 mRNA的转录和蛋白表达(P<0.05);可显著减少LPS介导的TNF-α分泌(P<0.05),但各组IL-8的量无变化(P>0.05)。结果提示:利用siRNA成功转染的Ilk可以影响细胞内Akt1的表达,降低细胞分泌的TNF-α含量,Ilk可能与小鼠MECs的抗炎有关,可作为靶基因进行更加深入的研究,以期为乳腺炎症的治疗提供新的思路及数据参考。
乳腺上皮细胞;Ilk基因;炎性因子
整合素连接激酶(integrin-linked kinase,Ilk)是一种丝氨酸/苏氨酸蛋白激酶,在全身多种组织均表达,可参与生物体内多种信号通路并发挥着关键作用[1]。目前研究表明,Ilk作为一种癌基因与许多肿瘤的形成、凋亡、黏附、增殖、侵袭和转移密切相关[2],研究还表明Ilk与LPS介导肿瘤细胞高表达炎性细胞因子IL-6有关[3]。有文献报道乳腺上皮细胞(MECs)在病原微生物侵入乳腺时,能分泌细胞炎性因子,如IL-1β、IL-6、IL-8和TNF-α[4],进而趋化中性粒细胞进入乳腺感染区,抵抗病原菌的感染[5],产生炎性因子与LPS刺激有关[6]。通过基因芯片技术发现,在LPS刺激下小鼠MECs上Ilk mRNA的表达发生了显著变化[7],然而,Ilk与LPS诱导乳腺上皮细胞分泌细胞炎性因子TNF-α和IL-8是否相关却未见报道。本研究利用Ilk siRNA转染小鼠乳腺上皮细胞沉默Ilk基因,探讨Ilk的表达对LPS 诱导小鼠乳腺上皮细胞分泌IL-8和TNF-α的影响,以期找到与乳腺炎症相关的关键靶点,这对乳腺炎症等相关疾病的治疗具有重要的意义,也为新药的开发和应用提供理论依据。
1 材 料
1.1 实验动物 SPF级3月龄的妊娠中期昆明小白鼠,体重(32±2)g,购自解放军第三军医大学实验动物中心(动物许可证号:SCXK(渝) 2012-0003),由贵州大学贵州省生化工程中心SPF级动物实验室(动物许可证号:SYXK(渝) 2013-0001)饲养。
1.2 试剂 DMEM/F12培养基、胎牛血清(FCS),Thermo scientific公司;小鼠表皮生长因子(rhEGF),SAB公司;胰岛素(Insulin)、L-谷氨酰胺、霍乱毒素(CT)、脂多糖(LPS),Sigma公司;I型胶原酶和II型胶原酶,Solarbio公司;Power SYBR Green PCR Master Mix,AB公司;动物组织/细胞RNA提取试剂盒,2×EsTaq MasterMix,北京康为世纪生物科技有限公司;mouse TNF-α ELISA kit、mouse IL-8 ELISA kit,武汉基因美生物公司;
1.3 实验仪器 ThermoFisher 8000储水型CO2细胞培养箱、MultiskanGo型全波段酶标仪,Thermo公司;qTOWER实时荧光定量RT-PCR仪,德国jena公司;T100 Thermal Cycler温度梯度PCR仪、GelDoc XR+ 凝胶成像系统,BIO-RAD公司。
2 方 法
2.1 细胞的制备 参照文献方法[4],选用3月龄的妊娠中期昆明小鼠1只,压颈处死小鼠,解剖并分离小鼠乳腺组织,用眼科剪将乳腺组织剪为1 mm×1 mm×1 mm大小的组织块。用混合酶消化液8 mL将乳腺组织转移到25 mL的三角锥形瓶中,密封放入37 ℃水浴锅中消化1 h,终止消化后将细胞消化液用细胞筛(160目)过滤,收集滤液,1000 r/min离心5 min,弃上清,在离心管中加入适量含10%FCS/DMEM/F12培养液悬浮细胞团。采用差速贴壁法纯化细胞后,将细胞悬液重新转移入细胞培养瓶中,置入37 ℃、5% CO2培养箱中静置培养,隔24 h换液1次,培养4 d。
2.2 实时荧光定量RT-PCR筛选Ilk的siRNA最佳转染条件 按2.1项方法制备小鼠MECs,将100 μL 5×105个/mL的细胞悬液加入24孔细胞培养板中,另加培养液400 μL,在5% CO2,37 ℃培养箱培养24 h,使用动物组织/细胞RNA提取试剂盒提取细胞的RNA,尽快用TIANScriptcDNA第一链合成试剂盒将提取的RNA逆转录,并于-80 ℃保存备用。从GeneBank获得Ilk基因序列,使用Primer 5.0设计引物,以Gapdh为内参基因,采用梯度PCR技术检测基因的最佳退火温度(表1)。
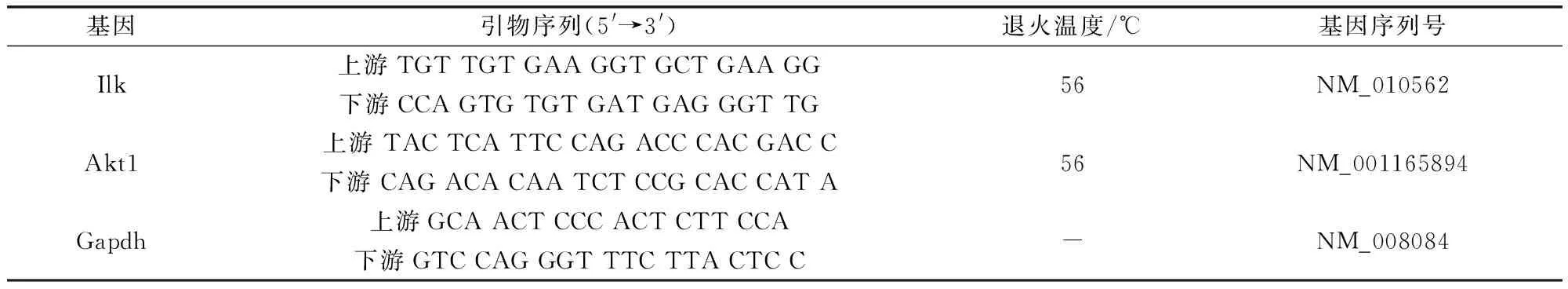
表1 qPCR 的引物序列及退火温度

表2 siRNA序列
根据NCBI数据库中小鼠Ilk的mRNA序列设计了2条siRNA片段(表2)。于转染前24 h,接种适当数量的小鼠MECs至24孔细胞培养板中,待细胞生长至30%~50%融合时,分别将转染片段加入细胞,使其各组终浓度分别为50 nM、30 nM、20 nM,另设空白对照组,转染培养24 h后,按照2.2项方法提取各孔细胞总RNA,将获得的总RNA反转录成cDNA,并于-80 ℃保存备用。
10 μL反应体系中,加入5 μL SYBR Green,2 μL模板cDNA,0.8 μL引物,用无RNase的水补充体积至10 μL。然后进行PCR反应和荧光测定。荧光定量RT-PCR反应程序为:95 ℃预热5 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,自变性开始三步为一个循环,共设40个循环;72 ℃延伸2 min,使产物延伸完全。反应结束后自50~95 ℃绘制溶解曲线。测定结果使用2-△△Ct法进行相对定量,计算转染效率,根据转染率筛选最佳转染条件。其中:(1)△△Ct=(Ct目的基因-Ct内参)转染后-(Ct目的基因-Ct内参)转染前;(2)转染率=1-2-△△Ct。
2.3 Ilk转染效果评价
2.3.1 实时荧光定量RT-PCR检测Ilk转染后下游蛋白Akt1 mRNA表达量 将适当浓度的小鼠MECs细胞接于12孔细胞培养板(共接2块板),待其生长至50%融合,设置4个实验组:转染组、NC组、脂质体组、正常对照组,转染组选用RT-PCR结果筛选出的最佳有效siRNA的浓度,NC组(阴性对照组)选用NC片段,脂质体组只选用转染的质粒。转染24 h后,抽去各孔中的培养基,加入终浓度为10 μg/mL含LPS生长培养液,继续培养24 h。按2.2项抽提各孔的总RNA,反转录,采用实时荧光定量RT-PCR测定Akt1 mRNA的转录量。
2.3.2 ELISA法检测Ilk转染后细胞内Akt1蛋白量 按2.3.1项方法对小鼠MECs采用相同处理,培养完成后,每孔取上清液,按照ELISA试剂盒说明书的方法,分别测定细胞内Akt1的蛋白量。
2.4 ELISA法检测Ilk转染后细胞分泌TNF-α、IL-8量 按2.3.1项方法对小鼠MECs采用相同处理,培养完成后,每孔取上清液,按照ELISA试剂盒说明书的方法,分别测定细胞分泌的TNF-α、IL-8的含量。
3 结果与分析
3.1 Ilk的siRNA最佳转染条件筛选结果 结果如图1、图2显示,与空白组比较,各转染组Ilk mRNA的表达量均显著下降(P<0.05)。其中Ilk-mus-595片段在50 nM、30 nM、20 nM浓度下的转染效率分别为76.97%、63.52%、84.83%,与空白组相比Ilk的mRNA表达均被极显著抑制(P<0.01);Ilk-mus-763片段在50 nM、30 nM、20 nM的转染效率分别为51.29%、53.90%、37.88%,其中50 nM和30 nM浓度下与空白组相比Ilk的mRNA表达均被极显著抑制(P<0.01),20 nM浓度下Ilk的mRNA表达被显著抑制(P<0.05)。比较各组转染率,Ilk-mus-595片段的20 nM浓度下转染率最高。
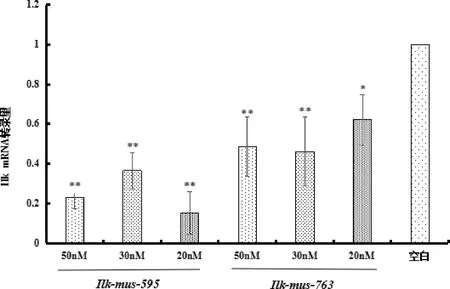
图1 RT-PCR法检测Ilk相对转录水平
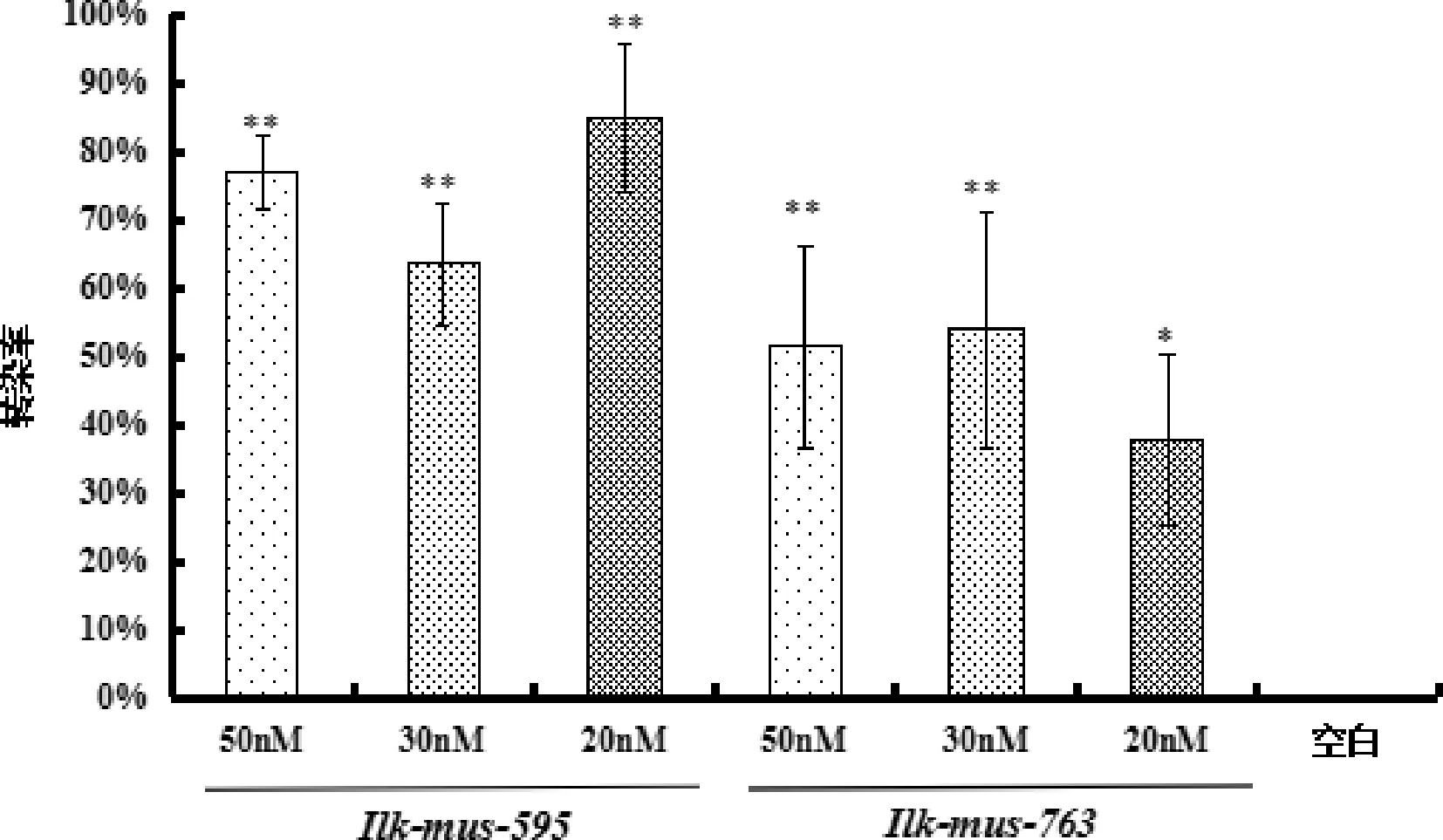
图2 Ilk-mus-595和Ilk-mus-763片段各组小鼠MECs转染率(**与空白组相比,P<0.01;*与空白组相比,P<0.05)
3.2 Ilk转染后对下游蛋白Akt1影响的结果3.2.1 Ilk转染后Akt1 mRNA表达量结果 如图3所示,与对照组相比,转染组中Akt1的mRNA表达量降低了20.2%,且差异显著(P<0.05),而NC组和脂质体组的表达量与对照组相比基本没有变化。
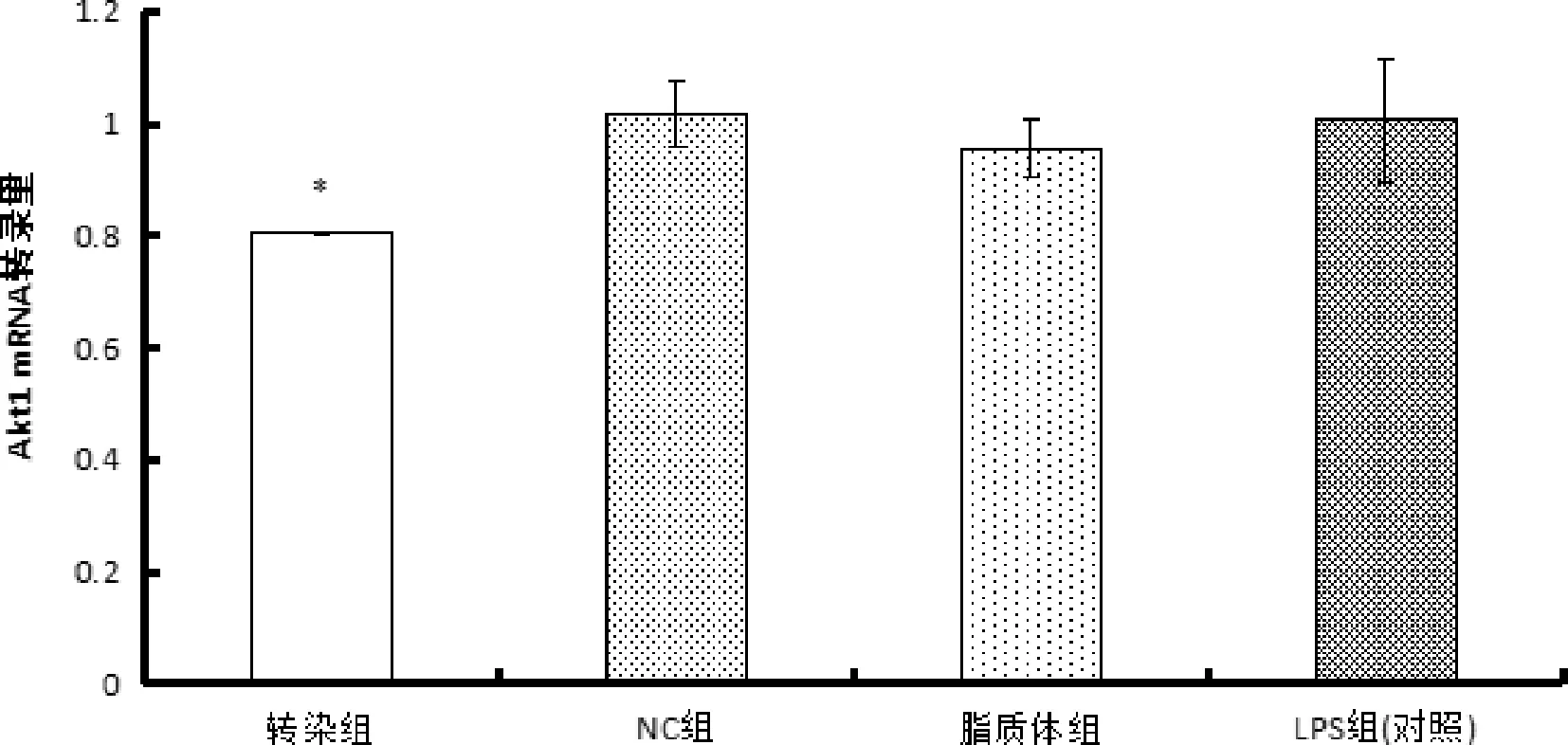
图3 RT-PCR法检测Akt1相对转录水平(** 与对照组相比,P<0.01;* 与对照组相比,P<0.05)
3.2.2 Ilk转染后细胞内Akt1蛋白量结果 如图4显示,同对照组相比,转染组Akt1的含量显著性降低(P<0.05),而NC组和脂质体组的蛋白量与对照组相比基本没有变化。
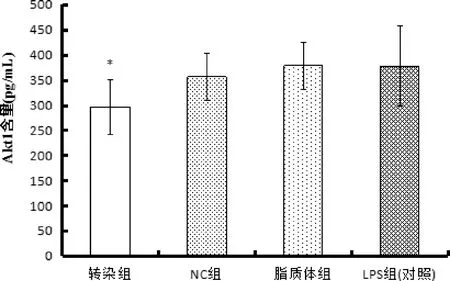
图4 ELISA 法检测细胞分泌Akt1的水平
3.3 Ilk转染后细胞分泌TNF-α、IL-8量的结果 如图5显示,同对照组相比,转染组TNF-α的含量显著性降低(P<0.05),而NC组和脂质体组与对照组相比基本无变化;图6结果显示,同对照组相比,转染组IL-8的含量无显著性降低(P>0.05),不具有统计学意义,NC组和脂质体组与对照组相比基本无变化。
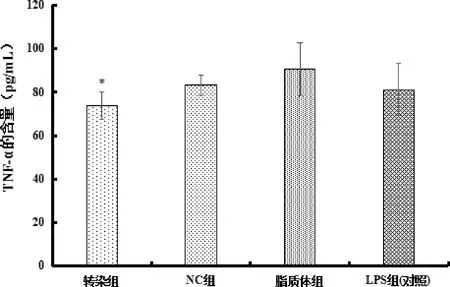
图5 各组TNF-α含量
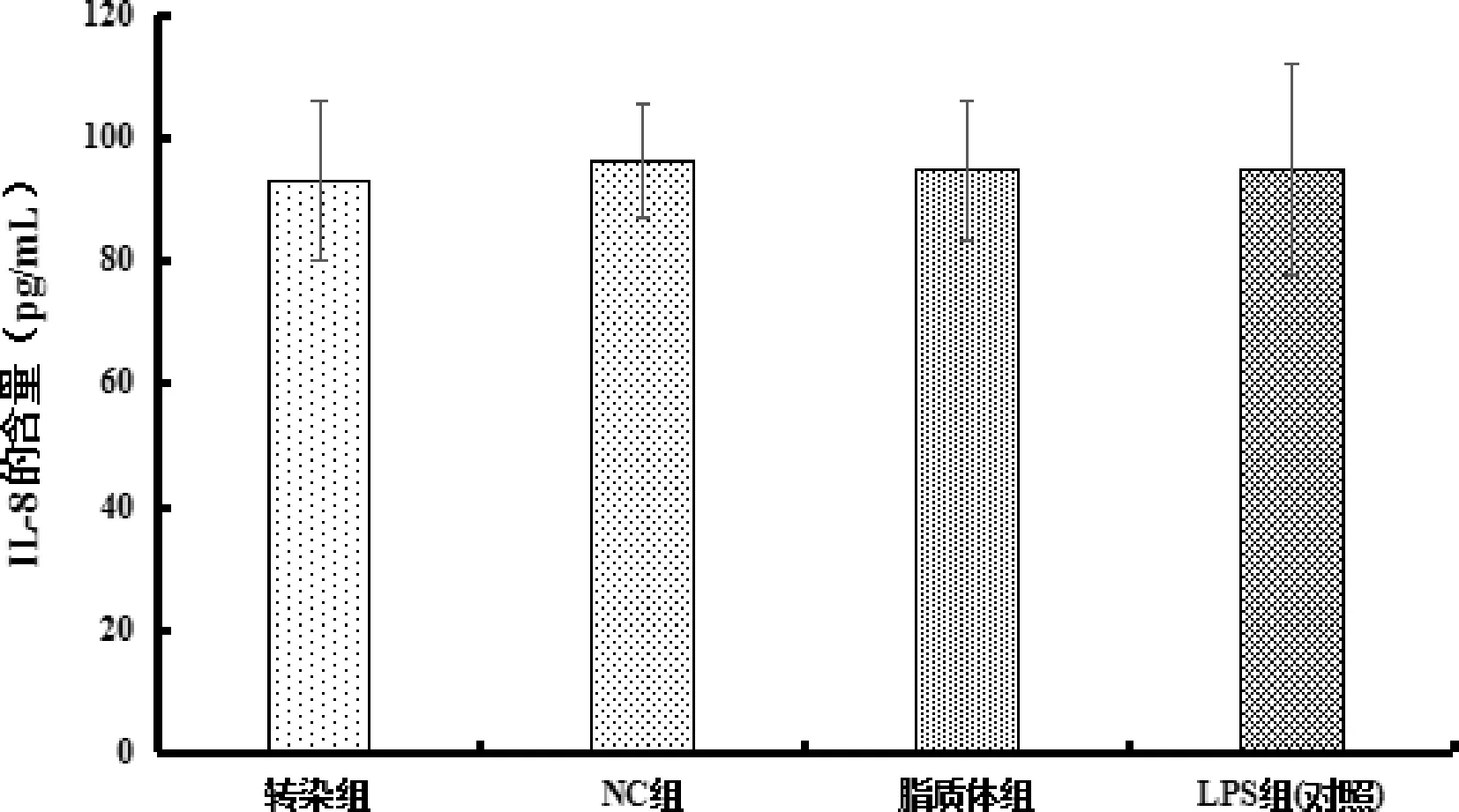
图6 各组IL-8含量(*与对照组相比,P<0.05)
4 讨论与小结
整合素连接激酶在全身的多种组织广泛表达,尤其在骨骼肌和心脏中高表达,因其自身三个结构域作用,使得Ilk成为整合素信号通路中的关键激酶,介导细胞外基质(extracellular matrix,ECM)对细胞的调控,从而参与细胞的增殖、迁移、葡萄糖代谢等多个方面的调控[8],还与血管发育、肿瘤血管生成、神经系统发育、心肌肥厚以及细胞免疫等相关[9]。研究还表明Ilk与LPS介导肿瘤细胞高表达炎性细胞因子IL-6有关。LPS是存在于革兰氏阴性菌上的PAMP,它能与免疫细胞膜上的模式受体相互作用,激活胞内TLR4信号通路相关分子的活化。通过基因芯片技术,发现LPS可引起PI3K/Akt信号通路的活化[7],提示TLR4信号通路与PI3K/Akt信号通路可能会相互影响,调节机体免疫应答。因此猜测,PI3K/Akt信号通路也可能会调控细胞因子的分泌,因Ilk分子是该通路的主要参与者,为此尝试探究Ilk能否成为调控关键炎性细胞因子分泌的新靶向基因。
研究发现,Akt1作为Ilk重要的作用底物,其上游基因Ilk的激活能直接引起Akt1的磷酸化。据报道,肿瘤抑制因子PTEN突变的人前列腺癌细胞中Ilk活化可引起Akt1的磷酸化;而抑制Ilk可以抑制Akt1的磷酸化,并诱导细胞周期停滞进而发生凋亡[10]。有报道PI3K异性抑制剂可以显著的抑制LPS刺激后肝脏内Akt1活化,并降低肝细胞核SREBP-1c的活化,说明LPS可以通过TLR4和PI3K信号通路介导肝脏Akt1的磷酸化[11];另有研究表明LPS刺激过表达ILK的A549细胞后,细胞因子的表达也呈现显著的增高,提示外源性炎症因子LPS与A549细胞表面TLR4结合后,促进了A549细胞产生炎性细胞因子IL-6[12]。这一系列研究都表明PI3K/Akt信号通路与LPS刺激信号通路的活化关系密切,也为本试验研究奠定了理论基础。
为了明确Ilk基因的沉默是否会影响LPS刺激下小鼠MECs中PI3K/Akt信号通路的活化,本试验利用siRNA转染技术抑制了基因Ilk的表达,结果显示与LPS刺激组相比,转染组显著下调了Akt1的mRNA的转录水平,这说明Ilk表达被抑制之后影响了下游Akt1的表达;通过检测转染后的蛋白水平,结果显示其表达量有所下降,说明Ilk的表达抑制,会对其下游的靶点Akt1产生一定的影响,这与肿瘤细胞的报道一致[9]。PI3K/Akt信号通路会受到干扰,是否会影响炎性因子的表达?本研究进一步测定了TNF-α和IL-8的含量,结果发现基因Ilk表达被抑制后,上清液中IL-8含量几乎没有变化;而TNF-α含量显著降低 (P<0.05)。结果说明,抑制基因Ilk的表达,从而抑制了其下游基因Akt1的活性,PI3K/Akt信号通路的下调对TLR4信号通路的持续活化有一定的干扰作用,进而抑制NF-κB的活化,最终降低细胞分泌细胞因子TNF-α的减少,进而可减轻LPS引起小鼠MECs炎性反应时对细胞的损伤。然而其为何只影响TNF-α的分泌,对IL-8分泌没有影响的现象有待进一步深入研究。
[1] 储昭节,周健,惠延年.ILK siRNA对高浓度葡萄糖诱导的人LECs增生和上皮向间质转化的抑制作用[J].眼科研究,2009,27(5):353-357.
[2] 赵勇.ILK-整合素信号传导通路中的关键激酶[J].国外医学分子生物学分册,2001,23(6):366-369.
[3] 刘璟,陈全,陈炎,等.ILK对LPS诱导肺癌A549细胞分泌免疫逃逸相关因子的影响[J].免疫学杂志,2013,29 (4):291-295.
[4] 易琼. 小鼠乳腺上皮细胞的体外培养及其天然免疫功能的探究[D]. 贵阳:贵州大学, 2012.
[5] Pareek R,Wellnitz O,VanDorp R,etal.Immunorelevant gene expression in LPS-challenged bovine mammary epithelial cells[J].J Appl Genet,2005,46(2):171-177.
[6] 李欣,李中改,张小艺,等.金英黄归汤对LPS介导乳腺上皮细胞TLR4信号通路中相关因子的影响[J].畜牧兽医学报,2016,47(3):609-614.
[7] 杨航.小鼠乳腺上皮细胞TLR4信号途径的研究[D]. 贵阳:贵州大学,2013.
[8] 王晓红.ILK在SD大鼠皮肤烧伤创面愈合过程中的作用[D]. 贵阳:暨南大学,2014.
[9] Ho B,Bendeck M P.Intergrin linked kinase(Ilk)expression and function in vascular smooth muscle cell[J].Cell AdhMigar,2009,3(2):174-176.
[10]Persad S, Attwell S, Gray V,etal. Inhibition of integrin-linked kinase(ILK) suppressesactivation of protein kinase B/Akt and induces cell cycle arrest and apoptosis of PTEN-mutant prostate cancer cells [J]. Proc Natl Acad Sci USA, 2000, 97(7): 3207-3212.
[11]张志辉. TLR4/MyD88介导的PI3K/Akt信号在调节小鼠肝脏糖脂代谢中的作用 [D]. 安徽: 安徽医科大学, 2013.
[12]孙晓杰,林梁,赵玫,等.ILK与HSP90相互作用对乳腺癌细胞迁移影响及其机制的探讨[J].中华肿瘤防治杂志,2012,19(3):161-165.
(编辑:侯向辉)
Effects of ILK on Secretion of IL-6 and TNF-α in LPS-stimulated Mammary Epithelial Cell
WANG Yu-kun1,2,YANG Hang3,FENG Jiang1,2,WEI Yu-hao1,2,YI Qiong2,WANG Lu2*
(1.CollegeofAnimalScience,GuizhouUniversity,Guiyang550025,China;2.BiochemicalEngineeringCenterofGuizhouProvince,GuizhouUniversity,Guiyang550025,China;3.HenanJintaiBiologicalStockLimitedCorporation,Zhengzhou450000,China)
To investigate the effect of Ilk on secretion of IL-8 and TNF-α in LPS-stimulated mammary epithelial cells (MECs),Ilk gene was transfected with RNA interference, then the best transfection concentration was obtained by real-time quantitative RT-PCR. Meanwhile, the transfection efficiency was evaluated by the Akt1 relative transcript levels assayed by RT-PCR and the content of Akt1 protein measured by ELISA.The content of IL-8 and TNF-α in the mouse MECs were measured by ELISA.The results showed that the transfection efficiency of Ilk-mus-595 in 20 nM was highest (84.83%),which could significantly inhibited Ilk mRNA expression(P<0.01). When the mouse MECs was transfected with siRNA of Ilk and stimulated with LPS, compared with the control group, the expression of Akt1 mRNA and protein was significantly reduced after the silence of Ilk gene (P<0.05). The secretion of TNF-α was prominently reduced (P<0.05), but there was no change (P>0.05) on the IL-8 content in each group.These results indicated that the silence of Ilk could change the expression of Akt1 and reduce the secretion of TNF-α in LPS-stimulated MECs, which proved that its anti-infection effect maybe related to Ilk,so Ilk could be chosen as a target gene to further explore the immune function of mouse MECs. Which can provide new train of thought and experimental data for treatment of mammary gland inflammation and provide theoretical basis for the development and application of new drugs.
MECs;Ilk; cytokine
2016-10-08
A
1002-1280 (2017) 02-0059-05
S852.331
国家自然科学基金项目(31260618; 31470128)
王玉坤,硕士研究生,从事中兽医学及中药药理研究。
王鲁。E-mail:wanglu7007@163.com

