进展性脑梗死患者血清HMGB1、FKN动态变化研究
盖昱辛, 盛宝英, 韩 凤, 魏春杰, 李丛言
进展性脑梗死患者血清HMGB1、FKN动态变化研究
盖昱辛, 盛宝英, 韩 凤, 魏春杰, 李丛言
目的 探讨高迁移率族蛋白B1(HMGB1)及不规则趋化因子(FKN)在进展性脑梗死中的可能作用机制。方法 用酶联免疫吸附试验(ELISA)法检测急性脑梗死患者不同时期血清HMGB1及FKN水平变化,根据斯堪的纳维亚脑卒中量表(scandinavian stroke scale,SSS)评分分为进展组和非进展组。根据梗死体积将180例患者分为大梗死灶组、中梗死灶组、小梗死灶组。另纳入30例健康体检者作为对照组。结果 180例急性脑梗死患者中有35例(19.44%)发展为进展性脑梗死。进展组SSS基线评分低于非进展组,差异有统计学意义(P<0.05)。进展性组患者发病后1 d、7 d、14 d血清HMGB1、FKN水平高于非进展组和对照组,有统计学意义(P<0.05)。梗死灶体积大则血清HMGB1、FKN水平高(P<0.05)。结论 血清HMGB1、FKN增加可能通过增加炎症反应促进动脉粥样硬化形成和进展,加重脑组织损伤,导致脑梗死患者病情进展。
进展性脑梗死; HMGB1; FKN
进展性脑梗死指发病后6 h~1 w内神经功能损害进行性加重或虽经临床治疗病情仍呈进展性恶化的一类脑梗死,约占脑梗死的20%~40%。目前已经明确脑梗死的主要病理基础是动脉粥样硬化,而炎症损伤机制在动脉粥样硬化病理损伤中的作用和地位尤为突出。脑缺血发生后,机体发生一系列免疫防御反应,众多炎症介质、趋化因子异常表达与释放对脑组织产生直接和间接的毒性作用是神经元继发损伤重要的病理基础。高迁移率族蛋白 1(high mobility group Box-1,HMGB1)是高度保守的核蛋白,当组织受到内源性刺激或外源性刺激后,可释放至细胞外,与受体结合后作为重要的炎症介质参与局部及全身的炎症反应过程[1]。在动脉粥样硬化的病理改变中,激活的平滑肌细胞和单核巨噬细胞是 HMGB1 的重要来源,能促进动脉粥样硬化的进展和易损斑块破裂[2]。不规则趋化因子(Fractalkine/CX3CL1,FKN)是一种兼具介导细胞黏附和趋化双重生物学作用的趋化因子,可通过加强淋巴细胞、单核细胞向血管内皮细胞趋化、黏附导致血管内皮细胞受损,也可通过增加血小板活化及黏附,促进动脉粥样硬化斑块形成[3]。本研究通过检测进展性脑梗死患者和非进展性脑梗死患者不同时期血清HMGB1及FKN水平变化,探讨其是否能影响脑梗死进展。
1 材料与方法
1.1 一般资料 研究对象:选取2015年6月-2016年6月我院神经内科住院治疗的急性脑梗死患者180例。根据入院后脑梗死是否进展分为进展组和非进展组,其中进展组患者35例,男24例,女11例,平均年龄(56.20±7.22)岁;非进展组患者145例,男86例,女59例,平均年龄(54.84±7.86)岁。根据发病后24 h头部CT计算脑梗死体积,脑梗死体积>10 cm3为大梗死灶组(54例);体积4~10 cm3为中梗死灶组(64例);体积<4 cm3为小梗死灶组(62例)。另外,选择同期30例健康体检者作为对照组,其中男20例,女10例,平均年龄(55.87±7.54)。诊断标准:急性脑梗死患者符合《中国急性缺血性卒中诊治指南2014》的诊断标准[4]。进展性脑梗死患者符合2003年欧洲进展性脑卒中研究组(European Progressing Stroke Study Group,EPSS)制订的进展性脑梗死诊断标准[5]。发病第3天神经系统症状和基线评分对比,在SSS评分里的意识水平、上下肢运动或者眼球运动加重≥2分(或)在言语功能加重≥3分或发病后72 h以内死亡的患者。排除标准:其他脑部疾病(颅内占位、颅脑外伤、颅内感染、脑出血)、感染性疾病、血液病、风湿免疫病、急性心血管事件、重度肝肾功能衰竭等患者。
1.2 方法 病例组分别于入院第1天、第7天、第14天,对照组于查体当天,均抽取空腹静脉血3 ml,于3000 r/min离心15 min,分离上层血清,-20 ℃冰箱保存,用于检测HMGB1和FKN。HMGB1、FKN均采用酶联免疫吸附法(ELISA法),试剂盒购自上海西唐生物科技有限公司。

2 结 果
2.1 进展组与非进展组一般临床资料、SSS基线评分、梗死灶体积、梗死部位对比 180例急性脑梗死患者中有35例发展为进展性脑梗死,占急性脑梗死患者的19.44%。 两组患者一般临床资料上不存在统计学差异(P>0.05)。梗死部位与梗死灶体积不存在统计学差异(P>0.05)。进展组SSS基线评分低于非进展组,差异有统计学意义(P<0.05)(见表1)。
2.2 进展组、非进展组、对照组患者血清HMGB1测定结果比较 进展组患者不同时间血清HMGB1水平高于同期的非进展组和对照组,差异有统计学意义(P<0.05);非进展组患者不同时间血清HMGB1水平高于同期的对照组,差异有统计学意义(P<0.05)(见表2)。
2.3 进展组、非进展组、对照组患者血清FKN测定结果比较 进展组患者不同时间FKN水平高于同期的非进展组和对照组,差异有统计学意义(P<0.05);非进展组患者不同时间FKN水平高于同期的对照组,差异有统计学意义(P<0.05)(见表3)。
2.4 急性脑梗死患者梗死灶体积与发病第1天血清HMGB1、FKN水平的关系 大梗死灶组患者血清HMGB1、FKN水平高于中梗死灶组、小梗死灶组(P<0.05);中梗死灶组患者血清HMGB1、FKN水平高于小梗死灶组(P<0.05)(见表4)。
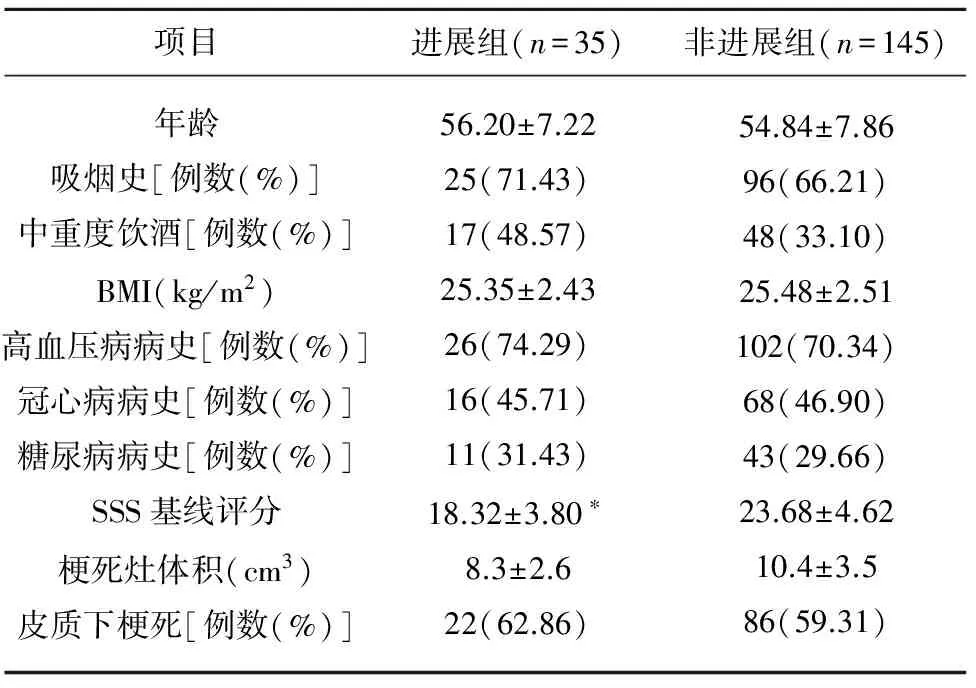
表1 进展组与非进展组一般临床资料、SSS基线评分梗死灶体积、梗死部位对比
与非进展组比较*P<0.05

表2 3组血清HMGB1测定结果比较(pg/ml)
与对照组比较*P<0.05;与非进展组比较#P<0.05

表3 3组血清FKN测定结果比较(pg/ml)
与对照组比较*P<0.05;与非进展组比较#P<0.05

表4 急性脑梗死患者不同梗死灶体积与血清HMGB1、FKN水平比较
与小梗死灶组比较*P<0.05;与中梗死灶组比较#P<0.05
3 讨 论
进展性脑梗死发生机制尚未完全明确,其危险因素有血压、血糖、发热、感染、癫痫发作、脑水肿等。病理生理机制包括动脉硬化斑块的破裂、炎性介质的激活、自由基损伤、兴奋性氨基酸毒性作用等。急性脑血管病发生的早期标志即是动脉粥样硬化,鉴于目前认为动脉粥样硬化本质上是一种多器官系统的无菌性炎症性疾病[6],所以,研究影响动脉粥样硬化进程的炎性反应受到广泛重视。动脉粥样硬化始于血管内皮功能障碍,血管内皮损伤后,其维持血管稳态、预防血栓等作用减弱,血管内平衡被破坏,在这慢性病理过程中,单核细胞迁移、泡沫细胞形成、血管平滑肌细胞增殖和炎性细胞浸润,形成粥样斑块。炎性反应的激活调节着动脉粥样硬化的形成、易损斑块的破裂,加重供血动脉的硬化与狭窄,是脑卒中进展的高危因素。吞噬细胞、淋巴细胞等炎症细胞在斑块内的浸润数目,一定程度上可反应斑块的炎症严重程度和判定斑块的不稳定性。
流行病学资料显示,进展性脑梗死的发生率国内外统计数据差别较大,国内约20%~40%;国外为9%~43%。本组研究选取一段时间内发生急性脑梗死患者180例,其中病情进展的患者为35例,约占总样本数19.4%,与国内统计数据有所差别。其原因可能为近年患者就医及时和医从性增高、治疗方案更新、影像学检查的发展、对心脑血管疾病危险因素的预防加强。且来我院就诊患者的特点、脑梗死的分型、进展性脑梗死诊断标准的使用不同所得出的结论也存在差异。研究过程中发现进展组患者入院时SSS基线评分低于非进展组,有统计学意义,其原因可能为SSS评分低意味着缺血损害范围广泛,累及语言、意识、肢体运动等方面功能,发生狭窄的血管往往是颈内动脉、大脑中动脉等大血管,发生闭塞时,缺乏有效的侧枝循环,缺血半暗带区发生不可逆损伤,使病情发生进展。
HMGB1属于高迁移率族蛋白家族,因其在凝胶电泳时泳动速度快而得名,广泛存在于哺乳动物的细胞核中,受到病理性损伤或内源性致炎因子刺激后可释放到细胞外[7]。作为炎症反应的关键调控分子,在脑梗死免疫炎症过程发挥的生物学作用逐渐受到重视。HMGB1主要表达于内皮细胞、平滑肌细胞以及巨噬细胞。在动脉粥样硬化病变内膜处,HMGB1不仅在胞浆中表达增加而且还能弥散释放到斑块基质内,刺激巨噬细胞的迁移、平滑肌细胞聚集,并募集其它免疫细胞以及增加多种炎症介质MCP-1,VCAM-1等释放[8]。在大脑中动脉闭塞动物模型中,HMGB1最初出现在神经元胞浆,而后迅速消失,被分泌至胞外[9]。释放至细胞外的HMGB1一方面可作为早期炎症介质,介导多种细胞合成和分泌炎性介质和促炎细胞因子,放大了脑组织的缺血再灌注损伤和炎症反应[10];另一方面也可认为是晚期炎症介质,激活单核巨噬细胞,主动分泌HMGB1,促进平滑肌细胞增殖并迁移至内膜,在趋化因子作用下,使更多炎症细胞聚集,进一步放大炎症反应。综上所述,前期研究已表明HMGB1在动脉粥样硬化的进展过程中扮演的上游炎症介质作用已被广泛证实,脑卒中后,由于血脑屏障破坏,HMGB1可以从中枢神经系统释放入外周血,通过测定血清中的HMGB1水平可以反映中枢神经系统HMGB1的表达水平以及脑损伤的程度。本实验结果显示,血清HMGB1水平在发生脑梗死时会有明显持续性升高,在第7天达到高峰,进展组患者高于同时期非进展组及正常对照组,在脑缺血2 w后仍呈较高水平表达。说明进展性脑梗死的无菌性炎症较非进展性更为剧烈。梗死发生后,HMGB1的过度表达提示着脑组织损伤后产生大量炎症因子抗原,引起严重的免疫应答反应,进而激活多种炎症细胞释放致炎因子,调控周围炎性反应,维持和放大生物学效应,HMGB1作为一种多效应的炎症调节因子,其强烈的致炎作用使动脉粥样硬化进展、斑块破裂、脑损伤加剧,可能对脑梗死进展有预测意义。
FKN属于CX3C家族,主要表达于血管内皮细胞和神经细胞表面,有膜结合型和分泌型两种形式,膜结合型能诱导内皮细胞活性,促进白细胞黏附;分泌型对单核细胞有强烈趋化作用。动脉粥样硬化灶内主要是淋巴细胞、单核细胞和巨噬细胞,暗示这些炎症细胞参与局部炎症反应。在动脉粥样硬化形成和发展过程中,泡沫细胞的前体细胞即单核细胞的聚集和激活贯穿始终,FKN在其向血管壁迁移过程中起关键作用。FKN可通过与高亲和力受体CX3CR1结合通过G蛋白偶联启动细胞内转导机制,发挥调节免疫和白细胞趋化作用,吸引炎性细胞在损伤区域聚集,诱导炎症表达,加速炎症反应。在损伤的血管内皮细胞以及动脉硬化斑块中,FKN和其受体CX3CR1均存在过度表达,且和病情严重程度成正比[11]。脑组织缺血 6 h时FKN即有所升高,高水平FKN可持续至发病90 d后[12],在大鼠MCAO模型中,CX3CR1缺陷(CX3CR1-/-)大鼠梗死后面积减小,血脑屏障破坏减轻,凋亡神经元减少,ROS水平降低,神经功能也有所改善[13]。血浆FKN增高提示血液中促炎因子水平与体内炎症反应的严重程度增高导致脑组织损伤的加重,一般炎症因子产生的高峰期约在1 w左右,而本实验结果中进展性脑梗死患者FKN水平在第1天即达到高峰,持续时间也较无进展的脑梗死组长。提示FKN一方面可能通过促进炎症细胞的趋化渗出,激活浸润的白细胞产生释放活性氧、自由基等,使脑损伤程度加重;同时加速斑块内的炎症反应使纤维膜损伤、泡沫细胞增多,加快斑块破裂,导致脑梗死进展;另一方面随着脑组织炎症反应的加剧,内皮细胞在细胞因子的作用下产生更多的FKN,进展性脑梗死患者病情更严重,炎症细胞活化触发了梗死后炎症的“瀑布链”,放大了炎症的级联反应,加重了脑水肿和神经细胞的凋亡,故FKN水平明显升高且高峰提前。可以推测FKN可能是反应脑梗死患者病情进展的标志物。
在血清HMGB1、FKN水平与梗死体积关系分析中可看出,大梗死灶组高于中梗死灶和小梗死灶,说明梗死体积越大血清HMGB1、FKN水平越高。在脑缺血发生后,激活的单核巨噬细胞可主动分泌HMGB1,促进平滑肌细胞增殖并迁移至内膜,在趋化因子作用下,使更多炎症细胞聚集,内皮功能失代偿,通过级联效应诱导局部炎症反应放大。而FKN可趋化泡沫细胞的前体细胞即单核细胞向血管壁迁移,吸引炎性细胞在损伤区域聚集,加速炎症反应。二者可协同作用通过调节局部炎症反应进而导致病灶扩大和神经功能缺损加重。
炎症在动脉粥样硬化的发生、不稳定斑块的破裂和血栓形成过程中起关键作用,是造成进展性卒中的重要原因。斑块内炎性反应促进斑块破裂,脑缺血后大量炎症因子异常表达和释放,对脑组织产生直接和间接的毒性作用,形成恶性循环,引起血栓的扩大及炎症的继发损害。因此,炎性标记物是判断脑血管事件发生发展程度的良好实验室补充指标。HMGB1、FKN水平升高所介导的炎症的级联反应可能参与进展性脑梗死病理损伤过程。通过监测HMGB1、FKN有助于早期判断进展性脑梗死,对于临床干预有一定的指导意义。
[1]Huang W,Tang Y,Li L.HMGB1,a potent proinflammatory cytokine in sepsis[J].Cytokine,2010,51(2):119-126.
[2]Inoue K,Kawahara K,Biswas KK,et al.HMGB1 expression by activated vascular smooth muscle cells in advanced human atherosclerosis plaques[J].Cardiovasc Pathol,2007,16(3):136-143.
[3]Schafer A,Schulz C,Fraccarollo D,et al.The CX3C Chemokine Fractalkine induces vascular dysfunction by generation of superoxide anions[J].Arterioscler Thromb Vasc Biol,2007,27(1):55-62.
[4]中华医学会神经病学分会,中华医学会神经病学分会脑血管病学组.中国急性缺血性脑卒中诊治指南2014[J].中华神经科杂志,2015,48(4):246-257.
[5]Birschel P,Ellul J,Barer D,et al.Progressing stroke:towards an internationally agreed definition[J].Cerebrovasc Dis,2004,17(2~3):242-252.
[6]Libby P,Ridker PM,Hansson GK.Progress and challenges in translating the biology of atherosclerosis[J].Nature,2011,473(7343):317-325.
[7]Lu B,Wang H,Andersson U,et al.Regulation of HMGB1 release by inflammasomes[J] .Protein Cell,2013,4(3):163-167.
[8]Kanellakis P,Agrois A,Kyaw TS,et al.High-mobility group box protein 1 neutralization reduces development of diet-induced atherosclerosis in apolipoprotein E-deficient mice [J].Arterioscler Thromb Vasc Biol,2011,31(2):313-319.
[9]Kim JB,Lim CM,Yu YM,et al.Induction and subcellular localization of high-mobility group box-1 (HMGB1) in the postischemic rat brain[J].Neurosci Res,2008,86(5):1125-1131.
[10]Yang QW,Lu FL,Zhou Y,et al.HMGB1 mediates ischemia-reperfusion injury by TRIF-adaptor independent toll-like receptor 4 signaling[J].J Cereb Blood Flow Metab,2011,31(2):593-605.
[11]Stolla M,Pelisek J,von Brahl ML,et al.Fractalkine is expressed in early and advanced atherosclerotic lesions and supports monocyte recruitment via CX3CR1[J].PLoS One,2012,7(8):e43572.
[12]Grosse GM,Tryc AB,Dirks M,et al.The temporal dynamics of plasma fractalkine levels in ischemic stroke:association with clinical severity and outcome[J].J Neuroinflammation,2014,11:74.
[13]Tang Z,Gan Y,Liu Q et al.CX3CR1 deficiency suppresses activation and neurotoxicity of microglia/macrophage in experimental ischemic stroke[J].Neuroinflammation,2014,11:26
Changes and clinical significance of serum HMGB1,FKN inpatients with progressive ischemic stroke
GAIYuxin,SHENGBaoying,HANFeng,etal.
(DepartmentofNeurology,TheFirstAffiliatedHospitalofJiamusiUniversity,Heilongjiang,Jiamusi154000,China)
Objective To investigate the role of high mobility group box (HMGB) 1 and fractalkine/CX3CL1 (FKN) in progressive ischemic stroke.Methods The serum levels of HMGB1 and FKN in patients with acute cerebral infarction at different perids were detected by ELISA.According to Scandinavian Stroke Scale(SSS),patients divided into progressive group and non-progressive group.According to the infarct volume,180 cases were divided into large infarction group,middle infarction group and small infarction group.30 asymptomatic healthy individuals who underwent annual health check up were chosen as control.Results Among 180 patients,35 patients (19.44%) were progressive stroke.The SSS basic score of progressive group was lower than non-progressive group (P<0.05).The levels of HMGB1,FKN in progressive group were higher than non-progressive group and control group at the 1st,7th,14th day after stroke onset(P<0.05).The levels of HMGB1,FKN was higher in patients with bigger size infarction (P<0.05).Conclusion The increase of the levels of HMGB1,FKN may promote and formate of atherosclerosis through increaseing the inflammatory response,which may deteriorate brain injury and lead to early neurological evolution.
Progressive ischemic stroke; HMGB1; FKN
1003-2754(2017)02-0141-04
2016-12-27;
2017-01-29
(佳木斯大学附属第一医院神经内科,黑龙江 佳木斯 154000)
盛宝英,E-mail:shengbaoying123@163.com
R743.3
A

