慢性口服糖皮质激素制备大鼠抑郁症模型
王颖 薛楠 刘小艳 王锐 陈建鸣 赵欣 张宇 张策 李建国
【摘要】 目的:通过慢性口服糖皮质激素制备大鼠抑郁模型,为抑郁症的研究提供有效的动物模型。方法:选取成年SD大鼠,随机分为对照组、高剂量组和低剂量组,自由进食饮水。对照组口服2.4%乙醇溶液,高剂量组(H组)和低剂量组(L组)分别口服皮质酮溶液。前14 d皮质酮浓度分别为100、25 μg/mL,第15天将其浓度降为起始浓度的50%,口服3 d,第18天将其浓度再次降为起始浓度的25%,口服4 d,共21 d。ELISA测定大鼠每周血清中糖皮质激素水平。观察大鼠在强迫游泳,高架十字迷宫和糖水偏爱实验中的各项指标,并评价抑郁模型的效果。结果:ELISA结果显示,口服皮质酮可以增加大鼠血清中激素浓度。给药后,实验组在强迫游泳中的漂浮時间均较给药前增加,在高架十字迷宫闭臂所待时间延长,在开臂的时间缩短,糖水偏爱度降低。结论:口服给予糖皮质激素可以制备理想的大鼠抑郁模型,操作简便,适合抑郁症的实验研究。
【关键词】 抑郁症; 糖皮质激素; 动物模型; 行为学观察; 大鼠
抑郁症(major depressive disorder,MDD)是一种高发病率、高复发率和高自杀率的情感障碍性精神疾病[1]。该病患者主要表现为情绪低落、快感缺失、睡眠紊乱、注意力无法集中等症状。抑郁症严重困扰患者的生活和工作,给患者家庭和社会带来极大负担[2]。研究表明,约15%的抑郁症患者死于自杀。世界卫生组织、世界银行和哈佛大学的一项联合研究表明,抑郁症已经成为中国疾病负担的第二大病[2],抑郁症的治疗非常重要。目前抑郁症的治疗主要是药物治疗、心理治疗及物理治疗等[3-4],但抑郁症患者的预后并不乐观,复发率较高[5]。因此,需要加大对抑郁症病因及机制的研究力度。研究抑郁症的动物模型有很多,包括嗅球切除模型、强迫游泳、悬尾、习得性无助、行为绝望和慢性温和不可预知性应激[6-7],但是很多模型不能很好地模拟临床抑郁症患者的表现。因此,能制备出较为稳定的抑郁模型有助于对抑郁症进行神经生物学研究。
糖皮质激素(glucocorticoids,GCs)是一种机体在应激情况下分泌的激素,主要受下丘脑-垂体-肾上腺皮质(hypothalamus-adrenohypophysis-adrenalcortex,HPA)轴调节[8-9]。它通过结合细胞内糖皮质激素受体发挥作用,GCs在外周及中枢神经系统都发挥着重要的作用,正常情况下,GCs具有抗焦虑、抗惊厥及神经保护作用[10],但在过度应激时,体内GCs过度增高,导致中枢神经系统,特别是海马脑区神经元死亡,引起抑郁的发生[11]。近年来,大量的研究证实GCs在抑郁症中有重要作用。
本文所采用的方法是通过长期口服GCs制备抑郁模型,同时从多角度检测动物抑郁症状,证实动物抑郁模型有效可靠,为抑郁症的研究提供理想的动物模型[1]。
1 材料与方法
1.1 实验材料 SD雄性大鼠30只,体重为200~250 g,由山西医科大学动物中心提供,FST-100睡眠剥夺与强迫游泳实验系统、PMT-100高架十字迷宫及视频分析系统(成都泰盟软件有限公司),皮质酮(Corticosterone,CORT)(Aladdin Industrial Corporation)。
1.2 实验方法 30只SD大鼠随机分为对照组、高剂量组、低剂量组,每组10只,每笼2只,所有大鼠均置于12 h昼夜循环的条件,自由摄食饮水,饲养5 d,各组大鼠给药前进行各项行为学实验,包括强迫游泳实验、高架十字迷宫和糖水偏爱实验。高剂量组和低剂量组分别给予浓度为100、25 μg/mL的CORT溶液。造模结束后,各组大鼠再次进行强迫游泳实验、高架十字迷宫、旷场实验和糖水偏好实验[12]。并于造模第1、7、14、21天晚上10点收集尾静脉血并称取大鼠体重。
1.3 配药方法 以一只大鼠每天消耗30~60 mL水为标准,每天上午九点新鲜配制CORT溶液。前14 d高剂量组和低剂量组分别给予皮质酮浓度为100、
25 μg/mL,高剂量组:称取60 mg CORT溶于14.4 mL的酒精中,加饮用水至600 mL,充分混匀,分装在5个水瓶中;低剂量组称取15 mg CORT,溶于600 mL水中并分装在5个水瓶中;对照组:14.4 mL酒精溶于600 mL水中,混匀、分装。第15天,高低剂量组皮质酮浓度降为原来浓度的50%,即分别为50 μg/mL、12.5 mg/mL,高剂量组称取30 mg CORT,低剂量组称取7.5 mg CORT,溶于600 mL水中,充分混匀,分装,连续3 d。第18天,浓度降为起始浓度的25%,即高低剂量组分别为25 μg/mL、12.5 mg/mL,高剂量组称取15 mg CORT,低剂量组称取3.75 mg CORT,加饮用水至600 mL,充分混匀,分装,连续4 d,共21 d。
1.4 观察指标与方法
1.4.1 强迫游泳实验(forced swim test) 强迫游泳装置置于安静的房间,由长348 mm,宽348 mm,高445 mm的有机玻璃水箱组成,装置内有直径200 mm,高400 mm的圆筒隔板,用于限制大鼠的活动范围,装置内水深度为35 cm,水温25 ℃左右。将大鼠单独放入圆筒,观察记录5 min内的不动时间,全过程使用摄像头记录。实验期间,主要观察大鼠在水中的挣扎、游泳和漂浮行为。挣扎:大鼠的四肢激烈运动,并同时伴随前肢伸出水面;漂浮:大鼠四肢没有运动或仅有后肢轻微的运动而漂浮在水面上。实验开始时,大鼠不断地挣扎来脱离受限的环境,一段时间后,会变成漂浮不动状态,仅露出鼻孔保持呼吸,四肢偶尔划动以保持身体平衡不至于沉下去,记录大鼠的不动时间作为评价抑郁严重程度的指标。
1.4.2 高架十字迷宫(high plus maze) 实验在安静环境下进行,实验开始时将大鼠从中央面向开放臂放入迷宫,记录5 min内的活动情况。记录大鼠在开放臂、闭停留的时间。实验完成后将大鼠取出,将两臂清理干净,喷洒酒精除去气味。
1.4.3 糖水偏爱实验(sucrose preference test) 第一个24 h,每个笼子放两瓶5%糖水;第2个24 h,每个笼子放两瓶纯净水,进行适应;第3个24 h,禁食禁水;第4天,开始检测,每个笼子放一瓶糖水,放一瓶纯净水,计算每只大鼠一小时水的消耗(糖水+纯净水消耗),从而计算糖水偏爱度(糖水偏爱度=糖水消耗/总液体消耗×100%),每小时检测10只。
1.4.4 Elisa试剂盒检测血清中CORT浓度 造模第1、7、14、21天晚10点采取大鼠尾静脉血,采血前对剪刀,镊子进行消毒,将大鼠置于固定装置,待大鼠安静后,用热水浸泡尾部数分钟,使尾静脉扩张后,消毒尾巴末梢,用剪刀快速減去2~3 cm,使血液自然流出,弃去第一滴血,从第二滴开始收集于EP管内,收集完毕后,对大鼠尾部进行止血数分钟,随后放入清洁笼内。收集好放置4 ℃过夜后,低温离心20 min,取上清,放于一次性无热原,无内毒素EP管,存于-80 ℃冰箱,整个操作过程尽量做到无菌,且减小对大鼠的损伤。用Elisa试剂盒检测血清中皮质酮的浓度。
1.5 统计学处理 用统计工具软件SPSS 13.0对上述实验所得实验数据进行统计检验。多组数据比较采用One-Way ANOVA分析,组间比较采用SNK法:自身给药前后数据比较采用配对t检验。检验水准α=0.05。以P<0.05为差异有统计学意义。
2 结果
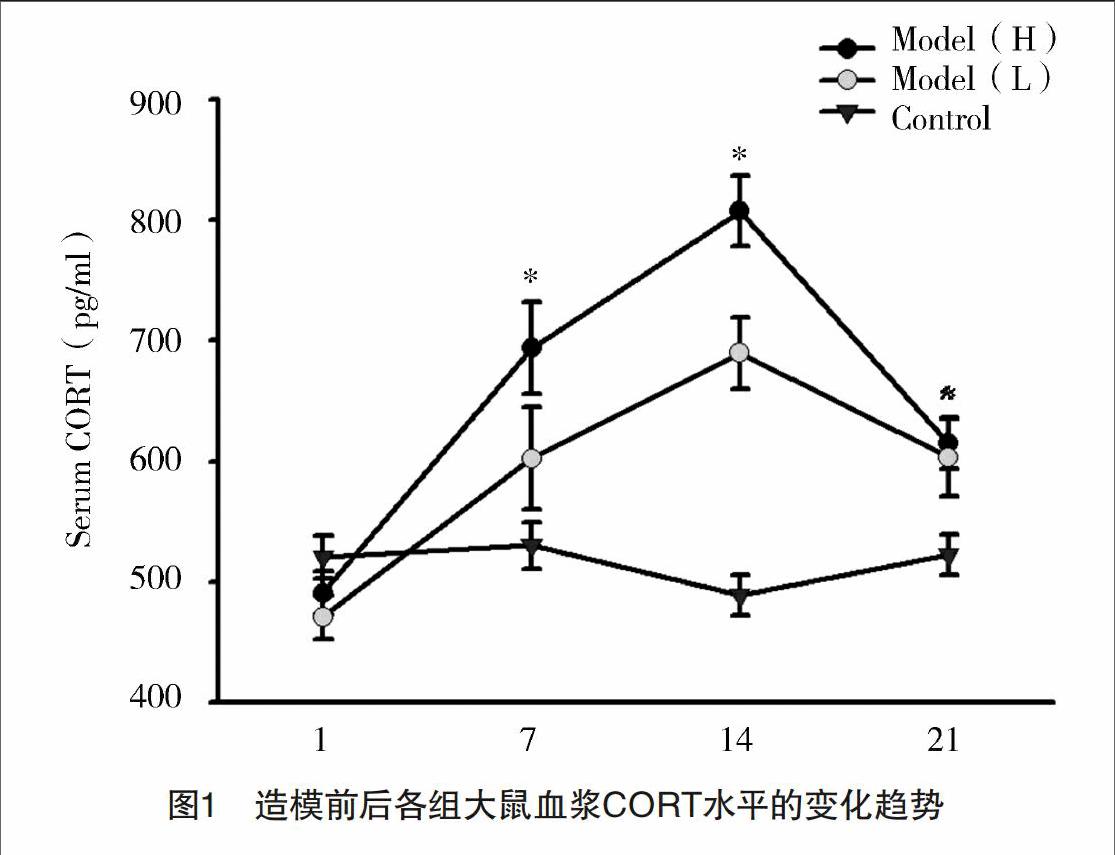
2.1 大鼠血清中皮质酮浓度 为了检测口服CORT的效果,在造模过程中检测大鼠血浆中检测CORT浓度的变化。ELISA实验结果显示,在给药期间前两周的血药浓度逐渐升高,当给药降低时,血药浓度也随之降低,但模型组的血药浓度仍然高于正常组,而正常组在21 d中,血药浓度并没有明显的变化趋势,见图1。
注:Model(H)为高剂量组,Model(L)为低剂量组;CORT组在前15 d浓度均高于正常组,且呈上升趋势,后7 d逐渐下降,但血药浓度始终高于对照组。
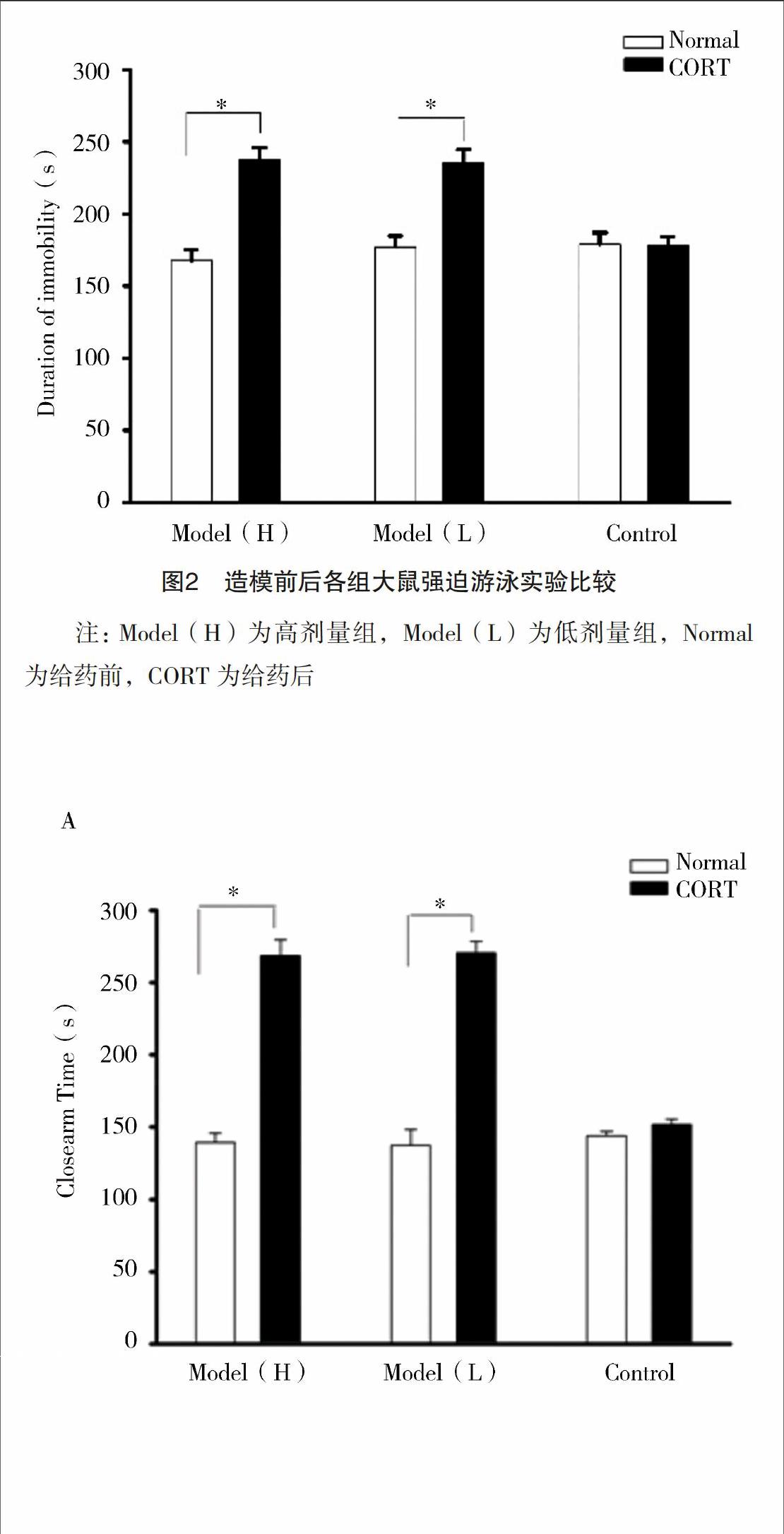
2.2 强迫游泳实验 高剂量组给药前后漂浮时间分别为(170.67±7.32)、(238.76±7.98)s(P<0.05),低剂量组给药前后漂浮时间分别为(176.89±7.67)、(235.78±6.98)s(P<0.05),对照组给药前后漂浮时间分别为(178,98±8.13)、(178.45±5.56)s(P>0.05)。强迫游泳实验显示,高剂量组和低剂量组给药后漂浮时间均较给药前增加,对照组给药前后漂浮时间变化不明显,见图2。
注:Model(H)为高剂量组,Model(L)为低剂量组,Normal为给药前,CORT为给药后
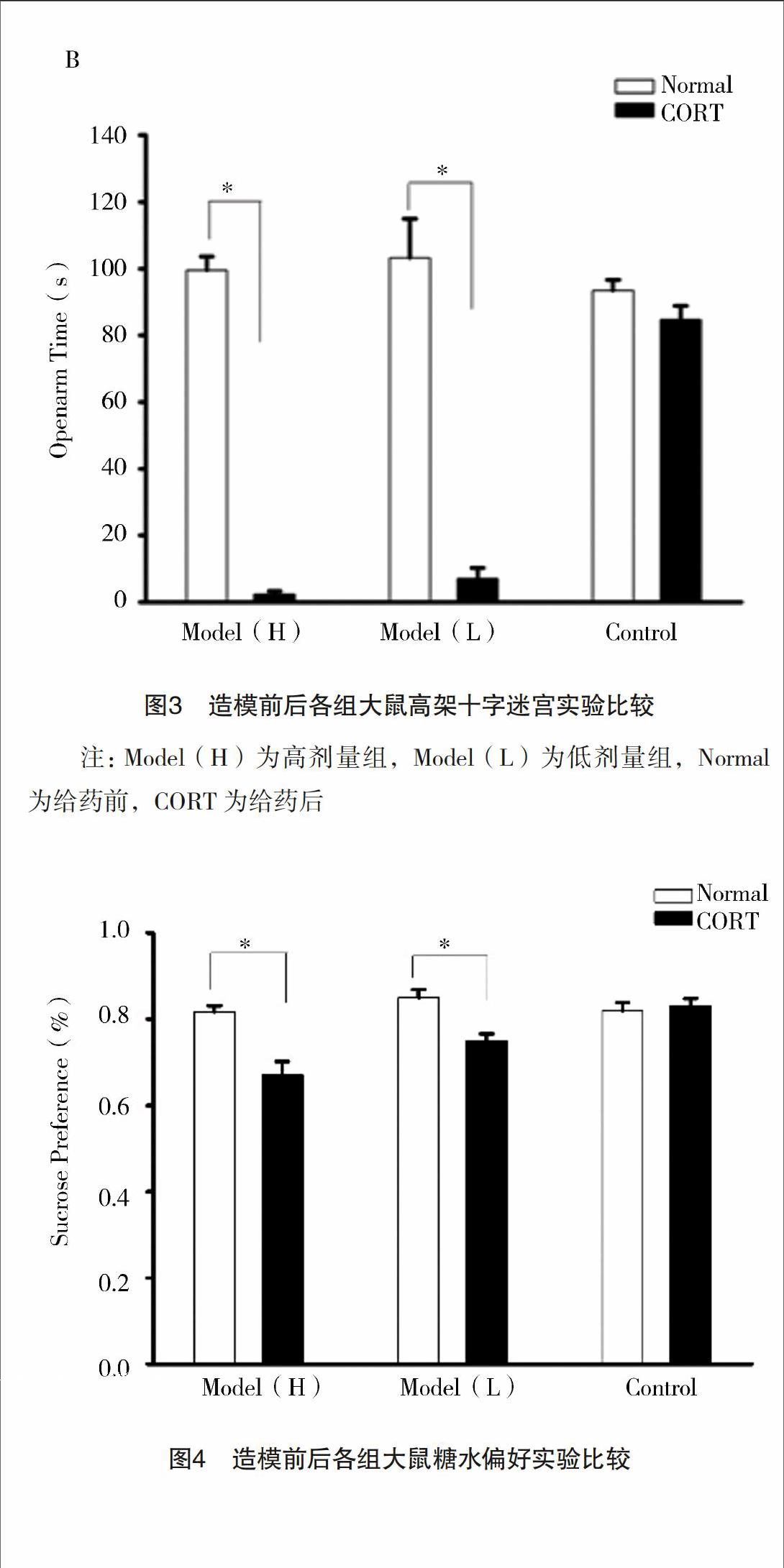
2.3 高架十字迷宫 高架十字迷宫实验中,高剂量组给药前后在闭臂所待时间分别为(139.34±6.45)、
(270.67±7.89)s(P<0.05),在开臂所待时间分别为(99.55±4.01)、(2.43±0.89)s(P<0.05);低剂量组给药前后在闭臂所待时间分别为(137.65±9.89)、(270.89±4.89)s(P<0.05),在开臂所待时间分别为(103.20±11.89)、(5.67±3.24)s(P<0.05);对照组给药前后在闭臂
所待时间分别为((143.67±2.98)、(151.87±3.78)s
(P>0.05),在开臂所待时间分别为(94.78±2.66)、
(89.78±2.78)s(P>0.05)。与对照组和给药前相比,给药后大鼠在闭臂所待时间延长,而在开臂的时间缩短,而正常对照组给药前后差异不明显,见图3。
图3 造模前后各组大鼠高架十字迷宫实验比较
注:Model(H)为高剂量组,Model(L)为低剂量组,Normal为给药前,CORT为给药后
2.4 糖水偏爱度 在糖水偏爱实验中,高剂量组给药前后糖水偏爱度分别为(0.817±0.014)、(0.671±0.031)(P<0.05),低剂量组给药前后糖水偏爱度分别为(0.850±0.018)、(0.760±0.056)(P<0.05),对照组给药前后糖水偏爱度分别为(0.820±0.065)、(0.840±0.032)(P>0.05)。与对照组和给药前相比,高剂量模型组和低剂量模型组大鼠的糖水偏好度降低,正常对照组在给药前后没有显著改变,见图4。
图4 造模前后各组大鼠糖水偏好实验比较
注:Model(H)为高剂量组,Model(L)为低剂量组,Normal为给药前,CORT为给药后
3 讨论
本实验采用持续3周口服给予皮质酮(Corticosterone,CORT),在成年大鼠制备抑郁症模型,并且从抑郁症的多方面表现对模型大鼠进行测试。
应激是机体对于外界刺激所产生的一种自身生理反应,当应激源作用于机体时,机体在行为和生理上产生对应的反应[13]。首先,在应激源的作用下,促肾上腺皮质激素释放激素由下丘脑分泌,通过垂体门静脉系统作用于腺垂体,使腺垂体释放促肾上腺皮质激素(ACTH)进入血液循环,激活肾上腺内分泌细胞分泌糖皮质激素[14-15],亦称为应激激素。糖皮质激素会通过血脑屏障进入中枢神经系统,发挥抗焦虑、抗惊厥及神经保护作用,也可促进大脑与认知,信息传递及记忆形成等方面的信息处理有关的边缘系统的神经网络的形成[16]。血液中糖皮质激素可以负反馈调节下丘脑-垂体-肾上腺皮质轴(HPA轴),从而保持机体的稳态[16-17]。
然而,当慢性应激刺激作用于机体时,HPA轴会过度兴奋,长时间高浓度糖皮质激素会损伤机体神经元,导致认知、记忆等功能减退,这也是抑郁症发病的主要原因之一[18-20]。因此,慢性持续给予动物糖皮质激素,可以模拟慢性环境应激刺激,诱导大鼠产生抑郁症的病理生理变化。
考虑到是慢性长期给药,而腹腔注射时的动物抓取和血药浓度的变化特点会影响实验大鼠的结果。因此,笔者采用了持续3周口服给药,选用啮齿类动物糖皮质激素的主要成CORT。造模4周后,采用动物行为检测方法,从抑郁症的多方面表现对模型大鼠进行测试,证实成年大鼠抑郁症模型制备成功。另外,虽然在实验选用低剂量乙醇溶解CORT,但是有实验研究发现,2.4%乙醇本身既不激活下丘脑-垂体-肾上腺轴,也不影响其他指标,包括器官(肾上腺,脾和胸腺)以及神经元[21-22],因此可以排除乙醇的作用。
海马是参与应激的一个重要脑区,且BDNF在海马中的分布最多[23]。研究表明,海马中糖皮质激素受体含量较高,长期应激情况下,HPA轴过度亢进,导致糖皮质激素长期处于较高的水平,使海马神经元萎缩[24]。另有研究表明,长期给予糖皮质激素,海马BDNF含量下降[18]。可见糖皮质激素与海马及BDNF有密切关系,这可能是导致抑郁症发生的重要原因之一。本实验采用糖皮质激素慢性长期制备抑郁模型,通过行为学研究来验证模型制备是否成功。
在研究中,两个CORT浓度的模型组大鼠均出现抑郁表现。高架十字迷宫实验中大鼠在开臂时间缩短,闭臂时间延长,这反应模型组大鼠探究与回避的冲突行为,显示焦虑程度增高;强迫游泳实验中,大鼠的漂浮不动时间增加,表现出绝望和无助;糖水偏爱实验中,大鼠糖水偏爱度降低,表示快感缺失。这些表现均与抑郁症状相同,表明本实验中采取口服CORT制备抑郁模型是成功的,可以用于抑郁症的发病机制及药物治疗等方面的研究。
大鼠长期慢性口服CORT后,通过强迫游泳、高架十字迷宫和糖水偏爱实验等行为学实验方法检测,均出现了抑郁样症状,表明口服CORT可以制备抑郁模型,且是一种简单有效的模型方法。
参考文献
[1] Willner P,Scheel-Kruger J,Belzung C.The neurobiology of depression and antidepressant action[J].Neuroscience and Biobehavioral Reviews,2013,37(10 Pt 1):2331-2371.
[2] Preston T C,Shelton R C.Treatment resistant depression: strategies for primary care[J].Current Psychiatry Reports,2013,15(7):370.
[3] Akindele A J,Ajao M Y, Aigbe F R,et al.Effects of Telfairia occidentalis(fluted pumpkin;Cucurbitaceae) in mouse models of convulsion,muscle relaxation,and depression[J].Journal of Medicinal Food,2013,16(9): 810-816.
[4] Krystal J H, State M W.Psychiatric disorders:diagnosis to therapy[J].Cell,2014,157(1):201-214.
[5]刘佳莉,苑玉和,陈乃宏.抑郁症的治疗研究进展[J].中国药理学通报,2011,27(9):1193-1196.
[6] Nestler E J,Hyman S E.Animal models of neuropsychiatric disorders[J].Nature Neuroscience,2010,13(10):1161-1169.
[7]韩晓蕾,胡风云,田峰.抑郁动物模型的研究进展及评价[J].临床医药实践,2015,24(7):533-536.
[8] Gelman P L,Flores-Ramos M,Lopez-Martinez M,et al.
Hypothalamic-pituitary-adrenal axis function during perinatal depression[J].Neuroscience Bulletin,2015,31(3):338-350.
[9] Shishkina G T,Kalinina T S,Bulygina V V,et al.Anti-Apoptotic Protein Bcl-xL Expression in the Midbrain Raphe Region Is Sensitive to Stress and Glucocorticoids[J].PLoS one,2015,10(12):e0 143 978.
[10]成承,張丽萍.焦虑抑郁状态与代谢综合征关系的研究[J].中华保健医学杂志,2016,18(2):131-133.
[11] Saaltink D J,Vreugdenhil E.Stress,glucocorticoid receptors,and adult neurogenesis:a balance between excitation and inhibition[J].Cellular and Molecular Life Sciences:CMLS,2014,71(13):2499-2515.
[12] Tye K M,Mirzabekov J J,Warden M R,et al.Dopamine neurons modulate neural encoding and expression of depression-related behaviour[J].Nature,2013,493(7433):537-541.
[13]黄攀,王然,王金甜.应激动物模型的构建与应用[J].畜牧与兽医,2016,48(3):146-151.
[14] Sterner E Y,Kalynchuk L E.Behavioral and neurobiological consequences of rolonged glucocorticoid exposure in rats: relevance to depression[J].Progress in Neuro-psychopharmacology & Biological Psychiatry,2010,34(5):777-790.
[15]陈姣,楚世峰,陈乃宏.糖皮质激素与抑郁发病相关机制研究进展[J].中国药理学通报,2013,29(11):1493-1495.
[16] Krishnan V,Nestler E J.The molecular neurobiology of depression[J].Nature,2008,455(7215):894-902.
[17] Lutter M,Krishnan V,Russo S J,et al.Orexin signaling mediates the antidepressant-like effect of calorie restriction[J].The Journal of Neuroscience:the Official Journal of the Society for Neuroscience,2008,28(12):3071-3075.
[18] Snyder J S,Soumier A,Brewer M,et al.Adult hippocampal neurogenesis buffers stress responses and depressive behaviour[J].Nature,2011,476(7361):458-461.
[19] Caspi A,Sugden K,Moffitt T E,et al.Influence of life stress on depression: moderation by a polymorphism in the 5-HTT gene[J].Science,2003,301(5631):386-389.
[20] Hyman S E.Revitalizing psychiatric therapeutics[J].Neuropsychopharmacology:Official Publication of the American College of Neuropsychopharmacology,2014,39(1):220-229.
[21] Cates L N,Roberts A J,Huitron-Resendiz S,et al.Effects of lurasidone in behavioral models of depression.Role of the 5-HT(7) receptor subtype[J].Neuropharmacology,2013,70(70C):211-217.
[22] Tajiri M,Hayata-Takano A,Seiriki K,et al.Serotonin 5-HT(7) receptor blockade reverses behavioral abnormalities in PACAP-deficient mice and receptor activation promotes neurite extension in primary embryonic hippocampal neurons:therapeutic implications for psychiatric disorders[J].Journal of Molecular Neuroscience:MN,2012,48(3):473-481.
[23] Davidson R J,Jackson D C,Kalin N H.Emotion,plasticity,context,and regulation:perspectives from affective neuroscience[J].Psychological Bulletin,2000,126(6):890-909.
[24] Tata D A,Anderson B J.The effects of chronic glucocorticoid exposure on dendritic length,synapse numbers and glial volume in animal models:implications for hippocampal volume reductions in depression[J].Physiology & Behavior,2010,99(2):186-193.
(收稿日期:2016-12-13) (本文編辑:程旭然)

