禾草灵对水稻生长和典型土壤酶活性的影响
范晓季,宋昊,孙立伟,钱海丰,*
1. 浙江工业大学生物工程学院,杭州 310032 2. 浙江工业大学海洋学院,杭州 310032 3. 浙江工业大学环境学院,杭州 310032
禾草灵是一种苯氧丙酸类除草剂,广泛用于控制小麦、大麦和高尔夫球场中的一年生杂草[1]。禾草灵的主要作用机理是抑制乙酰辅酶A羧化酶(ACCase)的合成,使脂肪酸合成受阻,最后导致植物的死亡[2]。2000年,美国的禾草灵使用量约为350 t[3],而中国的使用量约为1 000~5 000 t[4]。禾草灵的广泛使用,导致其在环境中的残留不可避免。有报道指出,农药在施用过程中,大部分(约73%)会洒落到土壤表面[5],从而进入土壤,并会随地表径流和雨水进入环境水体,在加拿大的水体和空气中都有检出[6],而禾草灵的降解产物禾草灵酸,在环境中较为稳定,施药126 d后的土壤中还有19%的残留[5]。环境中残留的禾草灵对大鼠具有雌激素活性[7],还会干扰夜蛾雌激素的产生[8],是一种内分泌干扰物,会导致小鼠细胞增殖,引发癌变[9]。水体中的禾草灵会抑制铜绿微囊藻和小球藻的生长,但具体机制仍不清楚[10-11]。
土壤微生物是土壤生态系统中的重要组成部分,参与土壤的各类生物化学反应,是物质和能量循环的主导者之一[12],在土壤氮、磷循环过程中起着重要作用[13]。土壤脲酶与土壤N元素的转化密切相关[14],其活性可以反映土壤的供氮能力[15]。土壤酸性磷酸酶是土壤中重要水解酶类,与土壤中C,N,P等多种元素的循环有密切关系[16-18]。土壤过氧化氢酶能分解土壤中的过氧化氢,对植物和微生物的生存具有重要意义[19]。土壤微生物的生物量和酶活性能在一定程度上反映土壤的状况,对环境的变化反应敏感,具有作为生态风险评估生物指标的价值[20-21]。据报道,在不同除草剂的作用下,土壤中细菌、真菌和放线菌的生物量有不同程度的降低,并且其抑制效果与除草剂浓度呈现正相关[22]。除草剂对玉米根际的土壤微生物量也有较为明显的抑制效果[23]。同时,也有研究发现,草甘膦处理60 d后的油茶林,其土壤多种酶活力显著下降[24]。
然而,有关禾草灵对环境生物的影响的研究还比较少,缺乏对禾草灵潜在生态风险的了解,因此本文通过检测水稻生长的变化,结合检测土壤酶活性和土壤微生物量来反映禾草灵对非靶标植物和土壤微生物的影响,从而为评价禾草灵的生态风险与合理使用提供一定的科学依据。
1 材料与方法(Materials and methods)
1.1 实验材料
水稻品种为秀水63(浙江大学农学院水稻研究所提供)。试验所用土壤采自浙江省杭州市浙江工业大学上塘河畔,表面有苔藓地衣层,去除表层约5 cm的表土,取5~10 cm处的土壤,用2 mm筛网去除石砾、植物根系及土壤动物,室温保存备用。所用禾草灵为R型禾草灵(纯度为99.0%,浙江省农科院提供),无水乙醇(>99.7%,安徽安特食品股份有限公司)溶解,放于4 ℃冰箱保存待用。
1.2 种子培养与药物处理
水稻种子用超纯水浸泡15 min,冲洗多次,用2.5% NaClO(工业纯,上海生工生物工程股份有限公司)浸泡消毒15 min,冲洗干净。均匀置于铺有纱布的塑料筐中,加入自来水湿润纱布并保持种子湿润,置于30 ℃的人工气候箱中,黑暗条件下发芽。每天浇水,保持纱布湿润。3 d后水稻种子萌芽,培养箱温度改为28 ℃,并开始进行光照,光周期12 h/12 h,光强为3 000 lx,继续培养7 d。
将培养7 d后的水稻幼苗移植到装有300 g土壤的塑料小罐中,加入200 mL自来水至土壤上层有浮水,适应培养2 d。随后再加入100 mL禾草灵溶液,浓度分别为200 μg·L-1或1 000 μg·L-1,每个浓度设置4个平行;对照组加入等体积的自来水,之后每天加入50 mL的自来水,使土壤上始终保持有浮水。每个实验进行2次生物学重复。
1.3 对水稻生长影响的检测
加药处理8 d后,取水稻幼苗根上部分,测得其鲜重,每个浓度6个平行。取水稻幼苗新鲜叶片30~50 mg,每个浓度6个平行,记录其重量,加入2 mL N,N-二甲基甲酰胺(DMF)(>99.0%,如皋市金陵试剂厂)中,4 ℃避光保存24 h,取上清液用酶标仪(powerwave XS,美国BIO-TEK公司)于647、664.5 nm波长下测定其吸光度值,代入公式(1)和(2)计算叶绿素的浓度。
Ca=12.7×OD664.5-2.79×OD647
(1)
Cb=20.7×OD647-4.62×OD664.5
(2)
式中Ca为叶绿素a的含量,Cb为叶绿素b的含量,以mg·L-1表示。
水稻幼苗黑暗处理30 min,并在黑暗条件下用叶绿素荧光仪(MINI-PAM II,德国WALZ公司)测定水稻叶片的光合参数,每个浓度6个平行。其中,qP(photochemical quenching)表征光化学淬灭,即由光合作用引起的荧光淬灭,反映了光合活性的高低;Y(II)(photochemical yield of PSII)是任一光照状态下光合系统II (PSII)的实际量子产量,表示实际光合能力;Y(NO)(unregulated non-photochemical quenching)是光损伤的重要指标,表示非调节性能量耗散的量子产量。
1.4 对土壤微生物影响的检测
分别取加药处理4 d和8 d的土壤,每个浓度4个平行,取样时尽量不伤害水稻的根系。使用土壤DNA提取试剂盒(美国MOBIO公司)提取土壤总DNA,用16s进行荧光定量PCR扩增,引物序列为338f(5’-ACTCCTACGGGAGGCAGCAG-3’)和518r(5’-ATTACCGCGGCTGCTGG-3’)[25],根据Ct(cycle threshold)值计算微生物拷贝数[26],测定在不同浓度禾草灵暴露下土壤微生物量的变化。
1.5 土壤酶活的检测
分别取禾草灵处理4 d和8 d的土壤,每个浓度4个平行,在室温条件下风干,之后分别使用土壤酸性磷酸酶(S-ACP)测试盒、土壤过氧化氢酶(S-CAT)测试盒、土壤脲酶(S-UE)测试盒(苏州科铭生物技术有限公司)分别检测土壤酸性磷酸酶、土壤过氧化氢酶和土壤脲酶的活性。
1.6 数据分析
采用EXCEL和STATVIEW 5.0.1进行数据分析,所有实验结果均表示为平均数±标准偏差(Mean±SD),使用单因素方差分析(one-way ANOVA)进行对照组和禾草灵加药组之间的差异显著性分析,P<0.05表示具有显著性差异。
2 结果(Results)
2.1 禾草灵对水稻生长的影响
禾草灵暴露对水稻鲜重的影响如图1所示。从中可以看出,200 μg·L-1禾草灵暴露8 d的水稻与对照组相比无差异(P>0.05)。当浓度高至1 000 μg·L-1时,明显抑制水稻幼苗的生长(P<0.05),表现为植株矮小,叶片较小,并伴有叶片发黄、枯萎等现象,鲜重下降至对照组的55%。同时,高浓度禾草灵(1 000 μg·L-1)对水稻幼苗光合色素影响明显(图2),其中叶绿素a和叶绿素b的含量显著下降(P<0.05),而低浓度(200 μg·L-1)禾草灵处理的水稻幼苗色素含量无变化(P>0.05)。
高浓度禾草灵(1 000 μg·L-1)处理8 d,水稻幼苗的qP和Y(II)显著下降(P<0.05),分别为对照组的78.7%、79.8%,Y(NO)值显著上升(P<0.05),为对照组的121.0%(图3)。而低浓度禾草灵(200 μg·L-1)处理组的各荧光参数与对照组相比均没有显著性差异(P>0.05)。

图1 禾草灵暴露8 d对水稻幼苗鲜重的影响注:“*”代表显著性差异,P<0.05。Fig. 1 Effect of diclofop-methyl on fresh weight of rice seedlings after 8 d of exposureNote:The asterisks (*) indicates a significant difference compared with the control groups (P < 0.05).
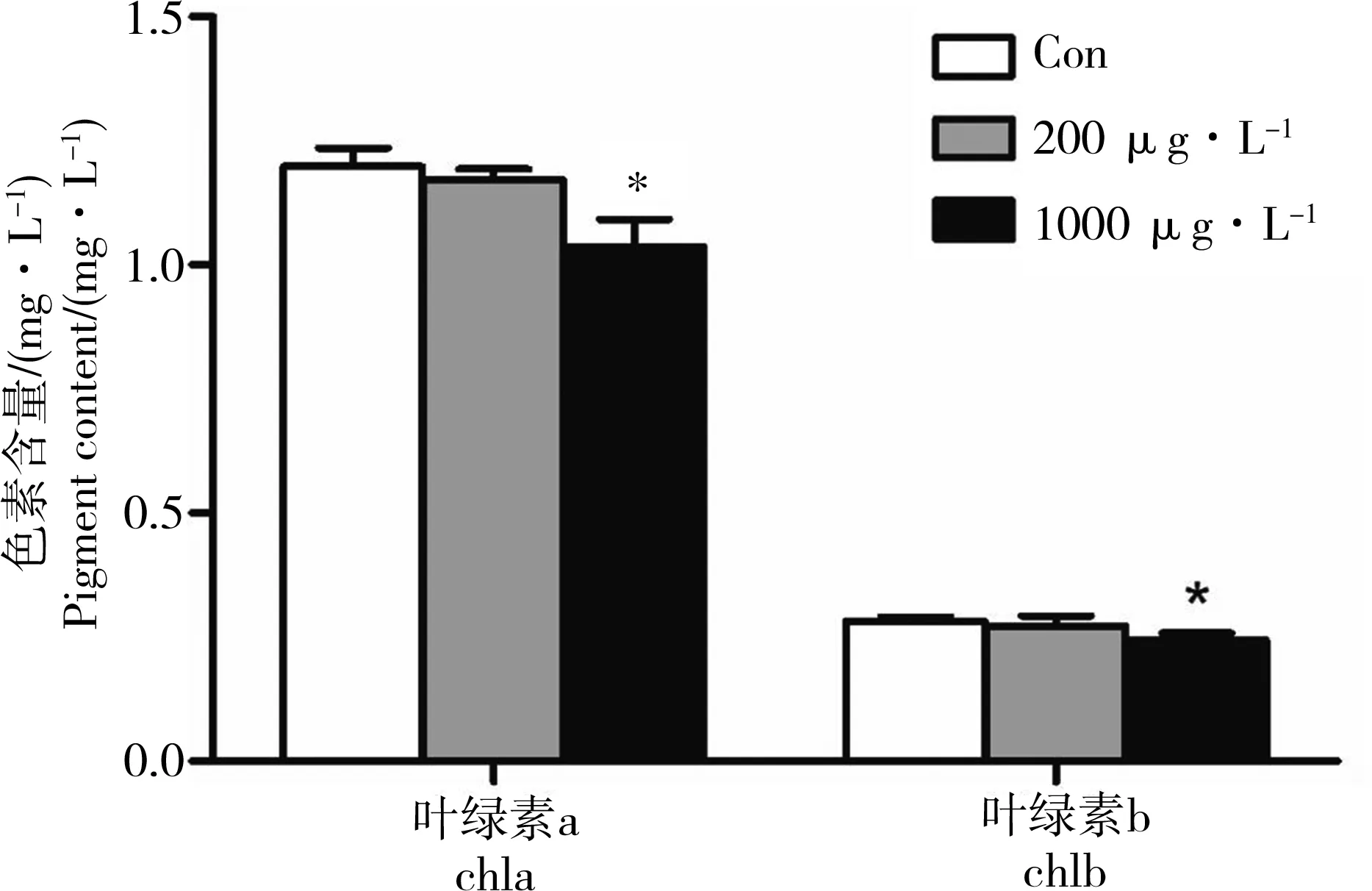
图2 禾草灵暴露8 d对水稻幼苗色素含量的影响注:“*”代表显著性差异,P<0.05。Fig. 2 Effect of diclofop-methyl on pigment content of rice seedlings after 8 d exposureNote:The asterisks (*) indicates a significant difference compared with the control groups (P< 0.05).

图3 禾草灵暴露8 d对水稻幼苗叶片qP,Y(II)和Y(NO)的影响注:“*”代表显著性差异,P<0.05。Fig. 3 Effect of diclofop-methyl on qP, Y(II) and Y(NO) of rice seedlings after 8 d exposureNote: The asterisks (*) indicates a significant difference compared with the control groups (P < 0.05).
2.2 禾草灵对土壤酶活性的影响
禾草灵处理4 d后,高浓度处理组的土壤脲酶、酸性磷酸酶和过氧化氢酶的活性均出现显著下降(P<0.05),下降幅度分别为8.9%、16.6%和10.2%,而在处理8 d后,其土壤酶活性又恢复至对照组水平(图4)。而低浓度(200 μg·L-1)禾草灵处理对3种土壤酶活性均无影响。
2.3 禾草灵对土壤微生物量的影响
禾草灵处理4 d,低浓度组土壤微生物量没有显著变化(P>0.05),高浓度组土壤微生物量显著下降(P<0.05),只有对照组的32.7%,;禾草灵处理8 d,低浓度处理组的土壤生物量显著升高(P<0.05),为对照组的158.2%,而高浓度组则与对照组没有显著差别(图5) (P>0.05)。
3 讨论 (Discussion)
叶璟等[27-28]研究发现,禾草灵对水稻的胚根生长有一定的抑制作用,并随着浓度的升高抑制作用增强,对水稻植株的生长也有明显的抑制作用,另外会引起铜绿微囊藻的细胞膜损伤。吡氟禾草灵对硬毛刺苞菊幼苗的生长有显著的抑制作用,处理10 h即可观察到叶脉褐变,32 h左右完全枯死[29]。禾草灵酸对拟南芥体外和体内的叶绿体的希尔反应均有显著的抑制作用[27]。禾草灵酸对拟南芥的处理使植株根变短,副根数目减少,部分叶片发黄或发黑,叶绿体体积膨胀,淀粉颗粒显著增加,说明叶肉细胞内的糖代谢受阻[30]。本研究发现,低浓度禾草灵(200 μg·L-1)处理后,水稻幼苗的鲜重和叶绿素含量,以及qP、Y(II)和 Y(NO)等光合作用参数均没有明显变化(P>0.05),说明低浓度禾草灵对水稻的生长没有影响。高浓度禾草灵(1 000 μg·L-1)处理的水稻幼苗生长受到抑制,鲜重和叶绿素含量显著下降(P<0.05),qP和Y(II)也显著下降(P<0.05),而Y(NO)显著上升(P<0.05)。qP下降说明水稻的光合活性下降,Y(II)下降说明实际光合能力下降,而Y(NO)上升则表示水稻的光系统受损伤。这些结果说明高浓度禾草灵的暴露使水稻的叶绿素含量下降,光合系统损伤,导致水稻的光合能力降低,最终抑制水稻的生长。

图4 禾草灵处理对土壤酶活性的影响注:“*”代表显著性差异,P<0.05。Fig. 4 Effects of diclofop-methyl on soil enzymes activityNote:The asterisks (*) indicates a significant difference compared with the control groups (P < 0.05); ACP, acid phosphatase; UE, urease; CAT, catalase.
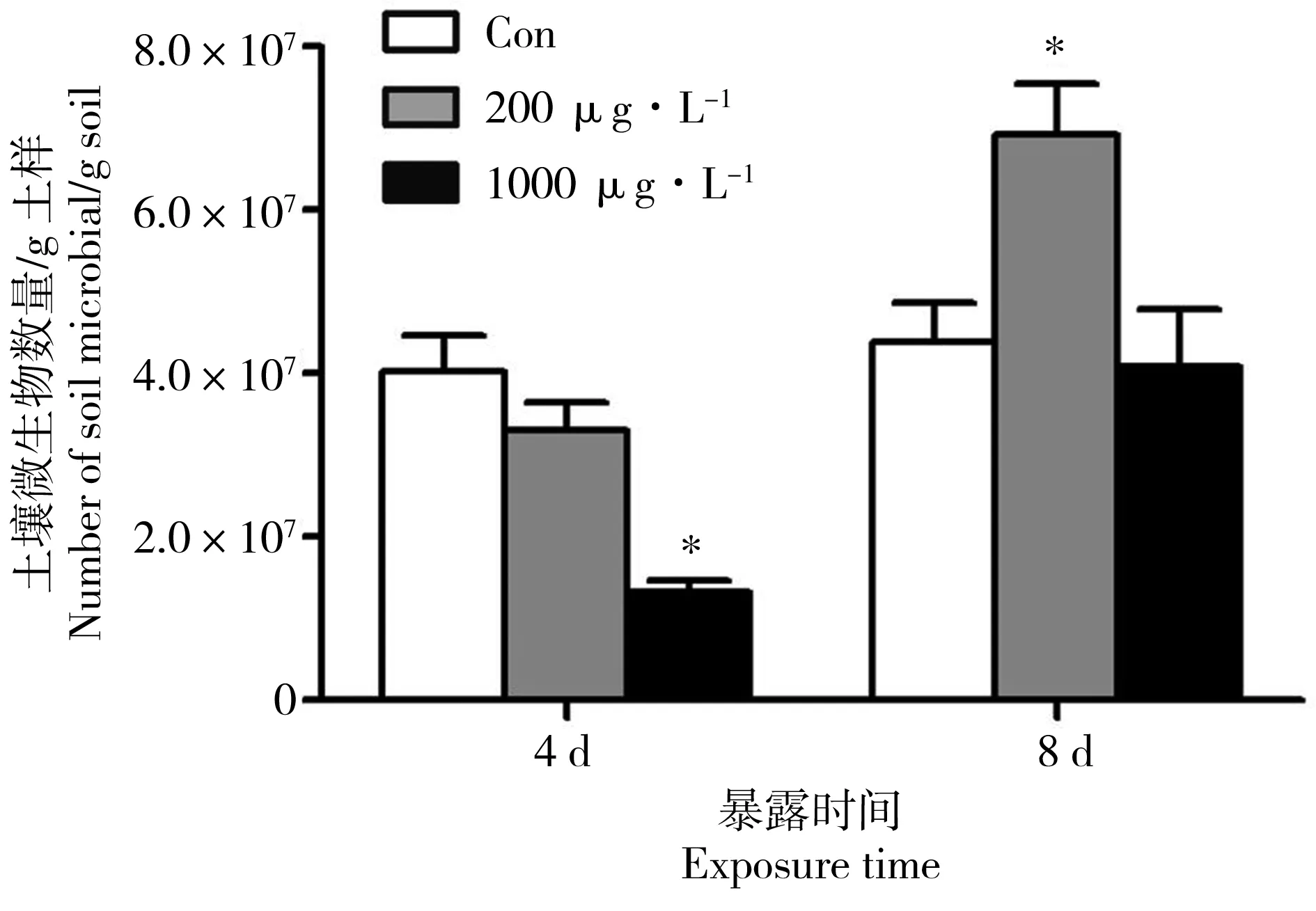
图5 禾草灵处理对土壤生物量的影响注:“*”代表显著性差异,P<0.05。Fig. 5 Effect of diclofop-methyl on soil microbial biomassNote:The asterisks (*) indicates a significant difference compared with the control groups (P< 0.05).
土壤酶活性的结果显示禾草灵对土壤酶活性有显著的抑制作用,表现为高浓度禾草灵处理4 d时3种土壤酶活性均出现显著下降(P<0.05) (图4)。吴小虎等[26]研究发现乳氟禾草灵对土壤脲酶活性表现为抑制-激活效应,后期恢复到对照水平。这与我们的研究结果相一致,本研究中禾草灵处理8 d后,3种土壤酶活性均回复到对照水平。多种使用广泛的除草剂均会对土壤酶活性产生类似的抑制-激活效应[24, 32-33],这可能是因为禾草灵在土壤中易降解[34],而其在水中的水解是毒性降低的过程[35]。
16s的拷贝数能反映土壤的微生物量,禾草灵的处理使土壤微生物的数量显著降低(P<0.05),说明禾草灵对土壤微生物有显著的抑制作用,而处理后期土壤微生物的数量有一个明显的回升趋势,表现为低浓度禾草灵处理8 d后微生物量显著高于对照组(P<0.05)。张妤等[36]研究发现二氯喹啉酸抑制土壤微生物总量。李立鑫等[18]发现常用除草剂对土壤微生物有一定程度的抑制作用,抑制作用随着施药时间的延长而降低。而孙约兵等[37]在研究中发现除草剂硝磺草酮对土壤微生物有促进作用。
本研究证实高浓度禾草灵残留对非靶标植物的鲜重、叶绿素含量和光合作用均造成不良的影响,对土壤微生物的数量和功能有一定的抑制作用,但抑制作用随着施用时间的延长而下降。本研究结果对于指导禾草灵的合理使用及其环境风险的准确评估方面均有一定的指导意义。
[1] Qian H F, Wang R Q, Chen J, et al. Analysis of enantioselective biochemical, physiological, and transcriptional effects of the chiral herbicide diclofop methyl on rice seedlings [J]. Journal of Agricultural and Food Chemistry, 2012, 60(22): 5515-5523
[2] Williams A. Opportunities for chiral agrochemicals [J]. Pesticide Science, 1996, 46(1): 3-9
[3] United States Environmental Protection Agency (US EPA). Prevention, Pesticides and Toxic Substance [R]. Cincinnati: EPA's National Service Center for Environmental Publications, 2000
[4] Liu W P, Jin M Q, Cai X Y, et al. Progress in the mechanism of action and ecological effects of the herbicide diclofop-methyl [J]. Chinese Journal of Pesticide Science, 2008, 10(4): 383-391
[5] Smith A E, Grover R, Cessna A J, et al. Fate of diclofop-methyl after application to a wheat field [J]. Journal of Environmental Quality, 1986, 15(3): 234-238
[6] Waite D T, Cessna A J, Grover R, et al. Environmental concentrations of agricultural herbicides in Saskatchewan, Canada: Bromoxynil, dicamba, diclofop, MCPA, and trifluralin [J]. Journal of Environmental Quality, 2004, 33(5): 1616-1628
[7] Petit F, Le G P, Cravédi J P, et al. Two complementary bioassays for screening the estrogenic potency of xenobiotics: Recombinant yeast for trout estrogen receptor and trout hepatocyte cultures [J]. Journal of Molecular Endocrinology, 1997, 19(3): 321-335
[8] Dorit E, Shalom A, Ada R. Moth sex-pheromone biosynthesis is inhibited by the herbicide diclofop [J]. Pesticide Biochemistry and Physiology, 2003, 77(2): 75-81
[9] Palut D, Ludwicki J K, Kostka G, et al. Studies of early hepatocellular proliferation and peroxisomal proliferation in Wistar rats treated with herbicide diclofop [J]. Toxicology, 2001, 158(3): 119-126
[10] Ye J, Wang L, Zhang Z, et al. Enantioselective physiological effects of the herbicide diclofop on cyanobacterium Microcystis aeruginosa [J]. Environmental Science and Technology, 2013, 47(8): 3893-3901
[11] Cai X, Liu W, Sheng G. Enantioselective degradation and ecotoxicity of the chiral herbicide diclofop in three freshwater alga cultures [J]. Journal of Agricultural and Food Chemistry, 2008, 56(6): 2139-2146
[12] 陶波, 蒋凌雪, 沈晓峰, 等. 草甘膦对土壤微生物的影响[J]. 中国油料作物学报, 2011, 33(2): 162-168, 179
Tao B, Jiang L X, Shen X F, et al. Effects of glyphosate on soil microorganisms [J]. Chinese Journal of Oil Crop Sciences, 2011, 33(2): 162-168, 179 (in Chinese)
[13] 滕春红, 陶波. 除草剂氯嘧磺隆对土壤酶活性的影响[J]. 农业环境科学学报, 2006, 25(5): 1294-1298
Teng C H, Tao B. Effects of chlorimuron-ethyl on soil enzymes activities [J]. Journal of Agro-Environment Science, 2006, 25(5): 1294-1298 (in Chinese)
[14] 宋日, 吴春胜, 牟金明, 等. 玉米根茬留田对土壤微生物量碳和酶活性动态变化特征的影响[J]. 应用生态学报, 2002, 13(3): 303-306
Song R, Wu C S, Mou J M, et al. Effects of maize stubble remaining in field on dynamics of soil microbial biomass and soil enzyme activities [J]. Chinese Journal of Applied Ecology, 2002, 13(3): 303-306 (in Chinese)
[15] 焦晓光, 隋跃宇, 张兴义. 土壤有机质含量与土壤脲酶活性关系的研究[J]. 农业系统科学与综合研究, 2008, 24(4): 494-496
Jiao X G, Sui Y Y, Zhang X Y. Study on the relationship between soil organic matter content and soil urease activity [J]. System Sciences and Comprehensive Studies in Agriculture, 2008, 24(4): 494-496 (in Chinese)
[16] Badiane N N Y, Chotte J L, Pate E, et al. Use of soil enzyme activities to monitor soil quality in natural and improved fallows in semi-arid tropical regions [J]. Applied Soil Ecology, 2001, 18(3): 229-238
[17] 曹慧, 孙辉, 杨浩, 等. 土壤酶活性及其对土壤质量的指示研究进展[J]. 应用与环境生物学报, 2003, 9(1): 105-109
Cao H, Sun H, Yang H, et al. A review: Soil enzyme activity and its indication for soil quality [J]. Chinese Journal of Applied and Environmental Biology, 2003, 9(1): 105-109 (in Chinese)
[18] Huang W J, Zhang D Q, Li Y L, et al. Responses of soil acid phosphomonoesterase activity to simulated nitrogen deposition in three forests of subtropical China [J]. Pedosphere, 2012, 22(5): 698-706
[19] 戴伟, 白红英. 土壤过氧化氢酶活度及其动力学特征与土壤性质的关系[J]. 北京林业大学学报, 1995, 17(1): 37-41
Dai W, Bai H Y. Correlation between catalase activity and its kinetic characteristic and some soil properties [J]. Journal of Beijing Forestry University, 1995, 17(1): 37-41 (in Chinese)
[20] Badiane N N Y, Chotte J L, Pate E, et al. Use of soil enzyme activities to monitor soil quality in natural and improved fallows in semi-arid tropical regions [J]. Applied Soil Ecology, 2001, 18(3): 229-238
[21] 李玮. 5种不同作用机理除草剂对青海高原农田土壤微生物的影响研究[J]. 安徽农学通报, 2014, 20(11): 74-77
Li W. Effects of five different mechanism of herbicides on soil microbes in Qinghai plateau [J]. Anhui Agricultural Science Bulletin, 2014, 20(11): 74-77 (in Chinese)
[22] 姜佳昌. 四种除草剂对燕麦田土壤微生物数量的影响研究[J]. 甘肃畜牧兽医, 2015, 45(10): 26-29
Jiang J C. Effects of four kinds of herbicides on the quantity of microorganisms in oats field [J]. Gansu Animal and Veterinary Sciences, 2015, 45(10): 26-29 (in Chinese)
[23] 李立鑫, 高增贵, 杨瑞秀. 常用除草剂对玉米根际土壤微生物的影响[J]. 辽宁农业科学, 2015(2): 14-16
Li L X, Gao Z G, Yang R X. Effects of commonly used herbicides on maize rhizosphere soil microorganism [J]. Liaoning Agricultural Sciences, 2015(2): 14-16 (in Chinese)
[24] 陈隆升, 陈永忠, 彭映赫, 等. 草甘膦对油茶林土壤微生物数量及酶活性的影响[J]. 湖南林业科技, 2015, 42(4): 32-35
Chen L S, Chen Y Z, Peng Y H, et al. Effect of glyphosate on number of soil microbial and enzyme activity of camellia forest [J]. Hunan Forestry Science and Technology, 2015, 42(4): 32-35 (in Chinese)
[25] Liu W T, Marsh T L, Cheng H, et al. Characterization of microbial diversity by determining terminal restriction fragment length polymorphisms of genes encoding 16S rRNA [J]. Applied and Environmental Microbiology, 1997, 63(11): 4516-4522
[26] Qian H F, Hu B L, Cao D, et al. Bio-safety assessment of validamycin formulation on bacterial and fungal biomass in soil monitored by real-time PCR [J]. Bulletin of Environmental Contamination and Toxicology, 2007, 78(3-4): 239-244
[27] 叶璟. 除草剂禾草灵对水稻与蓝藻的对映选择性毒理研究[D]. 杭州: 浙江大学, 2010: 31-38
Ye J. Enantioselective toxicology of chiral herbicide diclofop on rice and blue green alga [D]. Hangzhou: Zhejiang University, 2010: 31-38 (in Chinese)
[28] 叶璟, 刘超男, 刘维屏. 禾草灵对铜绿微囊藻氧化应激及藻毒素释放的影响[J]. 浙江大学学报: 农业与生命科学版, 2014, 40(3): 322-329
Ye J, Liu C N, Liu W P. Effects of herbicide diclofop-methyl on oxidative stress and microcystin release in cyanobacterium Microsystis aeruginosa [J]. Journal of Zhejiang University (Agric. & Life Sci.), 2014, 40(3): 322-329 (in Chinese)
[29] 商宇红. 吡氟禾草灵对硬毛刺苞菊作用过程的研究[D]. 青岛: 青岛农业大学, 2014: 17-18
Shang Y H. Study on the inhibitory process of fluzifop-butyl on Acanthospermum hispidum [D]. Qingdao: Qingdao Agricultural University, 2014: 17-18 (in Chinese)
[30] 张琼. 禾草酸与HCH异构体对铜绿微囊藻和拟南芥的结构选择性毒性和致毒机理研究[D]. 杭州: 浙江工业大学, 2012: 43-47
Zhang Q. Stereoselective phytotoxicity and toxic mechanisms against Microcystis aeruginosa and Arabidopsis thaliana induced by diclofop acid and HCH isomers [D]. Hangzhou: Zhejiang University of Technology, 2012: 43-47 (in Chinese)
[31] 吴小虎, 徐军, 董丰收, 等. 5种除草剂对土壤蔗糖酶和脲酶活性的影响[J]. 农药学学报, 2015, 17(2): 179-184
Wu X H, Xu J, Dong F S, et al. Effects of five herbicides on activities of soil invertase and urease [J]. Chinese Journal of Pesticide Science, 2015, 17(2): 179-184 (in Chinese)
[32] 王正贵, 封超年, 郭文善, 等. 除草剂异丙隆对麦田土壤微生物数量及酶活性的影响[J]. 应用与环境生物学报, 2010, 16(5): 688-691
Wang Z G, Feng C N, Guo W S, et al. Effects of isoproturon on soil microbial populations and enzyme activities [J]. Chinese Journal of Applied and Environmental Biology, 2010, 16(5): 688-691 (in Chinese)
[33] 徐蒋来, 胡乃娟, 张政文, 等. 两种除草剂对稻田土壤微生物数量和酶活性的影响[J]. 水土保持通报, 2015, 35(4): 168-171
Xu J L, Hu N J, Zhang Z W, et al. Effects of two herbicides on soil microbes and enzyme activities in a paddy field [J]. Bulletin of Soil and Water Conservation, 2015, 35(4): 168-171 (in Chinese)
[34] Smith A E. Degradation of the herbicide diclofopmethyl in prairie soils [J]. Journal of Agricultural and Food Chemistry, 1977, 25(4): 893-898
[35] 林晶. 精噁唑禾草灵和解草唑的水解、光解及对大型溞的急性毒性变化[D]. 大连: 大连理工大学, 2008: 105-106
Lin J. Evolution of acute toxicity upon hydrolysis and photolysis of fenoxaprop-pethyl and fenchlorazole-ethyl [D]. Dalian: Dalian University of Technology, 2008: 105-106 (in Chinese)
[36] 张妤, 郭爱玲, 崔烨, 等. 培养条件下二氯喹啉酸对土壤微生物群落结构的影响[J]. 生态学报, 2015, 35(3): 849-857
Zhang Y, Guo A L, Cui Y, et al. Effect of quinclorac on soil microbial community structure under culture conditions [J]. Acta Ecologica Sinica, 2015, 35(3): 849-857 (in Chinese)
[37] 孙约兵, 王润珑, 徐应明, 等. 除草剂硝磺草酮对土壤微生物生态效应研究[J]. 中国环境科学, 2016, 36(1): 190-196
Sun Y B, Wang R L, Xu Y M, et al. Ecological effects of herbicide mesotrione on soil microbial communities[J]. China Environmental Science, 2016, 36(1): 190-196 (in Chinese)

