响应面优化杉木种鳞多酚索氏提取工艺
李 佳,张 健,张家君,吕蒙蒙,林思祖,陈 宇
(1.福建农林大学林学院,福建 福州 350002;2.国家林业局杉木工程技术研究中心,福建 福州 350002)
植物多酚(Polyphenols)又称植物单宁,是一种普遍存在于植物体内的化合物[1]。植物多酚因其与氧自由基结合能力较强,而在植物的防御体系中起到重要作用,是植物抵御外界不利因素,如机械损伤、病虫害侵害、逆境胁迫等的关键次生代谢物质[2-3]。近年来,多酚类物质在植物的抗性生理[4-8]、生长发育[9-10]以及衰老死亡[11]等方面的功能逐渐形成了一项研究热点。而植物多酚提取及其产业化也呈一定规模,先后有报道从蓝莓[12]、茶叶[13-14]、苹果[15]、葡萄籽皮[16]、柑橘[17]和石榴[18]等植物原料中提取的多酚类物质被应用于饲料加工、食品保鲜和生物制药等领域。
杉木[Cunninghamia lanceolata(Lamb.)hook.]是我国南方的主要用材树种,其在国内的分布区遍布南方17个省区,人工用材林面积居用材树种的首位[19]。目前杉木资源的利用主要以木材为主,其他方面的资源利用研究报道较为少见。近年来,随着杉木优良种子园营建规模的扩大,每年产生大量采种后遗弃的杉木球果,对这部分资源加以利用,既能实现杉木资源综合利用,减少资源浪费;又能产生实际经济效益,提高生产部门效益。因此,开展有关杉木球果良种采收后剩余物再度利用的相关研究工作,是开发杉木种子园潜在价值、增加杉木非木质利用效率的有效途径。
为此,本研究拟以索氏提取法利用杉木种鳞开展多酚提取研究,并以响应面法优化其提取工艺,为深度开发利用杉木球果种鳞资源提供一定的技术支持,同时也为杉木非木质利用提供研究基础。
1 材料与方法
1.1 材料
本研究供试材料2017年11月收集于福建省三明市尤溪国有林场三代种子园。在种子园球果采收、晾晒、采种之后,收集废弃的空球果带回实验室。 空球果经粉碎机粉碎后过60目筛,粉末4℃冷藏备用。
1.2 实验方法
1.2.1 没食子酸标准曲线的建立
精确吸取 0、1、2、3、4、5mL 的 0.25mg·mL-1的没食子酸标准液于6个10mL棕色离心管中,用超纯水补足至 5mL,摇匀,得浓度为 0、0.05、0.10、0.15、0.20、0.25 mg·mL-1的标准液。
分别吸取各浓度没食子酸标准液0.2 mL于6个10mL棕色离心管中,加入0.4 mL福林酚试剂,充分摇匀,5min后加入2 mL 10% Na2CO3溶液,再分别加入2.4 mL超纯水定容至5mL,充分摇匀,50℃水浴1 h后在765 nm波长处分别测得其吸光值。得没食子酸浓度(X,mg·mL-1)和吸光值(Y)的标准曲线方程 y=2.8026x+0.0633,R2=0.999。
1.2.2 杉木球果种鳞多酚提取量的计算
分别精确吸取0.2 mL稀释适当倍数的种子提取液于10mL棕色离心管中,加入0.4mL福林酚试剂,充分摇匀,5min后加入2mL 10%Na2CO3溶液,超纯水定容至5mL,充分摇匀,50℃水浴1 h后在765 nm波长处测得其吸光值。样品中的多酚含量以没食子酸标准品计算,并按方程式计算多酚提取量。

式中:P 为多酚提取量,mg·g-1;N 为提取液稀释倍数;A为原液稀释后测得的吸光值;V为提取液的体积,m2;M 为原料的质量,g。
1.2.3 单因素试验
杉木球果种鳞粉末0.5 g,在不同提取时间(1、2、3、4、5 h)、提取温度(30、40、50、60、70 ℃)、乙醇浓度(20% 、40% 、60% 、80% 、100% )和液料比(15∶1、25∶1、35∶1、45∶1、55∶1)来考察各单因素对多酚提取量的影响。
1.2.4 响应面优化试验设计
在单因素试验的基础上,选择提取时间,提取温度,乙醇浓度,液料比为因子,以多酚提取量为响应值,建立四因素三水平的响应面设计试验,得到二元多项式回归方程,分析最佳提取工艺,每次试验重复三次。杉木球果种鳞的Box-Behnken试验设计因素及水平见表1。

表1 杉木球果种鳞Box-Behnken试验因素及水平表Table1 Factors and levels of Box-Behnken test of the bracts of Chinese fir
1.2.5 数据分析
所有数据均用Microsoft Office Excel 2016,Origin9.1和Design expert10处理、作图和分析。
2 结果与分析
2.1 单因素对杉木球果种鳞多酚提取量影响
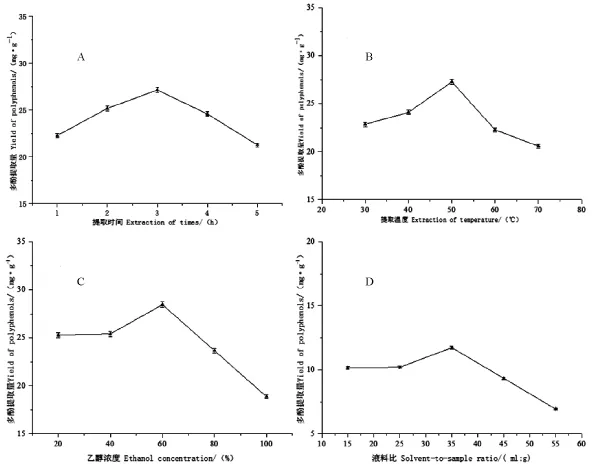
图1 不同处理对多酚提取量的影响Figure 1 Effects of different treatments on yield of polyphenols
不同因素对杉木球果种鳞多酚提取影响的单因素分析结果见图1。可见提取时间、提取温度、乙醇浓度和液料比这4个因素对杉木球果种鳞多酚提取量均有一定影响,4个因素各梯度水平下均表现出先上升后下降的趋势。各因素的最佳水平分别为:提取时间为3 h(多酚提取量27.14 mg·g-1,较最低水平提升了27.53%,图1A);提取温度为50℃(多酚提取量27.28 mg·g-1,较最低水平提升了 32.59% ,图1B);乙醇浓度为60%(多酚提取量28.46 mg·g-1,较最低水平提升了50.86%,图1C);液料比为35:1(多酚提取量 11.72mg·g-1,较最低水平提升了 69.21% ,图1D)。
2.2 Box-Behnken试验结果与分析
2.2.1 二次多项式回归模型建立与分析
利用Design expert 10软件进行Box-Behnken试验,结果见表2。Box-Behnken试验设计共计29个试验点,其中24个为分析因点,5个为零点,其中分析因点作为自变量,分别取值于提取时间(A),提取温度(B),乙醇浓度(C)及液料比(D)中所构成的三维顶点,零点为A、B、C、D的中心点,其中零点重复5次,检查中点试验的重复性是否良好,以观察不可控因素对试验造成的影响。

表2 Box-Behnken试验结果Table 2 Experimental results of Box-Behnken
将表2的数据采用Design expert 10软件进行二次多项式回归模型方程拟合,得到多酚提取量预测值(Y)、提取时间(A)、提取温度(B)、乙醇浓度(C)、液料比(D)的回归模型方程:

对该回归模型进行方差分析,结果见表3。该回归模型方程具备极显著性 (P<0.000 1),决定系数R2=0.935 5,调整后决定系数Radj2=0.870 9,说明该模型拟合性良好,预测相关系数Rpred2=0.870 9,模型预测可信度高,失拟性P=0.836 8,差异不显著,说明该回归模型方程与实际情况吻合程度高,试验误差小,变异系数C.V=1.04%,即模型置信度较高,具备可重复性。模型中,A、C、B2、C2、D2差异极显著,B、A2差异显著,D、AB、AC、AD、BC、BD、CD 差异不显著,由显著性和F值可知,杉木球果种鳞多酚提取量的影响因素为乙醇浓度C>提取时间A>提取温度B>液料比D。
2.2.2 两因子间交互作用分析
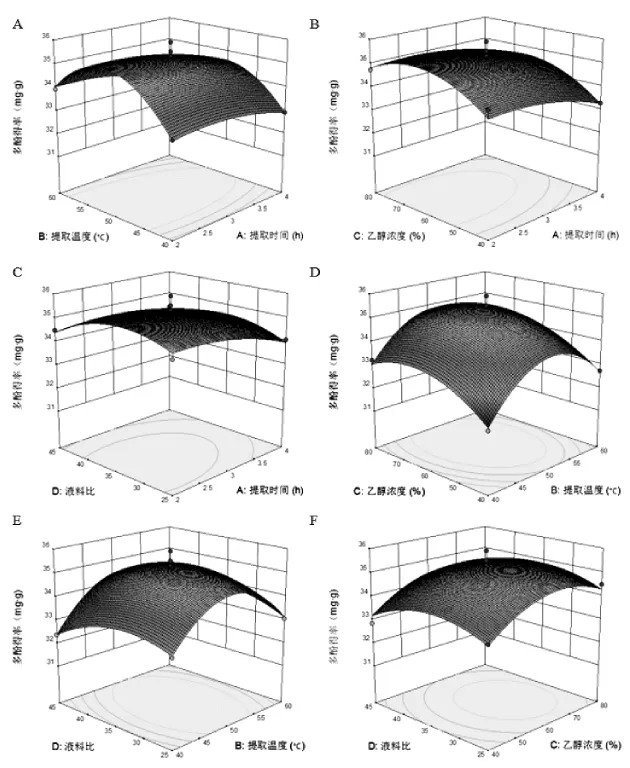
图2 任意两变量对多酚提取量影响的响应曲面图Figure 2 Response surface plots for the effects of any two variables on extraction rate of polyphenols
图2为响应值和各影响因子构成的立体曲面图,显示了分别为任意两个水平变量为零时,其他两个水平变量对响应值的影响。提取时间与其他三个因素的交互作用对杉木球果种鳞多酚提取量的影响结果显示(图2A、B、C),提取时间在2-4 h之间,多酚提取量略上升后缓慢下降。提取温度与其他三个因素的交互作用结果显示(图2A、D、E),提取温度在40-60℃之间,多酚提取量先上升后下降,同时响应曲面坡度较陡。乙醇浓度与其他三个因素的交互作用结果显示(图2C、D、F),乙醇浓度在 40%-80% 之间,多酚提取量为先上升后下降。液料比与其他三个因素的交互作用结果显示(图2C、E、F),液料比在 25-45 之间,多酚提取量为先上升后下降,响应曲面坡度较缓。

表3 回归方程系数显著性检验表Table 3 Testof significance for regression equation coefficients
2.3 最佳条件预测及验证性试验
通过建立二次多项式回归模型,对最佳试验条件进行了预测,得到最佳提取工艺为:提取时间2.43 h,提取温度50.84℃,乙醇浓度64.37%,液料比33.78:1,此时多酚提取量理论值为35.45mg·g-1。在此条件下重复6次,实际测定的多酚平均得率为(35.86±1.45)mg·g-1,高于理论值1.16%,表明该模型准确可靠,具备实际使用价值(表4)。为迎合实际生产需要,应在保证提取量的前提下尽量缩短提取时间,降低生产成本,使生产流程更为经济。因此将提取工艺改良为:提取时间2 h,提取温度50℃,乙醇浓度60%,液料比35:1。在此条件下重复测定6次,测得多酚平均得率为 (34.30±1.20)mg·g-1,低于最佳工艺值 4.35%,符合实际生产需要。

表4 验证性结果Table4 The verification result
3 讨论
本研究利用Box-Behnken试验原理,探讨索氏提取法从杉木种鳞提取植物多酚的工艺及其优化方案。从单因素分析结果来看,提取时间、温度、乙醇浓度和液料比等因素对多酚提取效果均有影响。通过加大提取时间、温度、乙醇浓度和液料比,能够加快提取液中的分子运动速度,增加溶液与溶质的接触表面积[20],同时有机溶剂和水的复合体系(有机溶剂占50%-70%)能够对氢键产生破坏,削弱疏水键[21],有助于杉木种鳞组织内多酚物质溶解,提升多酚提取量。当提取时间、温度、乙醇浓度和液料比超过一定限度,多酚提取量反而会降低,一方面可能是提取液中的酚类物质由于光,热,多酚氧化酶等其他因素的影响,发生氧化,聚合反应[22],降低多酚提取量,另一方面可能是乙醇水溶液(>50%)的沸点在80℃左右[23],过高的温度使得乙醇大量逸出,同时杂质,色素,脂溶性成分析出较多,这些成分与多酚类化合物形成了竞争关系,使得多酚提取量下降[24]。
从响应面分析结果来看,各个因素对杉木种鳞多酚提取效果的影响依次为:乙醇浓度>提取时间>提取温度>液料比。理论最佳提取工艺为:提取时间2.43 h,提取温度50.84℃,乙醇浓度64.37%,液料比33.78:1,此时多酚提取量理论值为(35.86±1.45)mg·g-1;改良工艺为提取时间2h,提取温度50℃,乙醇浓度60%,液料比35:1,在此条件下多酚平均得率为 (34.30±1.20)mg·g-1,可以满足实际生产需求。
相较于李波等[25]报道的红松松鳞的植物多酚提取效率(17.76±0.81)mg·g-1,杉木种鳞提取量较高,一方面可能是红松松鳞多酚提取前处理步骤石油醚脱脂,可能损失了一部分多酚类物质;另一方面可能杉木本身多酚类物质含量要大于红松松球鳞片中的含量。与杉木种子的多酚含量相比[涩籽(383.220±1.233)mg·g-1;健籽(18.360±0.069)mg·g-1][22],种鳞的多酚含量比健籽高,但是远低于涩籽,这可能是由于组织特异性造成的,也可能是提取方法的差异。相对于其他种类植物,如猕猴桃果皮28.14 mg GAE/g[26]、石榴皮 (10.63±0.28)mg·g-1[27]、苹果皮渣 4.53mg·g-1[28]等,杉木球果种鳞多酚类物质含量丰富,具有较大的利用潜力。
本研究是对杉木种鳞提取植物多酚的初步尝试,在某些方面还存在一些不足之处,在后续的研究中,可针对杉木球果种鳞开展不同提取方法的比较,进一步筛选出适合工业生产的提取方法,为杉木资源综合利用与产业化提供理论依据。
[1]宋立江,狄莹,石碧.植物多酚研究与利用的意义及发展趋势[J].化学进展,2000,12(2):161-170.
[2]杨澍,洪阁,刘天军.植物多酚类物质的生物学活性研究进展[A].中药与天然药物现代研究学术研讨会[C].贵阳:2013.
[3]SCALBERTA,WILLIAMSON G.Dietary intake and bioavailability of polyphenols[J].2000,130(8S):2073S.
[4]PAYRA D,NAITO M,FUJII Y,et al.Hydrophobized plant polyphenols:self-assembly and promising antibacterial,adhesive,and anticorrosion coatings[J].Chemical Communications,2015,52(2):312-315.
[5]ZHANG L,SHAMALADEVIN,PATIL B S,et al.Polyphenol-rich extract of Pimenta dioica berries (Allspice)kills breast cancer cells by autophagy and delays growth of triple negative breast cancer in athymicmice[J].Oncotarget,2015,6(18):16379-16395.
[6]TYAGIT,TREAS JN,MAHALINGAIAH P K,et al.Poten-tiation of growth inhibition and epigenetic modulation by combination of green tea polyphenol and 5-aza-2'-deoxycytidine in human breast cancer cells[J].Breast Cancer Research&Treatment,2015,149(3):655-68.
[7]TSAIh C,LIY C,YOUNGTh,etal.Citruspolyphenol fororal wound healing in oralulcersand periodontaldiseases.[J].Journalof the Formosan MedicalAssociation,2016,115(2):100-107.
[8]SUN Q,WEDICK NM,TWOROGER SS,et al.Urinary Excretion of Select Dietary Polyphenol Metabolites Is Associated with a Lower Risk of Type 2 Diabetes in Proximate but Not Remote Follow-Up in a Prospective Investigation in 2 Cohorts of USWomen[J].Journal of Nutrition,2015,145(6):1280-8.
[9]高智慧,朱治平.杉木种子发育生理,涩籽成因及降低败育措施的研究[J].林业科研究,2000,13(6):659-666.
[10]成小飞.杉木胚胎选择过程中几种酶的组织化学定位[J].植物学报,1994(s1):65-66.
[11]成小飞.杉木胚胎选择期的淀粉动态及其种子败育[J].林业科学,1995,31(6):481-484.
[12]雷良波,杨浩,陈军李,等.蓝莓果渣开发利用研究进展[J].中国酿造,2017(10):17-22
[13]沈新南,陆瑞芳,何更生,等.茶多酚对四氯化碳致小鼠肝损伤的影响[C]//中国营养学会全国营养学术会议.1996.
[14]王当丰,李婷婷,国竞文,等.茶多酚-溶菌酶复合保鲜剂对白鲢鱼丸保鲜效果[J].食品科学,2017,38(7):224-229.
[15]LU Y R,FOO L Y.Antioxidant and radical scavenging activities of polyphenols from apple pomace.[J].Food Chemistry,2000,68(1):81-85.
[16]赵竞,景浩.不同品种葡萄皮、籽提取物多酚念量及抗氧化能力的比较研究[J].食品工业科技,2009(10):154-158.
[17]KANG H J,Chawla SP,JO C,et al.Studies on the development of functional powder from citrus peel.[J].Bioresource Technology,2006,97(4):614-620.
[18]王周.石榴皮总多酚提取及减脂作用研究[D].成都:西华大学,2016.
[19]杨世先.杉木的栽培技术[J].中国林业,2009(17):50.
[20]曾献,YUAN Y Z,曹清明,等.油茶籽多酚的提取研究[J].食品与机械,2008,24(4):69-72.
[21]石壁,狄莹.植物多酚[M].北京:科学出版社,2000:30.
[22]林小琴,马志慧,何宗明,等.杉木种子多酚提取工艺优化[J].福建林学院学报,2017,37(1):47-53.
[23]冉晓敏,李忠海,付湘晋,等.樟树多酚提取工艺的研究[J].食品与机械,2011,27(2):51-54.
[24]耿中华,秦卫东,马利华,等.梨皮多酚的提取工艺优化的研究[J].食品工业科技,2009(12):233-234.
[25]李波,包怡红,王振宇.红松松球鳞片多酚提取工艺的优化[J].食品与机械,2012,28(5):111-115.
[26]郭彩霞,任晓婷,张生万,等.响应面法优化超声波辅助提取猕猴桃果皮多酚工艺研究[J].食品工业科技,2017,38(11).
[27]张艳霞,朱彩平,邓红,等.超声辅助双水相提取石榴皮多酚[J].食品与发酵工业,2016,42(12):150-156.
[28]李珍,哈益明,李安,等.响应面优化苹果皮渣多酚超声提取工艺研究[J].中国农业科学,2013,46(21):4569-4577.

