裸鼠人来源性子宫腺肌病造模方法的比较
范为之,姜心禅,关永格,李坤寅
(1. 广州中医药大学,广州 510006;2.广州中医药大学第一附属医院,广州 510405)
裸鼠人来源性子宫腺肌病造模方法的比较
范为之1,姜心禅1,关永格2,李坤寅1
(1. 广州中医药大学,广州 510006;2.广州中医药大学第一附属医院,广州 510405)
目的 通过不同的造模方法建立裸鼠人来源性子宫腺肌病模型,筛选出理想的造模方法,为研究子宫腺肌病发病机制及相关治疗方案提供理想的动物模型。方法 将80只雌性裸鼠随机分为腹腔种植组、皮下种植组、腹腔注射组和皮下注射组,每组20只。各模型组分别采用不同造模方法建立裸鼠人来源性子宫腺肌病模型,术后4周观察移植物的体积及组织形态学。结果 腹腔种植组建模成功率95%,皮下种植组建模成功率45%,腹腔注射法及皮下注射法成模率0%。结论 腹腔种植法建立子宫腺肌病裸鼠模型成模率高,稳定性良好,是一种理想的人来源性子宫腺肌病动物模型。
子宫腺肌病;人来源性;动物模型;裸鼠
子宫腺肌病近年来其发病率呈不断上升趋势,已成为妇科常见疑难病[1]。渐进性痛经、不孕为子宫腺肌病最主要的临床表现,痛经发生率高达77.8%[2],严重影响患者生活和工作。多年来,对于子宫腺肌病生理病理机制以及治疗效果的探索仍存在诸多空白,但因在人体中很难进行对照研究,限制了子宫腺肌病的研究进展。因此,建立一种理想的子宫腺肌病动物模型来深入探讨和研究子宫腺肌病的发生、发展和治疗,是目前迫切需要解决的问题。本研究采用4种造模方式对裸鼠进行造模:腹腔种植法、腹腔注射法、皮下种植法和皮下注射法[3-5],并筛选优化出成模率高、稳定性良好的人来源性子宫腺肌病裸鼠模型。
1 材料与方法
1.1 动物及分组
SPF级BALB/C-nu裸小鼠80只,6~8周龄,雌性,体重(19.12±0.46)g,购自广州中医药大学实验动物中心[SCXK(粤)2013-0034],饲养于广州中医药大学第一附属医院SPF级动物实验室[SYXK(粤)2013-0092],环境温度:(22±2)℃,相对湿度:50%~60%,光照:150~200 lx,12 h/12 h明暗交替,噪音<50 db,每只笼内饲养5只裸鼠,自由饮食,按照实验动物使用的3R原则给予人道的关怀,并通过广州中医药大学第一附属医院医学伦理委员会的动物实验伦理审查(编号:TCMF1-2015048)。
80只裸鼠随机分为四组进行实验造模,分别为腹腔种植组、皮下种植组、腹腔注射组、皮下注射组,每组各20只裸鼠。
1.2 手术器械及试剂
12.5 cm持针器、12.5 cm止血钳、10 cm眼科剪、10 cm眼用有齿镊、10 cm眼用有钩镊(上海金钟医疗手术器械厂);4/0带针可吸收缝线(上海金环医用缝线厂);电子游标卡尺;注射用青霉素钠(苏州润泽制药公司,批号:15062002);水合氯醛(国药集团化学试剂有限公司,批号:20150325)、乌拉坦(国药集团化学试剂有限公司,批号:20150723);BioCoatTMMatrigel基质(BD公司);PBS缓冲液(Hyclone公司,批号NZM1300);青-链霉素溶液(Hyclone公司,批号J130054)。
1.3 移植标本来源
广州中医药大学第一附属医院妇科住院要求手术的子宫腺肌病患者1例,取其部分病灶组织用于移植。同时取部分病灶组织用于子宫腺肌病原代细胞培养。
1.4 移植标本的采集及处理
1.4.1 腹腔种植组及皮下种植组的标本采集和处理
手术室无菌获取标本,用手术刀切开子宫后壁(一般病灶均位于子宫后壁)或者腺肌瘤处切取标本组织2 cm×2 cm×2 cm,放入冰浴PBS缓冲液,0.5 h内送实验室进行腹腔移植(术后冰冻病理检查结果不符合者及时剔出)。用无齿镊将病灶组织在小瓶中用PBS缓冲液(加入青-链霉素溶液200 U/mL)冲洗,去除组织液及血液,反复冲洗3次。在培养皿中用眼科剪刀剪碎组织(均为2 mm×2 mm×2 mm的组织块)。
1.4.2 腹腔注射组及皮下注射组的标本采集和处理
手术室无菌获取离体子宫或病灶组织,用手术刀切开病灶组织,切取大小约1.5 cm×1.5 cm×1.5 cm组织,放入冰浴PBS缓冲液,0.5 h内送细胞实验室处理,参考相关文献步骤[4]进行原代细胞培养?
1.5 动物造模
1.5.1 腹腔种植组的动物造模
手术当日早晨对欲行手术的裸鼠禁食水,术前称重。裸鼠行腹腔麻醉(5%水合氯醛+12.5%乌拉坦1∶1混合溶液,5 mL/kg)[5],宜手术麻醉深度:动物由兴奋转为抑制后,动物四肢紧张度明显降低,角膜反射迟钝,皮肤痛觉消失。全麻成功后,取仰卧位固定于操作板上,碘伏消毒腹部,并铺巾,充分暴露手术视野。取中下腹正中0.5 cm纵切口,依次切开腹壁、筋膜、腹膜层,将已备标本种植于裸鼠盆、腹腔不同部位,每只裸鼠植入2块。种植后依次缝合腹膜、腹壁切口。大腿肌注青霉素3 d预防感染。
1.5.2 皮下种植组的动物造模
裸鼠依照上法术前准备及麻醉后,取俯卧位固定于操作板上,碘伏消毒背部皮肤。取后背正中下1/3处做0.5 cm横切口,切开皮肤后,将已备标本组织自切口置入,用眼科镊将标本沿皮下与浅筋膜的间隙推至腋下皮肤松弛处,每只裸鼠植入2块,缝合皮肤。大腿肌注青霉素3 d预防感染。
腹腔种植组及皮下种植组的手术操作由4位技术熟练的实验人员同时进行,标本获取后至移植结束2 h内完成。术后裸鼠置于干净饲养笼内,使用暖光灯照射保温至苏醒。术后注意裸鼠排便、进食、饮水、皮色情况。
1.5.3 腹腔注射组的动物造模
将子宫腺肌病原代细胞培养至铺满培养皿后,进行计数。用I型胶原酶洗脱贴壁细胞并离心。将人子宫腺肌病原代细胞5×106个与0.5 mL Matrigel胶注射至裸鼠腹腔内。
1.5.4 皮下注射组的动物造模
将人子宫腺肌病原代细胞5×106个与0.5 mL Matrigel胶注射至裸鼠腋下皮下。
1.6 造模成功的观测指标与标准
1.6.1 移植物外观观察
造模后4周于造模部位取材,测量各组裸鼠病灶组织的最大直径(L)及最大横径(W),计算病灶体积(V),V=L×W2/2,比较植入病灶组织体积增大情况。
1.6.2 镜下病理检查鉴定与标准
造模后4周取造模部位肿物置于4%中性甲醛中固定,常规石蜡切片,HE染色,倒置显微镜检查并拍照。移植物组织内,见周围平滑肌组织内散在包裹子宫内膜腺体和疏松水肿的间质,内膜腺体腔内可有分泌物和炎细胞存在,可见泡沫细胞反应。内膜样组织旁可见含铁血红素颗粒状沉积。
1.7 统计方法
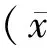
2 结果
2.1 裸鼠存活及成模情况
80只建模裸鼠,其中1只(腹腔种植组)因麻醉过深抑制呼吸心率,术后2 h未能苏醒并死亡。存活79只裸鼠,均于4周后取材鉴定造模结果。
腹腔种植组裸鼠取材后,造模移植部位呈深红色,表面欠规则球状,质地较硬,直径1.8~2.5 mm,基底部与盆腹壁连接处见有血管生成(图1 A)。组织学观察可见:组织血供良好,可见平滑肌组织内可见散在子宫内膜腺体,伴含铁血红素着色。平滑肌细胞肥大,间质疏松水肿,19例均符合子宫腺肌病表现(图2)。建模成功率为95%(19/20)。
皮下种植组裸鼠取材后,造模移植部位呈深红色或淡黄色椭圆状,质地硬,直径1.2~2.0 mm,周边未见明显血液供应(图1 B)。组织学观察可见:部分移植标本(9例)可见平滑肌组织透明变性,偶见萎缩的子宫内膜腺体(图3)。余11例均为平滑肌组织变性机化,伴局部钙化。建模成功率为45%(9/20)。
腹腔注射组20例取材时见盆腹腔广泛粘连,大网膜、肠管、腹部粘连明显,无法确定成模位置,取粘连严重部位组织行HE染色鉴定,组织学观察见:镜下均为疏松结缔组织及脂肪组织,未见子宫腺肌病样改变。建模成功率为0%(0/20)。
皮下注射组中3例在造模后第1周见注射处腋下皮下成瘤,约6 mm×6 mm×4 mm,第2~4周肿块逐渐减小至完全消失,余下17例未见外观形态学变化。造模后4周,取造模处皮下组织行HE染色鉴定,组织学观察见:大量淋巴细胞、成纤维细胞、脂肪细胞,未见子宫腺肌病样改变。建模成功率为0%(0/20)。
2.2 病灶移植物体积变化
建模后第4周取材并测量病灶移植物体积,腹腔种植组病灶体积(8.83±1.06)mm3,皮下种植组病灶体积(6.92±0.53)mm3,腹腔注射组及皮下注射组未见明显病灶组织生成。
四组建模方法比较后发现:移植物体积及成模率各组差异有显著性(发病率χ2=54.0659,P<0.05;移植物体积F=23.46,P<0.05)。腹腔种植组成模率高于其余各组(P<0.05),移植物体积腹腔种植组与其余各组差异有显著性(P<0.05)。
3 讨论
子宫腺肌病目前造模方法大致可分为药物诱导及手术诱导两种。药物诱导有长期饲喂雌激素(大于6个月)[6]、雌孕激素联合[7]、孕激素、催乳素和选择性雌激素受体调节剂(SERM)诱导[8]。他莫昔芬(tamoxifen,TAM)诱导法为最主要的药物诱导子宫腺肌病裸鼠模型的方法,其特点为发病快,发病率高。Mehasseb等[9]给新生CD-1小鼠出生第2~5天口服TAM 1 mg/kg,每日1次,10 d时已观察到子宫腺肌病灶的形成,42 d时发病率为100%。但药物诱导子宫腺肌病动物模型常常并发子宫内膜异常增生和子宫内膜癌,且其发病机制不符合人子宫腺肌病内膜异位侵袭的过程。手术诱导方式中子宫丘脑移植法是建立鼠子宫腺肌病模型的经典方法,将小鼠的垂体移植到同种异体的小鼠子宫腔内或肾包膜下均可诱导小鼠子宫腺肌病的形成。但这一方法对手术技巧要求较高、成模时间较长[10],可操作性较差,同时它造成了小鼠内分泌系统的紊乱,模型鼠出现高泌乳素血症几率较高[11]。

注:A.腹腔种植组子宫腺肌病病灶;B.皮下种植组子宫腺肌病病灶。图1 子宫腺肌病病灶Note. A.Adenomyosis lesion formed after intraperitoneal implantation. B. Adenomyosis lesion formed after subcutaneous implantation.Fig.1 Gross appearance of the uterine adenomyosis lesions
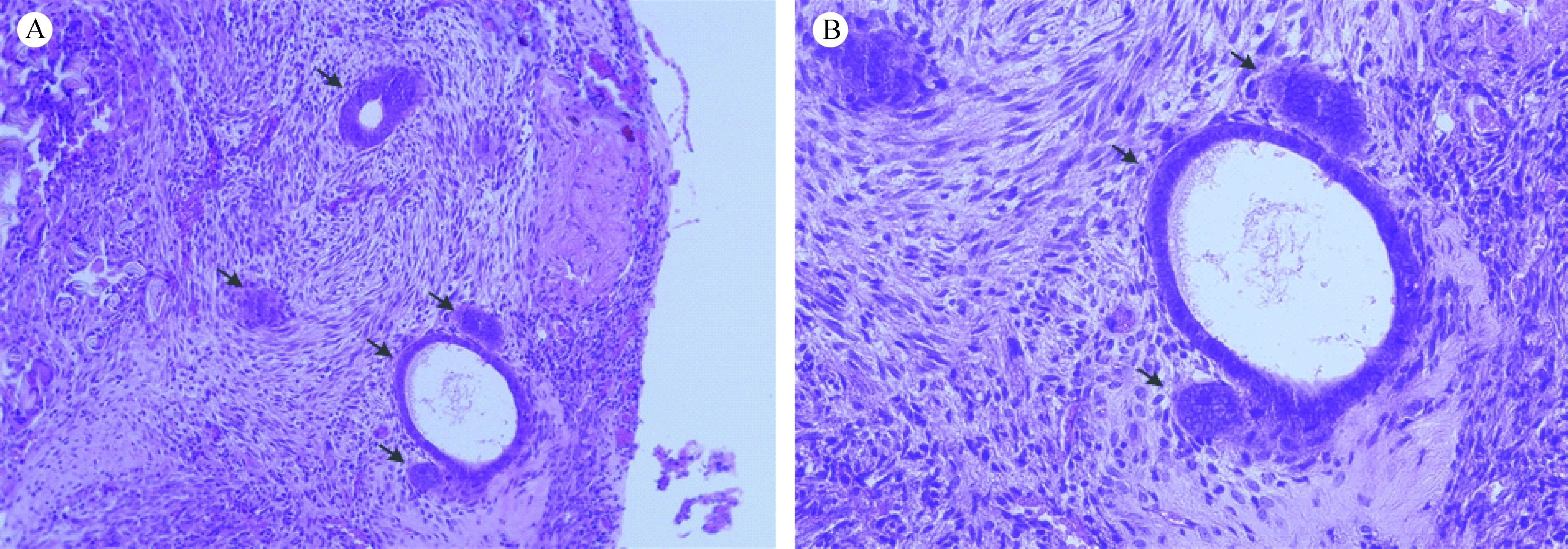
注:A. 腹腔种植组子宫腺肌病病灶(×200);B. 腹腔种植组子宫腺肌病病灶(×400)图2 腹腔种植组移植物HE染色切片Note. A.Adenomyosis lesion formed after intraperitoneal implantation. ×200. B. The same lesion,×400.Fig.2 Histological appearance of the adenomyosis lesions formed after intraperitoneal implantation at 4 weeks after surgery

注:A.皮下种植组子宫腺肌病病灶(×200);B. 皮下种植组子宫腺肌病病灶(×400)。图3 皮下种植组移植物HE染色切片Note. A. Adenomyosis lesion,×200. B. The same lesion,×400.Fig.3 Histological appearance of the adenomyosis lesions formed at 4 weeks after subcutaneous implantation
子宫腺肌病与子宫内膜异位症的发病机理相似,均是子宫内膜在被覆宫腔以外的地方种植生长。子宫内膜异位症裸鼠模型发展成熟,研究周期较短,可作为新的子宫腺肌病裸鼠模型参考。笔者在参考国内外文献的基础上,选取并采用了4种方法对裸鼠进行子宫腺肌病裸鼠造模。曾有研究认为腹腔种植及皮下种植建模成功率差异无统计学意义[6,12],但本研究中腹腔种植成功率高于皮下种植,差异有统计学意义。究其原因,可能因为腹腔种植法能够模拟子宫腺肌病灶在腹腔内自然生长过程以及适应腹腔微环境的变化,同时腹膜血运较为丰富,移植物能与周围组织建立良好的血运关系进而存活。皮下种植法虽然无需缝合固定移植物,创伤较小,但皮下及浅筋膜间血运较差,移植物易被周围结缔组织包裹机化,失去生物活性。腹腔注射法操作简单,但是病灶在腹腔内的定位盲目,容易遗漏。腹腔注射造模后广泛粘连的大网膜、肠管、腹壁,可能与Matrigel基质胶具有诱导成纤维细胞、血管上皮细胞生长,促进组织纤维酶原活化的作用有关。皮下注射法虽可直接观察移植物的大小,但无法体现移植物在腹腔内自然生长的临床特点[13]。从另一个角度思考,子宫腺肌病为良性肿瘤,其侵蚀性远低于恶性肿瘤细胞,具有侵入性的腺体及间质经过细胞培养后也必然存在活性下降的情况。因此,本实验中皮下注射法无法稳定成瘤。
本实验造模中的几点体会:有文献指出,广泛的粘连导致的肠梗阻和感染是导致建模动物死亡的主要原因[14],故术前建模动物应禁食水,肠道空虚可以降低术中腹腔操作误伤肠道,而且可以减少肠梗阻的发生率,能有效降低术后并发症的发生率。但术前裸鼠禁食水应当从术晨开始,到获得手术标本进行移植(约为4 h)。因裸鼠体重较轻且体质脆弱,如参考人类术前禁食水时限(术前夜22:00),易造成裸鼠脱水、或因饥饿互相撕咬而受伤、失血,上述两种情况都将大大降低裸鼠麻醉、手术耐受性,造成术后裸鼠死亡率上升。术中固定移植物、缝合伤口的缝线应当选择可吸收线[15],可以有效的降低术后因异物丝线造成的腹腔内粘连以及并发症。缝合皮肤时缝线尾端应当尽可能剪短,防止裸鼠苏醒后啃咬缝线,致使术后切口裂开,增加感染、死亡风险。术后麻醉复苏阶段应当将裸鼠置于温暖恒温处,加快苏醒时间,可以减少因体温过低、呼吸心率过慢而造成的死亡。
综上所述,使用腹腔种植法建立人来源性子宫腺肌病裸鼠模型成模率高,稳定性良好,且能够模拟子宫腺肌病病灶在腹腔内自然生长过程以及腹腔微环境的变化,是一种提高子宫腺肌病建模成功率、符合人体机制的新方法,能够为探索子宫腺肌病病理生理机制以及治疗方法提供理想的动物模型。
[1] Elisa G, Serafini A, Inversetti A, etal. Adenomyosis and its impact on women fertility[J].Iran J Reprod Med. 2015, 13(6): 327-336.
[2] 王珺, 张恒辉, 段华. 雌激素受体-α在子宫腺肌病子宫内膜肌层交界区中的表达 [J]. 中华医学杂志,2010, 90(27): 1914-1917.
[3] 崔阳阳,孙伟伟,赵瑞华. 子宫内膜异位症动物模型研究进展[J]. 中国实验动物学报,2013, 21(5):86-89+94.
[4] 王帅. 加味芍药甘草汤对子宫腺肌病MAPK/ERK信号通路干预机制[D].广州中医药大学,2015.
[5] 张全鹏,王慧,陈旦,等.水合氯醛、乌拉坦及其1:1混合液在SD大鼠麻醉中的效果比较及应用[J]. 现代生物医学进展,2011, 11(7):1208-1212.
[6] Mori T, Singtripop T, Kawashima S. Animal model of uterine adenomyosis: Is prolactin a potent inducer of adenomyosis in mice?[J].1991;165:231-234.
[7] Ostrander PL, Mills KT, Bern HA. Long-term responses of the mouse uterus to neonatal diethylstilbestrol treatment and to later sex hormone exposure[J].J Natl Cancer Inst, 1985;74:121-135.
[8] Green AR, Styles JA, Japan EL, etal. Neonatal tamoxifen treatment of mice leads to adenomyosis but not uterine cancer[J]. Exp Toxicol Pathol,2005, 56(4/5):255-263.
[9] Mehasseb MK, Bell SC, Habiba MA. The effects of tamoxifen and estradiol on myometrial differentiation and organization during early uterine development in the CD-I mouse[J]. Reproduction, 2009, 138(2):340-350.
[10] 饶妍妍, 项双卫. 舒必利与垂体移植诱发小鼠子宫腺肌病的比较[J]. 中国实验动物学报,2010,18(3):258-261.
[11] Medina MG, Lebovic DI.Endometriosis-associated nerve fibers and pain[J].Acta Obstet Gynecol Scand. 2009, 88(9):968-975.
[12] 彭艳,何援利.大鼠子宫内膜异位症动物模型建立方法的比较[J].重庆医学,2012,41(25): 2619-2620.
[13] 孙俊杰, 尹利荣. 子宫内膜异位症裸鼠模型的建立与血管生成研究进展[J]. 医学综述,2012,18(7):979-982.
[14] 哈春芳,肖成明,张晟宁,等.开放法大鼠子宫内膜异位症模型的建立与评价[J].山东大学学报:医学版,2011, 49(1):62-66.
[15] 伍明. 可吸收线(快薇乔4/0)连续缝合家兔头皮与普通慕丝线(4/0)间断缝合的优劣对照研究[D].中南大学,2007.
Comparison of four establishment methods of nude mouse models of human-derived uterine adenomyosis
FAN Wei-zhi1,JIANG Xin-chan1,GUAN Yong-ge2, LI Kun-yin1
(1. Guangzhou University of Chinese Medicine,Guangzhou 510006,China;2. The First Affiliated Hospital of Guangzhou University of Traditional Chinese Medicine,Guangzhou 510405)
Objective The purpose of this study was to compare the adenomyosis models in nude mice generated by four different methods,and to find out an optimal modeling method, and to provide an ideal animal model for exploring pathogenesis and experimental treatment of uterine adenomyosis.Methods 1. 80 female healthy nude mouse were divided randomly into 4 groups: Intraperitoneal implantation group,subcutaneous implantation group, intraperitoneal injection group, and subcutaneous injection group. The transplants were taken for pathological examination at 4 weeks after surgery.Results The success rate of intraperitoneal implantation group was 95%,and that of the subcutaneous implantation group was 45%,while the success rate of intraperitoneal injection group and subcutaneous injection group was 0%.Conclusions Establishment of a nude mouse model of uterine adenomyosis by intraperitoneal implantation method has a high success rate and with good stability, and is an ideal mouse model of human-derived uterine adenomyosis.
Adenomyosis; Human uterine adenomyosis; Mouse model; Nude mouse
LI Kun-yin,E-mail: lky0303@gzucm.edu.cn
国家自然科学基金项目(NO 81473715)。
范为之(1990-),女,博士研究生,研究方向:补肾活血法治疗妇科肿瘤及月经病研究。
李坤寅(1962-),男,教授,博士研究生导师,研究方向:中医药防治月经病及妇科癥瘕。E-mail: lky0303@gzucm.edu.cn
Q95-33
A
1005-4847(2017) 01-0043-05
10.3969/j.issn.1005-4847.2017.01.008
2016-07-13

