肺腺癌脑转移动物模型的生物发光成像和SPECT/CT的比较
陈愉生,陈正伟,俞梅娥,涂洵崴,李鸿茹,林凌,林如辉
(1. 福建医科大学省立临床医学院;福建省立医院呼吸内科,福州 350000;. 福建省呼吸四病研究室,福州 350000; 3. 福建医科大学基础医学院,福州 350000;4. 福建中医药大学中西医结合研究院,福州 350000)
肺腺癌脑转移动物模型的生物发光成像和SPECT/CT的比较
陈愉生1、2,陈正伟1,俞梅娥1,涂洵崴1,李鸿茹1、2,林凌3,林如辉4
(1. 福建医科大学省立临床医学院;福建省立医院呼吸内科,福州 350000;. 福建省呼吸四病研究室,福州 350000; 3. 福建医科大学基础医学院,福州 350000;4. 福建中医药大学中西医结合研究院,福州 350000)
目的 利用稳定表达荧光素酶的luc+-PC-9人肺腺癌细胞建立肺癌脑转移动物模型,比较生物发光成像和18F-FDG(18F-fluorodeoxyglucose,18F-氟代脱氧葡糖)SPECT/CT在肺癌转移模型中的评估作用。方法 将luc+-PC-9细胞悬液经左心室注入BALB/c裸鼠建立肺癌脑转移模型,分别在第4、5周行生物发光成像、18F-FDG SPECT/CT检查观察裸鼠成瘤情况, 以H&E染色病理结果为金标准比较两种方法在肺癌转移模型中的作用。结果 经左心室注射luc+-PC-9细胞建立肺癌脑转移模型,脑转移成功率85%。肿瘤细胞的个数与发光强度呈正相关,具有较好的线性关系(R2=0.96)。生物发光成像能在颅脑、脊柱和股骨观察到荧光信号,病理结果证实为转移灶。18F-FDG SPECT/CT在脑组织未见明显的代谢浓聚灶,在股骨或脊柱发现代谢浓聚灶,且病理证实均有骨髓转移。结论 左心室注射法是建立人肺腺癌脑转移模型的可靠方法。生物发光成像系统在检测脑转移和骨转移具有较高的灵敏度和特异度,能实现实时、动态、无创观察转移瘤的生长情况;18F-FDG SPECT/CT在检测脑转移灶并不具有优势,更适合于检测骨转移灶。
肺癌; 脑转移;骨转移; 动物模型; 生物发光成像;单光子发射计算机断层成像术
目前肺癌是最常见的恶性肿瘤之一,死亡率居所有恶性肿瘤之首。尽管用于治疗肺癌的技术和方法在不断进步,但是治疗效果并不理想,五年生存率仅有15%[1]。而非小细胞肺癌(non-small cell lung cancer, NSCLC)占所有的肺癌患者80%左右,其中20%~40%的非小细胞肺癌患者在病程中出现颅脑转移,自然生存时间为1~3个月[2-4]。由于肺癌脑转移患者放、化疗效果不佳,预后较差,其中位生存期仅有4~5个月[2]。故目前有很多的学者致力于肺癌远处转移机制的研究,迫切需求合适肺癌脑转移模型的建立以及合适的检测方法。本实验采用经左心室注射稳定表达荧光素酶的肿瘤细胞建立肺癌脑转移模型,以病理切片为金标准比较生物发光成像及18F-氟代脱氧葡糖(18F-fluorodeoxyglucose,18F-FDG) SPET/CT(单光子发射计算机断层扫描)评估转移灶的作用。为后续肺癌转移机制研究采用合适的肺癌转移评价方法提供证据。
1 材料与方法
1.1 材料
1.1.1 裸鼠与细胞
SPF级BALB/c裸鼠购自上海斯莱克实验动物有限责任公司【SCXK(沪)2012-002】,24只,体重15~17 g,4周龄,均为雌性,饲养于福建医科大学动物实验中心SPF级动物室【SYXK(闽)2012-0001】;所用的饲料、水、垫料都经严格灭菌处理,并按动物实验的3R原则给予人道的关怀。稳定表达荧光素酶的luc+-PC-9细胞购自上海吉凯公司。
1.1.2 试剂与设备
胎牛血清(杭州四季青,中国)、Pen-strep双抗(Gibco,美国)、RPMI1640培养基(HyClone,美国)、0.25% Trypsin-EDTA(Gibco,美国)、Luciferin底物(美国 Promega)、18F-FDG由福建省立医院PET-CT中心提供、倒置显微镜(奥林巴斯,日本)、生物安全柜和CO2培养箱(三洋,日本)、活体成像系统(ZVZS LUMINA II,美国Calzper Life Science)、SPET/CT(VECTor,MILabs,Netherland)。
1.2 方法
1.2.1 细胞培养
稳定表达荧光素酶的luc+-PC-9细胞常规培养于含有10%胎牛血清、1% Pen-strep的RPMI1640培养基,在37℃、5% CO2的恒温培养箱中培养。当细胞生长至80%~90%时用0.25% Trypsin-EDTA使贴壁细胞重悬于培养基中后1∶2传代。
1.2.2 luc+-PC-9细胞体外生物发光活性检测
luc+-PC-9细胞消化、计数后,悬浮于RPMI1640培养液中。分别接种1×105、5×104、2.5×104、1×104、5×103、1×103、500及100个luc+-PC-9细胞于黑色96孔板中,每个浓度梯度设置三个复孔,置于培养箱中培养。4 h后用PBS清洗2遍,加入Luciferin底物,使终浓度为150 μg/mL。室温下避光放置3~5 min后,在活体成像系统下观察,并读取数据,记录每孔的光子总数,统计分析总光子数与细胞数之间的相关性。
1.2.3 裸鼠肺癌脑转移模型的建立
裸鼠肺癌脑转移模型采用经左心室注射肿瘤细胞的方法造模。裸鼠经腹腔注射5%水合氯醛麻醉后,固定于平板上,于胸骨左缘第二肋旁开2 mm处45度角进针[1 mL针筒内已吸取肿瘤细胞悬液0.1 mL(即1×106个肿瘤细胞)并预留0.05 mL空气],进针5 mm左右见血液喷射涌入说明针头进入左心室,然后缓慢将肿瘤细胞注射入左心室。接种后的裸鼠置于SPF环境内继续饲养, 并每天密切观察裸鼠的精神状态、一般情况等。分别在注射肿瘤细胞第4周、5周后随机选取10只裸鼠行生物发光成像。同时分别在10只鼠中随机选取3只裸鼠行18F-FDG SPECT/CT成像。显像完成后留取脑、肝、肾、股骨以及脊柱。经脱水固定、石蜡包埋、切片、H&E染色观察。
1.2.4 生物发光成像
将待检测裸鼠麻醉后,腹腔注射事先配制好的浓度为30 mg/mL 荧光素酶底物(luciferin),每只0.2 mL。10 min后放入动物体内可见光成像系统中检测,计算机操作系统拍照。
1.2.518F-FDG SPET/CT
实验前10 h裸鼠禁食,但不禁水。从裸鼠尾静脉注射约200 μCi放射性示踪剂18F-FDG,待摄取18F-FDG 30 min后,通过吸入混有2%异氟烷的纯氧实施麻醉且在整个扫描显像过程中持续吸入,然后俯卧位固定于扫描床,打开恒温装置,进行SPET/CT显像。
1.2.6 统计方法
实验数据采用SPSS19.0软件包进行统计分析,luc+-PC-9细胞数与总光子数的相关性采用线性回归分析。
2 结果
2.1 活体成像系统体外检测luc+-PC-9的发光能力
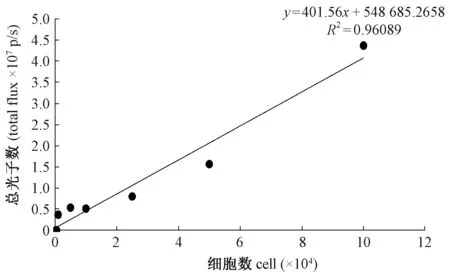
图1 luc+-PC-9细胞数与总光子数的关系Fig.1 Relation of numbers of luc+-PC-9 cells and total photon flux
利用活体成像系统检测luc+-PC-9细胞的发光能力,结果显示(图1):随着细胞数量的增多,其总光子数也相应增加,两者呈正相关,具有良好的线性关系(R2=0.96,回归方程为:y=401.56x + 548 685.2658),最低可检测到1000个细胞发出的光子。
2.2 裸鼠的一般情况
在注射肿瘤细胞后,其中一只裸鼠立即出现一侧肢体偏瘫,并于第2天死亡。其余裸鼠于注射肿瘤细胞3周后大部分出现体重下降,并逐渐出现弓背抬高、体型消瘦、精神萎靡、呼吸急促等恶液质表现。在整个实验过程中,1只裸鼠在颅骨肉眼观察到肿瘤结节,1只出现眼睛失明,2只出现肢体瘫痪。2只在整个观察期间均未发现任何异常症状,体重也未见明显下降。(图2)
2.3 病理形态学表现

注:A:裸鼠体型极度消瘦;B:可见裸鼠颅脑瘤结节;C:右眼失明;D:左侧后肢瘫痪;E箭头所示为颅脑转移灶;F:箭头所示为脊柱旁转移灶。图2 肺癌脑转移模型裸鼠的一般情况Note. A: An extensively emaciated mouse;B:Tumor nodules in the brain; C: Blindness of the right eye; D: Left hind limb paralysis; E: Arrow indicates the brain metastasis; F: Arrow indicates the paravertebral metastasis.Fig.2 Gross appearances of the mouse models with brain metastasis from lung cancer
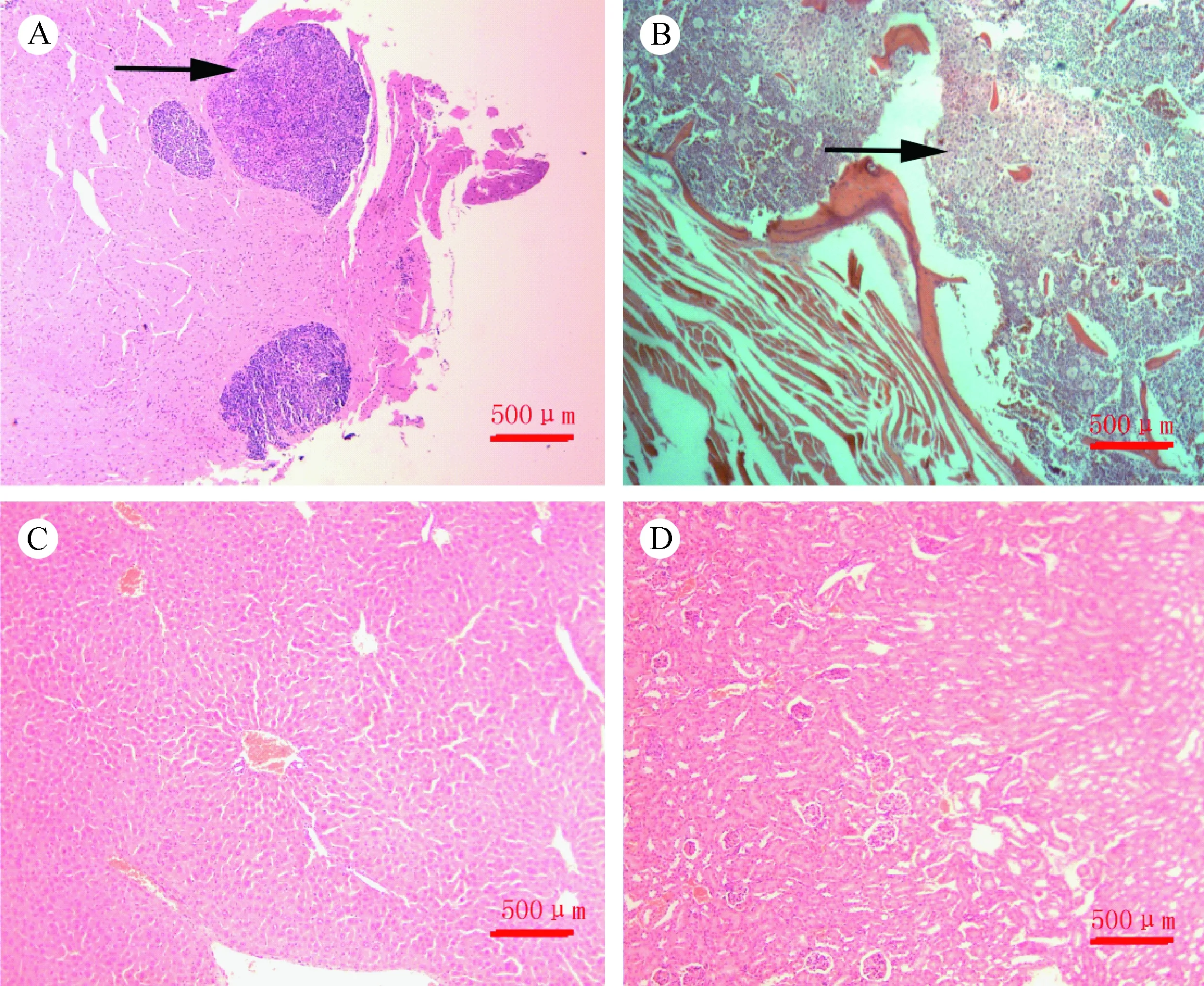
注:A:脑组织病理,箭头所示为脑转移灶;B:骨组织病理,箭头所示为骨转移灶;C:肝组织;D: 肾组织。图3 脑、骨、肝、肾组织H&E染色病理结果(×40)Fig.3 Histological changes of the brain(A), bone(B), liver(C) and kidney tissues (D). Arrows indicate tumor metastasis.HE staining.×40
在成像结束后,人道处死裸鼠,留取脑、肝、肾、骨等靶器官行H&E染色。脑组织H&E染色结果显示可观察到肺癌转移灶,表现为呈巣状分布,大小不一,与正常脑组织分界清楚,转移灶中未见明显正常脑组织结构,肿瘤细胞可见病理核分裂(图3A)。骨组织HE染色结果显示:在光镜下骨质破坏,骨髓腔内可见异常增生的肿瘤细胞,细胞大小不一,可见巨细胞,病理核分裂现象(图3B)。肝、肾等组织未见明显转移灶。根据病理结果,经左心室注射luc+-PC-9细胞建立肺癌脑转移模型,脑转移率:89.5%(17/19),骨转移率:78.9%(15/19),肝肾未见转移。
2.4 生物发光成像和18F-FDG SPET/CT成像诊断效能比较
2.4.1 生物发光成像
本实验通过左心室注射一定数量的luc+-PC-9细胞建立肺癌脑转移模型,通过在生物活体成像系统下观察肺癌转移情况。通过电脑图像分析,生物发光成像能检出最小的转移灶大小为0.3 mm3。实验中发现在第4、5周裸鼠颅脑、股骨及脊柱等位置可观察到明显的荧光信号,经病理证实,在相应的位置能发现转移灶。在第4周生物发光成像的结果:生物发光成像颅脑检测到荧光且病理证实脑转移的6只,未见荧光但脑转移3只,既没有荧光,病理也未见脑转移1只。在3只假阴性的裸鼠中,发现颅脑转移灶相对较小,且个数较少。在第5周显像的9只裸鼠中观察到颅脑荧光信号的有9只,没有信号的1只,H&E染色病理切片中颅脑有荧光信号的裸鼠均发现脑转移灶,没荧光信号的裸鼠未发现转移灶。第4周和第5周生物发光成像对比,荧光信号第5周明显增强(图4),结合病理结果,第5周比第4周脑转移灶明显数量较多,体积较大。转移灶的体积越大,荧光信号越强,但当转移灶增大到一定程度,转移灶出现液化,肿瘤细胞坏死,荧光信号强度反而降低。

注:A、B图分别为第4周、第5周裸鼠生物发光成像图片。图4 第4周与第5周裸鼠生物发光成像对比Fig.4 Comparison of bioluminescent imaging of the mice at 4th(A) and 5th(B) weeks
2.4.218F-FDG SPET/CT成像
分别从第4、5周生物发光成像的裸鼠中随机选择3只行SPET/CT成像,采集的图像由计算机处理后分别获得CT、SPECT和两者融合的图像。裸鼠脑组织未见明显的代谢浓聚;所有裸鼠的股骨或脊柱均发现异常18F-FDG浓聚;肝肾未见18F-FDG异常浓聚(图5)。病理H&E染色切片证实所有裸鼠颅脑均有大小不一的转移灶。异常代谢浓聚的股骨或者脊柱均证实有骨髓转移。肝肾未见明显转移灶。

注:A:颅脑SPECT/CT图像,可见颅骨(箭头)处代谢浓聚灶,脑组织未见明显浓聚灶;B: 在股骨处(箭头)可见代谢浓聚灶;C: 同一只裸鼠同时行生物发光成像和SPECT/CT。图5 生物发光成像与SPECT/CT成像比较Fig.5 Comparison of bioluminescence imaging and SPECT/CT.A:An abnormal concentration in the skull (arrow)rather than in the brain tissue;B:A abnormal concentration in the femurs(arrows);C:The same mouse detected by both bioluminescence imaging and SPECT/CT
3 讨论
目前建立肿瘤脑转移动物模型的方法,可以采用尾静脉注射、原位种植、劲动脉注射、左心室注射等。左心室注射法[5]能很好的模仿了肿瘤细胞血道转移,符合脑转移生物学特性,肿瘤细胞所形成的转移灶的转移部位、病理形态,影像学表现都与临床较相似。结合实验前期对肺癌脑转移动物模型的摸索,左心室注射法是一种简便、损害较少、成功率较高的,能较好模拟肺癌脑转移生理病理过程的造模方法[6]。根据本实验的病理结果,在第4周即可检出转移灶,脑转移率89.5%(17/19),骨转移率78.9%(15/19),提示所选择的肺腺癌细胞株PC-9具有较好的脑转移和骨转移倾向,可以为后续研究脑转移或骨转移提供一定的参考价值。在实验中我们发现:有一只裸鼠在注射相同细胞悬液后立即出现偏瘫,并于第2天死亡。分析可能的原因是:此裸鼠注射时间相对较后,可能出现细胞团块,或者细胞悬液不充分,存在细胞团块,在注射过程中,细胞团块堵塞脑血管引起的偏瘫。故我们建议在构建动物模型时,细胞悬液放置的时间不宜过长,且细胞需充分消化,尽量不存在细胞团块。本实验所选取的细胞悬液浓度经我们前期研究发现为较合适的浓度。当浓度过大时,容易形成细胞团块,且裸鼠的生存期较短,死亡率较高;但浓度过小时,脑转移的成功率反而下降。
目前在动物肿瘤模型研究中,不同的影像技术如X线、CT、MRI、超声、活体动物体内光学成像、PET/CT、SPECT/CT等发挥着重要的作用,其各有优缺点,根据不同的实验目的选择合适的方法就显得格外重要。本研究采用生物发光成像及18F-FDG SPECT/CT成像评价肺癌转移模型。活体动物体内光学成像技术包括荧光和生物发光两种技术。荧光发光需要外源激发光使荧光基团GFP发射出较长波长的发射光,但生物体内存在多种物质在激发光的作用下也可发出非特异性荧光,从而影响检测的灵敏度。而生物发光成像相对于荧光成像,其灵敏度较高。生物发光成像不需要激发光,仅需利用荧光素酶报告基因标记肿瘤细胞使之稳定表达荧光素酶,在荧光素底物、氧气、Mg2+以及ATP作用下将化学能转化为光能,且动物本身不发光,生物发光成像具有极低的背景[7,8]。有研究[9-11]认为:荧光发光技术适用于对浅表部位肿瘤或体外细胞水平的成像研究,而生物发光成像适用于研究深部组织原发或转移灶肿瘤。所以生物发光成像技术在肿瘤转移模型研究上比荧光发光技术更具优势。虽然如今PET/CT在肿瘤学研究中已经占有相当重要的作用,但是SPECT/CT在某些肿瘤影像中仍有其独到之处,同样可以定位放射性核素浓聚,通过核素浓聚的量化来评估病灶的代谢水平和良恶性鉴别。而且小动物SPECT/CT的研究成本较PET/CT更低[12]。18F-FDG是目前临床上使用最广泛的肿瘤代谢显像剂,绝大多数的肿瘤具有高代谢的特点,恶性肿瘤细胞的异常增殖需要过度利用葡萄糖,因此肿瘤细胞内可异常浓聚18F-FDG,经SPECT/CT可以显示肿瘤的位置、形态、大小、数量、活性等。
本实验采用生物发光成像以及18F-FDG SPECT/CT评价肺癌转移模型的成功率。经体外肿瘤细胞发光活性检测,发光强度与肿瘤细胞数目具有很好的线性关系,最低可检测到103个细胞,与既往报告结果一致[13]。对比第4、5周生物发光成像结果,发现第5周荧光强度明显强于第4周,结合病理结果:转移灶的体积和数量越多,荧光强度越强。结合体外发光活性检测结果,可根据荧光强度的多少,在一定程度上可以评估肿瘤细胞的多少,为后续的相关研究提供参考。本实验也发现在活体动物成像中能检出的最小转移灶大小为0.3 mm3,但受转移灶的在颅脑中位置深浅的影响,会存在一定的偏差。生物发光成像在第4周检测脑转移时有3只裸鼠漏诊,通过观察病理切片,分析原因可能为脑转移灶较小且发出的光子经脑组织后衰减,不能为机器设备检测到导致漏诊。生物发光成像在深部组织的小转移灶监测灵敏度有待进一步的提高。Wetterwald等[14]发现生物发光成像能发现0.5 mm3骨转移灶,且能在X线检查发现之前早期检测出骨髓转移。同时我们也发现生物发光成像在骨转移诊断上也具有较高的灵敏度和特异度,且能早期发现骨髓转移。类似于PET/CT,SPECT/CT也是一种将SPECT和CT影像融合的设备,与PET相同,SPECT通过显影异常核素浓聚灶与CT解剖异常部位相融合。在临床应用中,18F-FDG SPECT/CT较少用于诊断脑转移瘤,更多的是使用18F-FDG PET/CT。但PET/CT也存在其局限性,当转移灶较小,且被大脑皮层的高代谢本底所掩盖时,容易出现漏诊[15]。且有动物研究报告[5]18F-FDG示踪剂在脑转移瘤PET/CT上诊断同样不具有明显的优势,且18F-FDG作为非特异性肿瘤显像剂,除肿瘤外,其他正常生理组织、炎症等也可摄取,容易造成假阳性的结果。对于18F-FDG SPECT/CT检测脑转移瘤,在本实验中均未在颅脑的位置发现明显的异常浓聚灶。分析可能的原因是:首先,裸鼠大脑皮层的基础代谢较高,导致18F-FDG在大脑皮层的本底较高,可能会覆盖转移灶的显影。其次,转移灶的体积较小,受设备分辨率的限制,不能发现较小转移灶的显影。所以18F-FDG SPECT/CT诊断脑转移灶方面不具有优势,不适合于脑转移瘤研究,期待将来能开发出灵敏度和特异度更高的示踪剂。同时在实验中我们发现18F-FDG SPECT/CT在诊断骨转移时具有较高的准确率,而且相比X线、CT等只能在骨质结构遭到破坏时才能发现,18F-FDG SPECT/CT能更早的发现骨转移。目前临床上及动物实验中SPECT/CT对骨转移研究使用较多的是99TCmMDP,诊断骨转移瘤的准确度为96%[16]。根据实验结果,18F-FDG SPECT/CT诊断骨转移同样具有较高的准确率,而且还能显像其他器官的转移情况,相对于99TCmMDP可能更具优势。
生物发光成像与18F-FDG SPECT/CT相比,在检测脑转移具有灵敏度高,特异度高,无放射性,价格便宜等优点。生物发光成像只能观察到肿瘤的多少,但不能评估肿瘤细胞的代谢能力和活跃程度,且不能对转移灶进行精准定位,有时不能区分是脑转移还是颅骨转移。而SPECT/CT能实现对转移灶的精准定位,能反映肿瘤细胞的代谢情况,而且周期较短,在检测骨转移具有较高的灵敏度和特异度。
综上,通过左心室注射luc+-PC-9细胞成功建立肺癌脑转移模型,为研究肺癌脑转移机制奠定了基础。生物发光成像是检测脑转移及骨转移敏感、准确、无创的显像方法。18F-FDG SPECT/CT不适合于检测脑转移,但对骨转移具有较好的准确率。生物发光成像和18F-FDG SPECT/CT为肺癌转移动物模型的建立提供了先进的检测技术,为肿瘤转移机制研究和药物开发提供新的有用的工具。
[1] Siegel R, Naishadham D, Jemal A. Cancer statistics[J]. CA Cancer J Clin, 2012, 62(1):10-29.
[2] Sandler A, Hirsh V, Reck M, et al. An evidence-based review of the incidence of CNS bleeding with anti-VEGF therapy in non-small cell lung cancer patients with brain metastases.[J]. Lung Cancer,2012, 78(1):1-7.
[3] Mujoomdar A, Austin JH, Malhotra R, et al. Clinical predictors of metastatic disease to the brain,from non-small cell lung carcinoma: Primary tumor size, cell type,and lymph node metastases[J]. Radiology,2007,242(3):882-888.
[4] Takeshima H, Kuratsu J, Nishi T, et al. Prognostic factors in patients who survived more than 10 years after undergoing surgery for metastatic brain tumors:report of 5 cases and review of the literature[J]. Surg Neurol,2002,58(2):118-123.
[5] 雷贝,曹杰,沈杰,等.人肺腺癌脑转移动物模型建立及显像的研究[J]. 中国肺癌杂志,2013,16(8):391-399.
[6] 陈愉生,涂洵崴,俞梅娥,等.胸腔原位种植与经左心室注射建立肺癌脑转移动物模型的比较[J]. 中国实验动物学报,2015,23(5):490-494.
[7] Hastings JW. Chemistries and colors of bioluminescent reactions:a review[J]. Gene,1996,173:5-11.
[8] Wilson T,Hastings JW. Bioluminescence[J]. Annu Rev Cell Dev Biol,1998,14:197-230.
[9] Li W, Li H, Li J, et al. Self-assembled supramolecular nano vesicles for safe and highly efficient gene delivery to solid tumors[J]. Int J Nanomed.2012,7: 4661-4677.
[10] Cool SK, Breyne K, Meyer E, et al. Comparison of in vivo optical systems for bioluminescence and fluorescence imaging[J]. J Fluoresc,2013 ,23(5): 909-920.
[11] Burrell-Saward H, Rodgers J, Bradley B, et al. A sensitive and reproducible in vivo imaging mouse model for evaluation of drugs against late-stage human African trypanosomiasis[J]. J Antimicrob Chemother, 2015,70(2): 510-517.
[12] Franc BL, Acton PD, Mari C, et al. Small-animal SPECT and SPECT/CT:important tools for preclinical investigation[J]. J Nucl Med,2008,49(10):1651-1663.
[13] Devaud C, Rousseau B, Netzer B, et al. Anti-metastatic potential of human νδ1(+) γδ T cellsin an orthotopic mouse xenograft model of colon carcinoma [J]. Cancer Immunol Immunother 2013,62(7):1199-1210
[14] Wetterwald A, van der Pluijm G, Que I, et al. Optical Imaging of cancer metastasis to bone marrow: A mouse model of minimal residual disease[J]. Am J Pathol, 2002,160(3)1143-1153.
[15] 李奕钊,肖勇,郭晓君.18F-FDG PET/CT在脑转移瘤诊断中的局限性[J]. 海南医学,2009,20(6):11-13.
[16] Bunyaviroch T, Aggarwai A, Oates ME. Optimied scintigraphic evaluation of infection and inflammation:role of single-phton emission computed tomography/computed tomography fusion imaging[J]. Semin Nucl Med, 2006,36(4):295-311.
Comparison between bioluminescence imaging and SPECT/CT of mouse models of brain metastasis from lung adenocarcinoma
CHEN Yu-shen1,2, CHEN Zheng-wei1, YU Mei-e1, TU Xun-wei1,LI Hong-ru1,2, LIN Ling2, LIN Ru-hui3
(1.Department of Respiratory & Critical Care Medicine, Fujian Provincial Hospital, Provincial Clinical Medical College,Fujian Medical University, Fuzhou 350000 China; 2.Fujian Institute of Respiratory Diseases, Fuzhou 350000; 3.School of Basic Medicine, Fujian Medical University, Fuzhou 350000; 4. Academy of Integrated Traditional and Western Medicine, Fuzhou 350000)
Objective To establish a mouse model of lung adenocarcinoma brain metastasis with human luc+-PC-9 cells stably expressing luciferase and to compare the evaluation values of bioluminescence imaging and18F-FDG (18F-fluorodeoxyglucose) SPECT/CT in these models. Methods Suspension of luc+-PC-9 cells was injected into the left ventricle of BALB/c nude mice to establish a mouse model of brain metastasis from lung cancer. Bioluminescence imaging and18F-FDG SPECT/CT were used to evaluate the metastasis of tumors as compared with HE-staining pathology as a golden standard. Results The success rate of brain metastases was 85% through injecting luc+-PC-9 cells into the left ventricle. The number of tumor cells was positively related to the intensity of light, with a linear correlation (R2=0.96). Fluorescence was observed in the brain, spine and femur by bioluminescence imaging, and the metastases were confirmed by H&E pathological examination.18F-FDG SPECT/CT observed abnormal density collective foci in the spine or femur but not in the brain. Conclusions Injection of tumor cell suspension into the mouse left ventricle is a good method to establish a brain metastasis of lung cancer. Bioluminescence has a higher sensitivity and specificity in detecting brain metastasis and bone metastasis, with advantages of real-time, dynamical and non-invasive detection of tumor metastasis growth.18F-FDG SPECT/CT does not have superiority in detection of brain metastases but is suitable for detecting bone metastasis.
Lung cancer; Brain metastasis; Bone metastasis; Animal model; Bioluminescence imaging; Single-photon emission computed tomography/computed tomography
CHEN Yu-shen, E-mail: slyyywb@126.com
国家卫生计生委科研基金-福建省卫生教育联合攻关计划项目(WKJ-FJ-17);福建省立医院优秀青年医师项目(2014YNQN03);福建省自然科学基金(2015J01376)。
陈愉生(1957年-),女,教授,博士生导师。Email: slyyywb@126.com
Q95-33
A
1005-4847(2017) 01-0036-07
10.3969/j.issn.1005-4847.2017.01.007
2016-07-10

