Zmu-1:DHP近交系豚鼠的培育及其分子遗传结构初步鉴定
刘迪文,谢敏,陈雁虹,卫振
(浙江大学实验动物中心,杭州 310058)
Zmu-1:DHP近交系豚鼠的培育及其分子遗传结构初步鉴定
刘迪文,谢敏,陈雁虹,卫振
(浙江大学实验动物中心,杭州 310058)
目的 培育近交系豚鼠品系,建立检测豚鼠遗传结构的微卫星分子标记。方法 采取近交与回交、单线与优选繁育、选择与淘汰等方法,试图将Zmu-1:DHP远交系豚鼠培育成Zmu-1:DHP近交系豚鼠。用15对已筛选出的豚鼠多态性微卫星引物(另行报道),对该近交系及参照的Zmu-1:DHP远交系和Zmu-2:DHP近交系豚鼠DNA样本进行PCR,通过产物电泳条带分析相关品系的遗传结构,评价各品系遗传纯合性。同样方法研究Zmu-1:DHP近交系各支系豚鼠的遗传结构,评价各支系的遗传纯合性。结果 经过13年培育,获得8个20代以上的近交豚鼠支系(窝),每个支系分别有1-3只。经鉴定,Zmu-1:DHP近交2系的基因频率达到86.7%,分别高于Zmu-1:DHP远交系的6.7%及Zmu-2:DHP近交系的66.7%;其位点平均基因数为1.13个,分别低于Zmu-1:DHP远交系的2.47个及Zmu-2:DHP近交系的1.33个;Zmu-1:DHP近交系基因型频率也高于其他品系。Zmu-1:DHP近交系的基因类型均包含在Zmu-1:DHP远交系的基因内,但缺少Zmu-2:DHP近交系所携带的2个特征基因。Zmu-1:DHP近交系8个支系的基因纯合率各不相等,第2、8支系基因纯合率较高。结论 Zmu-1:DHP近交系与Zmu-1:DHP远交系之间既有同源性,又有特异性,Zmu-1:DHP近交系第2支系基本培育成新的近交系豚鼠,多个近交支系的形成有利于筛选具优势性状的支系。Zmu-2:DHP黑色近交系携带白色品系未有的微卫星标记,可能携有与毛色性状关联的优越性状基因。
近交系豚鼠;微卫星分子标记;遗传结构
豚鼠(Caviaporcellus) 又名荷兰猪或荷兰鼠,因其特殊的解剖结构及生物学特征而广泛用于药理学、病毒及细菌学、呼吸病学、耳眼科学研究和疫苗研制等,据报道,豚鼠生物学特性比大小鼠更接近人类[1]。目前,我国应用于实验的豚鼠主要是英国短毛种和哈脱莱Hartley远交系豚鼠。相对远交系动物,近交系动物基因位点纯合,遗传稳定,实验反应敏感,个体间遗传结构及实验结果一致,是探索疾病分子机理及药物作用靶点、定位疾病及正常基因等理想的实验材料。国际上常用的近交系豚鼠有美国1906-1933年间培育的2系及13系豚鼠[2],我国从未成功培育近交系豚鼠,也鲜见应用近交系豚鼠的报道。本研究组于2000年成功培育Zmu-1:DHP远交系豚鼠[3],研究发现该品系具多种优越遗传性状[4-6]。为了建立豚鼠动物模型、深入研究优越性状的分子机理及开发优势基因,培育携带优势基因的近交系显得非常有意义。于是,2002年笔者在Zmu-1:DHP远交系豚鼠的基础上启动了近交系豚鼠培育工作。
微卫星是广泛分布于基因组内含子的特定序列,微卫星重复序列因长度变化而使得同一位点的基因呈多态性,微卫星结构比较稳定易检测,因此是用于鉴定动物群体遗传相似性及定位性状基因等的分子标记[7]。本文拟就Zmu-1:DHP近交系豚鼠的培育及其分子标记遗传结构鉴定作一初步报道,为我国近交系豚鼠的培育及开发应用研究奠定基础。
1 材料与方法
1.1 材料
普通级Zmu-1:DHP远交系豚鼠(白色),来源于浙江大学实验动物中心【SCXK(浙)2012-0052】。
1.2 方法
1.2.1 Zmu-1:DHP近交系豚鼠的培育
Zmu-1:DHP近交系培育路径见图1。
(1)环境条件
采用屏障设施开放环境饲养【SYXK(浙)2012-0178】,饲养盒为W 60 cm × L 90 cm × H 25 cm塑料盒,垫料为消毒木片及稻草,饲喂直径3 mm颗粒饲料及少量青绿蔬菜,饮用消毒瓶装自来水,每周更换一次垫料。
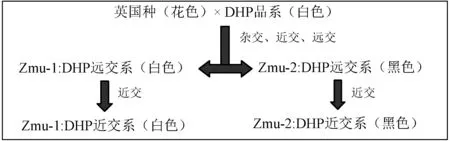
图1 近交系豚鼠品系培育路线Fig.1 Route chart of breeding of guinea pig inbred strains
(2)育种过程及方法
2002年从Zmu-1:DHP远交系豚鼠种群中随机挑选雌雄各4只豚鼠,要求身体健康有活力,全身白色,耳朵及脚爪粉色。按雌∶雄=1∶1配对同居,连续同胞兄妹近亲繁殖,当时采取单线平行法传代。第5~6代后,2条支线出现不育、体质差及耳朵和脚爪呈黑色的豚鼠,随即淘汰,剩余豚鼠采取优选法传代,选择繁殖性能高、全身呈纯白色的2条支线继续繁殖。突破10代繁殖瓶颈效应后,两支豚鼠后代逐渐增多,分离出多个支系。至第15代时,改为家族优势法选择,即保持优质支系,淘汰质劣支系。因豚鼠多种优势性状与毛色连锁,所以为了方便主要选择毛色纯白及生活力强为表型的豚鼠作为种鼠繁殖。一般情况下为了加快繁殖时间,采用第1胎作为种鼠,个别采用第2~3胎留种。某些情况下,个别豚鼠生产性能较差,为防止断种,只得采取亲子代回交繁殖,但其下一代不能晋级。等下一代繁殖性能回复正常,再继续采取同胞兄妹近亲繁殖晋级。育种过程中记录个体繁殖性能,进行个体编号,严格代数记录,编制家族系谱。
1.2.2 微卫星标记检测Zmu-1:DHP近交系豚鼠遗传结构
(1)样本采集
实验组为新培育的Zmu-1:DHP近交系豚鼠(白色),各支系编号、代数及数量见表1。对照组为原种Zmu-1:DHP远交系(白色)及Zmu-2:DHP近交系(黑色,第9代)。豚鼠行心脏采血1 mL,肝素抗凝,按照说明书介绍用TaKaRa试剂盒提取DNA(由于Zmu-1:DHP近交系豚鼠繁殖量低,又刚达到21代不久,所以每窝样本量较少)。

表1 Zmu-1:DHP近交系采样情况
(2)遗传结构鉴定
①微卫星引物设计及多态性引物筛选:从加州大学圣克鲁兹学院Genome Browser Home(http://genome.ucsc.edu/)网站的数据库内随机查找核心为AC、GT重复序列的豚鼠微卫星DNA,用软件设计引物。通过PCR对10份豚鼠全基因组DNA进行初次扩增,用凝胶电泳从400个位点中筛选出110对具多态性位点的引物(结果另处报道)。
②三个品系豚鼠对比实验:从上述多态性微卫星引物中选择15对多态性较高、条带少及清晰度高的引物,PCR扩增Zmu-1:DHP近交系、Zmu-1:DHP远交系及Zmu-2:DHP部分近交系豚鼠基因组DNA的微卫星位点,引物及退火温度见表2。豚鼠微卫星位点扩增及其产物电泳、照相等按常规程序操作[8]。根据扩增产物电泳条带的一致性,评估各品系的遗传差异及近交系豚鼠培育是否达到标准。
③ Zmu-1:DHP近交系豚鼠不同支系对比实验:同方法②,检测Zmu-1:DHP近交系豚鼠的微卫星位点,评估其各支系的遗传结构。

表2 豚鼠多态性微卫星位点引物
2 结果
2.1 近交系豚鼠建立
2015年10月诞生第21代豚鼠个体,命名为Zmu-1:DHP近交系,并形成若干个支系的群体。其中第21代豚鼠2窝,第20代8窝,第19、18、17代分别有3、7、7窝。这些不同支系豚鼠主要来源于4对原种的2大支系,每支又保持若干分支,各成支系。
2.2 近交系外观
上述大多数个体性状为全身白毛,耳朵和脚爪呈粉红色,见图2。在Zmu-1:DHP远交系豚鼠中发现,有些性状都与毛色相关,例如白色毛品系呈近视,黑色毛呈远视,等等,但有些性状如病毒敏感性实验因涉及生物安全问题,不宜操作,所以采取毛色作为遗传标记进行选择育种。
2.3 Zmu-1:DHP近交系的遗传纯合性

图2 Zmu-1:DHP近交系豚鼠Fig.2 Zmu-1:DHP inbred strain guinea pig
图3是Zmu-1:DHP近交系2支系5只豚鼠(21代3只,20代2只)及1支系1只豚鼠(21代)、Zmu-1:DHP远交系20只及Zmu-2:DHP部分近交系4只豚鼠微卫星位点的部分凝胶电泳图像,其基因条带类型见表3。按照实验动物遗传学标准规定,电泳条带从快至慢按a、b、c、d划分,有些等位基因2条连锁的带按1条带计算,如L148、L45、L56、D93引物以前面的一条为主带。将表3各品系豚鼠检测到的所有多态性位点与位点总数的比例,全部位点中最多基因数及所有基因数等汇总成表4。

注:1、22孔为M,2-21孔为Zmu-1:DHP远交系,23孔为Zmu-1:DHP近交系1系,24-28孔为Zmu-1:DHP近交系2系(标*),29-32孔为Zmu-2:DHP部分近交系。图3 三个品系豚鼠微卫星位点扩增产物电泳图Note. Lane 1 and 22:DNA marker;Lane 2-21:Zmu-1:DHP outbred strain;Lane 23:1st subline of Zmu-1:DHP inbred strain;Lane 24-28:2nd subline of Zmu-1:DHP inbred strain(*);Lane 29-32:Zmu-2:DHP inbred strain.Fig.3 Amplification products of three guinea pig strain microsatellites
表3、4显示,Zmu-1:DHP远交系豚鼠呈多态性的微卫星位点比例较高,多态性位点基因数较多;Zmu-2:DHP部分近交系居中;相比之下,Zmu-1:DHP近交系多态性位点显著减少,纯合型位点数增多,说明近交系群体多态性基因位点数量减少,培育的品系基本符合近交系标准。Zmu-1:DHP远交系有5个ab杂合位点,而 Zmu-1:DHP近交2系和Zmu-2:DHP部分近交系分别有1个杂合位点,说明近交系同一位点上基因趋于一致。
表3显示,Zmu-1:DHP近交1系和2系间有8个位点的基因型出现分离,分别形成独特的基因型或亚型,而Zmu-1:DHP近交2系和Zmu-2:DHP近交系间有11个位点的基因不同,说明育种过程中,品系间遗传离差大于支系间离差。Zmu-1:DHP近交系所携带的基因均包含在Zmu-1:DHP远交系内,而Zmu-2:DHP部分近交系在L57、D130位点分别携带Zmu-1:DHP远交系不含的d、b特征基因。
2.4 Zmu-1:DHP近交系各支系的遗传纯合性
基于对最高代数个体遗传结构进行研究的考虑,对Zmu-1:DHP近交系第20、21代8个支系29个样本(见表1)的微卫星位点作了检测,结果的部分凝胶电泳图像见图4,其基因条带类型见表5,并将表5归纳成表6。
从表5、6可见,Zmu-1:DHP近交系8个支系豚鼠基因均呈显著趋异现象,在近交培育过程中,各支系从亲代随机获得不同组合的遗传物质,形成各自的基因型。经过20代培育,有些支系遗传结构趋于纯合,如第2、8支系,而有些支系还相差甚远,如第1、5支系,这些标记为我们选择支系继续育种提供量化指标。其次,所有支系的基因数仅为2个,均少于Zmu-1:DHP远交系4个基因数,且缺少Zmu-2:DHP近交系拥有的特征基因。

表3 三个品系豚鼠多态性微卫星位点基因型分布表
注: Zmu-1:DHP近交1系(n=5);Zmu-1:DHP近交2系(n=1);Zmu-1:DHP远交系(n=20);Zmu-2:DHP部分近交系(n=4)。
Note. 1st subline of Zmu-1:DHP (n=5);2nd subline of Zmu-1:DHP (n=1);Zmu-1:DHP outbred strain(n=20),Zmu-2:DHP inbred strain(n=4).

表4 各品系豚鼠微卫星位点汇总表
注: Zmu-1:DHP近交1系数量太少,只作参考。
Note. Because of the number of Zmu-1:DHP inbred strain is too small, it is for reference only.
3 讨论
近交系是一种具有较高科研价值的实验动物。目前世界上已培育出近1000种近交系动物,包括大小鼠及豚鼠等。我国近交系动物培育工作起源于20世纪50年代[2],主要集中在近交系小鼠培育方面,比较有名的是1955年中国医学科学院和天津医学院分别培育的中国1号和津白1号小鼠;1961年中国医科院血液研究所培育的615小鼠;1963年天津医学院培育的津白2号小鼠;1974年中国军事医学科学院培育的AMMS/1号小鼠;1983年上海第二军医大学培育的SMMC/c小鼠;1996年南京总后医院培育的NJS小鼠,等等。多年来近交系动物的培养已形成较为成熟的方法。本课题组当时培育近交系豚鼠,首先考虑实验动物资源多样化反映了国家的生物科技水平,但我国尚未自主培育近交系豚鼠,其次,课题组培育的远交系豚鼠具多项优势性状,研究这些性状的分子机理需要携带相应优势基因的近交系豚鼠,三是试图提高现有豚鼠的实验一致性及优势基因的频率。

注:1孔为M;2-4孔为第1支系;5-9孔为第2支系;10-12孔为第3支系;13-16孔为第4支系;17-19孔为第5支系;20-22孔为第6支系;23-25孔为第7支系;26-30孔为第8支系。图4 Zmu-1:DHP近交系各支系豚鼠微卫星位点电泳图Note. Lane 1:DNA marker;Lane 2-4:1st subline;Lane 5-9:2nd subline;Lane 10-12:3rd subline;Lane 13-16:4th subline;Lane 17-19:5th subline;Lane 20-22:6th subline;Lane 23-25:7th subline;Lane 26-30:8th sublineFig.4 Amplification products of all sublines of the Zmu-1:DHP inbred strain
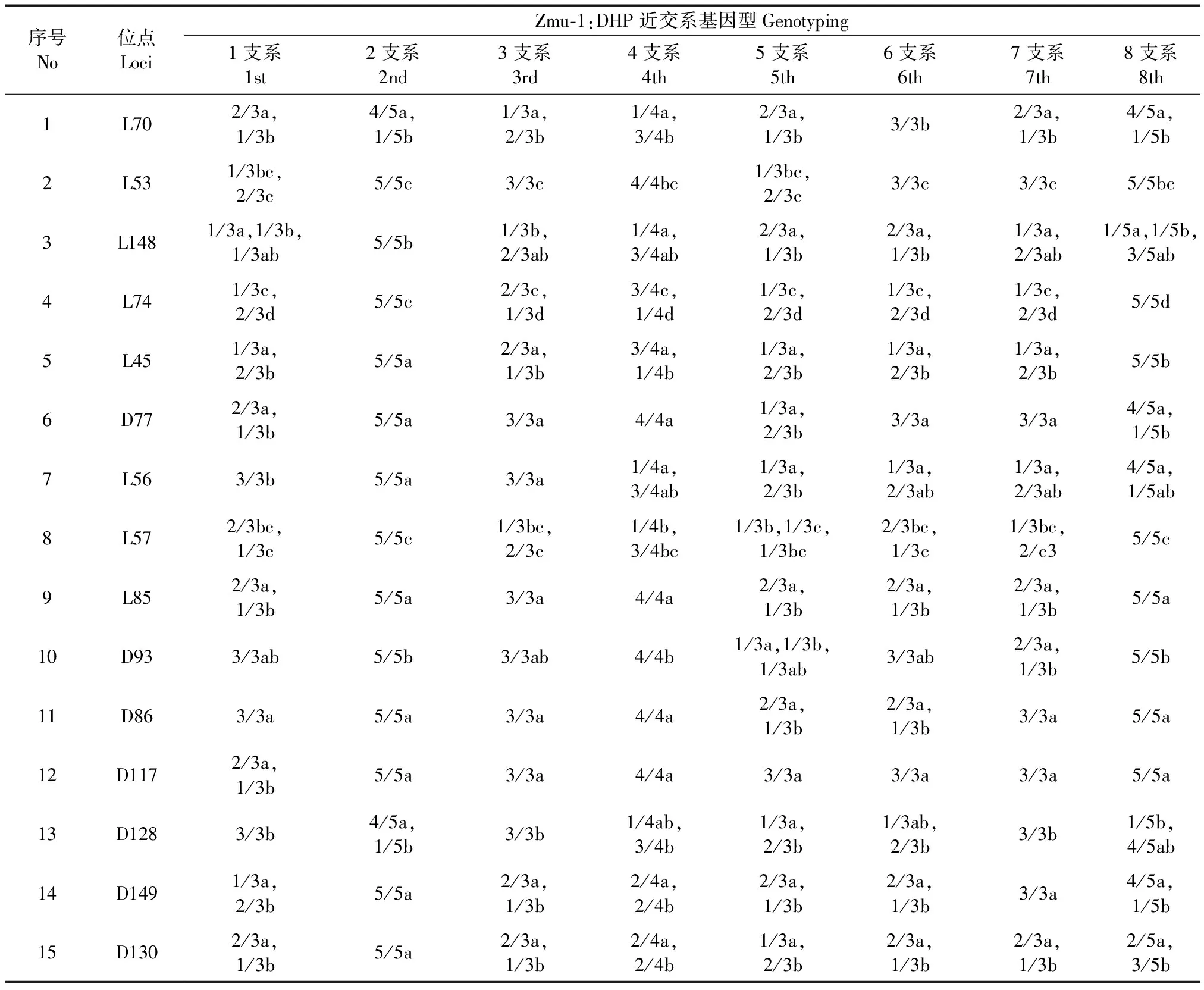
序号No位点LociZmu⁃1:DHP近交系基因型Genotyping1支系1st2支系2nd3支系3rd4支系4th5支系5th6支系6th7支系7th8支系8th1L702/3a,1/3b4/5a,1/5b1/3a,2/3b1/4a,3/4b2/3a,1/3b3/3b2/3a,1/3b4/5a,1/5b2L531/3bc,2/3c5/5c3/3c4/4bc1/3bc,2/3c3/3c3/3c5/5bc3L1481/3a,1/3b,1/3ab5/5b1/3b,2/3ab1/4a,3/4ab2/3a,1/3b2/3a,1/3b1/3a,2/3ab1/5a,1/5b,3/5ab4L741/3c,2/3d5/5c2/3c,1/3d3/4c,1/4d1/3c,2/3d1/3c,2/3d1/3c,2/3d5/5d5L451/3a,2/3b5/5a2/3a,1/3b3/4a,1/4b1/3a,2/3b1/3a,2/3b1/3a,2/3b5/5b6D772/3a,1/3b5/5a3/3a4/4a1/3a,2/3b3/3a3/3a4/5a,1/5b7L563/3b5/5a3/3a1/4a,3/4ab1/3a,2/3b1/3a,2/3ab1/3a,2/3ab4/5a,1/5ab8L572/3bc,1/3c5/5c1/3bc,2/3c1/4b,3/4bc1/3b,1/3c,1/3bc2/3bc,1/3c1/3bc,2/c35/5c9L852/3a,1/3b5/5a3/3a4/4a2/3a,1/3b2/3a,1/3b2/3a,1/3b5/5a10D933/3ab5/5b3/3ab4/4b1/3a,1/3b,1/3ab3/3ab2/3a,1/3b5/5b11D863/3a5/5a3/3a4/4a2/3a,1/3b2/3a,1/3b3/3a5/5a12D1172/3a,1/3b5/5a3/3a4/4a3/3a3/3a3/3a5/5a13D1283/3b4/5a,1/5b3/3b1/4ab,3/4b1/3a,2/3b1/3ab,2/3b3/3b1/5b,4/5ab14D1491/3a,2/3b5/5a2/3a,1/3b2/4a,2/4b2/3a,1/3b2/3a,1/3b3/3a4/5a,1/5b15D1302/3a,1/3b5/5a2/3a,1/3b2/4a,2/4b1/3a,2/3b2/3a,1/3b2/3a,1/3b2/5a,3/5b

表6 Zmu-1:DHP近交系各支系微卫星位点汇总表
微卫星是分析动植物遗传结构较为方便可靠的分子标记,通常微卫星标记与性状基因连锁,其纯合度反映了性状基因的纯合性及个体一致性,因此为近交系间筛选与之连锁的性状基因提供分子标记[9]。经过十多年的工作,我们初步培育出Zmu-1:DHP新近交系豚鼠,通过微卫星方法分析该品系的遗传背景,从表3、4发现与其他品系比较,该群体遗传结构一致性显著提高,基本达到近交系动物水平。结果说明本次育种工作是可行和成功的,当然该品系存在的杂合基因仍需继续近交来降低。有报道称,近交系数是通过理论计算的,不能完全准确地描述所培育的近交系动物,对每一代动物的基因纯度无法判明[10],所以近交系动物存在一定数量的杂合基因是允许的,现有的杂合位点可能是连锁基因的缘故。本近交系豚鼠微卫星位点趋于纯合也说明其性状基因可能基本纯合,至于该近交系有无携带优势性状目的基因及其性状表达如何,或这些基因一致性如何,必须通过豚鼠表型分析才能评定。需要说明的是本研究受近交系动物产量较低的限制,检测的样本量偏少,今后要扩大生产量,增加样本数及微卫星位点证实新品系的纯合度。
从遗传规律角度讲,通过近亲繁殖,远交系动物各位点上的杂合基因将单独分配到近交系的各支系中去,形成各种基因组合。表5、6显示20、21代Zmu-1:DHP近交系豚鼠形成8个支系,各支系从亲代得到不同遗传组合,并且基因位点上的基因频率降低,等位基因趋于纯合,这就是近交系各支系容易固定及选择优越性状,定位克隆特征基因的优点。当然各支系是否携带优势基因,如前面所述要通过表型鉴定,从中筛选具备显著优势性状的支系。一般来说,分离得到的支系越多,支系位点的基因越单纯,筛选出优势性状支系的可能性就越大。
表3、5显示,Zmu-1:DHP近交系携带的基因全部来自于Zmu-1:DHP远交系,而Zmu-2:DHP黑色近交系起源于Zmu-2:DHP黑色远交系豚鼠,携带表3中的d、b特异性基因,Zmu-1:DHP近交系却不携带这些基因,证明Zmu-1:DHP近交系在育种过程中没有受到黑色品系基因污染及出现基因突变,育种方法是可靠的。这两种毛色豚鼠起源于英国种花豚鼠,经过长期筛选演变成较远的血缘关系,黑色豚鼠获得色素基因,而白色豚鼠未获得。通常微卫星标记与某些性状基因紧密连锁,不同基因又控制不同品系特征性状,因此Zmu-1:DHP近交系与Zmu-2:DHP近交系这些基因差异可能与不同色素性状,以至于其他连锁的优势性状有关,当然这种遗传表型与特征基因的关系有待于进一步研究。
[1] D’Erchia AM,Gissi C, Pesole G,et al. The guinea pig is not a rodent [J]. Nature,1996,381(13): 597-600.
[2] 钟品仁. 哺乳类实验动物 [M],北京:人民卫生出版社,1983:251-265.
[3] 郭汉身,刘迪文,傅军,等. DHP白化豚鼠杂交后的生长与繁殖性能 [J]. 上海实验动物科学,1994,14(1): 34-36.
[4] 刘迪文. Zmu-1:DHP豚鼠部分生物学特性研究 [J]. 畜牧兽医学报,2006,37(5): 492-495.
[5] 卫振,张森,蒋丽琴,等. 两品系豚鼠屈光状态和眼球径的发展和比较 [J]. 中国比较医学杂志,2016,24(1): 92-96.
[6] 卫振,娄绘芳,吴凯,等. 两个豚鼠品系速发型哮喘模型中组胺受体H1R、H2R的表达及对肺功能的影响 [J]. 实验动物与比较医学,2016,36(2): 101-106.
[7] Burgos-paz W, Cerón-muoz M, Solarte-portilla C. Genetic diversity and population structure of the Guinea pig (Cavia porcellus,Rodentia,Caviidae) in Colombia [J]. Genet Mol Biol,2011,34(4): 711-718.
[8] [美] 萨姆布鲁克等著,金冬雁等译. 分子克隆实验指南(第二版)[M],北京,科学出版社,1992.
[9] Tautz D. Hypervariability of simple sequences as a general source for polymorphic DNA markers [J]. Nucl Acids Res,1998,17(16): 6463-6467.
[10] 李瑞生,董罡,陈燕敏,等. 微卫星DNA监控近交系小鼠的重组近交系培育研究 [J].中国比较医学杂志,2006,16(6): 335-338.
Breeding of Zmu-1:DHP inbred strain guinea pig and preliminary analysis of molecular genetic structure of the strain
LIU Di-wen*,XIE Min,CHEN Yan-hong,WEI Zhen
(Zhejiang University,Hangzhou 310058,China)
Objective To breed a guinea pig inbred strain and set up a method for detection of the microsatellite markers of genetic structure in guinea pigs. Method Using inbreeding methods we try to breed the Zmu-1:DHP inbred strain. With 15 pairs of polymorphism microsatellite primers, the genetic homozygosity of Zmu-1:DHP inbred strain,Zmu-1:DHP outbred strain and Zmu-2:DHP inbred strain (as control) were examined by PCR. Results After breeding for 13 years, 8 sublines of Zmu-1:DHP inbred strain (>20 generations) were bred. After identification, the gene frequency of the second subline of Zmu-1:DHP inbred strain was 86.7%,higher than Zmu-1:DHP outbred strain (6.7%) and Zmu-2:DHP inbred strain (66.7%). The average number of loci of Zmu-1:DHP inbred strain was 1.13,lower than that of Zmu-1:DHP outbred strain (2.47%) and Zmu-2:DHP inbred strain (1.33%). The genotypic frequency of Zmu-1:DHP inbred strain was also higher than that of the other strains. The gene types of Zmu-1:DHP inbred strain were included in the genes of Zmu-1:DHP outbred strain, but Zmu-1:DHP inbred strain was short of 2 characteristic genes. The gene homozygous rates of 8 sublines of Zmu-1:DHP inbred strain were different with each other,among them, those of the 2nd and 8th sublines were higher than others. Conclusions There are both homozygosity and specificity in the Zum-1:DHP inbred strain and Zum-1:DHP outbred strain. The second Zum-1:DHP subline becomes a new inbred strain guinea pig. It is essential that the subline with the characteristic property is screened from these sublines. The guinea pigs of black Zmu-2:DHP inbred strain carrying microsatellite markers not present in the white strains, may carry optimal genes related with hair color properties.
Inbred strain guinea pig;Microsatellite marker;Genetic structure
LIU Di-wen,E-mail: liudiwen2004@163.com
卫生部科学研究基金(编号98-2-323)。
刘迪文(1958-),男,研究方向:实验动物育种与遗传学。E-mail: liudiwen2004@163.com
Q95-33
A
1005-4847(2017) 01-0090-07
10.3969/j.issn.1005-4847.2017.01.017
2016-11-04

