神经干细胞特异性LSD1基因敲除对小鼠情绪及记忆的影响
石昌杰,花秋红,张丽红, 张儒
(上海市信号转导与疾病研究重点实验室, 同济大学生命科学与技术学院, 上海 200092)
神经干细胞特异性LSD1基因敲除对小鼠情绪及记忆的影响
石昌杰,花秋红,张丽红, 张儒*
(上海市信号转导与疾病研究重点实验室, 同济大学生命科学与技术学院, 上海 200092)
目的 条件敲除小鼠神经干细胞LSD1基因后,通过观察小鼠神经细胞增殖情况及小鼠行为的表现,揭示LSD1的神经生物学功能。方法 将LSD1(flox/flox) 转基因小鼠与神经干细胞特异性表达Cre重组酶的Nestin-cre(Tg)转基因小鼠进行的杂交,即利用Cre-LoxP系统,繁殖出LSD1(flox/flox)Nestin-cre(Tg) 基因型小鼠,即为所需神经干细胞LSD1条件性敲除小鼠(LSD1-CKO),LSD1(flox/ flox)做为对照小鼠。进一步运用免疫荧光染色方法检测小鼠海马DG区神经细胞的增殖;并通过小鼠的糖水偏好、强迫游泳及新物体识别等实验检测小鼠的行为表现。结果 与LSD1(flox/flox)小鼠相比,LSD1-CKO小鼠海马区神经细胞增殖显著降低(P=0.023);糖水偏好系数降低(P=0.0075);强迫游泳实验中不动时间明显增加(P<0.05);并在新物体识别实验中表现出记忆力显著下降现象(P=0.0019)。结论 小鼠脑神经干细胞敲除LSD1基因,海马区神经细胞增殖降低,LSD1-CKO小鼠表现出负面情绪和记忆障碍。
赖氨酸特异的脱甲基酶1;基因敲除;神经细胞增殖;情绪;记忆;小鼠
赖氨酸特异性组蛋白去甲基化基酶( lysine specific demethylase 1, LSD1)可以使组蛋白H3第四位上的赖氨酸(H3-K4)或H3第九位上的赖氨酸(H3-K9)脱去一个或二个甲基进而影响基因的转录水平。通常H3-K4脱甲基化抑制靶基因转录活性,而H3-K9脱甲基化则导致靶基因转录被激活[1]。表观遗传调控在发育及疾病中起着重要作用,其中组蛋白赖氨酸甲基化和去甲基化介导的基因转录调控是表观遗传调控的重要组成部分。目前关于LSD1的研究主要集中在细胞水平,研究发现LSD1可以影响多种干细胞的增殖,如神经干细胞、肿瘤干细胞、胚胎干细胞等[2]。而对LSD1在哺乳动物体内的研究,尤其是对体内神经细胞的调控功能研究较少。Nestin是一种中间丝类型的蛋白,能够特异性的表达在神经干细胞 (neural stem cell) 上,为神经干细胞的特征性标志物。神经干细胞是一类具有分裂潜能的母细胞,具有分化为神经元、星形胶质细胞和少突胶质细胞的能力。鉴于LSD1基因全身敲除的小鼠具有胚胎致死性[3],我们构建了LSD1基因条件性敲除小鼠(LSD1-CKO),即利用Cre-LoxP重组酶系统,条件性敲除小鼠脑神经干细胞中的LSD1基因,通过观察小鼠神经细胞增殖情况和行为的改变,来研究LSD1在哺乳动物体内的神经生物学功能。
1 材料与方法
1.1 试剂
鼠尾PCR试剂盒购(Selleck公司);冰冻包埋液NEG 50TM(Thermo);鼠抗BrdU,兔抗nestin,鼠抗LSD1一抗(Millipore公司);相应二抗(Invetrogen公司)。
1.2 仪器
PCR仪(Eppendorf);凝胶成像仪(Tanon 3500R);冰冻切片机(美康 Microm);激光共聚焦显微镜(Olympus FV10i);倒置荧光显微镜(Olympus);物体识别箱(上海吉量仪器)。
1.3 小鼠的饲养与繁殖
LSD1(flox/flox) 转基因小鼠在南方模式动物研究中心订制[SCXK(沪)2009-0023],此鼠与Nestin-cre(Tg)转基因小鼠(从同济大学实验动物中心丁玉强老师获得)进行杂交,繁殖出LSD1(flox/wild)Nestin-cre(Tg) 双转基因小鼠。然后利用LSD1(flox/wild)Nestin-cre(Tg) 双转基因小鼠再与LSD1(flox/flox)转基因小鼠进行杂交,繁殖培育出在神经干细胞内特异敲除LSD1基因的LSD1(flox/flox)Nestin-cre(Tg)小鼠(简写为LSD1-CKO)。同窝LSD1(flox/flox) 转基因小鼠(非敲除小鼠,简写为LSD1(f/f))为对照,并且行为学实验小鼠数目N值均大于8。小鼠饲养繁殖于同济大学实验动物中心[SYXK(沪)2009-0022]SPF级环境内,室温控制在20~25℃,湿度控制在40%~70%。
1.4 方法
1.4.1LSD1-CKO小鼠的PCR鉴定
Loxp与Cre基因片段的鉴定, 使用Selleck公司的鼠尾一步法PCR试剂盒。LSD1基因上的Loxp基因片段鉴定,设计上游引 物:5′-AAATGTTTCCTCCGGGCCTC-3′,下游引物:5′- GCAAATGAGCAGAGACCAGC -3′;PCR 条件为: 94℃ 预变性 5 min,继之 94℃ 变性 30 s,60℃ 退火 1min,72℃ 延伸 1 min,共 35 个循环,最后72℃延伸 5 min。Loxp基因片段插入的后,PCR扩增产物大小为426 bp,而野生型未插入Loxp基因扩增产物为356 bp。Cre重组酶基因片段鉴定,上游引物:5′- TCGATGCAACGAGTGATGAG-3′,下游引物:5′- TCCATGAGTGAACGAACCTG -3′;PCR 条件为:94℃预变性 5 min, 然后 94℃变性30 s,65℃ 退火 1 min,72℃ 延伸 1 min,共 35个循环,最后 72 ℃延伸 5 min。Cre基因鉴定的PCR扩增产物大小为300~400 bp。
1.4.2 LSD1与Nestin荧光共染
4周龄LSD1(f/f) 和LSD1-CKO小鼠,心脏灌流后取脑,4%多聚甲醛固定24 h,30%蔗糖脱水后包埋剂包埋,冰冻切片厚度为30 μm。取海马区脑片,95℃预热柠檬酸钠缓冲液中水浴脑片5 min,匀速慢摇1 h至室温,PBS洗3次后,上LSDI和Nestin一抗(各1∶1000, 0.3% Triton-X100, 1% goat serum in PBS)4℃过夜;PBS洗3次后换二抗(1∶1000 goat anti rabbit 488 +1∶1000 goat anti mouse 546 in PBS)室温1 h。Hoechst33342染核后,封片后经激光共聚焦显微镜下观察拍照。
1.4.3 神经细胞增殖的Brdu染色
8周龄LSD1(f/f)和LSD1-CKO小鼠,腹腔注射BrdU 100 mg/kg,每隔2 h 注射1次,共5次。第2天处死小鼠取脑,脑片处理方法同上文。BrdU染色:每只小鼠取6~8片海马DG区脑片,PBS洗三遍,每次5 min;2 mol/L HCl(浓HCl用水1∶5稀释)处理1 h;换硼酸缓冲液(A液: 硼酸 3.1 g/500 mL,B液: 硼酸钠·10H2O 7.6 g/200 mL,400 mL A + 100 mL B,pH 8.5)处理30 min,然后PBS洗三边,每次5 min;上BrdU一抗体(1∶2000,0.3% Triton-X100,1% goat serum in PBS)4度过夜,PBS洗3次后换二抗(1∶1000 goat anti-rat 488 in PBS)室温1 h。PBS洗后封片,倒置荧光显微镜下观察拍照。

注:A:LSD1(flox/ flox) 与nestin-cre(Tg)小鼠杂交后代鉴定;B:LSD1 (flox/ flox) 与LSD1(flox/wild) nestin-cre(Tg)小鼠杂交后代LSD1(flox/flox) nestin-cre(Tg)鉴定(1/4纯合敲除);C:LSD1 和 nestin的免疫荧光共染色。图1 神经干细胞LSD1基因特异性敲除小鼠的基因鉴定及免疫荧光染色Note. A: Identification of LSD1(flox/wild) Nestin-cre(Tg) offsprings. B: Identification of LSD1(flox/flox) nestin-cre(Tg) ( 1/4 chance) offsprings. C: Immunofluorescence staining of LSD1 and nestin.Fig.1 Generation of LSD1- CKO mice and immunofluorescence staining
1.4.4 糖水偏好实验
9周龄LSD1(f/f)和LSD1-CKO小鼠,雌雄各半单笼放置。方法为每笼放置两个水瓶,
一个为无菌水,另一个为2%的蔗糖水,称重后放置24 h,小鼠自由进食进水。计算24 h内的糖水消耗占液体总消耗的百分比。
1.4.5 强迫游泳实验
糖水偏好实验结束后,小鼠进行强迫游泳实验,操作为每只小鼠分别放在水中游泳适应15 min,在24 h后,每只小鼠再放水中6 min,记录小鼠的不动时间。统计不动时间有两种方法:前5 min内的不动时间;后4 min内的不动时间。不动表现为不爬缸、不游动。不动时间反映小鼠的抑郁情绪。
1.4.6 新物体识别实验
10周龄LSD1(f/f)和LSD1-CKO小鼠进行新物体识别实验,方法参照我们实验室之前发论文[4]。识别指数(recognition index)=新物体识别时间/新物体 + 旧物体识别的总时间。
1.5 数据统计
实验数据以mean±S.E.M.形式表示,利用统计学软件Graphpad Prism 5.0对数据进行分析,P<0.05为差异有统计学意义。
2 结果
2.1 神经干细胞LSD1基因敲除小鼠的基因鉴定及免疫荧光染色
图1A-B为LSD1-CKO小鼠的繁殖策略及后代PCR鉴定电泳结果。图A中标记1和6号小鼠为LSD1(flox/wild)Nestin-cre(Tg) 小鼠。图B中标记为1和2号的小鼠为神经干细胞LSD1特异性敲除小鼠LSD1(flox/flox)Nestin-cre(Tg);4号LSD1(flox/flox) 为非条件敲除小鼠对照。为进一步观察LSD1-CKO小鼠在nestin 表达阳性细胞内是否无LSD1表达,我们共染了LSD1与nestin。荧光染色结果显示,在LSD1(f/f)小鼠海马区,表达nestin (红色)的细胞内有LSD1(绿色)表达,而在条件敲除小鼠中,nestin标记的细胞中无LSD1表达,表明在LSD1-CKO小鼠中表达nestin阳性细胞内,LSD1确实被敲除而不再表达(图1C)。
2.2 神经细胞增殖的Brdu染色
通过BrdU染色实验,观察了敲除小鼠的神经细胞的增殖情况,亮绿色为标记的阳性增殖细胞(图2A)。并对BrdU阳性细胞个数做了统计(图2B),结果显示与对照小鼠相比,敲除小鼠的BrdU阳性细胞数目变少,即增殖降低,统计具有显著差异(P=0.023)。这与Sun 等[5]抑制LSD1 的活性或siRNA 敲除LSD1 的表达后,所看到的致神经干细胞增殖能力下降及导致野生鼠大脑海马齿状回细胞增殖的大幅减少这些现象,具有一致性。

注:A:海马区细胞增殖的BrdU荧光染色(×200);B:阳性BrdU细胞个数统计,P=0.023。图2 海马区神经细胞增殖的BrdU染色Note. A: Fluorescent staining of BrdU in the hippocampus, ×200. B: Count of positive BrdU-stained cells, P=0.023.Fig.2 Proliferation of neural cells in the hippocampus. BrdU staining
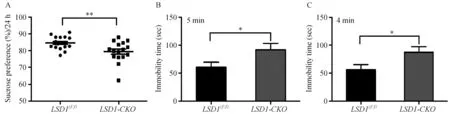
注:A:糖水偏好统计,P =0.0075;B:强迫游泳前5 min内不动时间统计,P =0.03;C:强迫游泳后4 min内不动时间统计,P=0.029。图3 LSD1-CKO小鼠抑郁症表现Note. A: Results of sucrose preference test, P =0.0075. B: Immobility time at 5 minutes before forced swimming test, P =0.03. C: Immobility time at 4 minutes after forced swimming test, P =0.029. Fig.3 Depressive behavior of the LSD1-CKO mice
2.3 行为学改变
2.3.1 条件敲除LSD1对小鼠情绪影响
神经干细胞的增殖抑制是抑郁症的关键因素,所以LSD1-CKO小鼠海马区神经细胞增殖数目减少及神经干细胞中LSD1失活,可能会对小鼠情绪造成影响。在对小鼠进行了糖水偏好实验后,发现LSD1-CKO小鼠对糖水的依赖性降低(P=0.0075),即糖水快感降低(图3A)。小鼠强迫游泳实验结果显示,LSD1-CKO小鼠无论是在前5 min,还是在后4 min中内,与LSD1(f/f)小鼠相比,不动时间都明显增加(P=0.03或P=0.029,见图3B-C)。糖水偏好实验和强迫游泳实验是判断小鼠是否具有一定的抑郁症的两种快速简单的方法[6]。从这两个实验我们初步判断这种LSD1-CKO小鼠具有情绪低落的抑郁症状。
2.3.2 条件敲除LSD1对小鼠记忆的影响
条件敲除LSD1后导致海马区神经细胞增殖的降低,而海马是小鼠学习记忆的主要脑区部分[7],所以条件敲除LSD1是否对小鼠的记忆产生影响,尚未有文献报道。新物体识别实验,是利用动物先天对新物体有探索倾向的特性而建立的非空间短期记忆测试方法[4]。我们应用新物体识别实验,在小鼠10周龄时,检测了条件敲除小鼠的记忆力情况。统计结果显示LSD1敲除后,小鼠对新物体的识别系数降低(P=0.0019),即记忆障碍。实验同时发现,LSD1-CKO小鼠还表现出对新旧两个物体总探索时间降低的趋势,也反映出LSD1-CKO小鼠运动活跃程度降低,结果见图4A-B。

注:A:小鼠新物体识别指数, P =0.0019; B:小鼠探索新旧物体的总时间。图4 新物体识别实验Note. A: Object recognition index, P=0.0019. B: Total time of exploration(s) in the object recognition test.Fig.4 Novel object recognition test
3 讨论
组蛋白氨基端的共价修饰大多是可逆的,如组蛋白的乙酰化、磷酸化和泛素化等。然而组蛋白甲基化的发生,在很长一段时间被认为是非常稳定且不可逆的,直到2004年Shi 等[8]发现了第一个赖氨酸特异性组蛋白去甲基化酶1 (lysine specific demethylase 1, LSD1)才改变了科研人员对组蛋白甲基化修饰机制的认知,组蛋白修饰在基因调节过程中更具动态性。
关于LSD1最初的研究,主要集中在肿瘤的发生发展中的作用,LSD1也成为抗肿瘤药物新的靶点。随着不断深入的对LSD1调节组蛋白甲基化修饰机制的研究,发现LSD1参与了动植物胚胎发育、干细胞分化、免疫等多种生物学功能,与很多疾病发生有着密切的关系[2,9,10]。
有文献报道,LSD1在斑马鱼神经细胞发育及体外干细胞增殖分化上具有重要作用[5,11]。全身敲除LSD1 导致围产期小鼠死亡,也充分体现的LSD1在哺乳动物发育中的重要作用。为了更好的观察LSD1基因缺失后,在体神经发生及神经功能行为体现,课题组制作并繁殖出神经干细胞LSD1基因敲除小鼠。条件敲除小鼠的nestin荧光标记细胞中不表达LSD1。神经干细胞内的LSD1基因敲除并不导致小鼠的死亡,但是条件敲除小鼠海马DG区Brdu标记后,染色显示神经细胞增殖降低。对于沉默LSD1导致细胞增殖降低,也存在多种可能机制[1,2]。海马在小鼠的学习记忆及情绪活动中具有重要作用,海马DG区神经细胞的增殖降低可能会对小鼠学习记忆及情绪产生影响。在利用糖水消耗实验、强迫游泳及新物体识别实验的行为学实验中,9~10周龄的LSD1-CKO小鼠就表现出了抑郁症及记忆力下降的症状,揭示条件敲除神经干细胞LSD1基因后,会导致情绪及记忆障碍。Jarome等[12]认为,组蛋白甲基化是记忆和行为的关键调节者。神经干细胞及之后分化的各类神经细胞内组蛋白的甲基化与脱甲基化,进一步会影响到DNA甲基化与脱甲基化的调节,而这可能是情绪抑制和认知损伤的因素。所以LSD1对组蛋白的甲基化与脱甲基化修饰的调节,对动物的行为及认知可能具有重要的调节作用,但是具体的作用机制尚不清楚。
基于LSD1在小鼠神经发生、学习记忆及情绪表现行为方面的作用,我们认为 LSD1 的调节机制与功能,可能为抑郁与神经退行性疾病治疗提供一种新的思路,当然还需要进一步深入研究。
[1] 邵根宝, 黄晓佳, 龚爱华, 等. 组蛋白去甲基化酶LSD1 及其生物学功能 [J]. 遗传, 2010, 32(4): 331-338.
[2] 闫红杰, 齐晖,王云帅, 等. 组蛋白去甲基化酶1在干细胞增殖与分化中的调控作用 [J].生命科学, 2012, 24(7): 646-651.
[3] Wang J, Scully K, Zhu X, et al. Opposing LSD1 complexes function in developmental gene activation and repression programms [J]. Nature, 2007, 446(7138): 882-887.
[4] Zhang R, Xue GZ, Wang SD, et al. Novel object recognition as a facile behavior test for evaluating drug effects in a PP/PS1 Alzheimer’s disease mouse model [J]. J Alzheimer’s Dis, 2012, 31(4): 801-812.
[5] Sun GQ, Alzayady K, Stewart R, et al. Histone demethylase LSD1 regulates neural stem cell proliferation [J]. Mol Cell Biol, 2010, 30(8): 1997-2005.
[6] 薛涛, 邬丽莎, 刘新民, 等. 抑郁症动物模型及评价方法研究进展 [J]. 中国实验动物学报, 2015,23(3): 321-326.
[7] 丁艳平, 邵宝平, 董辉,等. 胎次、性别对成年小鼠海马区齿状回神经发生及学习记忆的影响 [J]. 中国实验动物学报, 2013,21(3): 7-11
[8] Shi Y, Lan F, Matson C, et al. Histone demethylation mediated by nuclear amine oxidase homolog LSD1 [J]. Cell, 2004, 119(7): 941-953.
[9] 张武文, 李逸平. 组蛋白甲基化修饰酶与早期胚胎发育 [J]. 生命科学, 2012, 24(7): 653-659
[10] Sakane N, Kwon HS, Pagans S, et al. Activation of HIV transcription by the viral Tat protein requires a demethylation step mediated by lysine-specific demethylase 1 ( LSD1/KDM1) [J]. PLoS Pathog, 2011, 7( 8) : e1002184.
[11] 张洁.LSD1对斑马鱼发育的影响及其机制的初步研究 [D]. 上海:复旦大学, 2009.
[12] Jarome TJ, Lubin FD. Histone lysine methylation: critical regulator of memory and behavior [J]. Rev Neurosci, 2013, 24(4): 375-387.
Effects of neural stem cellLSD1 conditional knockout on the mood and memory in mice
SHI Chang-jie, HUA Qiu-hong, ZHANG Li-hong, ZHANG Ru*
(Shanghai Key Laboratory of Signaling and Disease Research, School of Life Sciences and Technology, Tongji University, Shanghai 200092, China)
Objective To study the function ofLSD1 in the development of neurons and the influence ofLSD1 on mood and memory-related behavior in mice. Methods TheLSD1(flox/flox) transgenic mice were crossed withNestin-cre(Tg) transgenic mice, using Cre-LoxP recombination system, to generateLSD1 conditional knockout of neural stem cell (LSD1-CKO) mice,LSD1(flox/flox)Nestin-cre(Tg) mice, andLSD1(flox/flox) mice as control. The neuron proliferation inLSD1-CKO mice was further detected by immunofluorescence staining. At the same time, the mood and memory-related behavior ofLSD1-CKO mice were examined using several methods: sucrose preference test (SPT), forced swimming test (FST) and novel-object recognition (NOR) assay. Results In theLSD1 brain-specific CKO mice, the neuron proliferation rate in the hippocampus was significantly reduced (P=0.023), the preference for sucrose was reduced (P=0.0075), immobility duration during the forced swimming test was increased (P<0.05), andLSD1-CKO mice also exhibits memory-decline (P=0.0019) during the novel-object recognition test. Conclusions Depletion ofLSD1 in mouse brain neural stem cells leads to significant reduction of the neuron proliferation in the hippocampus.LSD1-CKO mice show more negative emotions and memory impairment.
LSD1; Gene knockout; Neuron proliferation; Mood; Memory; Mice
ZHANG Ru, E-mail: ru.zhang@tongji.edu.cn
石昌杰(1981-),男,工程师,硕士,研究方向:神经疾病动物模型研究。E-mail: shichangjie@tongji.edu.cn
张儒,女,副教授, E-mail: ru.zhang@tongji.edu.cn
Q95-33
A
1005-4847(2017) 01-0079-06
10.3969/j.issn.1005-4847.2017.01.015
2016-05-18

