小鼠感染细小病毒的临床特征分析
潘金春,罗银珠,吴瑞可,王静,袁文,何丽芳, 黄碧洪,张钰*
(1.广东省实验动物监测所,广州 510663;2.广东省实验动物重点实验室,广州 510663)
小鼠感染细小病毒的临床特征分析
潘金春1,2,罗银珠1,2,吴瑞可1,2,王静1,2,袁文1,2,何丽芳1,2, 黄碧洪1,2,张钰1,2*
(1.广东省实验动物监测所,广州 510663;2.广东省实验动物重点实验室,广州 510663)
目的 分析小鼠细小病毒(MVM)在人工感染小鼠体内的分布规律、排毒和抗体变化,以及自然条件下小鼠感染MVM的情况。方法 对33只BALB/c小鼠腹腔接种0.2 mL MVM悬浮液,每天观察动物的外观、行为、饮食和精神状态,在接种第0~60 天共12个时间点各对2~3只动物进行安乐死,并采取组织、粪便和血清样本进行检测。荧光定量PCR(QPCR)方法检测组织和粪便的病毒核酸,ELISA方法检测血清抗体。同时,采取100只SPF小鼠、76只开放饲养小鼠检测MVM核酸,采取1463只SPF小鼠、82只开放饲养小鼠检测MVM抗体。结果 实验小鼠接种MVM后外观、行为、饮食和精神状态未见异常,剖检无明显病变。各组织在接种后都能检出病毒核酸,并在接种后4~7 d达到峰值,且到60 d仍可检出病毒核酸。各组织间比较,病毒峰值最高的组织是肝,其次是肾、脾、胃、心脏、肺、盲肠和脑。粪便排毒在接种后11 d可达到峰值,之后迅速下降,但到60 d还可检到。血清抗体在病毒接种后7 d开始产生,之后抗体效价逐渐升高,21 d就可以达到32倍左右,之后至60 d一直处于64倍左右。临床样本中,核酸检测SPF小鼠未检出,开放饲养小鼠的检测阳性率为14.5%,经过测序比较确认为MVM病毒感染;抗体检测SPF小鼠有较低的检出率(0.3%),开放饲养小鼠检出率为68.3%。结论 MVM感染小鼠后一般呈隐性感染状态,可长期排毒,主要组织脏器、粪便、血清都能用于MVM的检测,实验小鼠感染MVM可以通过病毒核酸和血清抗体检测方法进行病原检测。
小鼠细小病毒;人工感染;自然感染;临床特征
细小病毒按其是否能够自主增殖分为腺联病毒和自主性细小病毒,其中小鼠细小病毒(minute virus of mice,MVM)就是一种自主性细小病毒,最初由Crawford从被污染的小鼠腺病毒种毒中首次分离[1],后来又相继从实验小鼠和野生小鼠从分离到该病毒。MVM在世界范围内广泛存在,欧洲、美国、加拿大和澳大利亚等国家和地区都有相当高的感染率,中国1990年证实在普通小鼠群MVM感染也相当普遍[2]。
MVM在自然条件下常常呈隐性感染,临床上不表现任何症状[3]。在实验室条件下,MVM可感染小鼠、大鼠和仓鼠,小鼠和大鼠一般无临床症状,而仓鼠则可导致致死性感染[4]。MVM感染小鼠后带毒时间长,病毒在体内广泛分布,成为多个细胞系、白血病和可移植肿瘤的常见污染物[5],并可在细胞系中形成持续性感染,可能会严重影响细胞生物学、肿瘤学等方面的试验结果。
为验证在自然感染和人工接种条件下MVM在小鼠体内的抗原和抗体变化情况,本研究通过腹腔接种MVM的方式感染实验小鼠,对小鼠体内病毒分布、排毒和抗体产生进行研究,并结合对小鼠临床样本感染MVM的检测,为该病原检测技术方法的应用提供参考依据。
1 材料与方法
1.1 材料
1.1.1 病毒和细胞株
MVM标准株和A9细胞株购自美国典型菌种保藏中心(毒株:ATCC VR-1346;细胞株:ATCC® CCL1.4TM)。复苏A9细胞,10%胎牛血清,DMEM高糖培养液培养3~5 d,待细胞长至单层,传代分瓶,分瓶后待细胞长至80%~90%密度,弃去生长液,加入500 μL MVM病毒液于75 cm2细胞瓶中,37℃、5% CO2培养箱吸附l h,弃去瓶中的病毒液加入无血清的DMEM细胞维持液,37℃、5% CO2培养箱培养3~5 d,当细胞病变达“+++—++++”时,收获细胞培养病毒液,-80℃冻存,反复冻融三次后,3500 r/m离心30 min去除细胞碎片,留上清即为收获的MVM病毒裂解液,传代三次,收获的病毒裂解上清液用QPCR对病毒拷贝数进行定量。
1.1.2 实验动物
35只SPF级BALB/c小鼠,雄性,3周龄,体重11~13 g,购自于广东省实验动物中心[SCXK(粤)2013-0002],饲养于广东省实验动物监测所二级生物安全感染实验室内[SYXK(粤)2012-0122],实行光照/黑暗各12 h昼夜循环,自由进食及饮水。
1.1.3 临床样本
核酸检测临床样品包括SPF小鼠和开放饲养小鼠,SPF小鼠来源于2010~2014年本实验室收到广东、湖北、北京、四川、云南和上海等各省市送检的SPF级活体小鼠或小鼠粪便100份;开放饲养小鼠为从广州周边地区收集的76只KM小鼠和褐家鼠。
抗体检测临床样品包括成年SPF小鼠和开放饲养小鼠,SPF小鼠为2013~2015年之间广东省检测的1463只SPF小鼠,包括BALB/c、C57BL/6、KM、ICR、BALB/c-nu、NIH、129、C3H等常规品系以及多种基因工程小鼠;开放饲养小鼠为从广州周边地区收集的两批共82只开放饲养的KM小鼠。
1.1.4 主要试剂和仪器
DNA聚合酶购自大连宝生物公司,DNA抽提试剂盒购自天根公司(TIANamp Genomic DNA Kit),QPCR试剂盒购自Takara(Taqman PCR试剂盒),ELISA抗体检测试剂盒购于Express Bio公司,DMEM培养液购自Gibco公司,其余试剂均为进口或国产分析纯。荧光定量PCR仪为ABI的7500,酶标仪为Thermo的Multiskan GO。
1.1.5 引物
所用MVM QPCR引物由上海英俊生物技术有限公司合成,上游序列为:5’- GCCATACACACCTGCAGCAAA -3’;下游序列为:5’- TGGYGATGCTATGGTTGGT -3’;探针为:5’- FAM- TCAATGGAAACACTTGGTTTCTACCCTTGGA -BHQ-1-3’。
1.2 方法
1.2.1 病毒接种、观察及取材
实验小鼠禁食不禁水过夜,共33只小鼠每只小鼠腹腔注射病毒悬浮液0.2 mL(病毒含量为1.2×107copies/μL)。动物接种病毒后,连续观察60 d,每天观察动物的外观、行为活动、饮食和精神状态等。并在感染前第0天取2只动物,感染后第4、7、11、14、18、21、32、35、46、54、60 天时,随机各取3只动物,每只小鼠腹腔注射0.1 mL 0.1%戊巴比妥钠麻醉,然后摘眼球采血并制备血清,分别置-20℃待测抗体效价。动物脱颈椎安乐死后快速取出心脏、肝、脾、肺、肾、脑、胃和盲肠等置-20℃待测病毒核酸。同时采取粪便样本,置-20 ℃待测病毒核酸。
临床样本中核酸检测样品无菌采集活体小鼠的盲肠内容物或直接采集粪便,分别置-20℃待检病毒核酸;抗体检测样品则将小鼠麻醉后摘眼球采血并分离血清,分别置-20℃待检抗体。
1.2.2 病毒核酸检测(QPCR)
每个组织和粪便样本取0.2 g,加入600 μL的PBS缓冲液及加入适量氧化锆研磨珠,于研磨机上研磨3~5 min,将组织匀浆。研磨后,10 000 r/min离心10 min,取200 μL上清按试剂盒说明抽提核酸及QPCR检测。本QPCR检测的灵敏度为100拷贝,大于100拷贝的检测结果判为阳性;小于100拷贝则判为阴性。
1.2.3 血清抗体检测(ELISA)
试验开始前将试剂盒在室温平衡30 min左右,先将血清样本倍比稀释(临床样本不稀释,只检阴阳性),再按试剂盒说明进行操作。将检测结果为阳性的最高血清稀释倍数作为样本的抗体效价/稀释度。
1.2.4 数据处理及统计分析
实验结束,所有数据采用GraphPad Prim 5软件进行处理及分析。
2 结果
2.1 临床观察
BALB/c小鼠接种MVM后,外观、行为、饮食和精神状态等都无明显变化,无明显病理学变化,总体呈现隐性感染状态。
2.2 病毒核酸检测结果
2.2.1 组织
由图1可知,小鼠接种病毒后各组织脏器均可检测到病毒,除接种后18 d脑和盲肠低于100拷贝外,其他各组织各时间点的病毒拷贝数都在100以上。各组织脏器的病毒载量都在4~7 d达到峰值,之后病毒载量总体呈下降趋势,但还有所波动,肝和脾在接种后32~35 d仍可达到较高水平(2×104copies/μL左右),其他组织脏器已经降到1000 copies/μL左右。到接种后60 d各组织脏器还可以检测到病毒,但其拷贝数相对峰值已经较低(300 copies/μL左右)。各组织器官之间横向比较(图2),病毒载量峰值最高的是肝(1.10×105copies/μL),之后依次是肾(4.13×104copies/μL)、脾(2.63×104copies/μL)、胃(2.14×104copies/μL)、心脏(1.23×104copies/μL)、肺(1.09×104copies/μL)、盲肠(5.02×103copies/μL)、脑(1.73×103copies/μL)。
2.2.2 粪便
小鼠接种病毒后很快可以从粪便排毒,在第11天粪便排毒可以达到峰值(1.37×104copies/μL),之后病毒载量迅速下降,并呈现300 copies/μL到3806 copies/μL的波动,到接种后60 d排毒量降到398 copies/μL(图3)。
2.3 血清抗体变化
2.3.1 实验动物
小鼠接种MVM后7 d就开始产生抗体,之后抗体效价逐渐升高,21 d抗体稀释度就可以达到32倍左右,之后至60 d抗体稀释度一直处于64倍左右的水平,为便于计算,抗体稀释度用2的指数表示(图4)。
2.4 小鼠MVM临床样本检测
2.4.1 核酸检测
SPF小鼠未检测到MVM核酸,而开放饲养小鼠的检测阳性率为14.5%,具体结果见表1。对其中三份阳性样本进行测序验证,测序结果显示三个样本扩增的基因序列相同,均为73 bp(图5)。通过Genebank上的Blast软件进行序列比对,阳性样本的序列与Genebank上的MVM毒株(登录号J02275)的同源性为100%,证明临床样本为MVM阳性样本。

图1 各组织病毒载量(n =3)Fig.1 Viral loads of MVM in the mouse organs and tissues

注:A~H分别为:心脏、肝、脾、肺、肾、胃、脑、盲肠。图2 各组织病毒载量峰值(n=3)Note. A-H: Heart, liver, spleen, lung, kindey, stomach, brain, cecum.Fig.2 Viral peak loads of MVM in organs and tissues
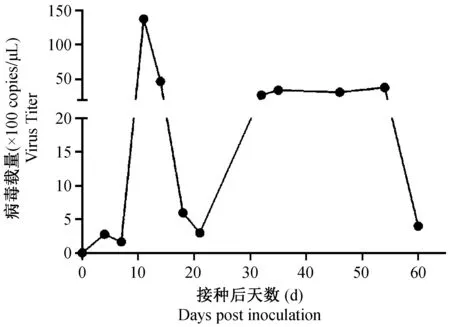
图3 粪便病毒载量(n =3)Fig.3 Viral load of MVM in the mouse feces

表1 小鼠MVM核酸阳性检出率统计
2.4.2 抗体检测
由表3可知,SPF小鼠有较低的抗体检测阳性率(0.3%),而开放饲养小鼠则有很高的检出率(68.3%)。
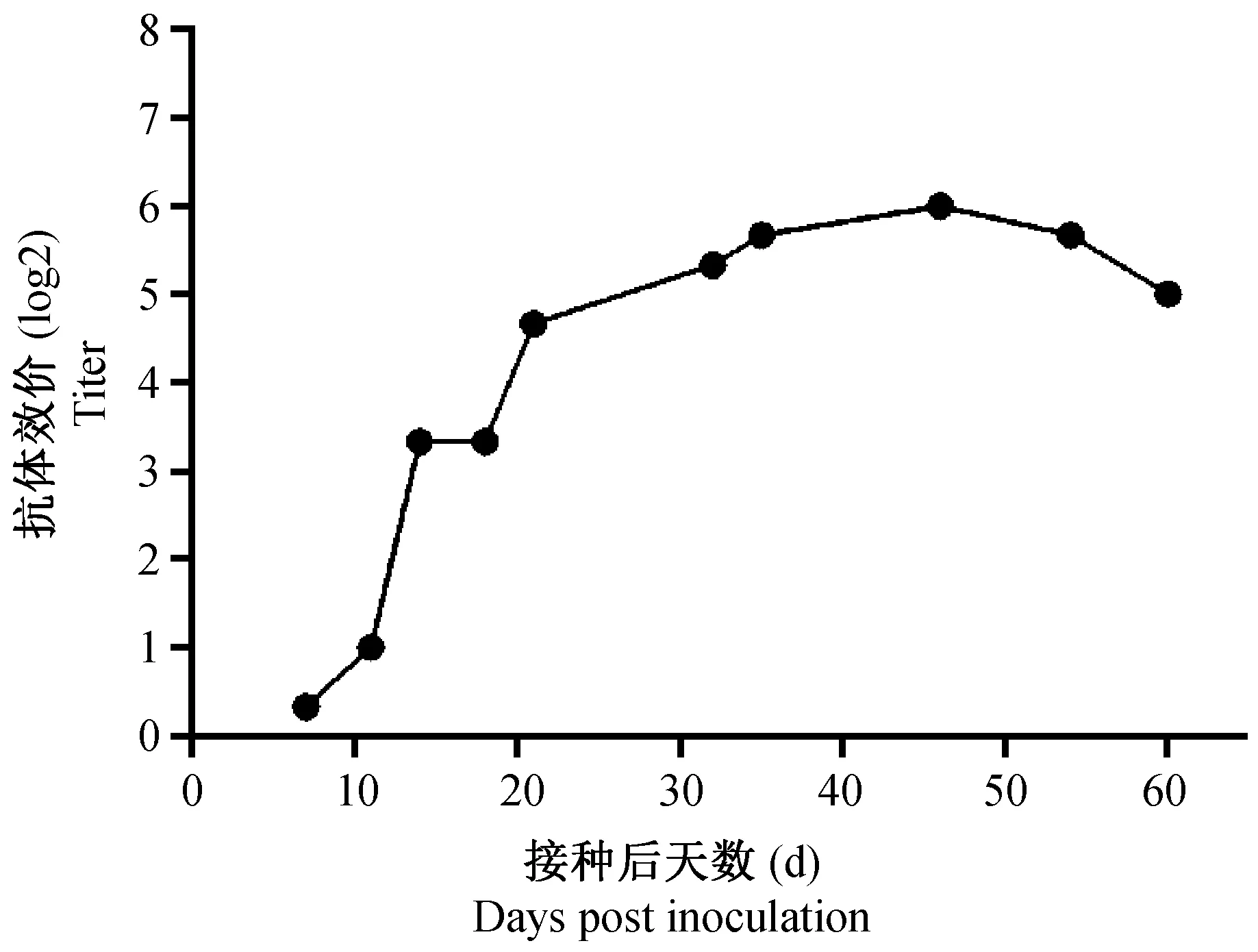
图4 接种MVM后BALB/c小鼠的血清抗体效价测定(n =3)Fig.4 Determination of serum antibody against MVM in the BALB/c mice after inoculation

样本类型动物数(N)Number阳性动物数Positivenumber阳性率/%PositiverateSPF小鼠SPFmice146340 3%开放饲养小鼠Miceinopenhousing825668 3
3 讨论
MVM是一种单链DNA病毒,其具有高度传染性、广泛存在于实验鼠和野生鼠群中。MVM可感染多种组织和细胞,尤其倾向于感染和杀死肿瘤细胞[6]。MVM感染小鼠后,可激活机体的免疫系统,尤其是T、B淋巴细胞的活性,因而可增强动物自发性和诱发性肿瘤的能力,并可抑制小鼠移植瘤的生长[7-8]。因此在使用小鼠从事肿瘤学方面的研究时,应特别注意排除MVM,否则将会严重地影响试验结果[5]。

图5 阳性样本测序结果Fig.5 Sequencing results of positive samples
本研究证实,BALB/c小鼠在感染MVM后呈隐性感染,临床上并未表现明显症状和病理变化,与文献报道一致[3、5]。动物心脏、肝、脾、肺、肾、脑、胃和盲肠等组织脏器很快就能检出病毒载量,接种后4~7 d达到峰值,之后病毒载量呈下降趋势,但至60 d还可以检出病毒核酸,说明MVM可侵袭小鼠的多个组织脏器,且能长时间带毒。在感染前期(5周内),肝、肾、脾的病毒载量较高,尤其是肝、脾可以维持较长时间的高病毒载量,适合于病毒核酸检测;到感染后期,各组织脏器的病毒载量都已下降到较低水平,但仍可用于病毒核酸检测。
小鼠接种MVM后很快就可以从粪便排毒,排毒量在第11天能达到峰值,相比组织峰值时间的4~7 d有所延迟。之后病毒载量呈下降趋势,但一直到60 d能可检出病毒核酸。说明小鼠感染MVM后可长期向外排毒,因此感染小鼠的粪便也可用于病毒核酸检测。小鼠接种MVM后7 d就可以检测到抗体,之后抗体逐渐升高,并一直到60 d都可以维持较高的抗体水平,说明血清MVM抗体检测也是一种有效的检测方法。
临床样品中,SPF小鼠的核酸检测率为0,而抗体有较低的检出率(0.3%),与之相比,开放饲养的小鼠核酸和抗体检出率分别为14.5%和68.3%。相关报道也说明临床上小鼠MVM有一定的检出率,隋丽华等检测了390只SPF小鼠,MVM抗体阳性率为0.52%[9];上海2010~2014年期间小鼠监督和委托检测数据显示MVM的抗体阳性率在0.1%~0.2%之间[10];巩薇用PCR法检测小鼠自身携带的细小病毒,MVM阳性率为16%[11]。王淑菁等建立了MVM荧光定量PCR的检测方法[12],具有特异、灵敏的优点。因此,这两种检测方法在临床上可以得到很好的应用。
本研究发现MVM感染小鼠后在动物体内的分布、排毒及血清抗体产生规律,并将核酸检测和抗体检测在临床样品检测中进行应用,说明感染小鼠的主要组织脏器、粪便、血清都能用于MVM的检测,同时病毒核酸载量、抗体水平与感染阶段密切相关。
[1] Crawford LV. A minute virus of mice [J]. Virology, 1966, 29(29): 605-612.
[2] 卫礼,吴惠英,贺争鸣. 小鼠细小病毒抗体的检测 [J]. 北京实验动物科学,1990, 7(1): 24-26
[3] Jacoby RO, Ball-Goodrich LJ, Besselsen DG, et al. Rodent parvovirus infections [J]. Lab Anim Sci, 1996, 46: 370-380.
[4] Kilham L, Margolis G. Pathogenicity of minute virus of mice (MVM) for rats, mice, and hamsters [J]. Proc Soc Exp Biol Med. 1970, 133(4): 1447-1452.
[5] 田克恭,贺争鸣,刘群, 等. 实验动物疫病学 [M]. 北京: 中国农业出版社. 2015:194-196.
[6] Garcin PO, Panté N. Cell migration is another player of the minute virus of mice infection [J]. Virology, 2014, 468-470: 150-159.
[7] Baker DG. Natural pathogens of laboratory mice, rats, and rabbits and their effects on research [J]. Clin Microbiol Rev. 1998, 11(2): 231-266.
[8] 张承延,田翠,梁永利,等. 小鼠细小病毒对小鼠移植瘤生长的抑制作用 [J]. 上海实验动物科学,1999,19(2): 111.
[9] 隋丽华, 范薇, 杨敬,等. 实验动物微生物、寄生虫抽样调查及分析 [J]. 实验动物与比较医学,2008, 28(4): 259-262.
[10] 魏晓锋. 上海地区实验动物质量检测现状 [R]. 广州:上海市实验动物质量监督检验站,2015.
[11] 巩薇. PCR法检测小鼠自身携带的细小病毒 [J]. 实验动物科学与管理,2003,20(1): 10.
[12] 王淑菁,付瑞,李晓波,等. 小鼠微小病毒(MVM)荧光定量PCR检测方法的建立及初步应用 [J]. 实验动物科学,2015,32(5): 18-21.
Analysis of the clinical features of mice with minute virus infection
PAN Jin-chun1,2, LUO Yin-zhu1,2, WU Rui-ke1,2, WANG Jing1,2, YUAN Wen1,2, HE Li-fang1,2, HUANG Bi-hong1,2, ZHANG Yu1,2*
(1. Guangdong Laboratory Animals Monitoring Institute, Guangzhou 510663, China;2.Guangdong Provincial Key Laboratory of Laboratory Animals, Guangzhou 510663)
Objective To analyze the tissue distribution, viral excretion and serological antibody in BALB/c mice artificially infected with minute virus of mice (MVM), and the natural infection status in mice. Methods Thirty-three SPF male 3-week old BALB/c mice were intraperitoneally injected with 0.2 mL of MVM in 1.2×107copies/μL concentration. The general status of the animals was observed daily post inoculation. The animals’ tissue,faeces and serum samples were taken at 12 time points before and after inoculation (2-3 animals at each time point). QPCR method was used to detect the viral nucleic acid in tissues and feces, and the serological antibody against MVM was tested by ELISA. Meanwhile,other clinical samples of 1563 SPF mice and 158 mice in open housing were collected for testing the viral nucleic acid and antibody. Result There were no clinical symptoms and pathological changes among all infected mice. The viral loads of each tissue reached the peak at 4 d or 7 d post inoculation, and then were generally on a declining curve, but were still found at 60 d. Comparing the viral load in tissues showed that the highest tissue was liver, followed by kidney, spleen, stomach, heart, lung, cecum and brain. The viral loads in feces reached the peak at 11 d, and then dropped rapidly, but could be still detected at 60 d. The antibody could be detected at 7 d, and then gradually raised. The antibody dilution degrees reached 32 at 21 d, and maintained high levels with 16 to 128 during 32 d to 60 d. In the clinical samples, the nucleic acid tests were negative in SPF mice, however, a positive rate of 14.5% was found in mice in open housing. Meanwhile, the antibodies of MVM showed a low positive rate in SPF mice, and the positive rate was 68.3% in the mice in open housing. Conclusions The mice generally present occult infection after inoculation of MVM. However, the infected mice can shed virus in a long period, and viral loads of tissues and serological antibody can be maintained for a long time. Thus, MVM can be detected by testing viral nucleic acid and serological antibody.
Minute virus of mice; Artificial infection; Natural infection; Clinical features
ZHANG Yu,E-mail: zhangyugzh@hotmail.com
广东省科技计划项目(2014B070706006,2013B060400028,2014A070705003)。
潘金春(1979-),男,硕士,助理研究员,研究方向:实验动物质量监测和比较医学研究。Email:jcpan@sina.com
张钰(1970-),女,研究员。E-mail: zhangyugzh@hotmail.com
Q95-33
A
1005-4847(2017) 01-0064-06
10.3969/j.issn.1005-4847.2017.01.012
2016-07-22