利用天然核酸制备的多层水凝胶球及其性能研究*
王 倩, 关 磊, 林 娇, 陈韦羽, 梁兴国, 李 敬❋❋
(1.中国海洋大学海洋生命学院,山东 青岛 266003;2.中国海洋大学食品科学与工程学院,山东 青岛 266003)
利用天然核酸制备的多层水凝胶球及其性能研究*
王 倩1, 关 磊2, 林 娇2, 陈韦羽2, 梁兴国2, 李 敬2❋❋
(1.中国海洋大学海洋生命学院,山东 青岛 266003;2.中国海洋大学食品科学与工程学院,山东 青岛 266003)
为了开发天然安全、结构稳定的细胞包埋载体,本研究初次选取天然鲑鱼精DNA作为材料,层层自组装构建DNA/壳聚糖/海藻酸钙多层水凝胶球。通过显微镜及扫描电镜观察水凝胶球结构,并表征其性能,透析法评价其在模拟消化液中的稳定性。结果显示水凝胶球形态圆整,膜层清晰,平均粒径为(2.7±0.1) mm,冻干脱水后球体内部呈大孔网格结构,外膜层致密无孔隙。该水凝胶球失水产生明显形变而复水后恢复原有形状;可固定吸附阳离子小分子及与DNA特异结合的分子。水凝胶球在模拟消化液中可稳定存在,其中pH=7.8条件下2 h仅有0.5% DNA释放。包埋酵母菌的水凝胶球孵育24 h后可发生局部形变,但结构仍保持完整,未见酵母菌逸出。研究结果表明此多层水凝胶球具有良好的生物相容性、形状记忆性、膜透性及结构稳定性,为细胞生长提供了良好的微环境,可包埋酵母细胞并使其在寡营养条件下增殖。
DNA;壳聚糖;多层水凝胶球;特性;固定化;酵母菌
层层自组装技术作为目前发展迅速的一种成膜技术,可以使带相反电荷的聚电解质在静电作用力下交替沉积得到自组装的多层薄膜[1]。相对于传统的载体,这种自组装膜具有核壳机构可以逐层控制周围分子的扩散行为,进而实现药物的释控,已广泛应用在生物医药领域[2]。Volodkin等[3]将PSS和PAH交替沉积在多孔碳酸钙微球的表面,用EDTA溶液将碳酸钙溶解后形成载药微胶囊,提高了被包埋药物的亲水性。Luo等[4]利用层层自组装技术构建了聚醛化葡聚糖接枝金刚烷(PAD-g-AD)和羧甲基葡聚糖接枝β环糊精(CMD-g-β-CD)微胶囊载体,可以控制阿霉素的释放,增强了肿瘤细胞对阿霉素的吸收,提高了肿瘤治疗的效率。但这些合成聚电解质没有很好的生物相容性,一些载体材料如聚二甲基二烯丙基氯化铵(PDADMAC)等还对生物体有毒性[5],因此,对基于层层自组装技术的天然聚电解质类载体的研究越来越关注。
天然核酸由于本身的生物相容性和低免疫原性,以及可与聚阳离子静电相互作用的性质,使其也成为载体应用的理想材料[6]。任科峰等[7]利用DNA与带正电荷的聚赖氨酸(PLL)通过层层自组装构建了多层超薄膜,并进一步研究了该多层超薄膜的酶解及释放。另有研究表明,核酸自组装材料具有良好的形状记忆性[8],在自组装材料发生形变后在一定条件下可以恢复其初始形状。壳聚糖因为其安全无毒性、抗菌活性及生物相容性,被广泛用于药物载体的制备[9]。将壳聚糖作为材料层层自组装制备功能载体的研究也很广泛。Jiang等[10]发现丙烯酸(AA)与壳聚糖可通过静电作用自组装形成空心微囊,用于抗肿瘤药阿霉素的包埋,提高了阿霉素的包封率及稳定性。Donath等[11]将天然高分子壳聚糖与硫酸葡聚糖、海藻酸钠或羧甲基纤维素通过层层自组装技术将药物布洛芬包裹,研究结果表明所得微囊对布洛芬具有很好的缓释性能。此外,海藻酸钠也是一种生物相容性和生物降解的聚电解质,已被广泛应用于食品工业,医药工程等[12-13],通常海藻酸钠与溶液中的Ca2+可形成能固化的膜层,被成功用于一些敏感药物的释放[14]及蛋白质、活性细胞的固化[15]。黄达明等[16]利用海藻酸钙微球实现了对酵母细胞的包埋,但其凝胶球在细胞生长环境下易破碎溶解,稳定性较差,不利于固定化细胞的多次利用[17]。因此,利用天然核酸类凝胶基质良好的形状记忆性,以及其与壳聚糖分子间相互作用构建具有良好生物相容性和功能特性的水凝胶球,有望解决以上问题。
本研究首次将天然核酸,鲑鱼精DNA聚阴离子大分子作为功能性载体材料,利用鲑鱼精DNA、壳聚糖、海藻酸钠这3种安全、无毒的生物大分子层层自组装制备水凝胶球,对多层水凝胶球的结构、特性进行系统研究,并将其初步用于酵母细胞的固定化。
1 材料与方法
1.1 材料
鲑鱼精DNA(Salmon sperm DNA, DNA)、壳聚糖(Chitosan, CS)、海藻酸钠(Sodium alginate, SA)、溴百里香酚蓝(Bromothmol blue, BB)、中性红(Neutral red, NR)、吖啶橙(Acridine orange, AO)购于Sigma 公司;胃蛋白酶、胰蛋白酶、HBSS缓冲液购于gibco 公司;氯化钙、盐酸、氢氧化钠、磷酸二氢钾均为国产分析纯。
1.2 方法
1.2.1 DNA/壳聚糖/海藻酸钙(DCS)多层水凝胶球的制备 DNA/CS软凝聚态核心球由滴注法制成,用1 mL规格的注射器吸取DNA溶液,以1 mL/min的速度逐滴滴入正在搅拌(100 r/min)的壳聚糖(CS,pH=5)溶液中,孵育30 min使其交联均匀。将制成的核心球取出并用去离子水冲洗干净以去除球表面未结合的CS。将核心球转移至海藻酸钠(SA)溶液中,孵育30 min使其膜层交联均匀,然后将其用水冲洗干净并转移至CaCl2溶液中孵育20 min,使SA层固化,最后将多层球取出并用水冲洗干净即得DCS多层水凝胶球。
1.2.2 DCS多层水凝胶球的形态表征 随机选取10粒制得的水凝胶球,在倒置显微镜下观察其多层膜结构,并计算水凝胶球的平均粒径。吸干多层水凝胶球表面多余的水分,于-80 ℃冷冻过夜,随后将其置于真空冷冻干燥机中冻干24 h。小心的将冻干小球用小刀纵向剖开,固定在金属支架上,表面喷金后通过扫描电镜观察多层水凝胶球的微观结构。
1.2.3 DCS多层水凝胶球的形状记忆特性 将新鲜制备的DCS多层水凝胶球转移至光滑的0.22 μm滤膜上,37 ℃干燥脱水;然后将载有脱水球的滤膜重新浸泡于去离子水中,观察复水前后多层水凝胶球的形态变化。
1.2.4 DCS多层水凝胶球的膜透性 称取一定量的溴百里香酚蓝(BB)、中性红(NR)、吖啶橙(AO)染料分别用去离子水溶解并定容制成浓度为1‰(m/v)的染液。将BB、NR、AO 3种染料分别与DNA溶液按照体积比为1∶9的比例混合,得到染料与DNA的混合液。将混合液分别在CS、SA、CaCl2溶液中孵育,制备得到包载染料分子的多层水凝胶球,依次标注为BB-水凝胶球、NR-水凝胶球、AO-水凝胶球。将包载染料分子的水凝胶球浸入Hank’s缓冲液(pH=7.4)中,在倒置显微镜下观察水凝胶球形态以及核心球内染料分子的释放情况。
1.2.5 模拟胃、肠消化液对DCS多层水凝胶球稳定性的影响 结构稳定性观察:取盐酸234 mL加水稀释至1 000 mL得到稀盐酸,取16.4 mL稀盐酸加水约800 mL,与胃蛋白酶10 g混匀后,加水定容至1 000 mL得到模拟胃液;取磷酸二氢钾6.8 g溶于500mL水,用0.4% 氢氧化钠调pH至6.8,另取胰蛋白酶10 g,加水适量使溶解,将两液混合后,加水稀释成1 000 mL,得到模拟肠液。取3-4粒新鲜制备的多层水凝胶球用缓冲液润洗后,分别置于装有20 mL 模拟胃液和20 mL 模拟肠液的烧杯中,于室温下低速搅拌(50 r/min),观察水凝胶球在孵育过程中的形态变化,并在设定时刻拍照记录。
DCS水凝胶球内DNA含量的检测: DCS水凝胶球的制备步骤同2.2.1。取一定体积的DNA溶液(C,10 mg/mL)连续制备40粒多层水凝胶球,根据剩余的DNA溶液体积计算制备40粒凝胶球所用的DNA溶液体积(V)。吸干DCS水凝胶球表面多余的水分放入冻干瓶内,于-80 ℃冷冻过夜,随后将其置于真空冷冻干燥机中冻干24 h后取出。用精密分析天平称量40粒冻干球的总质量(m总)。脱水DCS水凝胶球中DNA的含量根据公式(1)计算。
DNA含量=C×V/m总×100% 。
(1)
DCS水凝胶球内DNA的累积释放检测:取新制备的多层水凝胶球,用模拟消化液(模拟胃液、模拟肠液)润洗后,投入装有4 mL模拟消化液的离心管中,在37 ℃,100 r/min水浴震荡锅中孵育。每隔一定时间,取40 μL清液,同时向释放体系内补充等体积的模拟消化液。将清液与等体积的苯酚/氯仿/异戊醇(25∶24∶1),7 800 r/min,4 ℃离心2 min;取上清30 μL重复前面的抽提、离心步骤,最终得到的上清液取30 μL冻存备用。在避光条件下,将取出的待测液用1×SYBR Green I染色,其中待测液与染液的体积比为19∶1,小心吸取100 μL混合液置于96孔板中,通过荧光酶标仪检测样品在激发波长497 nm,发射波长520 nm下的荧光强度。
1.2.6 DCS多层水凝胶球对酵母细胞的包埋 将DNA溶液高压灭菌后置于超净台内备用;CS(pH=6)、SA及CaCl2溶液通过无菌滤膜过滤的方式灭菌备用。挑取少量经纯化培养的菌种接种到无菌的葡萄糖蛋白胨液体培养基中培养12 h。按照5%的接种量吸取适量含菌培养液与已灭菌的DNA溶液按照体积比为9∶1的比例充分混合,用1 mL规格的注射器吸取混有菌液的DNA溶液并逐滴滴加到CS溶液中,100 r/min搅拌30 min以保证DNA与CS充分交联,小心取出核心球并用无菌去离子水充分冲洗以除去残留在核心球表面的CS和菌体。然后依次浸入SA溶液和CaCl2溶液中(孵育条件同2.2.1),最终制得包载酵母菌的多层水凝胶球,简称为酵母菌/水凝胶球。将新鲜制备的酵母菌/水凝胶球分别置于无菌的HBSS缓冲液或葡萄糖蛋白胨液体培养基中,30 ℃恒温箱中培养24 h。在倒置显微镜及扫描电镜下观察新鲜制备的以及培养24 h的酵母菌/水凝胶球的形态和结构。
2 结果与讨论
2.1 DNA/壳聚糖/海藻酸钙(DCS)多层水凝胶球的制备及形态表征
DCS多层水凝胶球是利用聚电解质分子之间的静电相互作用层层自组装制得。制得的水凝胶球呈半透明状的圆球形,在显微镜下可观察到清晰的三层膜结构(见图1),由内到外依次是DNA/CS凝胶膜、CS/SA 凝胶膜及海藻酸钙固化膜。通过对比显微镜中的标尺计算可得水凝胶球的平均粒径为(2.7±0.1)mm,CS/SA膜层厚度约为0.24 mm。扫描电镜(SEM)观察到水凝胶球表面光滑无褶皱,水凝胶脱水后其内部形成大孔网格结构,从其剖面的微观结构图可见两层大孔网格结构分别由两层致密的薄膜层隔开(见图2A),其中海藻酸钙外膜层的厚度约为6 μm(见图2B),网格孔隙内壁光滑致密,且有丝状或柱状纤维状结构支承大孔空间结构(见图2C),这使得水凝胶球具有较快的球内外分子的交换和溶胀/去溶胀速度,保持水凝胶球有较好的弹性形变[18]。

图1 新鲜制备的水凝胶球(A)及其在显微镜下(60 X)的照片(B)Fig.1 Freshly prepared hydrogel beads (A) and its microcope photographs observed under 60 X zoom, ordinary light (B), respectively

图2 DCS多层水凝胶球的扫描电镜照片:冻干球的剖面(A)、外膜层(B)及内部结构(C)图
2.2 DCS多层水凝胶球的形状记忆特性
如图3所示,制备的DCS水凝胶球在自然干燥后,由圆润的球形变成圆形薄片贴附于中性红染色的滤膜上(见图3B)。当将已发生形变的的水凝胶球复水后,片状的水凝胶逐渐吸水膨胀,当浸泡12 h后水凝胶球恢复到最初的球形,不再发生形态变化(见图3C),呈现出较好的形状记忆特性。由DNA组装形成的水凝胶球可以在失水过程中产生明显形变,而在复水后可恢复原有形状的记忆特性得益于DNA的双螺旋结构,碱基对间作用力及磷酸二酯键连接的DNA骨架使其有一定的韧性和刚性,而DNA与CS的非共价相互作用更加强了这一特性。
2.3 DCS多层水凝胶球的膜透性
分别选取带负电荷(BB)、正电荷(NR)及可与DNA特异结合(AO)的染料分子包封于DNA/CS核心球内,多层水凝胶球在Hank’s缓冲液(pH=7.4)中各染料的释放情况如图4所示。其中,包裹BB的水凝胶球(BB-水凝胶球)内染料分子已几乎全部释放至球外,水凝胶球呈无色透明状(见图4A),在显微镜下观察与未染色水凝胶球的颜色和形状均无差异(见图4B);包裹NR的水凝胶球(NR-水凝胶球)中染料分子几乎无释放,球体呈艳丽的红色(见图4C),NR分子集中于DNA-CS凝胶膜层以内,外层膜仍保持无色透明状(见图4D)。这可能是由于碱性NR染料分子可与聚阴离子DNA发生静电相互作用而滞留于DNA/CS膜层以内,而不扩散至同样带负电荷的SA分子与CS组装的膜层,另外CS分子对带相同电荷的NR分子的排斥作用也阻碍了NR分子的自由扩散;包裹AO的水凝胶球(AO-水凝胶球)中染料分子在水凝胶球制备过程中可稳定存在于水凝胶球的DNA/CS核心球中,但由于AO的分子量较小,且分子在溶液中不解离出电荷,因此未嵌入DNA的游离AO分子可以透过多层膜,将多层水凝胶球均匀的染为荧光黄色(见图4E),即使在显微镜下也无法观察到明显的多层膜结构(见图4F)。

图3 DCS水凝胶球在脱水干燥前、后(A、B)及复水12 h后(C)的形态照片

图4 新鲜制备的BB-水凝胶球(A)、NR-水凝胶球(C)和AO-水凝胶球(E),以及在光学显微镜下(60 X)观察的BB-水凝胶球(B)、NR-水凝胶球(D)和AO-水凝胶球(F)的显微照片Fig.4 Freshly prepared BB-hydrogel beads (A), NR-hydrogel beads (C), AO-hydrogel beads (E), and their microcope photographs (B, D and F) observed under 60X zoom
结果说明水凝胶球内的大孔网格结构可以允许染料小分子物质“进出”膜层,小分子自身所带电荷,以及小分子与聚电解质分子间特异性结合作用对其在凝胶膜层间的运动有较大影响,其中与DNA能特异性结合的小分子可以被稳定的包裹于水凝胶球内。阳离子分子不仅易与呈负电性的DNA相互作用,且易被呈正电性的CS分子排斥,因而不易跨越DNA-CS膜层;阴离子分子不易与DNA分子相互作用,CS分子与其作用力也较弱,因而可以在膜层间自由扩散;中性分子则可以在各凝胶膜层自由扩散。
2.4 模拟胃、肠消化液对DCS多层水凝胶球稳定性的影响
2.4.1 模拟胃、肠消化液中DCS多层水凝胶球的结构形态 载体材料在人体消化液中的稳定性影响着所包载物质的靶向释放,由于制备的多层水凝胶球允许小分子及带电荷粒子通过自由扩散的方式进出水凝胶球的各层膜结构,因此我们研究了多层水凝胶球在人体胃肠环境中pH对其结构稳定性的影响。在模拟胃液中,随着CS-SA凝胶膜层的“硬化”,水凝胶球的膜结构更致密结实,使得在pH=1.8的环境中多层水凝胶球仍保持完整形态(见图5A),说明在胃环境中多层水凝胶球有良好的稳定性。而水凝胶球颜色由半透明状逐渐变为白色漂浮于液面上,这可能是因为过高的酸性环境使组成水凝胶球膜结构的SA分子逐渐转换为海藻酸而析出,其水合能力逐渐降低使得水凝胶球的比重减小而造成的。将多层水凝胶球置于模拟肠液中孵育一定时间,水凝胶球仍保持着球形状态(见图5B),显示了其较好的稳定性。而水凝胶球颜色由最初的半透明状逐渐变为透明状,可能是因为维持球体结构的海藻酸钙固化膜在碱性溶液中逐渐溶胀,使得水凝胶球的膜层“吸收”更多水分后厚度变大,从而水凝胶球的颜色更加透明。
2.4.2 DCS多层水凝胶球在模拟胃、肠液中DNA累积释放量 DCS多层水凝胶球的核心球内是高浓度的DNA,DNA在脱水凝胶球中的含量比重很大,为(72.1±6.4)%。为了定量分析水凝胶球在模拟消化液中的稳定性,测定了核心球内DNA的累积释放量(见图6)。结果表明当多层水凝胶球在模拟胃液中孵育24 h时,释放介质中仍未检测到游离DNA,说明水凝胶球在模拟胃液中可稳定存在。当水凝胶球在模拟肠液中孵育2 h后,只有0.5%游离DNA“逸出”,15 h内DNA的累积释放量仅有约4%。但是孵育15 h后出现DNA的突释,孵育至24 h时DNA的累积释放量达到15%。以上结果表明该水凝胶球有一定的pH响应性,在酸性环境中水凝胶球稳定性良好,而在碱性环境中稳定性相对较弱,这种pH响应特性使得多层水凝胶球可用于活性物质或药物的靶向定位释放,如肠道微环境等[19]。

图5 DCS多层水凝胶球在模拟胃液(A)和模拟肠液(B)中孵育的形态照片

图6 DCS多层水凝胶球在模拟胃、肠液中游离DNA的释放
2.5 包载酵母菌的水凝胶球的制备及固定化培养
利用聚电解质层层自组装的方法固定酵母菌,材料安全且制备过程温和,能够保证酵母菌的活性。通过显微镜观察酵母菌/水凝胶球具有明显的核-膜结构,各膜层均保持透明状(见图7A)。将酵母菌/水凝胶球在HBSS缓冲液和液体培养基中分别孵育24 h后,均可观察到明显的酵母细胞增殖。其中,酵母菌/水凝胶球在HBSS缓冲液培养24 h后,原本透明状的球体逐渐变白,在暗视野下可观察到水凝胶球内部几乎被酵母菌“占据”(见图7B),水凝胶膜层比新制备的酵母菌/凝胶球膜层明显变薄,且开始出现膜层向球内凹陷的趋势(见图7C箭头所指处),说明该凝胶球在HBSS缓冲液中孵育过程中,随着酵母菌繁殖和数量的增多而使核心球“膨胀”而产生形变。当将酵母菌/水凝胶球置于酵母菌的液体培养基中培养24 h后,水凝胶球的颜色同样变为白色,球体局部发生形变(见图7D箭头所指处),多层膜结构被破坏,仅可见完整的外膜层(见图7E)。此外,球体硬度明显比在HBSS中孵育的水凝胶球高,说明酵母菌的密度非常高,甚至已因局部酵母菌的大量繁殖而形成凸出于原来球体的新半球,但水凝胶球的完整结构并未被破坏,且未发现有酵母菌从水凝胶球中“逸出”。水凝胶球能够包裹活性菌并保持其增殖活性,主要得益于多层水凝胶球的结构优势。海藻酸钙外膜层有利于保护包埋在核心球内的细胞不受外界机械力的破坏,为其增殖过程提供了稳定的培养环境。水凝胶球的多层膜结构均为相互连通的网状大孔,可以保证营养分子的供给,促进细胞增殖,而且能够使细胞分泌的代谢产物有选择性的蓄积或扩散至多层膜外,利于活性代谢产物的收集。此外,该水凝胶球的内核主要由DNA组成,维持了球体很好的形变能力,利于细胞在核心球内的运动和增殖,为细胞的繁殖提供相对宽松自由的生长空间。
为了进一步了解水凝胶球内固定的酵母细胞在增殖过程中的分布情况及水凝胶球的内部结构变化,通过扫描电镜观察其微观结构(见图8)。图8A为在HBSS中培养的水凝胶球微观结构照片,核-膜结构完整,网状大孔结构清晰可见。将图8A中标记区域B放大5倍可以清晰的观察到依附于大孔网格内的酵母菌,且酵母菌周围的凝胶支架结构光滑完整,未出现被降解或结构疏松的现象,说明水凝胶球成功包裹酵母菌。图8C为酵母菌/水凝胶球在液体培养基中孵育24 h的微观结构照片,可见其核-膜结构已经模糊,部分网孔的支架结构已经断裂,膜层表面及切面均富集了大量微生物及其代谢产物。将图8C中标记区域D放大5倍可见球形的酵母菌及其周围无规则状的代谢产物固态形式,酵母菌及其代谢产物已经覆盖且填充满了球内凝胶支架。比较分别在缓冲液和培养液中培养相同时间的酵母菌/水凝胶球,在培养液中孵育的水凝胶球内酵母菌繁殖速度明显比在缺乏营养的缓冲液中快,说明水凝胶球外的营养物质可以通过自由扩散进入到水凝胶球的核心区内,提供细胞生长繁殖所需的碳源、氮源。以上结果表明利用天然核酸制备的多层水凝胶球安全无毒,具有良好的生物相容性,可用于固定活性细胞及其代谢产物。

图7 新鲜制备的酵母菌/水凝胶球(A, 60×)及其分别在HBSS缓冲液(B, 40×)和液体培养基(C, 40×)中培养24 h的显微镜照片
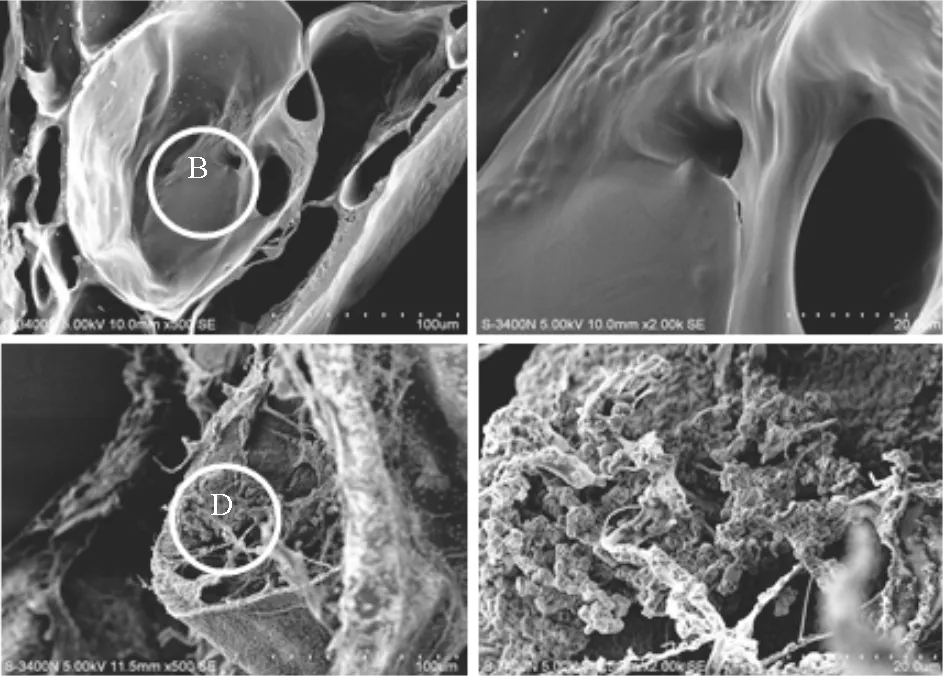
图8 酵母菌/水凝胶球分别在HBSS缓冲液(A、B)和液体培养基(C、D)中培养24 h的扫描电镜照片
3 结语
本研究利用层层自组装技术成功制备了DCS多层水凝胶球。制得的水凝胶球形态圆整,膜层清晰,平均粒径为(2.7±0.1) mm。基于DNA特殊的双螺旋结构,该多层水凝胶球具有良好的形状记忆特性及膜透性,可以固定吸附带正电荷的小分子和可与DNA特异性结合的分子。此外,DCS多层水凝胶球在模拟胃肠液中具有结构稳定性,可实现球内被包载物质pH响应性释放,可以用于药物或活性物质的包载和肠道微环境的靶向释放。利用该水凝胶球成功包埋了活性酵母菌,并实现了包埋菌株的存活和繁殖,为水凝胶球在活性菌的靶向释放以及细胞固定化等应用领域提供了理论和数据支持。
[1] Wu G, Zhang X. Layer-by-layer assembly: From conventional to unconventional methods[J]. Chemical Communications, 2007, 14 (14): 1395-1405.
[2] 杨耀彬,苏丽娜,王婀娜.层层自组装技术应用研究进展[J].化学世界, 2014, 55(10):636-640. Yang Y B, Su L N, Wang A N. Research progress of layer-by-layer self-assembly[J].Technology Chemical World, 2014, 55(10): 636-640.
[3] Volodkin D, Skirtach A, Möhwald H. Bioapplications of light-sensitive polymer films and capsules assembled using the layer-by-layer technique[J]. Polymer International, 2012, 61(5): 673-679.
[4] Luo G F, Xu X D, Zhang J, et al. Encapsulation of an adamantane-doxorubicin prodrug in pH-responsive polysaccharide capsules for controlled release[J]. Acs Applied Materials & Interfaces, 2012, 4(10): 5317-5324.
[5] 王宗文, 苏保卫, 韩姗姗, 等. 层层自组装PDADMAC/PSS纳滤膜的制备[J].膜科学与技术, 2012(1): 27-32. Wang Z W, Su B W, Han S S, et al. Preparation of nanofiltration membrane by LBL assembly technology[J]. Membrane Science and Technology, 2012(1): 27-32.
[6] Thanou M, Verhoef J C, Junginger H E. Oral drug absorption enhancement by chitosan and its derivatives[J]. Advanced Drug Delivery Reviews, 2001, 52(52): 117-126.
[7] Hu Y, Jiang X, Ding Y. Core-template-free strategy for preparing hollow nanospheres[J]. Advanced Materials, 2004(16): 933-937.
[8] Wen G L, Jian R Z, Kang D Y. DNA/lipid complex organogel with shape-memory behavior[J]. Journal of Applied Polymer Science, 2002, 86(1): 259-263.
[9] 王彩飞, 安毅, 刘向东. 天然DNA用于功能材料的研究进展[J]. 化学通报, 2011, 74(11): 1008-1013. Wang C F, An Y, Liu X D. Progress on the applications of natural DNA as functional materials[J]. Chemistry, 2011, 74 (11): 1008-1013.
[10] 任科峰, 计剑, 沈家骢. 层-层自组装构建固相可降解基因传递体系的研究[J]. 高等学校化学学报, 2004, 25(8): 1576-1578. Ren K F, Ji J, Shen J C. Construction of biodegradable multilayer films via layer-by-layer self-assembly as gene delivery system[J]. Chemical Journal of Chinese Universities, 2004, 25(8): 1576-1578.
[11] Volodkin D V, Larionova N I, Sukhorukov G B. Protein encapsulation via porous CaCO3microparticles templating[J]. Biomacromolecules, 2004, 5(5): 1962-1972.
[12] Yang Y, Qiang H, Li D, et al. Assembled alginate/chitosan nanotubes for biological application[J]. Biomaterials, 2007, 28(20): 3083-3090.
[13] Capela P, Hay T K C, Shah N P. Effect of homogenisation on bead size and survival of encapsulated probiotic bacteria[J]. Food Research International, 2008, 40(10): 1261-1269.
[14] Kolambkar Y M, Dupont K M, Boerckel J D, et al. An alginate-based hybrid system for growth factor delivery in the functional repair of large bone defects[J]. Biomaterials, 2011, 32(1): 65-74.
[15] Stabler C, Wilks K, Sambanis A, et al. The effects of alginate composition on encapsulated β TC3 cells[J]. Biomaterials, 2001, 22(11): 1301-1310.
[16] 黄达明, 李聪, 张志才, 等. 海藻酸钠固定化啤酒酵母及应用的研究[J]. 食品科技, 2013(3): 31-34. Huang D M, Li C, Zhang Z C, et al. Application of immobilized saccharomyces cerevisiae by sodium alginate[J]. Food Science and Technology, 2013(3): 31-34.
[17] 渠文霞, 岳宣峰. 细胞固定化技术及其研究进展[J].陕西农业科学, 2007(6): 121-123. Qu W X, Yue X F. Progress in cell immobilization techniques and its application[J]. Shanxi Journal of Agricultural Sciences, 2007(6): 121-123.
[18] Yin Y, Ji X, Dong H, et al. Study of the swelling dynamics with overshooting effect of hydrogels based on sodium alginate-g-acrylic acid[J]. Carbohydrate Polymers, 2008, 71(4): 682-689.
[19] And S E B, Barrett C J. pH-dependent loading and release behavior of small hydrophilic molecules in weak polyelectrolyte multilayer films[J]. Macromolecules, 2004, 37(14): 5375-5384.
责任编辑 高 蓓
Multi-Layerd Hydrogel Beads Prepared by Using Natural Nucleic Acids and Its Properties
WANG Qian2, GUAN Lei1, LIN Jiao1, CHEN Wei-Yu1, LIANG Xing-Guo1, LI Jing1
(1.College of Marine Life Science, Ocean University of China, Qingdao 266003, China;2.College of Food Science and Engineering, Ocean University of China, Qingdao 266003, China)
Cell immobilization is an attractive choice for high-throughput cell isolation and culture due to its advantageous such as protecting cell viability and improving the environmental stability of cell growth, which is widely used in the fields of food, medical application, and environmental protection, etc. In order to improve the micro-environment of cell growth, as well as the stability of the carrier media, bioavailable hydrogel beads composed of natural DNA was developed as a novel matrix for cell immobilization. Based on the biological compatibility and the double helix structure of DNA, DNA/chitosan/calcium alginate multi-layered hydrogels bead (DCS) was prepared by using layer-by-layer (LbL) technique. The morphology and inner micro-structure of DCS were observed by microscopy and scanning electron microscopy, respectively. The stability of DCS was evaluated by determining the cumulative DNA release content in different simulated digestive fluids by dialysis method. Yeast was used as a model cell for cell immobilization. DCS was composed of a soft condensed DNA/CS inner-core and a solid calcium alginate outer-layer through intermolecular electrostatic interactions between DNA, chitosan, and alginate. The prepared hydrogel beads were transparent with spherical shape. The average particle size of the beads was (2.7±0.1) mm, and the thickness of CS/SA layer and calcium alginate outer-layer was about 240 and 6 μm, respectively. The interior morphology of the DCS demonstrated open, interconnected highly porous structure, which enabled the multi-layered hydrogel beads fast swelling/deswelling. Re-hydration test showed that the DCS had good shape memory, having obvious deformation in the process of water loss and recover its original shape after re-incubated in water. In addition, small molecules, such as positively charged molecules and specific DNA-binding molecules, can be absorbed and encapsulated in DCS. Stability studies showed that the beads could be stable in simulated gastric fluid, and only 0.5% DNA was released in 2 hours in simulated intestinal fluid. For the first time, yeast cell was successfully embedded in the multilayer hydrogel beads. After incubation of 24 h in the buffer solution and liquid culture medium, cell-embedded hydrogel beads with integrity structure showed local deformation due to the proliferation of the yeast cells. The multilayer hydrogel beads were still intact, and no leak yeast was found outside the hydrogel beads. The above results showed that natural DNA can be used for constructing bioavailable multi-layered hydrogel beads. This novel transparent hydrogel beads showed good shape memory property, membrane permeability and stability, which provided a good micro-environment for cell immobilization and culture.
DNA; chitosan; multilayer hydrogel beads; characteristic; immobilization; yeast
中国博士后科学基金项目(2014M551965);国家自然科学基金项目(31301420;31571937)资助 Supported by the China Postdoctoral Science Foundation Funded Project(2014M551965);the National Natural Science Foundation of China (31301420;31571937)
2016-04-15;
2016-05-13
王 倩(1987-),女,硕士生。E-mail: wangqian366616552@163.com
** 通讯作者:E-mail: lijouc@ouc.edu.cn
TS201
A
1672-5174(2017)03-0066-08
10.16441/j.cnki.hdxb. 20160126
王倩, 关磊, 林娇, 等. 利用天然核酸制备的多层水凝胶球及其性能研究[J]. 中国海洋大学学报(自然科学版), 2017, 47(3): 66-73.
WANG Qian, GUAN Lei, LIN Jiao, et al. Multi-layerd hydrogel beads prepared by using natural nucleic acids and its properties[J]. Periodical of Ocean University of China, 2017, 47(3): 66-73.

