川陈皮素对糖尿病大鼠海马Nrf-2表达及认知功能的影响
张红蕊,赵轶群,高晓红,刘春梅,李春霞,郑 佳
(1.河北省唐山市人民医院体检中心 063000;2.华北理工大学研究生院,河北唐山 063000;3.唐山职业技术学院临床医学系,河北唐山 063000)
论著·基础研究
川陈皮素对糖尿病大鼠海马Nrf-2表达及认知功能的影响
张红蕊1,2,赵轶群1,高晓红1,刘春梅1,李春霞1,郑 佳3△
(1.河北省唐山市人民医院体检中心 063000;2.华北理工大学研究生院,河北唐山 063000;3.唐山职业技术学院临床医学系,河北唐山 063000)
目的 探讨川陈皮素(NOB)对糖尿病认知功能的改善作用及可能机制。方法 实验大鼠均为雄性,分为正常组:12周龄Wistar大鼠8只,清洁级,正常饲料喂养;糖尿病组:12周龄GK大鼠8只,SPF级,正常饲料喂养;NOB组:12周龄GK大鼠6只,SPF级,正常饲料喂养,同时每天给予NOB 10 mg/kg灌胃8周。喂养到22周龄时,Morris水迷宫行为学实验评估大鼠认知功能、免疫组织化学和Western blot检测海马中核因子E2相关因子2(Nrf-2)的表达水平。结果 与正常组相比,糖尿病组潜逃潜伏期延长(P<0.05),NOB组潜逃潜伏期较糖尿病组缩短(P<0.05)。平台撤走后,与正常组相比,糖尿病组在目标象限停留时间较短(P<0.05),NOB组较糖尿病组延长(P<0.05)。与正常组相比,糖尿病组Nrf-2的表达增加(P<0.05);与糖尿病组相比,NOB组Nrf-2的表达水平上升(P<0.05)。结论 NOB可以升高海马Nrf-2表达水平,改善糖尿病大鼠认知功能障碍,提示可能与增强Nrf-2活性及激活抗氧化应激通路有关。
川陈皮素;神经元;海马;氧化应激;核因子E2相关因子2
糖尿病认知功能障碍(diabetes mellitus with cognitive impairment,DMCI)是糖尿病严重的并发症,而如何预防和改善DMCI,近年来成为研究热点。目前公认为氧化应激造成脑损伤是其重要发病机制之一。机体内源性抗氧化应激通路核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf-2)-ARE信号通路可激活以减轻脑损害。Nrf-2是通路中重要的抗氧化转录因子,通过与ARE的作用,产生大量的抗氧化酶及Ⅱ相解毒酶,抵消活性氧簇(ROS)的作用。川陈皮素(hobiletin,NOB)主要在中药陈皮中提取,在柑橘类水果的果皮中广泛存在,是多甲氧基黄酮类化合物,具有抗氧化[1]、抗动脉硬化[2]、抗炎、降糖、保肝[3]、营养神经等作用。本文旨在通过研究NOB改善糖尿病大鼠DMCI及对海马Nrf-2表达的影响,探索NOB改善DMCI的机制及防治DMCI的有效方法。
1 材料与方法
1.1 实验动物 12周龄GK大鼠,清洁级,体质量(300±20)g;12周龄Wister大鼠,清洁级,体质量(300±20)g。所有实验大鼠均为雄性。GK大鼠购自北京维通利华公司,许可证号SCXK(京)2012-0001。Wister大鼠由华北理工大学动物实验中心提供。严格按照华北理工大学动物实验伦理委员会的条例执行。
1.2 主要药物及试剂 NOB由陕西慧科生物科技有限公司生产,兔抗Nrf-2多克隆抗体由美国KPL公司生产,β-actin抗体和免疫组织化学试剂盒由北京中衫金桥生产,十二烷基硫酸钠(SDS)凝胶试剂盒由碧云天生物科技研究所提供,SDS-聚丙烯酰氨凝胶电泳(PAGE)电泳液粉剂抗体稀释液、BCA蛋白浓度测定试剂盒由北京艾德莱生物科技有限公司提供。
1.3 仪器设备 Morris水迷宫及分析软件由中科院药研所研发,电泳转移槽和垂直电泳仪由北京六一仪器厂提供,FluorChen 5500凝胶成像分析系统由美国Thermo提供,XMOOOLDR-MLM温控摇床、高速低温离心机、体质量秤由北京中西远大提供。
1.4 方法
1.4.1 实验分组 为适应环境,早期喂养大鼠2周后,检测GK大鼠空腹血糖均大于11.1 mmol/L,按随机数字表法分为糖尿病组:GK大鼠8只,给予正常饲料;NOB组:GK大鼠6只,给予正常饲料喂养,同时每天给予NOB 10 mg/kg灌胃;正常组:Wistar大鼠8只,食用正常饲料。均喂养8周。
1.4.2 Morris水迷宫实验 大鼠22周龄时,行Morris水迷宫实验,由实验室固定人员完成,并不了解大鼠分组情况。(1)定位航行能力测试:确保周围环境安静的情况下进行连续4 d的测试,第1天为适应性训练。水池为圆形,高50 cm,直径214 cm,水深30 cm,水温约20 ℃,把4个标记点放池壁上,分成4个象限,把圆形平台放到一个象限的中央。动物面朝池壁入水,记录爬上平台的时间,即潜逃潜伏期。若在120 s内未上台,潜逃潜伏期则记录为120 s。轮流测试,共进行4轮,计算平均值作为当天成绩。比较潜逃潜伏期的长短,代表大鼠空间学习能力水平;(2)空间探索能力测试:第5天把圆形平台取出, 记录120 s内大鼠在目标象限停留多长时间。
1.4.3 灌注取材 Morris水迷宫实验结束后大鼠空腹过夜8 h。之后每组选取4只大鼠进行心脏灌注,予10%的水合氯醛(3.0 mL/kg) 行腹腔注射麻醉,开胸使心脏暴露,行左心室插管,同时将右心耳剪开,用生理盐水灌注,至眼球肝脏变白时,以4% 中性多聚甲醛灌注固定,快速将脑组织完整取出,并迅速分离海马组织,装到冻存管,用液氮冷冻后,放置于-80 ℃冰箱储存。
1.4.4 免疫组织化学检测 将分离的海马组织在4%多聚甲醛中固定1 d。用石蜡包被、切片,约5 μm厚。脱蜡至水化后,用3% H2O2室温处理20 min。在正常血清中封闭反应1 h。在4 ℃冰箱条件下兔抗Nrf-2(1∶500)孵育过夜,滴加二抗(已生物素化),37 ℃孵育40 min。镜下观察,自来水冲洗,充分漂洗后,中性树胶封片,显微镜下观察。用Kodak 图像分析系统和Image-Proplus 软件,在400倍光镜下每张切片选5个视野,计算细胞数,并取平均值作为结果。
1.4.5 Western blot检测 制备蛋白样品,将RIPA裂解液加到各组样本中,充分裂解样本,用高速低温离心机离心后取出上清液。严格按照BCA法对蛋白的浓度进行测定。加好蛋白样品后,恒压电泳,直到溴酚蓝到凝胶底部时结束。使用半干转法把蛋白转移到硝酸纤维膜上。取出膜后,用3%BSA-TBST封闭,用摇床摇洗60 min。将1∶1 000稀释的一抗加入,在4 ℃摇床上过夜,TBST漂洗。将稀释的二抗加入,室温下置摇床上孵育60 min,TBST漂洗。膜上加ECL后反应大约5 min。曝光胶片,显影、定影。使用凝胶成像分析系统对条带进行分析。
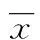
2 结 果
2.1 Morris水迷宫实验结果 第1天适应性训练期后,与正常组相比,糖尿病组大鼠潜逃潜伏期有所延长(P<0.05);NOB组较糖尿病组潜逃潜伏期缩短(P<0.05)。平台撤走后,与正常组相比,糖尿病组在目标象限停留时间缩短(P<0.05);与糖尿病组相比,NOB组停留时间延长(P<0.05)。表明糖尿病大鼠学习记忆能力、空间探索能力均下降,出现认知障碍;而在NOB治疗后改善,提示NOB在剂量为10 mg/kg时对糖尿病大鼠DMCI有改善作用,见图1。

A:定位航行能力测试中各组大鼠连续4 d的潜伏潜逃期;B:平台撤走后各组大鼠在目标象限的停留时间。a:P<0.05,与正常组比较。
图1 NOB治疗增强糖尿病大鼠的学习记忆能力
2.2 免疫组织化学结果显示 光镜下可见在阳性细胞的细胞质中出现棕黄色颗粒,各组均有阳性表达的细胞。与正常对照组(6.25±2.11)比较,糖尿病组(15.34±3.34)海马CA1 区Nrf-2的阳性表达数目明显增多(P<0.01) 。与糖尿病组相比,NOB组(20.38±3.27)海马CA1区Nrf-2的阳性细胞数显著增多(P<0.01)。
2.3 Western blot检测结果 正常组海马Nrf-2低水平表达,糖尿病组较正常组增加(P<0.05); NOB组较糖尿病组海马Nrf-2的表达升高(P<0.05),表明NOB治疗后Nrf-2表达增加,抗氧化能力随之增强。见图2。
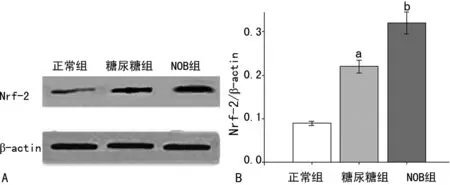
A:各组大鼠海马Nrf-2表达;B:各组大鼠海马Nrf-2表达水平分析图。a:P<0.05,与正常组比较;b:P<0.05,与糖尿病组比较。
图2 NOB治疗增加糖尿病大鼠海马Nrf-2的表达
3 讨 论
海马与认知功能相关,有研究显示糖尿病大鼠出现认知功能障碍时海马结构受损,考虑与高血糖透过血脑屏障损伤海马神经元有关。近年来很多学者认为氧化应激是DMCI发病的机制之一。氧化应激作用使细胞氧化-抗氧化的稳态失去平衡,ROS增多而产生细胞毒性,损害脑组织。为抗衡氧化应激的破坏作用,机体自身内源性抗氧化应激通路激活,如Nrf2-ARE信号通路,发挥重要的抗氧化作用。
Nrf-2属于CNC家族,是家族中活性最强的转录因子。在正常情况下,Nrf-2被细胞质中Keap1 锚定,其活性相对抑制;Keap1对氧化还原非常敏感,有氧化应激时与Nrf-2解离,使其进入细胞核,在核内与抗氧化反应元件(antioxidant response element,ARE)作用,启动下游抗氧化蛋白,增强解毒酶系的表达等,如γ谷氨酸半月光氨酸合成酶(γ-glutamylcysteine synthetase,γ-GCS)、超氧化物歧化酶(superoxide dismutase,SOD)、醌氧化还原酶(NADPH:quinine oxidoreductase 1,NQO1)等,清除大量的自由基,减轻细胞损伤[4],而且通过下调胶质细胞的活化介导对神经元的保护作用[5]。有研究发现在阿尔茨海默病中Nrf-2表达量升高,表明Nrf-2水平及活性升高可以起到保护中枢神经的作用。有报道糖尿病大鼠DMCI时海马中Nrf-2表达量升高,与本研究得出的结果一致。
NOB属于多甲氧基黄酮类化合物,化学结构为5,6,7,8,3′4′-六甲氧基黄酮(5,6,7,8,3′4′-A′-hexamethoxy flavone),是从芸香科植物村橘中提取出来的中药单体,有抗癌、抗血小板聚集、抗炎、抗氧化等作用。近期发现NOB可通过降低p38 丝裂原活化蛋白激酶的活性水平而抑制皮肤黑色素瘤的细胞增殖[6];NOB还有抗组胺的作用[7],NOB可改善阿尔茨海默病模型大鼠的认知功能[8],有效改善脑缺血导致的认知功能下降。也有研究提出在实验性脑梗死大鼠中9 mg/kg NOB对其脑组织有保护作用,也可预防脑卒中[9],故本实验选用NOB 10 mg/kg的剂量研究其对糖尿病认知作用是否也有所改善。
本研究得出Nrf2在正常组大鼠海马中即有少量表达,考虑是用来维持正常情况下的生理功能。与正常组相比,糖尿病组大鼠海马中Nrf-2的表达水平升高,但是认知功能明显下降,提示在脑内高血糖环境下,对氧化应激敏感的Keap1即释放Nrf-2入细胞核,Nrf-2活性增强、表达量增加,启动下游抗氧化蛋白等表达(如γ-GCS、SOD、NQO1等),中和大量氧化应激产物、神经元毒素等,以保护海马神经元,但是仍然不能抵抗高血糖导致的氧化应激状态,所以海马的损伤使大鼠出现认知功能障碍。而经过NOB治疗的糖尿病大鼠认知功能有所改善,海马中Nrf-2表达水平较糖尿病组显著增高,笔者推测NOB是Nrf-2的激活剂,可以诱导Nrf-2活性增强、表达量增加,从而产生更多的抗氧化蛋白等保护海马结构,激活Nrf2-ARE信号通路的抗氧化作用。NOB对糖尿病大鼠的DMCI有一定的治疗作用。
在本研究中,NOB药物剂量选用10 mg/kg治疗,可以提高DMCI大鼠海马Nrf-2转录活性及表达,Nrf2-ARE信号通路激活,下游产生大量抗氧化蛋白及解毒酶,中和大量损害神经元的ROS,从而神经元细胞的药物解毒能力、抗氧化应激的能力都被提高,这对保护海马神经元有重要的作用,可见NOB药物剂量是10 mg/kg时海马Nrf-2表达增加,改善了DMCI。如果NOB药物剂量继续增大,如20 mg/kg、30 mg/kg或更多时,NOB治疗对DMCI的作用如何呢?在正常细胞严格限制Nrf-2表达,除了氧化还原途径外,还有不依赖氧化还原反应的途径,如磷酸化途径;另外,Nrf-2表达量增加也有不良影响,如Nrf-2在肿瘤组织中高表达易导致其预后不良,有报道发现Nrf-2持续高表达有致死性作用。综合以上,所以笔者推测Nrf-2表达在一定范围内随着NOB药物剂量的增加而增高,但当到达某一药量时即出现平台期,或者Nrf-2的持续高表达会造成极不利影响。如何找到这个效果最佳的药量范围,需要今后进一步的研究证实。
NOB可以提高糖尿病大鼠海马Nrf-2表达水平,改善其认知功能。在糖尿病患者中,NOB在某个合适的剂量是否对改善DMCI有此明显的作用,是否可以起到预防作用,这些都需要更多更深入的研究。
[1]Lu YH,Su MY,Huang HY,et al.Protective effects of the citrus flavanones to PC 12 cells against cytotoxicity induced by hydrogen peroxide[J].Neurosci Lett,2010,484(1):6-11.
[2]Mulvihill EE,Assini JM,Lee JK,et al.Nobiletin attenuates VLDL overproduction,dyslipidemia,and atherosclerosis in mice with diet-induced insulin resistance[J].Diabetes,2011,60(5):1446-1457.
[3]Akachi T,Shiina Y,Ohishi Y,et al.Hepatoprotective effects of flavonoids from shekwasha(Citrus depressa) against D-galactosamine-induced liver injury in rats[J].Nutr Sci Vitaminol(Tokyo),2010,56(1):60-67.
[4]Koriyama Y,Nakayama Y,Matsugo S,et al.Protective effect of lipoic acid against oxidative stress is mediated by Keap1/Nrf2-dependent heme oxygenase-1 induction in the RGC-5 cellline[J].Brain Res,2013,1499(5):145-157.
[5]Izumi Y,Matsumura A,Wakita S,et al.Isolation,identification,and biological evaluation of Nrf2-ARE activator from the leaves of green perilla(Perilla frutescens var.crispa f.viridis)[J].Free Radic Biol Med,2012,53(4):669-679.
[6]Yamamoto Y,Shioda N,Han F,et al.Nobiletin improves brain ischemia-induced learning and memory deficits through stimulation of CaMKⅡ and CREB phosphorylation[J].Brain Res,2009(1295):218-229.
[7]Kim JJ,Korm S,Kim WS,et al.Nobiletin suppresses MMP-9 expression through modulation of p38 MAPK activity in human dermal fibrobalsts[J].Biol Pharm Bull,2014,37(1):158-163.
[8]Jang SE,Ryu KR,Park SH,et al.Nobiletin and tangeretin ameliorate scratching behavior in mice by inhibiting the action of histamine and the activation of NF-κB,AP-1 and p38[J].Int Immunopharmacol,2013,17(3):502-507.
[9]Yang EJ,Lim SH,Song KS,et al.Identification of active compounds from Aurantii Immatri Pericarpium attenuating brain injury in a rat model of ischemia-reperfusion[J].Food Chem,2013,138(1):663-670.
The influence of hobiletin on the cognitive impairment of diabetic rats and the expression of Nrf-2 in hippocampus
ZhangHongrui1,2,ZhaoYiqun1,GaoXiaohong1,LiuChunmei1,LiChunxia1,ZhengJia3△
(1.DepartmentofPhysicalExamination,TangshanPeople′sHospital,Tangshan,Heibei063000,China;2.PostgraduateCollege,NorthChinaUniversityandTechnology,Tangshan,Heibei063000,China;3.DepartmentofClinicalMedicine,TangshanVocationalTechnicalCollege,TangshanHebei,06300,China)
Objective To explore the Hobiletin improving cognitive function and the possible mechanism to protect the hippocampal neurons.Methods Eight of Wistar rats,SPF,12 weeks of age,male,were set to the normal group;Eight of GK male rats,SPF,12 weeks of age,only for diabetes group;Both of the two groups were given the normal feed.6 of GK male rats,12 weeks of age,to feed Hobiletin of orange peel 10 mg/kg and lavage for 8 weeks,were set to the NOB group.After 22 weeks the rats were tested by Morris water maze behavior experiment for test the ability of learning and memory;the expression of Nrf-2 was detected by immunohistochemistry and Western Blot.Results Compared with the normal group,the incubation period of diabetes group was longer (P<0.05),and the escape latency of NOB group was shorter than that of diabetes group (P<0.05).Compared with the normal group,the residence time in the target quadrant was shorter in the diabetes group (P<0.05),and prolonged in the NOB group than in the diabetes model group (P<0.05).The expression of Nrf-2 in diabetes group was significantly higher than that in diabetes group (P<0.05).The expression of Nrf-2 in NOB group was significantly higher than that in diabetes group (P<0.05).Conclusion NOB can increase the expression of Nrf-2 in hippocampus and improve the cognitive function of diabetic rats,which may be related to the enhancement of Nrf-2 activity and the activation of anti-oxidative stress pathway.
hobiletin;neurons;hippocampus;oxidative stress;Nrf-2
张红蕊(1981-),在读硕士,主治医师,主要从事内分泌与代谢研究。△
,E-mail:zhengjia0514@163.com。
10.3969/j.issn.1671-8348.2017.06.004
R285.5
A
1671-8348(2017)06-0732-03
2016-10-11
2016-11-23)

