HIFU联合载HSV-TK基因的纳米级超声分子探针治疗对裸鼠肝移植瘤血管生成的影响*
谢 辉,刘 山,曾 辉,李友伟,许 进,丁 雄,刘长安,李 峰△
(1.四川省德阳市人民医院肝胆外科 618000;2.重庆医科大学附属第二医院肝胆外科 400010)
·论 著·
HIFU联合载HSV-TK基因的纳米级超声分子探针治疗对裸鼠肝移植瘤血管生成的影响*
谢 辉1,刘 山1,曾 辉1,李友伟1,许 进1,丁 雄2,刘长安2,李 峰1△
(1.四川省德阳市人民医院肝胆外科 618000;2.重庆医科大学附属第二医院肝胆外科 400010)
目的 观察高强度聚焦超声(HIFU)治疗裸鼠肝移植瘤后,再注入载单纯疱疹病毒-胸苷激酶基因(HSV-TK)的纳米级超声分子探针治疗效果,并探讨其治疗机制。方法 用人肝癌HepG2细胞构建裸鼠皮下移植瘤模型60只,采用CZF型HIFU机治疗后,分别经鼠尾静脉注射200 μL的微泡+HSV-TK+磷脂酰肌醇蛋白多糖-3(GPC3)(A组)、微泡+HSV-TK(B组)、HSV-TK+GPC3(C组)、HSV-TK(D组)、微泡+GPC3(E组)、PBS液 (F组),每3天1次,共注射3次。每次注射后,根据超声监测微泡到达靶组织的情况,对A、B、D、E组用DZC型超声转染仪给予2 W/cm2、1 MHz、 5 min超声辐照。首次注射48 h后,各组经腹腔注射0.2 mL更昔洛韦(GCV,100 mg·kg-1·d-1),连续注射14 d。治疗结束后,用免疫组织化学法测残瘤中微血管密度(MVD)水平,用Western blot和免疫组织化学法测量残癌中缺氧诱导因子-1α(HIF-1α)和血管内皮生长因子(VEGF)的变化情况,用Q-PCR 检测肿瘤中HIF-1α、VEGF基因的转录水平。结果 治疗14 d后,B、C、D、E、F组肿瘤组织中 HIF-1α、VEGF 蛋白表达量,VEGF及HIF-1α mRNA水平,MVD均明显高于A 组(P<0.05)。结论 载HSV-TK的纳米级超声分子探针治疗可降低HIFU治疗后残瘤组织中的VEGF、HIF-1α及MVD水平,从而抑制肿瘤的生长,提高HIFU的治疗效果。
血管内皮生长因子A;高强度聚焦超声;缺氧诱导因子1;分子探针;微血管密度
高强度聚焦超声(high-intensity focused ultrasound,HIFU)已成为手术难以切除的中晚期肝癌的一种重要治疗方法。但由于各种因素的影响,HIFU治疗难以完全杀灭病灶组织,因此存在治疗后肿瘤的残存和复发[1-2]。所以,研究提高和巩固HIFU疗效的方法,对于提高患者生活质量、延长生存时间具有重要意义。
随着医疗技术的快速发展,肿瘤的基因治疗逐渐成为一个新的研究热点[3]。其中,单纯疱疹病毒-胸苷激酶/更昔洛韦(HSV-TK/GCV)自杀基因系统已显示出了良好的应用前景[4]。Zhou等[5]使用超声击碎携带自杀基因的微泡,从而使自杀基因定向释放的技术,提高了靶基因在癌细胞中的转染效率。但是该方法是一种被动寻靶作用,缺乏主动靶向性,这有可能降低该方法的转染效率,其疗效仍有待提高。
磷脂酰肌醇蛋白多糖-3(glypican-3,GPC3)在胎儿的肝脏中高度表达,在成人正常肝组织中无表达,但肝癌发生时会再度高表达。有研究提示,在原发性肝癌中,GPC3的阳性率约为80%、特异性为90%,这表明GPC3有望成为原发性肝癌靶向治疗的靶点[6-7]。本课题组前期已成功制备靶向超声分子探针,即已完成了载基因微泡与GPC3单克隆抗体的连接。同时通过实验证明,该方法成功地提高了自杀基因在肝癌细胞中的表达,从而靶向杀伤肝癌细胞,提高HIFU疗效。本实验旨在通过用HIFU联合载基因纳米级超声分子探针治疗裸鼠肝移植瘤,以观察肝癌移植瘤中血管内皮生长因子(VEGF)、微血管密度(MVD)、缺氧诱导因子-1α(HIF-1α)的变化,并探讨其可能的机制。
1 材料与方法
1.1 细胞株与实验动物 人肝癌HepG2细胞由重庆医科大学附属第二医院刘长安教授赠送。SPF级BABL/C 4~6周龄雄性裸鼠共60只,体质量(20±2)g,购自重庆医科大学动物实验中心。
1.2 主要试剂及仪器 叠氮磷酸二苯酯(DPPA)、链霉亲和素(SA)、生物素化二硬脂酰磷脂酰乙醇(Bio-DSPE)、甘油、二棕榈酰磷脂酰胆碱(DPPC)购自美国Sigma公司;全氟丙烷气体(C3F8)由重庆医科大学超声影像研究所惠赠;DMEM/高糖培养基购自美国HyClone公司;质粒提取试剂盒购自美国Omega公司;生物素化GPC单克隆抗体购自Abcam公司;兔抗人CD34多克隆抗体购自武汉博士德生物工程有限公司;兔抗人VEGF多克隆抗体、兔抗人HIF-1α多克隆抗体为碧云天进口分装;注射用GCV购自宜昌长江药业公司,DZC型低频超声转染仪由重庆医科大学超声影像学研究所研制。
1.3 微泡的合成、质粒的提取及载HSV-TK基因的超声分子探针的构建 首先提取质粒。HSV-TK质粒由课题组前期构建完成,该质粒以pIRES2-EGFP为载体,用其克隆转化大肠杆菌DH5α,经卡那霉素筛选克隆成功菌体后,在LB培养基中扩增大肠杆菌;用Omega质粒大抽试剂盒抽提、纯化质粒;紫外分光光度计调整质粒纯度为A260/A280=1.91,浓度为1 mg/mL。参照李奥等[8]方法合成纳米级超声微泡后,通过生物素-亲和素连接法,参照景周宏等[9]方法实现GPC3单克隆抗体与微泡的结合,构建成肝癌特异性超声分子探针,再通过静电吸附作用,加入多聚赖氨酸连接质粒与微泡,进而制备成载HSV-TK基因的纳米级超声分子探针。
1.4 HIFU治疗后裸鼠移植瘤残瘤模型的建立 取培养生长良好的HepG2细胞,用DMEM/High Glucose培养基调整细胞浓度为1×107/mL,锥虫蓝拒试验检测其细胞活力大于90%。取0.2 mL在裸鼠背部皮下接种,15 d后观察见成瘤率为100%,肿瘤直径达1.0~1.5 cm。经腹腔注射水合氯醛麻醉裸鼠后,用CZF型HIFU治疗仪消融治疗80%裸鼠皮下移植瘤,消融治疗完成后无裸鼠死亡现象。
1.5 动物分组及处理 将HIFU治疗后裸鼠分成6组,每组10只,消融后立即经鼠尾静脉各注射200 μL(0.1 μg/μL)微泡或PBS液,微泡+HSV-TK+磷脂酰肌醇蛋白多糖-3(GPC3)记为A组、微泡+HSV-TK记为B组、HSV-TK+GPC3记为C组、HSV-TK记为D组、微泡+GPC3记为E组、PBS液记为F组。每3天注射1次,共注射3次。对于A、B、D、E组超声辐照,在每次注射探针后根据超声监测其到达肿瘤中的情况,调整超声频率为1 MHz、声强为2 W/cm2进行照射,持续时间为5 min。所有裸鼠在首次辐照后48 h,经腹腔注射0.2 mL GCV(100 mg·kg-1·d-1),连续注射14 d。
1.6 免疫组织化学检测及判定标准 采用免疫组织化学SP法检测各组残瘤组织中HIF-1α和VEGF的表达及MVD。所用一抗分别为兔抗人HIF-1α和VEGF多克隆抗体(工作浓度1∶100),及兔抗人CD34多克隆抗体(工作浓度1∶100)。结果判定标准:在细胞质或(和)细胞核内出现棕褐色和棕黄色颗粒的细胞为VEGF和HIF-1α阳性细胞,每张切片在400倍光镜下取5个视野,用IPP图像分析系统扫描,取5个视野积分光密度值(IOD)。MVD计数测定按照Weidner等[10]的方法:先在100倍视野下确定MVD最高区域,然后在400倍光镜下计数微血管数目。微血管判定标准为:呈棕黄色且有管腔(管腔小于8个红细胞大小)的内皮细胞形成的条索间隙状结构;黄染的细胞或者细胞簇未显示管状结构,但与周围的肿瘤细胞、微血管及其他结缔组织分开者;管腔直径大于8个红细胞和可见平滑肌的管壁不计算在内。
1.7 肿瘤组织中VEGF和HIF-1α基因转录水平的检测 采用Q-PCR法。治疗完成后,取各残瘤组织,用Trizol法提取液取总RNA,依步骤行荧光定量PCR。其反应条件为:94 ℃ 4 min;94 ℃ 20 s,60 ℃ 30 s,72 ℃ 30 s,共循环35次;72 ℃检测信号。
1.8 Western blot检测HIF-1α,VEGF蛋白表达 治疗结束后,取各组肿瘤组织,以GAPDH为内参照,Western blot法检测各组残瘤组织中HIF-1α和VEGF蛋白的表达,并采用UVP凝胶图象处理系统Labworks4.6软件分析目的条带的灰度值。
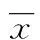
2 结 果
2.1 各组残瘤中VEGF和HIF-1α蛋白的表达 免疫组织化学和Western blot结果显示,各组残瘤中HIF-1α和VEGF蛋白的表达明显高于A组(P<0.05),同时C、D、E及F组也明显高于B组(P<0.05),见图1~4。

A:A组;B:B组;C:C组;D:D组;E:E组;F:F组。
图1 各组肿瘤组织中VEGF表达(免疫组织化学×400)

A:A组;B:B组;C:C组;D:D组;E:E组;F:F组。
图2 各组肿瘤组织中HIF-1α表达(免疫组织化学分析×400)

a:P<0.05,与B、C、D、E、F组同指标比较;b:P<0.05,与C、D、E、F组同指标比较。
图3 各组肿瘤组织中HIF-1α和VEGF表达的IOD

a:P<0.05,与B、C、D、E、F组同指标比较;b:P<0.05,与C、D、E、F组同指标比较。
图4 Western blot检测各组肿瘤中VEGF、HIF-1α的表达

A:VEGF;B:HIF-1α;a:P<0.05,与B、C、D、E、F组比较;b:P<0.05,与C、D、E、F组比较。
图5 各组肿瘤组织中HIF-1α和VEGF基因转录水平
2.2 各组肿瘤组织中VEGF、HIF-1α mRNA的水平 Q-PCR结果显示,B、C、D、E、F组残癌组织中HIF-1α和VEGF mRNA的转录水平明显高于A组(P<0.05),同时C、D、E及F组也明显高于B组(P<0.05)。见图5。
2.3 各组肿瘤组织中MVD的水平 免疫组织化学结果显示,与A组比较,其余各组肿瘤组织中MVD的水平均明显偏高(P<0.05),见图6、7。

A:A组;B:B组;C:C组;D:D组;E:E组;F:F组。
图6 各组肿瘤组织中MVD测定(免疫组织化学×400)

a:P<0.05,与B、C、D、E、F组同指标比较;b:P<0.05,与C、D、E、F组同指标比较。
图7 各组肿瘤组织中MVD水平
3 讨 论
肿瘤的生长转移与新生毛细血管的形成密切相关,而新生血管的形成又与血管内皮生长因子、表皮生长因子等血管生成因子有关。大量研究已表明,VEGF是目前已知的作用最强、特异性最高的血管生成刺激因子。HIF-1是一种核转录因子,它由HIF-1α和HIF-1β两个亚基组成,主要在组织缺氧时出现。其中HIF-1α作为氧分子调节单位,对HIF-1的功能和活性起着决定性作用。大多数肿瘤组织中均存在着HIF-1α,包括早期癌变甚至癌前病变[11],这表明肿瘤细胞缺氧发生于微血管生成之前,并对肿瘤的生长和转化起促进作用[12]。因VEGF是HIF-1最重要的靶基因,HIF-1α也被认为是肿瘤新生血管生成的核心启动子[13]。研究证明,HIF-1α不仅能增强VEGF的转录活性,还可以增加VEGF mRNA的稳定性[14-15]。Tsuzuki等[16]发现,VEGF主要表达于缺氧的肿瘤细胞内。同时,将缺失HIF-1的肿瘤细胞移植,其生成的肿瘤组织中VEGF的表达明显降低,这再次证明了VEGF的高表达与HIF-1α的激活有关。
HSV-TK/GCV自杀基因系统是目前肿瘤基因治疗的新热点。HSV-TK基因可磷酸化无毒的GCV,将其转化成细胞毒性药物,从而对肿瘤细胞起杀伤作用。既往使用超声辐照破坏携带目的基因的微泡,该方法提高了自杀基因在肿瘤组织中的表达,但是该方法是一种被动寻靶作用,缺乏主动靶向性。本研究采用的载HSV-TK基因的纳米级超声分子探针,采用纳米级微泡作为载体,同时连接上GPC3抗体,解决了传统微泡不能主动寻靶的问题,进而提高了自杀基因的转染率、表达率,增强了基因治疗的肿瘤杀伤效应。
本实验结果表明,HIFU治疗裸鼠肝移植瘤后,再注入载HSV-TK的纳米级超声分子探针治疗,在残瘤中MVD、 VEGF及HIF-1α的表达均低于HIFU联合包裹HSV-TK基因的超声微泡组及其他对照组。这表明HIFU联合载HSV-TK基因的纳米级超声分子探针治疗可以更有效地抑制肿瘤组织中血管的生成,使得肿瘤生长的血供条件受限,造成肿瘤内部出现缺血坏死,从而提高肿瘤的治疗效果。分析其机制,可能是由于载HSV-TK基因的纳米级超声分子探针,改善了肿瘤组织中的缺氧环境,进而使HIF-1α的表达降低,使得VEGF的表达下调来降低残瘤中的MVD。但HIFU联合载HSV-TK基因的纳米级超声分子探针治疗裸鼠肝移植瘤,其导致缺氧环境改善的具体机制目前尚不明确,可能与治疗过程中自由基的产生有关,这有待于进一步研究。
综上所述,HIFU联合载HSV-TK基因的纳米级超声分子探针治疗肝癌,可降低肝癌组织中VEGF和HIF-1α的表达,使肿瘤新生血管减少,破坏肿瘤生长的血供条件,进而抑制肿瘤生长、转移,提高并巩固了HIFU治疗肝癌的疗效,这为肝癌治疗手段的改善提供了理论依据。
[1]Zhou YF.High intensity focused ultrasound in clinical tumor ablation[J].World J Clin Oncol,2011,2(1):8-27.
[2]Wijlemans JW,Bartels LW,Deckers R,et al.Magnetic resonance-guided high-intensity focused ultrasound(MR-HIFU) ablation of liver tumours[J].Cancer Imaging,2012,28(12):387-394.
[3]Duarte S,Carle G,Faneca H,et al.Suicide gene therapy in cancer:where do we stand now[J]Cancer Lett,2012,324(2):160-170.
[4]Yin X,Yu B,Tang Z,et al.Bifidobacterium infantis-mediated HSV-TK/GCV suicide gene therapy induces both extrinsic and intrinsic apoptosis in a rat model of bladder cancer[J].Cancer Gene Ther,2013,20(2):77-81.
[5]Zhou S,Li S,Liu Z,et al.Ultrasound-targeted microbubble destruction mediated herpes simplex virus-thymidine kinase gene treats hepatoma in mice[J].J Exp Clin Cancer Res,2010,29(1):170-175.
[6]Wang HL,Anatelli F,Zhai QJ,et al.Glypican-3 as a useful diagnostic marker that distinguishes hepatocellular carcinoma from benign hepatocellular mass lesions[J].Arch Pathol Lab Med,2008,132(11):1723-1728.
[7]Shirakawa H,Kuronuma T,Nishimura Y,et al.Glypican-3 is a useful diagnostic marker for acomponent of hepatocellular carcinoma in human liver cancer [J].Int J Oncol,2009,34(3):649-656.
[8]李奥,王志刚,赵建农,等.纳米级超声分子探针的制备及其体外寻靶实验[J].中国超声医学杂志,2010,26(4):289-292.
[9]景周宏,何承俊,潘万龙,等.载肝癌细胞GPC3抗体的纳米级脂质超声微泡制备及体外寻靶研究[J].重庆医科大学学报,2013,38(5):449-453.
[10]Weidner N.Current pathologic methods for measuring intratumoral microvessel density within breast carcinoma and other solid tumors[J].Breast Cancer Res Treat,1995,36(2):169-180.
[11]Keith B,Johnso RS,Simon MC.HIF1α and HIF2α:sibling rivalry in hypoxic tumour growth and progression[J].Nat Rev Cancer,2011,12(1):9-22.
[12]Ku JH,Park YH,Myung JK,et al.Expression of hypoxia inducible factor-1α and 2α in conventional renal cell carcinoma with or without sarcomatoid differentiation[J].Urol Oncol,2011,29(6):731-737.
[13]Kong J,Kong J,Pan B,et al.Insufficient radiofrequency ablation promotes angiogenesis of residual hepatocellular carcinoma via HIF-1α/VEGF[J].PLoS One,2012,7(5):e37266.
[14]Florczyk U,Czauderna S,Stachurska A,et al.Opposite effects of HIF-1α and HIF-2α on the regulation of IL-8 expression in endothelial cells[J].Free Radic Biol Med,2011,51(10):1882-1892.
[15]Nagao K,Oka K.HIF-2 directly activates CD82 gene expression in endothelial cells[J].Biochem Biophys Res Commun,2011,407(1):260-265.
[16]Tsuzuki Y,Fukumura D,Oosthuyse B,et al.Vascular endothelial growth factor(VEGF) modulation by targeting hypoxia-inducible factor-1α→hypoxia response element→VEGF cascade differentially regulates vascular response and growth rate in tumors[J].Cancer Res,2000,60(22):6248-6252.
The effect of HIFU combined with nanoscale ultrasound molecular probes with simple virus thymidine kinase gene on angiogenesis in the nude mouse tumor*
XieHui1,LiuShan1,ZengHui1,LiYouwei1,XuJin1,DingXiong2,LiuChangan2,LiFeng1△
(1.DepartmentofHepatobiliarySurgery,People′sHospitalofDeyang,Deyang,Sichuan618000,China;2.DepartmentofHepatobiliarySurgery,theSecondAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400010,China)
Objective To observe the change of the protein and gene expression of hypoxia inducing factor-1α(HIF-1α) and vascular endothelial growth factor (VEGF) in the nude mouse tumor,which has been treated by HIFU combined with nanoscale ultrasound molecular probes with HSV1-TK gene microvascular density.Methods Sixty nude mice were implanted with HepG2 Cells to establish subcutaneous transplanted tumor.Divided this mice into six groups at random after treated by HIFU:MB+HSV-TK+GPC3 (group A),MB+HSV-TK (group B),HSV-TK+GPC3 (group C),HSV-TK (group D),MB+GPC3 (group E),PBS (group F).They were injected into the tail vein every after 3 days.Mice in group A,B,D and E were exposed to ultrasound by 2 W/cm2,1 MHz,5 mintues and 0.2 mL ganciclovi(GCV) was intraperitoneally injected at the first 48 hours after injection.After the treatment,immunohistoche were used to detect the microvascular density(MVD),Western blot and immunohistoche was employed to test the protein change of the VEGF and HIF-1α,Q-PCR was used to test the mRNA gene transcription of VEGF and HIF-1α in the tumor tissues.Results After 14 days,the protein expression of HIF-1α and VEGF in group A was significantly lower than that in group B,C,D,E and F (P<0.05),the MVD level in the tumor is also like this,and the difference is statistically significant.Conclusion Anoscale ultrasound molecular probes with HSV1-TK can reduce the the level of VEGF,MVD and HIF-1α in the tumor which has been treated by HIFU,so it can inhibit tumor growth and improve the therapeutic efficacy after HIFU treatment.
vascular endothelial growth factor A;high-intensity focused ultrasound;hypoxia-inducible factor 1;molecular probe;microvascular density
10.3969/j.issn.1671-8348.2017.06.002
国家自然科学基金资助项目(81272570)。
谢辉(1988-),住院医师,硕士,主要从事肝硬化,胆道结石等肝胆疾病的临床诊治和研究。△
,E-mail:1340482261@qq.com。
R735.7
A
1671-8348(2017)06-0725-04
2016-10-23
2016-11-16)

