市售夏枯草饮片质量调查及评价标准研究
陈蕾,戴衍朋,王亮,曲永胜,王萌,周倩*
(1.深圳福田区中医院,广东 深圳 518034,2. 山东省中医药研究院,山东 济南 250014)
【中药与天然活性产物】
市售夏枯草饮片质量调查及评价标准研究
陈蕾1,戴衍朋2,王亮2,曲永胜2,王萌2,周倩2*
(1.深圳福田区中医院,广东 深圳 518034,2. 山东省中医药研究院,山东 济南 250014)
为了对夏枯草饮片质量进行全面的评价和控制,对市售18批饮片进行了外观性状考察、TLC鉴别以及水分、灰分、浸出物检测,建立了夏枯草饮片HPLC指纹图谱和咖啡酸、迷迭香酸含量测定方法,并结合主成分分析和聚类分析方法用于对不同批次饮片的模式识别。结果表明,18批饮片外观性状均符合药典标准,但少有符合传统对优品夏枯草外观的要求。TLC图谱均可检出迷迭香酸;水分、总灰分、浸出物含量均符合药典要求;酸不溶性灰分除3批外,其余符合药典要求,但不同批次间有较大的差异;指纹图谱的整体相似度较高,批次间主要色谱峰峰面积和批次间咖啡酸、迷迭香酸的含量有较大差异。通过上述研究,对市售饮片质量有了初步了解,建议提高外观评价标准,增加指纹图谱质量评价指标。
夏枯草; 质量调查研究;HPLC;指纹图谱;咖啡酸;迷迭香酸
夏枯草为唇形科植物夏枯草PrunellavulgarisL.的干燥果穗[1],主产于湖南、安徽、浙江和江苏[2],因“此草夏至后即枯”得名,是临床常用的一味中药。其味辛、苦,性寒,归肝、胆经,具有清肝明目、消肿散结等功效,主要含有三萜及其苷类、黄酮、有机酸和糖类等活性成分[3-4]。近年来,常用于治疗甲状腺肿大、淋巴结核、乳腺增生、肺结核、高血压以及肿瘤等疾病[5-6]。随着以夏枯草为原料的中成药及保健品如夏枯草颗粒、夏桑菊凉茶等的相继问世,该品种越来越受到人们重视,对其开展的研究也日益广泛[7-9],因此对其质量的控制就显得更加关键。目前国内对夏枯草开展的研究多针对化学成分和药理作用展开,质量评价集中在对指标成分的含量测定和指纹图谱检测方面[10-13],缺乏对市售饮片系统全面的质量调查和评价研究。为了解市售夏枯草饮片质量,本研究收集了市售18批夏枯草饮片,参照2010年版中国药典[1](以下简称药典)要求对各项目进行了检测。同时为了反映更多化学成分的相关信息,建立了夏枯草饮片HPLC指纹图谱,并在该色谱条件下对咖啡酸和迷迭香酸两个成分进行了含量测定,结合主成分分析和聚类分析方法用于对不同批次饮片的模式识别,为夏枯草的质量控制提供方法和数据支持。
1 仪器与材料
Agilent 1200型高效液相色谱仪(Agilent G1315B PAD,美国);十万分之一电子天平(Sartorius R200D,德国);LC-350A超声波中药处理机(济宁市中区鲁超仪器厂)。乙腈为色谱纯;水为超纯水;乙醇、甲醇、环己烷和乙酸乙酯等其他试剂均为分析纯;迷迭香酸对照品(成都瑞芬思科技生物有限公司,批号331-39-5);咖啡酸对照品(中国药品生物制品检定所,批号110831-200302)。
18批次夏枯草均为市售中药饮片,产地分别为安徽、河南、广东、山东和湖北,部分产地不详。经山东省知名老药工姜保生先生鉴定为唇形科植物夏枯草PrunellavulgarisL.的干燥果穗。
2 方法与结果
2.1 外观质量考察
对收集的夏枯草饮片外观性状进行外观质量考察。结果见表1。
2.2 迷迭香酸TLC鉴别
参照药典“鉴别”项下方法,以迷迭香酸对照品对夏枯草饮片进行TLC鉴别,结果见图1。由图谱可见,供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点;但同时可见,不同批次夏枯草在TLC图谱中,色谱行为表现出较为明显的区别。

1,20为迷迭香酸对照品;2~19 分别为1~18号夏枯草样品。图1 夏枯草TLC图谱Fig.1 The TLC chart for Prunellae Spica
2.3 水分测定
取供试品2 g,参照药典附录IX H水分测定法中的第一法(烘干法)进行测定。结果测得夏枯草水分质量分数在9.12%~9.93%之间,均符合药典不得过14.0%的规定。结果见表1。
2.4 总灰分测定
取供试品粉末(过二号筛)3 g,参照药典附录Ⅸ K灰分测定法中的总灰分的测定法进行测定,计算总灰分含量,结果,测得夏枯草总灰分质量分数在1.12%~9.75%之间,均符合药典不得超过12.0%的规定。测定结果见表1。
2.5 酸不溶性灰分测定
取2.4项所得夏枯草总灰分,照药典附录Ⅸ K灰分测定法中的酸不溶性灰分的测定法进行测定,计算酸不溶性灰分含量。测得夏枯草酸不溶性灰分质量分数在0.04%~4.32%之间。共有3个批次不符合药典不得高于4.0%的要求。测定结果见表1。
2.6 浸出物含量测定
取供试品约2 g,精密称定,照药典附录X A 浸出物测定法中的水溶性浸出物测定法项下的热浸法,采用水作为提取溶剂进行测定。以干燥品计算供试品中水溶性浸出物的质量分数,结果测得水溶性浸出物质量分数在11.66%~18.90%之间,均符合药典不得少于10.0%的规定。
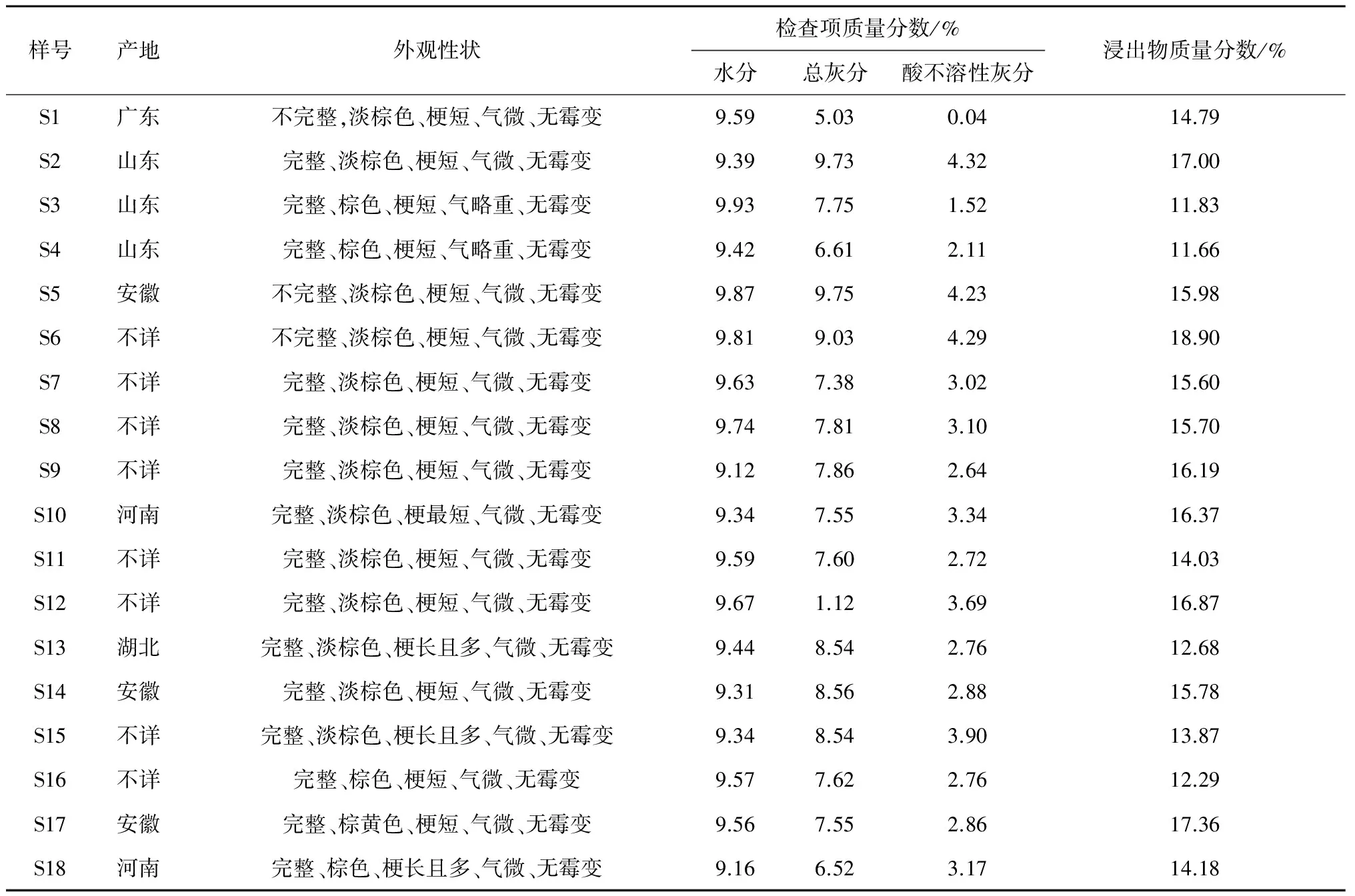
表1 不同批次夏枯草质量检查结果
2.7 夏枯草饮片HPLC指纹图谱的建立
通过研究建立了夏枯草饮片HPLC指纹图谱[14],以期对所收集的饮片质量做出较为综合和全面的评价。
2.7.1 色谱条件
Agilent Eclipse XDB-C18(250 mm×4.6 mm,5 μm)色谱柱;以乙腈(A)-0.1%磷酸(B)为流动相,梯度洗脱(0~10 min,5%~18%A;10~35 min,18%A;35~40 min,18%~30%A;40~55 min,30%A;55~75 min,30%~100%A);检测波长210 nm;流速1.0 mL·min-1;柱温30 ℃。
2.7.2 对照品溶液的制备
取迷迭香酸和咖啡酸对照品各适量,精密称定,加甲醇制成每1 mL含迷迭香酸114.5 μg、咖啡酸3.1 μg的对照品储备溶液。
2.7.3 供试品溶液的制备
取各供试品粉末(过二号筛)0.25 g,精密称定,精密加入甲醇25 mL,称重,超声提取30 min,放凉,再次称定质量,用甲醇补足减失的质量,摇匀,滤过,取续滤液,滤液过0.45 μm微孔滤膜,即得。
2.7.4 精密度实验
取18号夏枯草样品的供试品溶液,连续进样5次,以迷迭香酸的保留时间和峰面积为参照,分别对各共有峰相对保留时间和相对峰面积进行统计。结果表明,各共有色谱峰的相对保留时间基本一致,相对标准偏差在0.00%~0.28%之间,相对峰面积相对标准偏差在0.00%~2.34%之间,表明夏枯草饮片指纹图谱精密度实验符合要求。
2.7.5 稳定性实验
取夏枯草供试品溶液室温保存,分别于0、3、6、12和24 h测定,以迷迭香酸保留时间和峰面积为参照,对各共有峰相对保留时间和相对峰面积进行统计。结果,各共有色谱峰的相对保留时间相对标准偏差在0.00%~0.36%之间,相对峰面积相对标准偏差在 0.00%~2.76%之间,表明夏枯草饮片指纹图谱24 h内稳定性良好。
2.7.6 重复性实验
取夏枯草粉末6份,照2.7.3项下方法提取测定,以迷迭香酸保留时间和峰面积为参照,对各共有峰相对保留时间和相对峰面积进行统计。结果表明,各共有色谱峰的相对保留时间相对标准偏差在0.00%~1.05%之间,相对峰面积相对标准偏差在 0.00%~2.98%之间,表明夏枯草饮片指纹图谱重现性实验符合要求。
2.7.7 咖啡酸和迷迭香酸线性范围考察
精密吸取混合对照品储备液,分别稀释至储备液浓度的0.1、0.2、0.4、0.7、1倍,制成系列标准溶液,依2.7.1项下方法进行测定,以峰面积A积分值(y)为纵坐标,对照品浓度(x,g·L-1)为横坐标进行线性回归处理,得咖啡酸的回归方程为y= 30 613x+ 1.33,相关系数R为0.999 7,线性范围为3.06×10-4g·L-1~3.06×10-3g·L-1,迷迭香酸的回归方程为y= 40 492x+ 38.4,相关系数R为0.999 9,线性范围为1.15×10-2g·L-1~1.15×10-1g·L-1。
2.7.8 迷迭香酸和咖啡酸加样回收实验
取夏枯草样品(过2号筛)6份,分别精密加入迷迭香酸和咖啡酸对照品适量,按2.7.3项方法依法提取测定,计算回收率,结果二者平均回收率分别为99.34%和101.22%,相对标准偏差分别为2.19%和1.97%,说明该方法测定结果准确。
2.7.9 夏枯草饮片指纹图谱测定
取搜集的各批次夏枯草饮片,分别制备供试品溶液,进样。将所得图谱以AIA格式依次导入国家药典委员会编写的“中药色谱指纹图谱相似度评价系统2004A版”软件。以1号夏枯草饮片色谱图作为参照图谱,进行指纹匹配。采用平均数法生成对照图谱。夏枯草饮片HPLC指纹图谱和对照图谱叠加图见图2和图3。18个批次饮片与对照图谱之间的相似度均大于0.9。
通过统计指纹图谱数据,18批次市售夏枯草饮片共有14个共有峰,保留时间分别为5.98、9.43、12.39、15.60、29.82、43.39、49.66、51.58、63.62、74.43、75.94、78.53、80.55、81.81 min。其中4号峰(15.60 min)为咖啡酸,6号峰(43.39 min)为迷迭香酸。各共有峰相对保留时间的相对标准偏差均小于3%,符合指纹图谱的要求,但主要色谱峰的峰面积有一定的差异。
此外,通过指纹图谱比较可见不同批次间成分比例关系有明显不同,以峰面积响应值最大的6(迷迭香酸)和12号色谱峰为例,二者在绝大多数两批次相比时均呈现出反比的趋势,如图3中所示。在一定程度上表明单一成分评价饮片质量是不全面的。

S1~S18为1~18号夏枯草样品;R为对照图谱。图2 18批夏枯草饮片指纹图谱色谱图Fig.2 The overlapped HPLC fingerprints for Prunellae Spica

a1 S8;a2 S9;b1 S12;b2 S13。 图3 批次间主成分峰面积比较叠加图Fig.3 The overlapped chart for Prunellae Spica between different batches
2.8 主成分分析
通过SPSS 18.0 软件中的因子分析对原始数据进行标准化处理。经过计算,前4个成分A1、A2、A3和A4的特征值大于1,即6.209、3.093、1.443、1.101,对总方差的累计率达84.538%,接近85%。故选择A1、A2、A3和A4为第一、二、三和第四主成分。根据表2中信息,可见主成分一主要反映了来自原始色谱峰1、2、4、6 、7、8和14的信息,主成分二反映了色谱峰3、4、5、8、9、11的信息,主成分三反映了色谱峰10、11和13的信息,主成分四反应色谱峰12的信息。故用前四个主成分就可表示原HPLC数据的主要信息。根据主成分矩阵及变量的观测值,计算各成分得分,继而计算综合主成分得分,结果见表3。

表2 成分矩阵

表3 主成分因子得分及综合主成分总得分表
2.9 夏枯草饮片指纹图谱聚类分析
由表3中的1~4主成分的得分,运用SPSS 18.0 软件对18 个批次夏枯草样品进行系统聚类,采用组间平均数联结法,以欧式平方距离对样品聚类,得到聚类分析树状图(图4) 。根据聚类分析可以看出:S1、S3、S8、S11为一类;S9、S12、S13、S14、S15、S18为一类;S4、S7、S16为一类;S2、S6、S17为一类;S10为一类;S5为一类。通过分析可见,分类并未表现出明显的地域特征。聚类判别结果( 图5) 证明夏枯草聚类分析分类合理。

图4 样品系统聚类分析图Fig.4 The cluster-analysis figure of the samples

图5 聚类判别结果Fig.5 Clustering discriminant results
2.10 迷迭香酸和咖啡酸含量测定
在上述色谱条件下,分别精密吸取对照品溶液和供试品溶液各10 μL,注入高效液相色谱仪,从标准曲线上计算出质量分数,计算样品含量(以干燥品计)。测定结果见表4。

表4 夏枯草饮片中咖啡酸和迷迭香酸质量分数测定结果
由表4可见,不同批次间夏枯草饮片中咖啡酸和迷迭香酸的质量分数存在一定的差异,咖啡酸在0.011%~0.035%之间,迷迭香酸在0.09%~0.78%之间。药典规定,迷迭香酸质量分数不得低于0.20%,有3个批次夏枯草饮片含量不符合要求。
3 结果与讨论
药典对夏枯草的性状要求如下:圆柱形,略扁,呈淡棕色至棕红色、体轻,气微,味淡等。姜宝生先生对优品夏枯草的描述为:色以深黄色为最优,梗(非药用部位)越短越好,无霉变、气微、味淡。通过对收集饮片外观性状的观察,发现18个批次中,颜色有棕色、淡棕色和棕黄色,以淡棕色居多,其他标准中除了个别批次梗偏长、气味略重外,总体符合药典要求,但无一个批次可达到传统外观对于优品夏枯草的要求,即外观深黄色。传统外观质量评价标准是中医药宝贵经验的总结,是目前单一化学成分和化学部位尚不能替代的评价标准,因此为保证临床疗效,对于外观的要求建议应该进一步提高标准。
在鉴别、检查和浸出物的检测结果中,18批次饮片TLC图谱均可检测到迷迭香酸斑点,但批次间色谱行为(斑点大小、颜色)表现出较为明显的区别。水分含量质量分数在9.12%~9.93%之间,总灰分在1.12%~9.75%之间,浸出物在12.39%~18.90%之间,均符合药典中的要求(水分不得超过14.0%,总灰分不得超过12.0%,浸出物含量不得低于10.0%)。根据测定结果,建议在对夏枯草饮片做相应限度要求时,可较药典标准适当提高。酸不溶性灰分有3批饮片略高于药典不得高于4.0%的规定(分别为2号4.32%,5号4.23%和6号4.29%),其余批次符合药典要求。
本研究建立了夏枯草饮片HPLC指纹图谱及同时测定咖啡酸和迷迭香酸含量的质量评价方法,方法学考察符合指纹图谱基本要求。18批次夏枯草饮片共含有14个共有指纹峰,共有峰相对保留时间RSD 均小于3% ,表明其在HPLC 色谱的相对位置稳定,可作为定性鉴别的指标参数,相对含量部分成分存在差异(不同批次色谱峰峰面积差异较大,测得咖啡酸质量分数在0.011%~0.035%之间,迷迭香酸质量分数在0.09%~0.78%之间),但其指纹图谱的整体相似度较高,因此可以作为鉴别夏枯草质量的指标之一。此外,通过比较不同批次特征图谱发现,指标成分含量较低的批次,其他成分却可能表现较高的峰面积响应值,进一步表明饮片质量评价可加入指纹图谱的要求,待检测样品应与标准图谱基本一致,并检出共有特征峰。
为了更好地从多角度综合判断饮片质量,本研究还引入了主成分分析和聚类分析的方法,将反映重要色谱指纹图谱的多维多息特征用四个主成分来描述,信息损失少,且更加便于数据分析。
[1]国家药典委员会.中华人民共和国药典2010年版一部[M].北京:中国医药科技出版社,2010:263-263.
[2] 江苏新医学院. 中药大辞典[M].上海:上海科学技术出版社,1977:1827.
[3]秦蕊,陆军.夏枯草的化学成分及药理作用的研究进展[J].中国医药指南,2012,10(36):435-436.
[4]冯怡,薛明,姜玲海,等.夏枯草中水溶性多糖的分离纯化及化学研究[J].中国医院药学杂志,2008,28(6):431-434.
[5]顾晓洁,钱士辉,李友宾,等.夏枯草的化学成分及药理作用研究进展[J].中国野生植物资源,2007,26(2):5-7.
[6]王海南.中药有效成分研究与中药新药研发[J].中华中医药杂志.2007,22(5):268-270.
[7]陈宇航,郭巧生,王澄亚.夏枯草本草及其入药部位变化的考证[J].中国中药杂志,2010,35(2):242-246.
[8]王玉霞,尹金宝,郭巧生,等.夏枯草不同部位活性成分含量动态研究[J].中国中药杂志,2011,36(6):741-745.
[9]刘光敏,贾晓斌,陈彦,等.HPLC法比较不同产地夏枯草属药材中成分组成的差异性[J].中草药,2010,41(8):1384-1386.
[10]柏玉冰,李春,周亚敏,等.夏枯草的化学成分及其三萜成分的抗肿瘤活性研究[J].中草药,2015,46(24):3623-3629.
[11]谭剑斌,赵敏,杨杏芬,等.夏枯草对氧化应激损伤的保护作用研究[J].中国实验方剂学杂志,2016,22(4):89-94.
[12]方罗,林能明,吴永江. 高效液相色谱同时测定夏枯草药材中4种活性成分的含量[J].中国中药杂志,2010,35(5):616-619.
[13]许招懂,姚江雄,刘菊妍,等.夏枯草药材HPLC指纹图谱研究[J].中药材,2012,35(8):1234-1237.
[14]张壮丽,刘力,徐德生.夏枯草注射液高效液相特征图谱的研究[J].中国医院药学杂志,2007,27(10):1341-1343.
Research on quality investigation and evaluation criteria of commercially available Prunellae Spica
CHEN Lei1,DAI Yan-peng2,WANG Liang2,QU Yong-sheng2, WANG Meng2,ZHOU Qian2 *
(1.Shenzhen Futian Hospital of TCM,Shenzhen 518034,China;2.Shandong Academy of Chinese Medicine,Jinan 250014,China)
∶ In order to evaluate and control their qualities completely,18 batches of Prunellae Spica were bought,and their appearances, TLC identification, the inspection of moisture, ash, extract content were carried out. Furthermore, the HPLC-fingerprint of Prunellae Spica, the determination; of caffeic acid and rosmarinic acid content and the pattern identification of different batches by principal analysis and cluster analysis have been established. The results showed that the appearance of each batch accorded with the standards of China Pharmacopoeia, but few of them could reach standard of superior grade product; rosmarinic acid could be detected from all batches by TLC; Moisture, total ash and extract content were in line with the requirements of Pharmacopoeia; Acid insoluble ash of all the batches except 3 of them could comply with the requirement of Pharmacopoeia, but there were rather big difference among various batches; the overall similarity of the fingerprints was high, but the chromatographic peak area and the content of the caffeic acid and rosmarinic acid existed rather big difference between batches. Through the research above, the quality of Prunellae Spica was preliminarily understood, and it is recommended to further improve the appearance evaluation criteria, and add fingerprint as a new quality evaluation index .
∶Prunellae Spica; HPLC fingerprints; caffeic acid; rosmarinic acid
10.3976/j.issn.1002-4026.2017.01.002
2016-04-22
深圳市福田区卫生公益性科研项目(FTWS2014028);山东省中医药科技发展计划(2015-167)
陈蕾(1982—),女,主管药师,研究方向为临床药学、中药炮制。E-mail:86208906@qq.com
*通信作者,周倩,女,助理研究员,研究方向为中药炮制、中药及复方活性成分与质量控制研究。E-mail:merveilleqq@163.com
R284.1
A
1002-4026(2017)02-0008-07

