二乙醇胺制备氧化铁脱硫剂及其性能评价
邓国伟,夏明桂,李 锐,张腊梅,王彩凤
(武汉纺织大学化学与化工学院,湖北 武汉 430200)
二乙醇胺制备氧化铁脱硫剂及其性能评价
邓国伟,夏明桂*,李 锐,张腊梅,王彩凤
(武汉纺织大学化学与化工学院,湖北 武汉 430200)
采用氧化沉淀法,以钛白粉副产物硫酸亚铁(FeSO4·7H2O)为铁源,以二乙醇胺(DEA)为沉淀剂制备了氧化铁脱硫剂,探讨了DEA浓度、搅拌时间、反应温度、DEA与FeSO4·7H2O物质的量比等对氧化铁脱硫效果的影响,并通过XRD、SEM、孔结构分析对氧化铁的结构和形貌进行了分析。结果表明:在FeSO4·7H2O浓度为0.72 mol·L-1时,控制DEA浓度为25%、搅拌时间为1.5 h、反应温度为40 ℃、DEA与FeSO4·7H2O物质的量比为2.0∶1时所制得的氧化铁脱硫剂的穿透硫容最高可达31.17%;XRD图谱显示,所得产品为无定型氧化铁,在高温灼烧后逐渐转变成晶态的α-Fe2O3;SEM图谱显示,所得产品为不规则片状结构;孔结构分析表明,所得产品的孔道主要为3~10 nm狭缝型介孔,比表面积达到132.162 m2·g-1,孔容为0.183 cm3·g-1,平均孔径为5.541 nm,最可几孔径为4.11 nm。
脱硫剂;氧化铁;二乙醇胺;穿透硫容
煤气、天然气及合成原料气等燃气和工艺气体通常都含有一定量的无机硫(H2S)及有机硫(COS、CS2、RSH等)成分,严重影响生产过程并危害终端用户。目前,市场上的脱硫剂种类繁多,但普遍存在精度不够、吸收不充分、比表面积较小、性质不稳定、能耗大等缺陷[1-3]。为此,开发一种硫容高、比表面积大、稳定性好的氧化铁脱硫剂具有重要意义。
对于气固相催化来说,反应物在催化剂内的扩散往往是控制因素,多孔材料中的介孔可以选择性地容纳客体分子,所具有的大比表面积有利于气体分子吸附[4-5]。根据脱硫的基本原理和氧化铁的特殊形态可以得知,对于具有特定晶相或形态的氧化铁,使其疏松多孔、比表面积大、活性中心高度分散是提高其脱硫效率的核心所在,而这些往往取决于氧化铁脱硫剂的制备工艺和成型条件等因素[6-7]。
参照文献[8],作者以钛白粉副产物硫酸亚铁(FeSO4·7H2O)为铁源,以二乙醇胺(DEA)为沉淀剂,采用氧化沉淀法制备氧化铁脱硫剂,探讨了DEA浓度、搅拌时间、反应温度、DEA与FeSO4·7H2O物质的量比(以下简称反应碱比)等对氧化铁脱硫效果的影响,并对氧化铁脱硫剂的结构和形貌进行了分析。
1 实验
1.1 试剂与仪器
FeSO4·7H2O,湖北某钛白粉厂副产物经提纯后制得;DEA、DOP、双硫腙、无水乙醇、氢氧化钠、CTMAB、氧化汞、硝酸等均为分析纯。
DD-5M型低速大容量离心机,湖南湘仪实验室仪器有限公司;HH-2型数显恒温水浴锅,国华电器有限公司;多功能电动搅拌器,巩义予华仪器有限责任公司;标准实验筛,浙江上虞五四纱筛厂;脱硫评价装置,自制;FE20K型pH计、ME204E型电子天平,梅特勒公司;ST2BCⅡ型真空干燥箱,武汉研润科技发展有限公司;X′Pert PRO型X-射线衍射仪,荷兰PANalytical B.V.公司;扫描电子显微镜,荷兰FEI公司;JW-BK112型比表面积测定仪,北京精微高博科学技术有限公司;GC-2060型硫专用气相色谱,北京中科惠分仪器有限公司。
1.2 氧化铁脱硫剂的制备原理
以钛白粉副产物FeSO4·7H2O为铁源,以DEA为沉淀剂,采用氧化沉淀法,在一定条件下制得墨绿色的水合氧化铁沉淀,再经过滤、洗涤、氧化、干燥等工序,得到亮黄色的活性氧化铁粉末。制备过程可分为3个阶段,即沉淀阶段、氧化阶段和脱水阶段,反应原理如下:
(1)沉淀反应:
FeSO4·7H2O+(HOCH2CH2)2NH+2H2O→
(2)氧化反应:
4Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)脱水反应:
Fe(OH)3→FeOOH或Fe2O3·xH2O+H2O
1.3 氧化铁脱硫剂的制备流程
称取一定量的精制FeSO4·7H2O,配制成0.72 mol·L-1的浅绿色铁盐溶液A;称取一定量的DEA,配制成一定浓度的碱溶液B;移取计算量的铁盐溶液A于1 000 mL烧瓶中,水浴加热至一定温度;边搅拌(搅拌速度为400 r·min-1)边将计算量的碱溶液B用恒压滴液漏斗逐滴(滴加速度为3滴·秒-1)加到铁盐溶液A中,期间观察反应物的颜色变化,以掌握反应程度,同时检测每个阶段的体系pH值,以确定反应终点;当溶液颜色为墨绿色,且体系pH值不再变化时,判定反应完成;将所得沉淀离心,于空气中自然氧化完全后用蒸馏水洗涤至中性;放入减压干燥箱中60 ℃干燥6 h,冷却后研磨成粉,得亮黄色活性氧化铁粉末;将制得的活性氧化铁粉末与一定量的粘结剂C按质量比1∶0.1混合,加水捏合成型,经干燥后即得氧化铁脱硫剂成品。将制得的氧化铁脱硫剂粉碎过筛,获得16~40目的小颗粒,按一定规则均匀装入自制的固定床微反应器中,记录装填的氧化铁脱硫剂的质量和体积,通过脱硫剂评价系统对其脱硫性能进行评价。
1.4 氧化铁脱硫剂的性能评价
参照HG/T 2513-2006氧化锌脱硫剂硫容试验方法和HG/T 4354-2012 常温氧化铁脱硫剂硫容试验方法,自主设计了实验室氧化铁脱硫剂的评价系统,如图1所示。
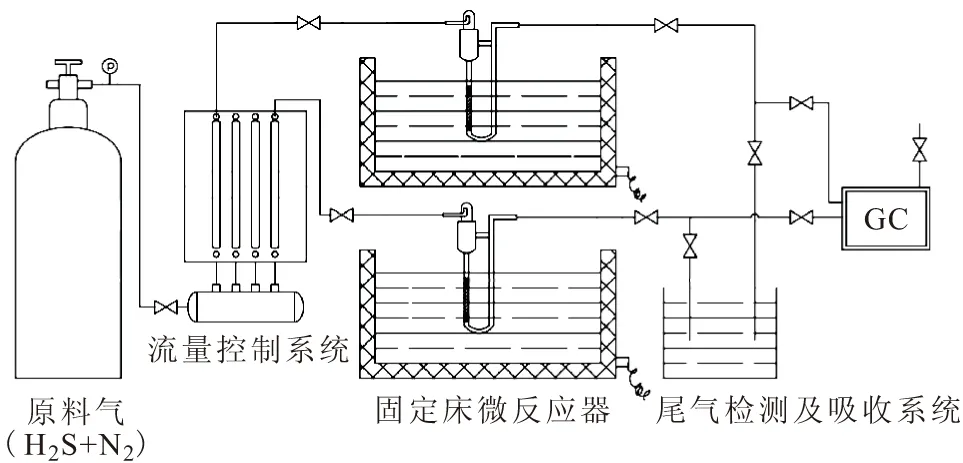
图1 脱硫剂评价系统
脱硫剂评价系统由流量控制系统、固定床微反应器和尾气检测及吸收系统3部分组成。为了真实反映实际工况,进口H2S含量控制在15 000×10-6~20 000×10-6,空速400 h-1,脱硫温度35 ℃。原料气(H2S+N2)经过流量控制系统进入高径比为5~8的固定床微反应器中,通过测定进出口H2S含量(c进、c出,g·m-3)、原料气实时空速(Sy,h-1)、硫吸收时间(t,h)、脱硫剂床层堆密度(d,g·mL-1)等参数,综合评价氧化铁脱硫剂的脱硫性能。
脱硫剂吸收硫的能力用硫容来表示,即单位质量的脱硫剂所能吸收硫的质量。一旦反应器尾气中检测到0.02×10-6的H2S时,默认脱硫剂已经失活,此时的硫容称作穿透硫容(S),按下式计算:
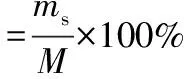
式中:ms为催化剂吸附硫化物的质量,g;M为装填催化剂的质量,g;Vg为通过床层的原料气体积,m3;Vm为催化剂的填充体积,mL。
采用汞量法测定c进,采用气相色谱法测定c出,检测限0.02×10-6。由于c出很低,与c进相差几个数量级,计算时可以忽略不计。
2 结果与讨论
2.1 氧化铁脱硫效果影响因素考察
2.1.1 DEA浓度对氧化铁脱硫效果的影响
在反应碱比为2.0∶1、反应温度为60 ℃、搅拌时间为1.5 h、搅拌速度为400 r·min-1的条件下,分别将配制好的浓度为5%、15%、25%、35%、45%的DEA溶液逐滴加入到FeSO4·7H2O溶液中,测定穿透硫容和比表面积,考察DEA浓度对氧化铁脱硫效果的影响,结果见图2。
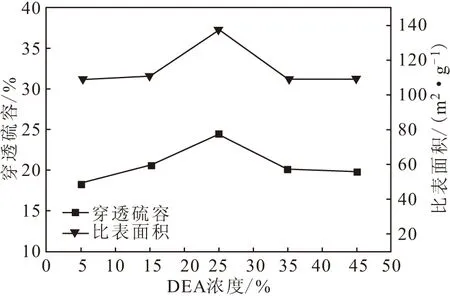
图2 DEA浓度对氧化铁脱硫效果的影响
从图2可以看出,随着DEA浓度的升高,穿透硫容和比表面积均先升高后降低,在DEA浓度为25%时达到最高,其中穿透硫容为 24.34%;且穿透硫容与比表面积在一定条件下呈正相关关系。实验发现,DEA浓度过高使得体系长期处于pH值过高的状态,导致产物颜色偏暗、偏深且带有一定磁性,收率较低,滤液颜色很深。由此可以推断,合适的DEA浓度有利于活性氧化铁的生成,但DEA浓度过高,会趋向于生成结构紧密的Fe3O4等其它晶型,而且高浓度的DEA容易与Fe2+形成络合物,造成铁源损失,降低氧化铁的脱硫效率。因此,选择DEA浓度为25%较为适宜。
2.1.2 搅拌时间对氧化铁脱硫效果的影响
在反应碱比为2.0∶1、反应温度为60 ℃、搅拌速度为400 r·min-1的条件下,逐滴将25% DEA溶液滴入FeSO4·7H2O溶液中,分别控制搅拌时间为0.5 h、1.5 h、2.5 h、3.5 h、4.5 h,测定穿透硫容和比表面积,考察搅拌时间对氧化铁脱硫效果的影响,结果见图3。

图3 搅拌时间对氧化铁脱硫效果的影响
从图3可以看出,随着搅拌时间的延长,穿透硫容和比表面积均先升高后降低,在搅拌时间为1.5 h时达到最高。这可能是因为,搅拌时间过长,新生成的粒子易发生团聚,晶粒变得细小而紧密,比表面积减小,脱硫效率降低。因此,选择搅拌时间为1.5 h较为适宜。
2.1.3 反应温度对氧化铁脱硫效果的影响
在反应碱比为2.0∶1、DEA浓度为25%、搅拌速度为400 r·min-1、搅拌时间为1.5 h的条件下,考察反应温度对氧化铁脱硫效果的影响,结果见图4。
从图4可以看出,穿透硫容随着反应温度的升高先升高后降低,在反应温度为40 ℃时达到最高,为30.16%;比表面积则随着反应温度的升高持续增大。这是因为,在一定范围内,升高温度有利于多孔氧化铁的生成,提高脱硫效率;但温度过高,比表面积虽然增大,但脱硫效率并未得到提高,表明,比表面积并不是决定氧化铁脱硫效率的唯一原因。因此,选择反应温度为40 ℃较为适宜。

图4 反应温度对氧化铁脱硫效果的影响
2.1.4 反应碱比对氧化铁脱硫效果的影响
在DEA浓度为25%、反应温度为40 ℃下,考察反应碱比对氧化铁脱硫效果的影响,结果见图5。
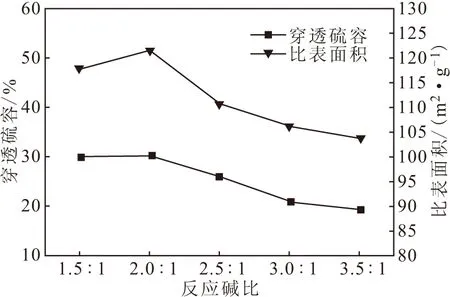
图5 反应碱比对氧化铁脱硫效果的影响
从图5可以看出,总体上穿透硫容和比表面积均随着反应碱比的增大而下降,虽然在反应碱比为2.0∶1时穿透硫容和比表面积略有升高,但并不明显。这可能是因为,一方面反应碱比增大,DEA用量过多,使得反应体系的pH值升高,新生成的Fe(OH)2胶体形貌发生变化,脱硫效率降低;另一方面反应碱比过大时,DEA与Fe2+形成络合物,使胶体溶解,孔道塌陷,导致氧化铁的脱硫效率降低。因此,选择反应碱比为(1.5~2.0)∶1较为适宜。
综上,在FeSO4·7H2O浓度为0.72 mol·L-1时,控制DEA浓度为25%、反应温度为40 ℃、搅拌时间为1.5 h、搅拌速度为400 r·min-1、反应碱比为2.0∶1时所制备的氧化铁脱硫效果最好,穿透硫容高达31.17%。
2.2 产品的性质分析
为更清晰地把握氧化铁脱硫剂的性质,对最佳条件下制备的氧化铁进行XRD、SEM及孔结构分析。
2.2.1 XRD分析
将所制得的氧化铁分别置于200 ℃、350 ℃、500 ℃、700 ℃的马弗炉中灼烧3 h后进行XRD分析,结果如图6所示。

图6 氧化铁在不同温度下灼烧后的XRD图谱
从图6可以看出,实验条件下(60 ℃)制备的氧化铁的XRD图谱在2θ为25°~45°之间有很宽的馒头峰,没有尖锐的衍射峰,说明所制备的产品是无定型氧化铁[9];将制得的氧化铁在不同温度下灼烧后,随着灼烧温度的升高,α-Fe2O3的特征峰开始出现,并逐渐增强,表明无定型铁向晶态转化,最终全部转变成晶态的α-Fe2O3。
2.2.2 SEM分析(图7)

图7 氧化铁的SEM照片
从图7可以看出,所制得的氧化铁为片状或层状结构,疏松多孔。从图7b可以得知,片状粒子的大小约为200~400 nm,形状不规整,堆叠方式不一,这可能是氧化铁具有优良脱硫活性的一个原因。
2.2.3 孔结构分析
孔结构分析是催化剂物性研究的基本内容之一。采用比表面积及孔结构分析仪用氮气吸附法对所制得的氧化铁进行孔结构分析,结果见表1。
从表1可以看出,所制得的氧化铁具有较大的比表面积,达到132.162 m2·g-1,孔容为0.183 cm3·g-1,平均孔径为5.541 nm,主要为小孔和介孔的双重复杂孔道。
表1孔结构分析数据
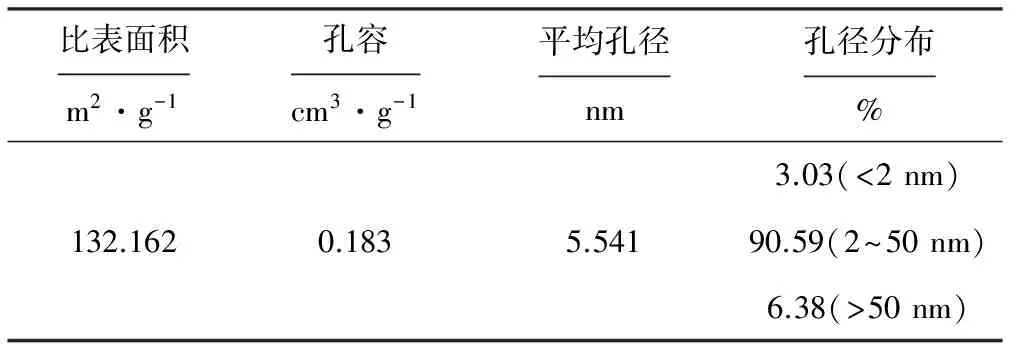
Tab.1Data of pore structure analysis
所制得的氧化铁的等温吸附-脱附曲线如图8所示。
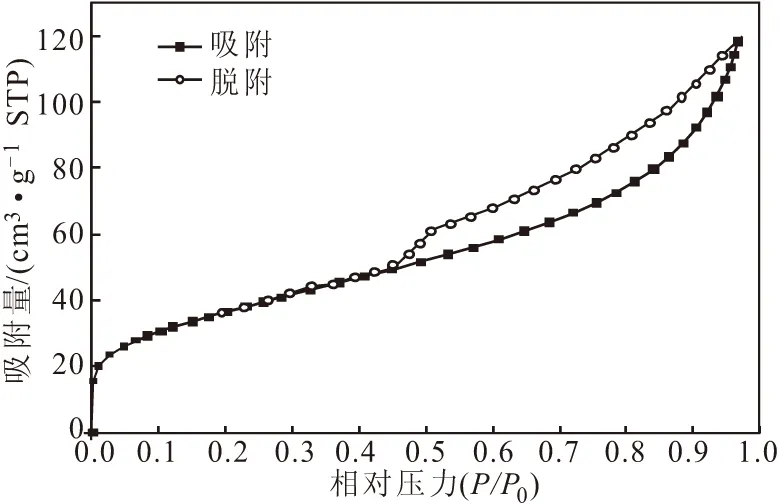
图8 氧化铁的等温吸附-脱附曲线
从图8可以看到,吸脱-脱附曲线形成容量较大的滞后环,根据BDDT分类法可知,该类等温线属于第Ⅳ类型的介孔吸附等温线;而且可以看出,样品在高压端有较大的吸附量,表明该样品为片状离子堆积的狭缝孔,这一点与SEM形貌分析相吻合。
所制得的氧化铁的孔径分布曲线如图9所示。

图9 孔径分布曲线
从图9可以看出,所制得的氧化铁的孔径主要分布在3~10 nm之间,最可几孔径为4.11 nm,孔径分布较窄。从脱硫机理可以知道,H2S分子进入氧化铁脱硫剂孔道后,在水汽的作用下离解为HS-和S2-,然后与活性氧化铁作用而脱除。而HS-和S2-的离子直径约为3.5 Å,H2S分子直径约为3.6 Å,是所制备的氧化铁最可几孔径的1/10,H2S、HS-和S2-能顺畅地扩散进入氧化铁疏松的孔道中,避免了由于内扩散控制而对脱硫效率造成的影响。
3 结论
提出了一种用二乙醇胺(DEA)制备氧化铁脱硫剂的新方法。在FeSO4·7H2O浓度为0.72 mol·L-1时,控制DEA浓度为25%、搅拌时间为1.5 h、反应温度为40 ℃、DEA与FeSO4·7H2O物质的量比为2.0∶1时所制得的氧化铁的脱硫效果最好,穿透硫容最高可达31.17%。随着比表面积的增大,氧化铁脱硫剂的穿透硫容逐渐升高;但比表面积增大到一定程度后,穿透硫容反而下降,表明穿透硫容与比表面积在一定条件下呈正相关关系,但比表面积并不是决定脱硫剂脱硫效率的唯一因素。XRD图谱显示,所制得的氧化铁为无定型氧化铁,在高温灼烧后逐渐转变成晶态的α-Fe2O3。SEM照片显示,所制得的氧化铁为不规则片状结构。孔结构分析表明,所制得的氧化铁孔道为3~10 nm狭缝型介孔,比表面积为132.162 m2·g-1,孔容为0.183 cm3·g-1,平均孔径为5.541 nm,最可几孔径为4.11 nm。
[1] 唐忠钰.焦炉煤气制甲醇中的精脱硫工艺优化[J].氮肥技术,2011,32(4):33-34.
[2] 颜杰,李红,刘科财,等.干法脱除硫化氢技术研究进展[J].四川化工,2011(5):27-31.
[3] 吕金光,陈钢,岳克敬,等.EF-2型特种氧化铁常温精脱硫剂在天然气脱硫中的应用[J].天然气化工:C1化学与化工,1999,24(5):25-27.
[4] 黄秋实.多孔氧化铁的制备、性能及应用研究[D].广州:华南师范大学,2010.
[5] WANG X H,JIA J P,ZHAO L,et al.Mesoporous SBA-15 supported iron oxide:a potent catalyst for hydrogen sulfide removal[J].Water,Air and Soil Pollution,2008,193(1):247-257.
[6] BANTSIS G,BETSIOU M,BOURLIVA A.et al.Synthesis of porous iron oxide ceramics using Greek wooden templates and mill scale waste for EMI applications[J].Ceramics Interbational,2012,38(1):721-729.
[7] 张玉,张卫民,孙中溪.纳米介孔氧化铁的制备[J].化学进展,2007,19(10):1503-1509.
[8] 巩志坚,田原宇,李文华.等.不同原料制备羟基氧化铁的晶型及脱硫活性研究[J].煤炭学报,2006,31(6):790-793.
[9] 郭文川.无定型羟基氧化铁脱硫技术的研究与应用[J].河北能源职业技术学院学报,2014,14(2):62-64.
Preparation and Property Evaluation of Iron Oxide Desulfurizer Using Diethanolamine
DENG Guo-wei,XIA Ming-gui*,LI Rui,ZHANG La-mei,WANG Cai-feng
(CollegeofChemistryandChemicalEngineering,WuhanTextileUniversity,Wuhan430200,China)
Usingtitaniumdioxideby-productferroussulfate(FeSO4·7H2O)asanironsource,diethanolamine(DEA)asaprecipitant,ironoxidedesulfurizerswerepreparedbyanoxidationprecipitationmethod.TheinfluencesofDEAconcentration,stirringtime,reactiontemperature,molarratioofDEAtoFeSO4·7H2Oonthedesulfurizationeffectofironoxidewereinvestigated.AndthestructureandmorphologyofironoxidewereanalyzedbyXRD,SEM,andporestructureanalysis.Resultsindicatedthat,thepenetratingsulfurcapacityofironoxidedesulfurizerreachedamaximumvalueof31.17%whenFeSO4·7H2Oconcentrationwas0.72mol·L-1,DEAconcentrationwas25%,stirringtimewas1.5h,reactiontemperaturewas40 ℃,andthemolarratioofDEAtoFeSO4·7H2Owas2.0∶1.XRDpatternsshowedthat,theobtainedproductwasamorphousferricoxide,anditwasgraduallytransformedintocrystallineα-Fe2O3aftercalcinatingatahightemperature.SEMimageshowedthat,thestructureoftheobtainedproductwasirregularsheetstructure.Porestructureanalysisshowedthat,theporeoftheobtainedproductwasmainlymesoporousof3~10nmslit,thespecificsurfaceareareached132.162m2·g-1,theporevolumewas0.183cm3·g-1,theaverageporediameterwas5.541nm,andthemostprobableporesizewas4.11nm.
desulfurizer;ironoxide;diethanolamine;penetratingsulfurcapacity
武汉纺织大学绿色化工创新团队项目(201401022)
2016-10-05
邓国伟(1991-),男,湖北十堰人,硕士研究生,研究方向:工业催化,E-mail:dengguoweileisure@163.com;通讯作者:夏明桂,教授,E-mail:mingguixia1@163.com。
10.3969/j.issn.1672-5425.2017.02.013
TQ 546.5
A
1672-5425(2017)02-0054-05
邓国伟,夏明桂,李锐,等.二乙醇胺制备氧化铁脱硫剂及其性能评价[J].化学与生物工程,2017,34(2):54-58.

