Jagged1/Notch3信号通路蛋白在人三阴乳腺癌中的表达及临床意义*
王晓珊, 李芳华, 张 晓, 曹 丹, 罗 锋
(1.四川省人民医院肿瘤中心, 成都 610072; 2.四川大学华西医院肿瘤中心, 成都 610041)
Jagged1/Notch3信号通路蛋白在人三阴乳腺癌中的表达及临床意义*
王晓珊1, 李芳华1, 张 晓1, 曹 丹1, 罗 锋2△
(1.四川省人民医院肿瘤中心, 成都 610072; 2.四川大学华西医院肿瘤中心, 成都 610041)
目的: 研究Jagged1/Notch3在TNBC患者中的表达水平及临床意义,探讨Jagged1和Notch3异常表达对TNBC患者的预后影响。方法: Ventana免疫组化法检测Jagged1、Notch3在石蜡标本的蛋白表达,分析其与临床病理及复发转移的关系。结果: Jagged1和Notch3在TNBC组织中的阳性表达率分别为35.7%(25/70)和40.0%(28/70)。Jagged1在无淋巴结转移患者中表达高,Notch3则在4个以上淋巴结转移和Ⅲ期患者中的表达更高。结论: TNBC患者中Jagged1/Notch3蛋白的异常表达与淋巴结转移和分期相关。
Jagged1; Notch3; 预后; 三阴乳腺癌
乳腺癌是目前全球女性发病率高居第一位的恶性肿瘤,全球每年新发乳腺癌病例超过一百万,欧美发达国家平均不到十名女性就有一名患乳腺癌。中国是目前乳腺癌发病率增长最快的国家之一,且中国妇女发病年龄更加年轻,是目前的重大疾病负担[1]。应用内分泌治疗以及曲妥珠单抗靶向治疗对激素受体阳性和Her2(+)乳腺癌患者的治疗有效率有了明显提高[2]。但是分子亚型三阴乳腺癌(triple-negative breast cancer,TNBC)因为缺乏雌激素受体(estrogen receptor,ER)和孕激素受体(progesterone receptor,PR)表达,并且无人表皮生长因子受体-2(human epidermal growth factor receptor 2,Her2)基因扩增表达,对激素内分泌治疗和针对Her2(+)的靶向治疗都不敏感,预后差[3]。因此对于这一难治性乳腺癌亚型急需有意义的靶点和治疗方法改善治疗效果和延长生存[4-5]。Jagged1/Notch3是目前Notch信号通路研究的热点,其在TNBC的作用及预后的关系目前还不清楚,亟待解决与阐明。因此我们研究了Jagged1/Notch3蛋白水平的表达情况及与临床病理因素的相关性,期望初步揭示Jagged1/Notch3在TNBC中的作用。
1 材料与方法
1.1 一般临床资料
收集四川省人民医院2005年3月到2012年12月临床病理资料完整的乳腺癌手术切除标本70例,病例均经过免疫组化染色(IHC)或原位荧光检测(FISH)确认为三阴乳腺癌。标本经10%中性福尔马林液固定,石蜡包埋及常规HE染色。所有病例由两名高年资病理医师复核病理诊断,选取肿瘤组织丰富的蜡块用于后续Ventana免疫组化检测。
1.2 主要试剂
采用全自动多功能组织病理检测系统(Benchmark XT)进行免疫组织化学Jagged1、Notch3的染色。兔抗人Notch3多克隆抗体(购自英国Abcam公司,产品编号为ab23426)工作浓度为1 ∶500;兔抗人Jagged1单克隆抗体(购自美国EPITOMICS公司, 产品编号为3772- 1)工作浓度为1 ∶250;全自动多功能组织病理检测系统Benchmark XT试剂盒(购自罗氏诊断产品上海有限公司);非生物素标记EnVisionTM System,HRP,鼠/兔(购自丹麦Dako公司,产品编号为20003627);DAB(购自丹麦Dako公司,产品编号为00092783)。
1.3 免疫组化染色
由仪器全程操作,步骤严格按照说明书进行,已知强阳性表达的组织作为阳性对照,Notch3阳性对照为乳腺癌组织,Jagged1阳性对照为膀胱癌组织。以PBS代替一抗做阴性对照。Notch3结果依据Hajime[6]已报道标准进行判读,Notch3定位在细胞膜和细胞核。具体为:在低倍镜下(×100)观察乳腺正常上皮和对应的癌灶组织,在中倍镜下(×200)对强度表达明显的地区进行染色强度评价。阳性细胞率<5%或未检测到为0分;阳性细胞率为5%~50%为1+;阳性细胞率≥50%但小于3+表达为2+,强度高于正常上皮两倍表达为3+;0~2+为阴性表达(-) ,3+为阳性表达(+)。Jagged1结果依据Dickson已报道Allred评分标准进行判读[7],Jagged1定位在细胞膜,具体为:免疫组化染色阳性为黄色或棕黄色颗粒,在低倍镜下(×100)和中倍镜下(×200)依据肿瘤细胞染色强度和着色细胞占总肿瘤细胞的比例进行分级评分。染色强度:无着色记0分,弱着色或淡黄色记1分,中间色记2分,强棕黄色记3分。着色细胞数比例评分:每张切片光镜随机观察5个中倍镜视野(×200),每个视野计数100个细胞,计算染色细胞占肿瘤细胞平均百分比作为该切片阳性细胞百分比。无细胞着色记0分,着色细胞< 1%记1分,着色细胞1%~10%记2分, 11%~33%记3分,34%~65%记4分,≥66%记5分。两者计分之和<4分为阴性表达(-), ≥4分为阳性表达(+)。
1.4 临床治疗及随访
按2009年第七版美国癌症研究联合会(AJCC)TNM分期进行病理分期,2003年WHO《乳腺及女性生殖器官肿瘤病理学和遗传学》标准进行病理分型、分级。根据ECOG标准体力状态评分为0~1分,术前均未接受过放疗、化疗、内分泌治疗及生物靶向治疗,术中根据手术情况,术后根据NCCN指南推荐及患者风险评估制定术后辅助治疗方案。患者在术后及术后辅助治疗中均进行了规律随访,为术后前两年每3个月1次,术后三年到五年每6个月1次,五年后每年1次。随访内容包括查体,血常规、生化及肿瘤标志物等血液学检查,每年1次的胸部CT检查,乳腺和腹部B超检查,而骨扫描、骨密度、钼靶摄片及核磁共振则根据情况选择进行。复习所有患者的病历资料,记录每例患者的临床病理特征以及随访资料。
1.5 统计学分析
采用SPSS19.0 统计分析软件进行统计学处理,研究数据均以平均值(Mean)±标准偏差(SD)表示。蛋白表达量比较采用方差分析ANOVA检验,两两比较采用配对Student’s-t检验;比较研究因素在三阴乳腺癌不同临床及病理特征的差别采用χ2检验;所有数据的统计分析均以P<0.05为检验标准。
2 结 果
2.1 临床病理特征
70例三阴乳腺癌患者全部为女性,中位年龄50岁(27~87岁),其中38例患者已绝经。所有病例均接受改良根治术或保乳术,术后标本经常规HE及免疫组化检查,依据2012年WHO《乳腺及女性生殖器官肿瘤病理学和遗传学》标准证实为三阴乳腺癌,原发肿瘤≤2cm的21例(30%),>2cm的49例(70%);包括65例(92.9%)浸润性导管癌3例(4.3%)化生性癌,2例(2.9%)髓样癌;其中高分化5例(7.1%),中分化32例(45.7%),低分化33例(47.1%)。根据术后病检结果,有淋巴结转移12例(17.1%),无淋巴结转移58例(82.9%);依据第六版美国癌症研究联合会(AJCC)TNM分期,Ⅰ期11例(15.7%),Ⅱ期43例(61.4%),Ⅲ期16例(22.9%)。术后63例(90%)患者接受了包含紫杉醇或蒽环类药物为基础的辅助化疗。最后一次随访截止为2015年12月。在随访期间9例(12.9%)患者出现局部复发;24例(34.3%)患者出现转移,其中单纯骨转移4例(5.7%),单纯肺转移5例(7.1%),单纯脑转移5例(7.1%),单纯肝转移1例(1.4%),肺、骨转移5例(7.1%),脑、骨转移3例(4.3%),肺肝转移1例(1.4%)。
2.2 Jagged1的表达
Jagged1主要表达于细胞膜,阳性染色呈棕黄色细颗粒状。癌巢肿瘤细胞的着色强,间质和正常乳腺组织不表达。Jagged1在三阴乳腺癌组织中的阳性表达率为35.7%(25/70)。(见图1)
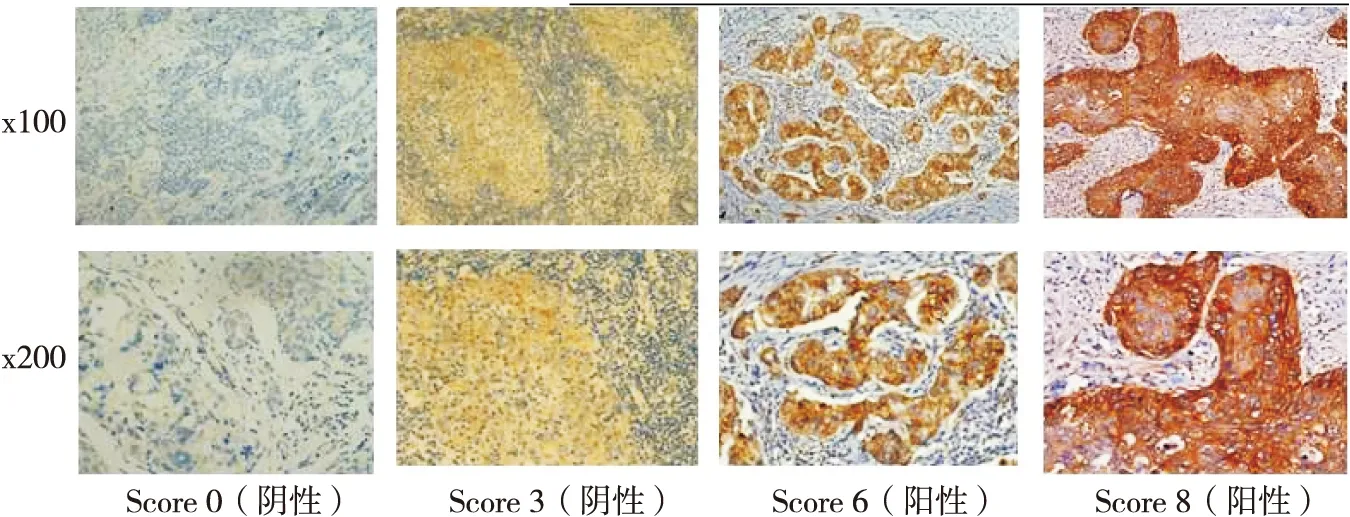
图1 Jagged1蛋白在TNBC癌组织的不同表达(Ventana IHC)
Jagged1的表达分别在三阴乳腺癌患者不同年龄、绝经状态、原发肿瘤大小、组织类型、分化程度、脉管癌栓、分期组别之间的差异均无统计学意义(P>0.05),但在不同的淋巴结转移组别之间的差异有统计学意义(P<0.001)(表1)。无淋巴结转移患者较有淋巴结转移患者的Jagged1表达高。
2.3 Notch3的表达
Notch3主要表达于细胞膜和细胞核,阳性染色呈棕黄色细颗粒状。癌巢肿瘤细胞的着色强,间质血管内皮偶有非特异着色。Notch3在三阴乳腺癌组织中的阳性表达率为40.0%(28/70)。(见图2)

图2 Notch3蛋白在TNBC癌组织的不同表达(Ventana IHC)
Notch3的表达分别在三阴乳腺癌患者不同年龄、绝经状态、原发肿瘤大小、组织类型、分化程度、脉管癌栓的差异均无统计学意义(P>0.05),但在不同的淋巴结转移(P=0.017)、不同分期(P=0.027)之间的差异有统计学意义(表1)。4个以上淋巴结转移和分期Ⅲ期患者的Notch3表达更高。

表1 TNBC中Jagged1/Notch3的表达与临床病理特征的关系
3 讨 论
乳腺癌是一种异质性疾病,具有不同的组织病理特点及不同的临床结果。根据ER/PR/HER2的表达,将乳腺癌分类为luminal A (ER+orPR+/HER2-),luminal B (ER+orPR+/HER2+),HER2(ER-/PR-/HER2+),TNBC(ER-/PR-/HER2-)。TNBC又进一步亚分类为基底型乳腺癌BLBC(ER-/PR-/HER2-/CK5/6+orEGFR+)及五阴乳腺癌QNBC (ER-/PR-/HER2-/CK5/6-/EGFR-)。三阴乳腺癌占到了所有乳腺癌的15%~25%,相比其他亚型预后更差,总生存和无复发生存期更短,同时存在侵袭性的基因表型如高分级低分化,大范围的坏死和高分裂指数,容易发生复发和转移,更好发于年轻人群[8]。本研究中,我们使用了全自动的Ventana免疫组化平台分析Jagged1和Notch3的表达,该检测具有非常好的可重复性及一致性[4]。Ventana全自动免疫组化平台在ALK检测中据报道有100%的敏感性和98%的特异性,与FISH检测有较高的一致性[9-10]。
本研究结果显示:Jagged1和Notch3在TNBC组织中的阳性表达率分别为35.7%(25/70)和40.0%(28/70)。相关研究显示Notch信号通路在很多恶性肿瘤中表达失调,其配体及受体在宫颈癌、结肠癌、头颈癌、肺癌、肝癌、肾癌、胰腺癌、急性白血病、脑胶质瘤、淋巴瘤、卵巢癌、前列腺癌及乳腺癌中过表达[11-16]。本研究临床病理分析提示,Jagged1在无淋巴结转移患者中表达高,Notch3则在4个以上淋巴结转移和Ⅲ期患者中的表达更高。Jagged1/Notch3在其他实体瘤中的表达也与临床病理特征相关。Jagged1作为Notch3的主要配体也在卵巢癌中高表达,Jagged1/Notch3的相互作用形成近分泌环路从而促进卵巢癌的增殖[17]。卵巢癌中Jagged1表达正反馈调节Notch3信号通路[18],Notch3过表达与卵巢癌更晚分期相关[19-20]。Jagged1高表达的头颈鳞状细胞癌新生血管形成能力增强,肿瘤生长加快,并且Jagged1的表达水平与肿瘤血管形成和肿瘤生长密切相关[21]。相关的研究显示726名淋巴结阴性乳腺癌患者进行原位杂交和免疫组化组织微阵列研究中Jagged1的mRNA过表达与基底细胞型乳腺癌标志物相关(P=0.0077),将近2/3的基底细胞型乳腺癌患者高表达Jagged1mRNA。Jagged1阳性表达的患者肿瘤更大,ER与PR阴性,分化低,更容易发生脉管癌栓,与淋巴结阴性转移的复发相关[22]。我们的研究中也显示Jagged1在无淋巴结转移患者中表达高。对62例中国乳腺癌患者标本分析显示,Notch1和Notch3的RNA水平似乎与Her2表达相关,高Notch3表达的患者有更低的ER阳性、PR阳性表达率,Notch3在低Notch1表达的乳腺癌患者中表达更为常见,但未显示出统计学差异[23]。Notch信号通路在TNBC增殖、生长、侵袭中起重要作用并存在不同程度的激活[24],与三阴乳腺癌密切相关。对Notch通路的靶向抑制,可能是对TNBC治疗有意义的靶点。Sansone[25]等最近在乳腺癌细胞系中发现Jagged1依赖的Notch3信号通路的激活可调节其干细胞特性,Notch3不仅在三阴乳腺癌细胞系中扩增表达[26],还可在体外标记克隆源性乳腺导管前体细胞并调控细胞增殖,并在病理状态下促进癌细胞生存从而保护其免受药物的靶向攻击[27]。
本研究初步分析了Jagged1/Notch3在TNBC患者中的表达水平及临床意义,探讨了Jagged1和Notch3异常表达对TNBC患者的预后影响了解其在乳腺癌亚型如三阴乳腺癌分子机制中的作用,以便更好的预测预后及制定治疗策略,具有重要的理论和现实意义。本研究的不足之处在于组织样本量还可扩大以进一步明确差异, Jagged1/Notch3对三阴乳腺癌长期预后的影响还不清楚。希望在后续的临床工作中继续深入研究。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任。
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。
[1] Hurvitz S, Mead M.Triple-negative breast cancer: advancements in characterization and treatment approach[J].Curr Opin Obstet Gynecol, 2016, 28(1):59-69.
[2] Cohen B, Shimizu M, Izrailit J,et al.Cyclin D1 is a direct target of JAG1-mediated Notch signaling in breast cancer[J]. Breast Cancer Res Treat, 2010,123(1):113-124.
[3] Jia LY, Shanmugam MK, Sethi G, et al.Potential role of targeted therapies in the treatment of triple-negative breast cancer[J].Anticancer Drugs,2016, 27(3):147-155.
[4] 谢 芳,倪进斌. EGFR在三阴性乳腺癌中表达情况的Meta分析[J]. 肿瘤预防与治疗, 2013, 26(3):125-130.
[5] Yadav BS, Chanana P, Jhamb S.Biomarkers in triple negative breast cancer: A review[J].World J Clin Oncol,2015,6(6):252-263.
[6] Hajime H, Hideshi I, Koshi M, et al. Notch pathway as candidate therapeutic target in Her2/Neu/ErbB2 receptor-negative breast tumors[J]. Oncology Reports, 2010,23(1):35-43.
[7] Dickson BC, Mulligan AM, Zhang H, et al. High-level JAG1 mRNA and protein predict poor outcome in breast cancer[J]. Modern pathology,2007,20(6):685-693.
[8] Berrada N, Delaloge S, André F.Treatment of triple-negative metastatic breast cancer: toward individualized targeted treatments or chemosensitization?[J].Ann Oncol, 2010, 21(7):30-35.
[9] Colbert LS, Wilson K, Kim S,et al. NILCO biomarkers in breast cancer from Chinese patients[J].BMC Cancer, 2014, 14(1):249.
[10]Shan L, Lian F, Guo L,et al. Combination of conventional immunohistochemistry and qRT-PCR to detect ALK rearrangement[J].Diagn Pathol,2014,9(1):41-42.
[11]Leong KG, Karsan A.Recent insights into the role of Notch signaling in tumorigenesis[J].Blood, 2006,107(6):2223-2233.
[12]Villaronga MA, Bevan CL, Belandia B.Notch signaling: a potential therapeutic target in prostate cancer[J].Curr Cancer Drug Targets,2008,8(7):566-580.
[13]Kopan R, Ilagan MX.The canonical Notch signaling pathway: unfolding the activation mechanism[J].Cell, 2009,137(2):216-233.
[14]Serafin V, Persano L, Moserle L, et al.Notch3 signalling promotes tumour growth in colorectal cancer[J].J Pathol, 2011,224(4):448-460.
[15]Egloff AM, Grandis JR.Molecular pathways: context-dependent approaches to Notch targeting as cancer therapy[J].Clin Cancer Res, 2012,18(19):5188-5195.
[16]Zhou L, Zhang N, Song W,et al.The significance of Notch1 compared with Notch3 in high metastasis and poor overall survival in hepatocellular carcinoma[J].PLoS One, 2013,8(2):e57382.
[17]Choi JH, Park JT, Davidson B,et al.Jagged-1 and Notch3 juxtacrine loop regulates ovarian tumor growth and adhesion[J].Cancer Res, 2008,68(14):5716-5723.
[18]Chen X, Stoeck A, Lee SJ,et al. Jagged1 expression regulated by Notch3 and Wnt/β-catenin signaling pathways in ovarian cancer[J].Oncotarget,2010,1(3):210-218.
[19]Park JT, Chen X, Tropè CG,et al.Notch3 overexpression is related to the recurrence of ovarian cancer and confers resistance to carboplatin[J].Am J Pathol, 2010,177(3):1087-1094.
[20]Hu W, Liu T, Ivan C,et al.Notch3 pathway alterations in ovarian cancer[J].Cancer Res,2014,74(12):3282-3293.
[21]Zeng Q, Li S, Chepeha DB,et al.Crosstalk between tumor and endothelial cells promotes tumor angiogenesis by MAPK activation of Notch signaling[J].Cancer Cell, 2005,8(1):13-23.
[22]Reedijk M, Pinnaduwage D, Dickson BC,et al.JAG1 expression is associated with a basal phenotype and recurrence in lymph node-negative breast cancer[J].Breast Cancer Res Treat,2008,111(3):439-448.
[23]Ma D, Dong X, Zang S, et al. Aberrant expression and clinical correlation of Notch signaling molecules in breast cancer of Chinese population[J]. Asia-Pacific journal of clinical oncology,2011,7(4):385-391.
[24]Wang J, Cai Y, Dong Y,et al.Clinical characteristics and outcomes of patients with primary lung adenocarcinoma harboring ALK rearrangements detected by FISH, IHC, and RT-PCR[J].PLoS One,2014,9(7):e101551.
[25]Sansone P, Storci G, Tavolari S,et al. IL-6 triggers malignant features in mammospheres from human ductal breast carcinoma and normal mammary gland[J].J Clin Invest, 2007,117(12):3988-4002.
[26]Turner N, Lambros MB, Horlings HM,et al.Integrative molecular profiling of triple negative breast cancers identifies amplicon drivers and potential therapeutic targets[J].Oncogene,2010,29(14):2013-2023.
[27]Lafkas D, Rodilla V, Huyghe M,et al.Notch3 marks clonogenic mammary luminal progenitor cells in vivo[J].J Cell Biol, 2013,203(1):47-56.
Expression and Significance of Jagged1/Notch3 Signaling Pathway Proteins in Human Triple Negative Breast Cancer*
Wang Xiaoshan, Li Fanghua, Zhang Xiao, et al
(CancerCenter,AcademyofMedicalSciences&SichuanProvincialPeople’sHospital,Chengdu610072,Sichuan,China)
Objective: To study the expression and clinical significance of Jagged1/Notch3 in Triple-negative breast cancer, and to clarify abnormal expression of Jagged1 and Notch3 protein for prognosis of TNBC patients. Methods: Protein expression of Jagged1 and Notch3 in paraffin wax fixed specimens were detected by Ventana Immunohistochemistry, and the relationships with clinical pathologic significance, recurrence and metastasis were analyzed. Results: A total of 70 patients were enrolled, protein expression of Jagged1 and Notch3 from paraffin specimens were detected by Ventana IHC. Positive rate of Jagged1 and Notch3 in cancer tissues were 35.7%(25/70)and 40.0%(28/70)respectively. Jagged1 expression was higher in patients with no lymph node metastasis. Notch3 expression was higher in patients with more than 4 lymph nodes metastasis and stage Ⅲ. Protein expression of Jagged1 was related to recurrence and metastasis (P=0.035), the expression of Notch3 was related to bone metastasis (P=0.038). Conclusion: It is suggested that positive expressions of Jagged1/Notch3 proteins were related with poor prognosis of TNBC patients.
Jagged1; Notch3; Prognosis; Triple-negative Breast Cancer
2016- 11- 14
2017- 01- 10
*四川省人民医院青年基金(30305030605)
王晓珊(1982-),女,四川人,副主任医师,主要从事肿瘤治疗工作。
△罗 锋,男(汉族),教授,博士生导师,E-mail:luofeng@medmail.com.cn
R737.9
A
10.3969/j.issn.1674- 0904.2017.01.005
•临床研究与技术交流•

