姜黄素抑制Cu2+诱导的转APP695基因SH-SY5Y细胞氧化损伤和凋亡作用
郑博闻,姜招峰,黄汉昌⋆
(北京联合大学 生物活性物质与功能食品北京市重点实验室,北京 100191)
姜黄素抑制Cu2+诱导的转APP695基因SH-SY5Y细胞氧化损伤和凋亡作用
郑博闻,姜招峰,黄汉昌⋆
(北京联合大学 生物活性物质与功能食品北京市重点实验室,北京 100191)
目的:研究Cu2+诱导的转β-淀粉样前体蛋白(amyloid-β precursor protein,APP)基因SH-SY5Y(SHSY5Y-APP695)细胞氧化损伤、凋亡及姜黄素的抑制作用。方法:在姜黄素预保护和无姜黄素预保护条件下,50 μmol/L Cu2+处理细胞24 h,测定细胞存活率、胞外乳酸脱氢酶(lactate dehydrogenase,LDH)水平、胞内活性氧(reactive oxygen,ROS)水平、线粒体膜电位、半胱氨酸天冬氨酸蛋白酶(caspase)-3、caspase-8和caspase-9活力,蛋白免疫印迹法测定核转录NF-E2相关因子2(NF-E2-related factor 2,Nrf2)Ser40位点磷酸化(pSer40-Nrf2)水平以及血红素加氧酶(heme oxygenase,HO)-1蛋白表达水平。结果:与空白对照相比,Cu2+损伤组细胞存活率降低,胞内ROS水平和胞外LDH活性升高,线粒体膜电位下降,caspase-9和caspase-3活性明显升高,pSer40-Nrf2和HO-1含量增加,而姜黄素保护组细胞存活率升高,胞内ROS水平和LDH释放水平降低,线粒体膜电位恢复升高,caspase-9和caspase-3活性明显降低,pSer40-Nrf2和HO-1表达量减少。结论:姜黄素在一定程度上减弱了Cu2+诱导的氧化损伤和细胞凋亡作用。
阿尔茨海默病;Cu2+;氧化损伤;细胞凋亡;姜黄素;Nrf2/ARE信号通路
阿尔茨海默病(Alzheimer’s disease,AD)是一种神经系统退行性疾病,其病理特征主要表现为β-淀粉样蛋白(amyloid-β,Aβ)沉积形 成的老年斑,tau蛋白异常磷酸化形成的神经纤维缠结,以及突触缺失损伤[1-2]。Aβ是由β-淀粉样前体蛋白(amyloid-β precursor protein,APP)经β-裂解途径分泌的含39~43 个氨基酸残基的多肽。APP基因位于人类第21号染色体长臂上,唐氏综合症(Down syndrome)患者体细胞内有3 条21号染色体。AD患者与唐氏综合症患者具有很多相似的病理特征表现,包括低的行为认知能力、老年斑沉积和神经纤维缠结等[3]。有报道显示,在AD患者大脑中APP的mRNA表达水平升高[4]、切割APP产生Aβ的限速酶β-分泌酶蛋白表达水平升高[5]。前期的实验也表明,在海马区注射链脲佐菌素联合颈背皮下注射D-半乳糖的AD模型大鼠中海马区APP表达及Aβ分泌水平升高[6]。这些事实提示大脑衰老退行性病变可能与APP的表达或代谢密切相关,但是,导致APP异常表达和代谢的因素和作用机制还有待进一步地研究。
铜是人体必需的重要微量元素,Cu2+的稳态失衡会导致疾病的发生[7]。与同年龄对照组相比,AD患者血液中游离Cu2+水平明显升高[8],AD患者脑脊液中的Cu2+浓度也明显升高[9-10]。血清中未与铜蓝蛋白结合的游离的Cu2+可能与轻度认知损伤(mild cognitive impairment,MCI)、AD的发展相关,MCI患者中4 a内AD病情发展的概率与血清中游离Cu2+浓度相关,浓度大于1.6 μmol/L患者的概率是小于1.6 μmol/L患者的3 倍[11]。高浓度的Cu2+与Aβ结合后可能通过芬顿反应产生活性氧,从而诱导神经元的氧化损伤[12]。因此,Cu2+稳态失衡可能是AD发生发展的风险因素,维持神经元氧化应激稳态水平可能是AD预防或治疗的有效策略。
近来姜黄素在AD预防中的作用和效果受到很多关注[13]。姜黄素可减弱由H2O2导致的SH-SY5Y细胞氧化损伤及细胞凋亡作用[14]。体内实验表明,姜黄素能够降低老年鼠脑内氧化产物脂质过氧化产物丙二醛(malonaldehyde,MDA)和核酸氧化产物8-羟基脱氧鸟苷(8-hydroxy-2-deoxyguanosine,8-OHdG)的含量[15]。姜黄素不仅可以使实验鼠大脑中的淀粉样蛋白分解,还能预防这种蛋白的生成[16],另外,姜黄素还能改善AD模型大鼠的行为能力[17],前期研究表明,适量浓度的姜黄素减弱了Cu2+诱导的原代培养神经元的氧化损伤[18],在SH-SY5Y细胞中姜黄素能够抑制Cu2+对Nrf2-ARE信号通路的激活作用[19]。本研究以转染人APP695基因的SH-SY5Y细胞(SH-SY5Y-APP695)为细胞模型,研究姜黄素对Cu2+诱导细胞损伤和凋亡信号的抑制作用及对Nrf2-ARE信号通路的调节作用。
1 材料与方法
1.1 材料
SH-SY5SY-APP695细胞由生物活性物质与功能食品北京市重点实验室自行构建,将APP转录本NM_201414.2编码序列构建到慢病毒表达载体、包装成慢病毒颗粒后感染SH-SY5Y细胞,经筛选后得到稳定表达人APP695的转基因细胞。
1.2 试剂
姜黄素(≥95% HPLC,生物活性物质与功能食品北京市重点实验室自提)临用时用二甲基亚砜(dimethyl sulfoxide,DMSO 美国Sigma-aldrich公司)溶解配成20 mmol/L的储备液。乳酸脱氢酶(lactate dehydrogenase,LDH)测定试剂盒 南京建成生物工程研究所;细胞增殖-毒性检测试剂盒(cell counting kit-8,CCK-8)、活性氧检测试剂盒、半胱氨酸天冬氨酸蛋白酶(caspase)-3活性检测试剂盒、caspase-8活性检测试剂盒、caspase-9活性检测试剂盒 上海碧云天生物技术有限公司;JC-1线粒体膜电位检测试剂盒 美国Genview公司。
1.3 方法
1.3.1 细胞培养
从液氮中取出细胞,立刻置于37 ℃水浴锅中将其迅速解冻,4 ℃、100×g离心5 min;吸去上清液,加入1 mL PRMI 1640培养基清洗,反复3 次,离心条件同上;吸取上清,加入1 mL含血清培养基(PRMI 1640培养基+10%胎牛血清+1%链霉素-青霉素溶液,100 μg/mL新霉素),均匀接种于培养皿中,每3~4 d传代1 次。加药培养时,培养液换成不含血清培养液。实验分组:空白对照组;姜黄素对照组:10 μmol/L姜黄素孵育细胞24 h;Cu2+损伤组:50 μmol/L CuCl2孵育细胞24 h;姜黄素保护组1、2、3:分别用1、5、10 μmol/L姜黄素孵育细胞4 h,换液后加入50 μmol/L CuCl2孵育细胞24 h。
1.3.2 CCK-8法测定细胞存活力测定
采用CCK-8法测定细胞存活力,将SH-SY5YAPP695细胞1×104个/孔接种于96 孔板中(细胞悬液100 μL/孔),加药培养24 h后,每孔加入10 μL CCK-8溶液,置于37 ℃含5% CO2培养箱中培养4 h。酶标仪测定吸光度,选定波长450 nm(参比波长630 nm),测定每孔的光密度(OD)值。
1.3.3 LDH活力测定
将SH-SY5Y-APP695细胞以1×104个/孔接种于96 孔板中,加药处理后,按照LDH测定试剂盒测定培养基中的LDH含量。培养基中的LDH是细胞膜损伤的生化指标,可催化培养基中的乳酸和氧化型烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)生成丙酮酸和还原型烟酰胺腺嘌呤二核苷酸(NADH);在碱性条件下产生的丙酮酸将2,4-二硝基苯肼还原成丙酮酸二硝基苯腙,于450 nm波长处测定OD值。
1.3.4 细胞内活性氧水平测定
将SH-SY5Y-APP695细胞以5×105个/孔接种于6 孔板中,药物处理24 h后吸除培养液,装载无荧光的二氯二氢荧光素二乙酸酯(dichloro-dihydro-fluorescein diacetate,DCFH-DA)探针(终浓度为10 μmol/L),于细胞培养箱中孵育30 min。该探针可自由透过细胞膜,进入胞内的DCFH-DA可被酯酶水解成二氯二氢荧光素(dichlorodihydro-fluorescein,DCFH),该物质不能自由穿过细胞膜。此时,细胞内的活性氧(reactive oxygen species,ROS)可使无荧光性的DCFH氧化生成具有荧光性的二氯荧光素(dichloro-fluorescein,DCF),因此胞内DCF的荧光值可反映胞内ROS含量水平。孵育后用磷酸盐缓冲液(phosphate buffered saline,PBS)清洗3 次,加入无酚红PRMI 1640培养基,于荧光酶标仪测定荧光值(激发波长485 nm,发射波长530 nm)。
1.3.5 线粒体膜电位测定
将SH-SY5Y-APP695细胞以5×105个/孔接种于6 孔板中,药物处理24 h后吸除培养液加入1 mL无血清培养基和1 mL JC-1染色工作液,充分混匀,于细胞培养箱中37 ℃孵育20 min。孵育结束后,吸除上清,用JC-1染色缓冲液洗涤2 次,加入2 mL无血清培养液,于荧光酶标仪测定荧光值(单体激发/发射波长:490/530;聚集体激发/发射波长:525/590)。
1.3.6 caspase-3、caspase-8、caspase-9活力测定
将SH-SY5Y-APP695细胞以5×105个/孔接种于6 孔板中,药物处理24 h后吸除培养液,用冰PBS清洗3 次,加入裂解液收集细胞,于冰上裂解30 min后4 ℃、20 000×g离心13 min。将上清转移至预冷EP管中,而后按照caspase-3、caspase-8、caspase-9活力测定试剂盒测定其酶活力。
1.3.7 蛋白免疫印迹(Western blot)分析
将SH-SY5Y-APP695细胞以5×105个/孔接种于6 孔板中,药物处理24 h后收集细胞,每孔加入150 μL含有磷酸酶抑制剂和蛋白酶抑制剂的RIPA裂解液,将细胞收集至1.5 mL离心管中,冰上裂解30 min;12 000 r/min离心10 min;收集上清液,一部分用BCA法测蛋白浓度,另一部分按V(5×十二烷基硫酸钠(sodium dodecyl sulfate,SDS)上样缓冲液):V(样品)=1∶4混合处理,100 ℃煮10 min后置于冰上。经过SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gel electropheresis,PAGE)分离不同分子质量的蛋白,电转膜至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,用含5%脱脂奶粉的TBST封闭1 h,4 ℃ 条件下一抗过夜;TBST清洗3 次,常温条件下二抗孵育2 h,TBST清洗3 次后,用增强型化学发光液(enhanced chemiluminescence,ECL)测定蛋白质条带光密度,并用软件Quantity One分析条带灰度值。
1.4 数据处理
2 结果与分析
2.1 姜黄素对铜离子诱导的细胞形态的影响
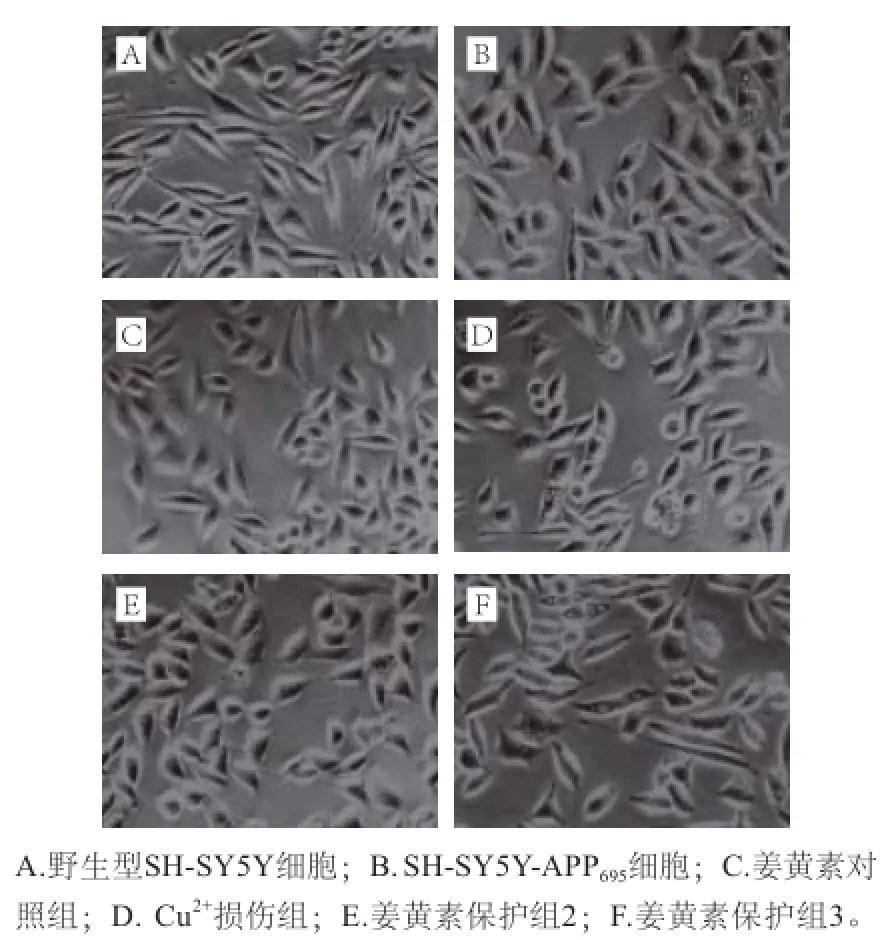
图1 不同处理条件下细胞形态观察(×4400)Fig.1 Images of cell morphology (×40)
与野生型细胞(图1A)相比,转APP基因SH-SY5YAPP695细胞(图1B)突起变短,胞体增大,有的细胞胞体出现空泡。在10 μmol/L姜黄素孵育下,SH-SY5Y-APP695细胞突起延展较好,胞体较完好,表明姜黄素没有明显的细胞损伤作用(图1C)。经50 μmol/L CuCl2处理24 h后,较多细胞胞体皱缩,突起收缩(图1D)。首先由姜黄素预保护4 h、再经CuCl2处理24 h后,细胞胞体较为完整,突起延展较为充分(图1E、F),表明姜黄素在一定程度上减轻了Cu2+诱导的细胞损伤作用。
2.2 姜黄素对Cu2+诱导的SH-SY5Y-APP695细胞膜损伤的影响
SH-SY5Y-APP695细胞经50 μmol/L Cu2+处理后,培养液中LDH活力与对照组相比显著上升(P<0.05),表明Cu2+可造成细胞膜损伤,进而导致胞浆LDH释放到胞外;与Cu2+损伤组相比。姜黄素保护组1、2、3(1、5、10 μmol/L姜黄素)LDH活力显著降低(P<0.05),这表明姜黄素对SH-SY5Y-APP695细胞预保护后,可减轻Cu2+对细胞膜的损伤程度(图2)。
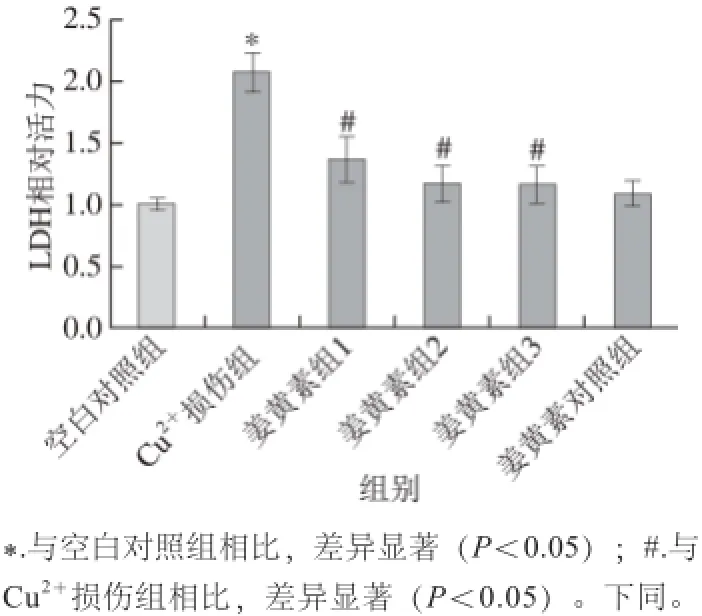
图2 细胞培养液中的LDH活性(n=6)6Fig.2 LDH activity in culture medium (n = 6)
2.3 姜黄素对Cu2+诱导的SH-SY5Y-APP695细胞存活力的影响
与空白对照组相比,SH-SY5Y-APP695细胞经Cu2+处理后(Cu2+损伤组),细胞存活力随Cu2+浓度升高而显著下降(P<0.05)(图3A)。与Cu2+损伤组相比,5 μmol/L和10 μmol/L姜黄素保护组细胞存活力显著升高(P<0.05)(图3B)。可见,姜黄素在一定浓度条件下能够提升Cu2+诱导的SH-SY5Y-APP695细胞存活力。
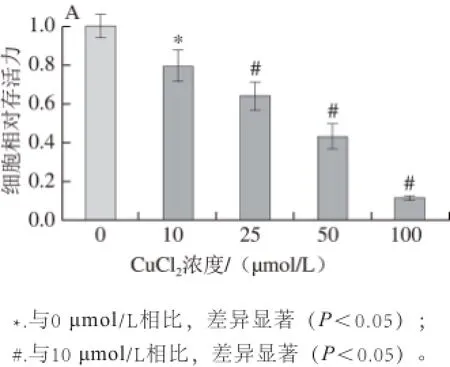

图3 细胞相对存活力(n=66)Fig.3 Relative cell viability (n = 6)
2.4 姜黄素对Cu2+诱导的SH-SY5Y-APP695细胞内ROS水平的影响
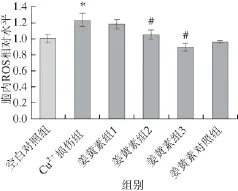
图4 胞内ROS相对水平(n=66)Fig.4 Relative intracellular ROS (n = 6)
与空白对照组相比,50 μmol/L Cu2+损伤组细胞内ROS水平显著升高(P<0.05),而5 μmol/L和10 μmol/ L姜黄素保护组与Cu2+损伤组相比胞内ROS则显著下降(P<0.05),说明姜黄素可在一定程度上起到抑制Cu2+诱导胞内ROS水平升高的作用(图4)。细胞内ROS主要来源于电子传递链,还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶、黄嘌呤氧化酶以及一氧化氮合酶等。
2.5 姜黄素对Cu2+诱导的线粒体膜电位去极化作用的影响
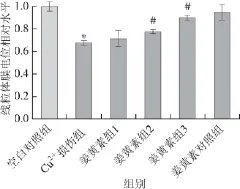
图5 细胞线粒体相对膜电位(n=66)Fig.5 Relative mitochondrial membrane potential (n = 6)
由图5可知,与空白对照组相比,Cu2+损伤组细胞线粒体膜电位显著下降(P<0.05);随着姜黄素浓度升高,线粒体膜电位呈上升趋势,其中5 μmol/L和10 μmol/L姜黄素保护组相比于Cu2+损伤组线粒体膜电位显著升高(P<0.05),说明姜黄素在一定浓度范围内起到抑制Cu2+诱导的SH-SY5Y-APP695细胞线粒体膜电位的去极化作用。
2.6 姜黄素对Cu2+诱导的SH-SY5Y-APP695细胞caspases活性的影响
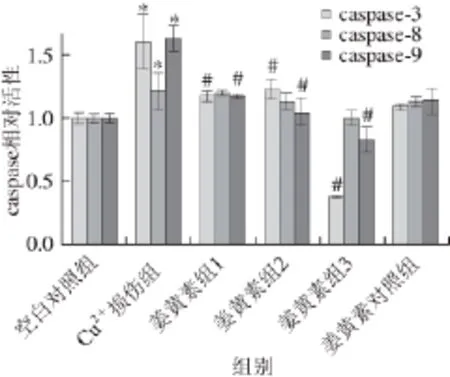
图6 caspases相对活性(n=66)Fig.6 Relative activity of caspase enzymes (n = 6)
线粒体膜电位下降与细胞凋亡的发生关系密切,线粒体损伤导致细胞色素c等促凋亡因子的释放,进而激活caspase级联效应,最终引发细胞凋亡[20]。本研究进一步分析了凋亡相关caspases活性。如图6所示,与空白对照组相比,Cu2+损伤组中caspase-3和caspase-9活力上升显著(约为空白对照组的1.6 倍)(P<0.05)、caspase-8活力也有一定的升高(约为空白对照组的1.2 倍)(P<0.05)。与Cu2+损伤组相比,姜黄素保护组中caspase-3和caspase-9活力均显著降低(P<0.05)、caspase-8活力呈现降低的趋势;姜黄素保护组中,与caspase-8活力相比,caspase-9活力抑制更为明显。涉及caspase-9的内源性线粒体途径凋亡和涉及caspase-8的胞表面受体或死亡受体等激活的外源性凋亡是重要的细胞凋亡途径。本实验结果说明,姜黄素主要通过抑制线粒体损伤途径抑制Cu2+诱导的细胞凋亡。
2.7 姜黄素对Cu2+诱导的Nrf2-ARE通路激活作用的影响
核转录因子NF-E2相关因子2(NF-E2-related factor 2,Nrf2)是机体内细胞氧化应激反应的关键因子,受到胞质接头蛋白(kelch-like ECH-associated protein 1,Keap1)调控,与抗氧化反应元件(antioxidant response element,ARE)相互作用,进而调节抗氧化酶系和Ⅱ相解毒酶的表达。Nrf2与Keap1的双甘氨酸重复区 (double glycine repeat,DGR)结合,以复合物形式存在于细胞浆[21];当细胞受到氧化应激或化学药物刺激时,胞内产生的亲电子化合物等与Keap1的半胱氨酸残基作用,或在刺激状态下Nrf2或Keap1发生磷酸化修饰,导致Nrf2与Keap1解离,随后Nrf2进入细胞核内并与ARE结合,启动抗氧化相关酶系基因的表达[22-23]。最近研究发现,患有轻度认知障碍患者脑中的外周血单核细胞内,其Nrf2磷酸化水平升高,且大脑皮层细胞核中Nrf2含量增加[24]。Joshi等[25]发现APP/PS1转基因大鼠敲除Nrf2的基因后,胞内APP水平、Aβ42和Aβ40生成量均有所增加,这些说明细胞内源性Nrf2-ARE抗氧化信号通路可能是AD治疗的靶点。本研究进一步探讨了Cu2+对SH-SY5Y-APP695细胞中Nrf2-ARE信号通路的影响及姜黄素的抑制作用。
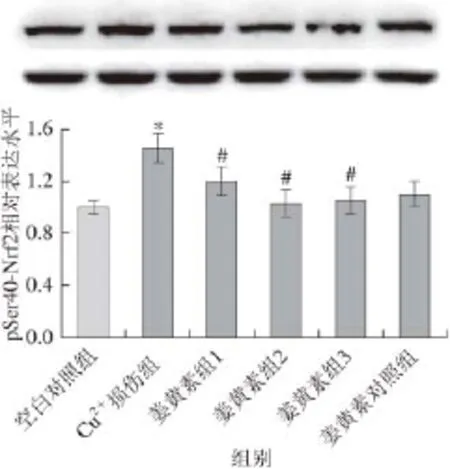
图7 pSer40-Nrf2相对表达水平Fig.7 Relative expression level of pSer40-Nrf2
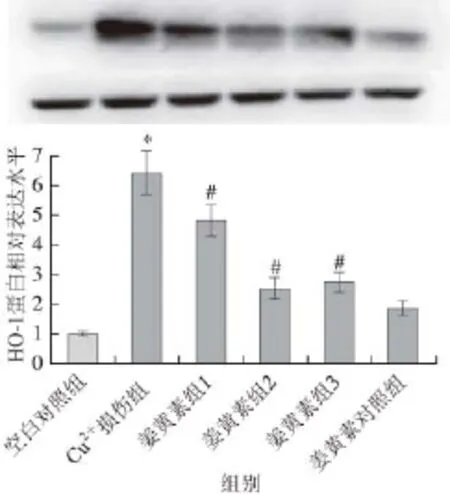
图8 HO-1蛋白相对表达水平Fig.8 Relative expression level of HO-1
由图7、8可知,与空白对照组相比,50 μmol/L Cu2+损伤组显著增强了pSer40-Nrf表达水平以及HO-1蛋白表达水平(P<0.05),这说明Cu2+激活了Nrf2,Nrf2进入细胞核并启动下游抗氧化酶HO-1等的表达。与Cu2+损伤组相比,姜黄素保护组显著降低pSer40-Nrf2表达水平以及HO-1蛋白表达水平(P<0.05),说明姜黄素抑制了细胞对Cu2+氧化应激反应,这可能与姜黄素本身具有较强的自由基清除能力有关。
3 结 论
AD患者脑脊液Cu2+水平明显高于正常成人,脑中Cu2+升高导致的氧化应激损伤可能是神经细胞凋亡的原因之一。本实验结果表明,Cu2+可在一定程度上引起SH-SY5Y-APP695细胞损伤,导致ROS水平升高、线粒体膜电位发生去极化,增强了caspase-9、caspase-3蛋白酶活性、诱发细胞凋亡。另外,Cu2+导致细胞自身抗氧化防御系统的激活以抵抗细胞应激水平。姜黄素能够减弱Cu2+诱导的氧化损伤和细胞凋亡作用,也在一定程度上减弱了Nrf2/ARE通路的激活作用,即在姜黄素的保护作用下,细胞在一定程度上不必加强过多的Nrf2/ARE防护系统来抵御氧化损伤。
[1] TIRABOSCHI P, HANSEN L A, THAL L J, et al. The importance of neuritic plaques and tangles to the development and evolution of AD[J]. Neurology, 2004, 62(11): 1984-1989. DOI:10.1212/01. WNL.0000129697.01779.0A.
[2] KRSTIC D, KNUESEL I. Deciphering the mechanism underlying lateonset Alzheimer disease[J]. Nature Reviews Neurology, 2013, 9(1):25-34. DOI:10.1038/nrneurol.2012.236.
[3] HEAD E, POWELL D, GOLD B T, et al. Alzheimer’s disease in Down syndrome[J]. Europe Journal of Neurodegenerative Disease, 2012, 1(3): 353-364.
[4] MENENDEZ-GONZALEZ M, PEREZ-PINERA P, MARTINEZRIVERA M, et al. APP processing and the APP-KPI domain involvement in the amyloid cascade[J]. Neurodegenerative Disease, 2005, 2(6): 277-283. DOI:10.1159/000092315.
[5] MOUTON-LIGER F, PAQUET C, DUMURGIER J, et al. Oxidative stress increases BACE1 protein levels through activation of the PKR-eIF2alpha pathway[J]. Biochimica et Biophysica Acta, 2012, 1822(6):885-896. DOI:10.1016/j.bbadis.2012.01.009.
[6] HUANG H C, ZHENG B W, GUO Y, et al. Antioxidative and neuroprotective effects of curcumin in an Alzheimer’s disease rat model co-treated with intracerebroventricular streptozotocin and subcutaneous D-galactose[J]. Journal of Alzheimers Disease, 2016, 52(3): 899-911.
[7] 朱志兀, 姚琳. 铜离子稳态平衡分子机理研究进展[J]. 生命科学, 2012, 24(8): 847-856. DOI:10.13376/j.cbls/2012.08.022.
[8] SQUITTI R, VENTRIGLIA M, BARBATI G, et al. ‘Free’ copper in serum of Alzheimer’s disease patients correlates with markers of liver function[J]. Journal of Neural Transmission, 2007, 114(12): 1589-1594. DOI:10.1007/s00702-007-0777-6.
[9] LOVELL M, ROBERTSON J, TEESDALE W, et al. Copper, iron and zinc in Alzheimer’s disease senile plaques[J]. Journal of the Neurological Sciences, 1998, 158(1): 47-52. DOI:S0022-510X(98)00092-6.
[10] SQUITTI R, BARBATI G, ROSSI L, et al. Excess of nonceruloplasmin serum copper in AD correlates with MMSE, CSF β-amyloid, and h-tau[J]. Neurology, 2006, 67(1): 76-82. DOI:10.1212/01. wnl.0000223343.82809.cf.
[11] SQUITTI R. Copper subtype of Alzheimer’s disease (AD): metaanalyses, genetic studies and predictive value of non-ceruloplasmim copper in mild cognitive impairment conversion to full AD[J]. Journal of Trace Elements in Medicine and Biology, 2014, 28(4): 482-485. DOI:10.1016/j.jtemb.2014.06.018.
[12] 徐魏, 黄汉昌, 姜招峰. Aβ-Cu(Ⅱ)神经毒性及Cu(Ⅱ)螯合剂的缓解机制[J]. 生命的化学, 2009, 29(4): 485-489. DOI:10.13488/ j.smhx.2009.04.030.
[13] LEE W H, LOO C Y, BEBAWY M, et al. Curcumin and its derivatives:their application in neuropharmacology and neuroscience in the 21st Century[J]. Current Neuropharmacology, 2013, 11(4): 338-378. DOI:10.2174/1570159X11311040002.
[14] UĞUZ A C, ÖZ A, NAZIROĞLU M. Curcumin inhibits apoptosis by regulating intracellular calcium release, reactive oxygen species and mitochondrial depolarization levels in SH-SY5Y neuronal cells[J]. Journal of Receptors and Signal Transduction Research, 2015, 25: 1-7. DOI:10.3109/10799893.2015.1108337.
[15] 张盼, 俞彬, 刘莎, 等. 姜黄素对老年鼠脑内氧化性平衡和星形胶质细胞的影响[J]. 华东师范大学学报(自然科学版), 2015(6): 108-116. DOI:10.3969/j.issn.1000-5641.2015.06.014.
[16] YANG F, LIM G P, BEGUM A N, et al. Curcumin inhibits formation of amyloid beta oligomers and fibrils, binds plaques, and reduces amyloid in vivo[J]. Journal of Biological Chemistry, 2005, 280(7):5892-5901. DOI:10.1074/jbc.M404751200.
[17] WANG Y L, YIN H L, WANG L, et al. Curcumin as a potential treatment for Alzheimer’s disease: a study of the effects of curcumin on hippocampal expression of glial fibrillary acidic protein[J]. The American Journal of Chinese Medicine, 2013, 41(1): 59-70. DOI:10.1142/S0192415X13500055.
[18] HUANG H C, LIN C J, LIU W J, et al. Dual effects of curcumin on neuronal oxidative stress in the presence of Cu(Ⅱ)[J]. Food and Chemical Toxicology, 2011, 49(7): 1578-1583. DOI:10.1016/ j.fct.2011.04.004.
[19] 黄汉昌, 路书彦, 常平, 等. Nrf2-ARE信号通路参与姜黄素对Aβ诱导细胞氧化损伤和凋亡的抑制作用研究[J]. 现代食品科技, 2015, 31(6): 1-5. DOI:10.13982/j.mfst.1673-9078.2015.6.001.
[20] GREEN D R, KROEMER G. The pathophysiology of mitochondrial cell death[J]. Science, 2004, 305: 626-629. DOI:10.1126/ science.1099320.
[21] ITOH K, MIMURA J, YAMAMOTO M. Discovery of the negative regulator of Nrf2, Keap1: a historical overview[J]. Antioxidants and Redox Signaling, 2010, 13(6): 1665-1678. DOI:10.1089/ ars.2010.3222.
[22] LI Y, PAONESSA J D, ZHANG Y. Mechanism of chemical activation of Nrf2[J]. PLoS ONE, 2012, 7(4): e35122. DOI:10.1371/journal. pone.0035122.
[23] SATOH T, MCKERCHER S R, Lipton S A. Nrf2/ARE-mediated antioxidant actions of pro-electrophilic drugs[J]. Free Radical Biology and Medicine, 2014, 66: 45-57. DOI:10.1016/ j.freeradbiomed.2013.11.002.
[24] MOTA S I, COSTA R O, Ferreira I L, et al. Oxidative stress involving changes in Nrf2 and ER stress in early stages of Alzheimer’s disease[J]. Biochimica et Biophysica Acta, 2015, 1852(7): 1428-1441. DOI:10.1016/j.bbadis.2015.03.015.
[25] JOSHI G, GAN K A, JOHNSON D A, et al. Increased Alzheimer’s disease-like pathology in the APP/PS1ΔE9 mouse model lacking Nrf2 through modulation of autophagy[J]. Neurobiology Aging, 2015, 36(2): 664-679. DOI:10.1016/j.neurobiolaging.2014.09.004.
Inhibitory Effects of Curcumin on Cu2+-Induced Oxidative Damage and Cell Apoptosis in Transgentic APP695SH-SY5Y Cells
ZHENG Bowen, JIANG Zhaofeng, HUANG Hanchang⋆
(Beijing Key Laboratory of Bioactive Substances and Functional Foods, Beijing Union University, Beijing 100191, China)
Objective: This study was focused on the protective effect of curcumin on cellular oxidative damage and cell apoptosis induced by Cu2+in human neuroblastoma SH-SY5Y cells transfected by human amyloid-β precursor protein (APP) (SH-SY5Y-APP695). Methods: SH-SY5Y-APP695cells were treated with 50 μmol/L Cu2+at 37 ℃ for 24 h with or without curcumin pre-protection. Cell viability was detected by cell counting kit-8 (CCK-8). Extracellular lactate dehydrogenase (LDH), intracellular reactive oxygen species (ROS) and mitochondrial membrane potential were determined by commercial assay kits. The enzymatic activities of caspase-3, caspase-8 and caspase-9 were assessed. Phosphorylation levels of NF-E2-related factor 2 (Nrf2) at Ser-40 (pSer40-Nrf2) and HO-1 were detected by Western blot analysis. Results: Compared with the control group, Cu2+administration led to decreased cell viability and mitochondrial membrane potential, increased levels of LDH, intracellular ROS and caspase-3, caspase-8 and caspase-9 activities, and elevated levels of pSer40-Nrf2 and HO-1. Conversely, curcumin increased cell viability and mitochondrial membrane potential, decreased the levels of LDH and intracellular ROS, significantly mitigated caspase-9 and caspase-3 activities, and reduced the expression levels pSer40-Nrf2 and HO-1. Conclusion: Curcumin can attenuate Cu2+-induced cellular oxidative damage and cell apoptosis.
Alzheimer’s disease; Cu2+; oxidative damage; cell apoptosis; curcumin; Nrf2-antioxidant response element pathway
10.7506/spkx1002-6630-201703027
Q26
A
1002-6630(2017)03-0164-06
2016-03-18
国家自然科学基金面上项目(31471587);北京市属高等学校高层次人才引进与培养计划项目(CIT&TCD201504034)作者简介:郑博闻(1990—),男,硕士研究生,研究方向为食品生物活性物质功能评价。E-mail:tz19901111@163.com
⋆通信作者:黄汉昌(1975—),男,副教授,博士,研究方向为食品神经分子营养学。E-mail:hanchang@buu.edu.cn
郑博闻, 姜招峰, 黄汉昌. 姜黄素抑制Cu2+诱导的转APP695基因SH-SY5Y细胞氧化损伤和凋亡作用[J]. 食品科学, 2017, 38(3): 164-169. DOI:10.7506/spkx1002-6630-201703027. http://www.spkx.net.cn
ZHENG Bowen, JIANG Zhaofeng, HUANG Hanchang. Inhibitory effects of curcumin on Cu2+-induced oxidative damage and cell apoptosis in transgentic APP695SH-SY5Y cells[J]. Food Science, 2017, 38(3): 164-169. (in Chinese with English abstract)
10.7506/spkx1002-6630-201703027. http://www.spkx.net.cn

