AB-8型大孔树脂纯化桦褐孔菌三萜的工艺研究
刘晓庆 李广林 瞿 亮 王星丽 孙培龙 张安强*
AB-8型大孔树脂纯化桦褐孔菌三萜的工艺研究
刘晓庆1李广林1瞿 亮2王星丽2孙培龙1张安强1*
(1. 浙江工业大学食品科学技术系,浙江杭州 310014;2. 杭州百山祖生物科技有限公司,浙江杭州310026)
为得到纯度较高的桦褐孔菌三萜类物质,采用大孔树脂分离纯化桦褐孔菌三萜粗提物,并研究其最佳工艺。先通过静态吸附-解吸实验,确定AB-8型大孔树脂对桦褐孔菌三萜具有最佳吸附效果,吸附量为18.81 mg/g,吸附率为89.02 %,解吸率达到82.51 %。再通过AB-8型大孔树脂的动态吸附与解吸实验得到桦褐孔菌三萜最佳分离纯化条件为上样样品浓度1.5 mg/mL,上样体积1.5 BV,上样流速1.5 mL/min,上样pH为溶液本身pH值,洗脱液为95%乙醇、体积5 BV,在此条件下,桦褐孔菌三萜纯度可达69.96%。
桦褐孔菌;大孔树脂;三萜;分离纯化
桦褐孔菌()又名白桦茸,属担子菌亚门,层菌纲,非褶菌目,多孔菌科,褐卧孔菌属[1],主要分布于中国黑龙江、吉林长白山和日本北海道、俄罗斯北部及北欧等地[2]。近年来,国内外研究人员发现,桦褐孔菌含有三萜类化合物、木质素、黑色素、叶酸衍生物[3]及多糖[4]等活性物质,其中,三萜类物质具有抗肿瘤、抗突变、抗炎等功能[5],而目前研究多集中在桦褐孔菌的多糖上,对其三萜类物质的研究则较少。
大孔吸附树脂是近年来发展起来的一种具有多孔立体结构、人工合成的有机高分子聚合物,因其特殊的理化性质和吸附性能,已经广泛用于化学、医药、食品等领域[6]。周桃英等利用AB-8型大孔树脂分离纯化了荷叶总黄酮[7],孟宪军等用大孔树脂纯化北五味子藤茎中的三萜类物质[8],钱竹等用大孔树脂成功分离提取了发酵液中的灵芝三萜类物质[9]。笔者在前人的研究基础上,选用大孔吸附树脂吸附法对桦褐孔菌三萜类化合物的吸附量、解吸率及影响因素进行了研究,以期探索桦褐孔菌三萜类化合物分离纯化的最佳工艺条件。
1 材料、试剂与仪器设备
1.1 材料与试剂
桦褐孔菌子实体由杭州百山祖生物科技有限公司提供,浙江省农业科学院蔡为明研究员鉴定。AB-8、D101型大孔吸附树脂购自上海摩速科学器材有限公司,白桦脂酸对照品购自美国Sigma公司,高氯酸、次氯酸、香草醛、甲醇等其他化学试剂均为国产分析纯。
1.2 仪器设备
实验仪器有AL-104电子天平(METTLER TOLEDO有限公司),FS-1200 型超声波细胞破碎器(上海生析仪器公司),SENCO旋转蒸发仪(上海申生科技有限公司),V-1800PC 型可见分光光度计(上海美谱达仪器公司),高速冷冻离心机(日本日立仪器公司),ALPHA2-4LD真空冷冻干燥机(德国Christ公司)。
2 方 法
2.1 桦褐孔菌三萜类化合物的提取
桦褐孔菌子实体干燥粉粹后过40目筛,用60%的乙醇超声辅助提取1 h,取出离心过滤、减压浓缩,浓缩物冷冻干燥后得三萜粗提物。
2.2 大孔吸附树脂的选择
大孔吸附树脂预处理:用95%乙醇密封浸泡树脂,去除漂浮物,反复用乙醇浸泡直至浸泡液无白色浑浊,再用纯净水洗至无醇味。最后进行酸碱处理:先用5%的HCl溶液浸泡3 h,接着用纯净水洗至中性,随后再用5%的NaOH溶液浸泡3 h,用纯净水洗至中性,反复3次,完成预处理[8]。
大孔树脂的筛选:采用静态吸附-解吸实验,准确称取经预处理后的AB-8和D101两种大孔树脂各5.00 g于具塞磨口三角瓶中,分别加入30 mL已测定质量浓度的桦褐孔菌三萜样品液,置于摇床中,在室温下以100 r/min振荡12 h,充分吸附后过滤,测定滤液中三萜的浓度[11]。按式(1)、式(2)计算两种树脂对三萜的吸附容量和吸附率。
将吸附饱和的树脂放入具塞磨口三角瓶中,加入30 mL无水乙醇,置于摇床中,在室温下以100 r/min转速振荡12 h进行解吸,过滤,测定滤液中三萜的浓度[12],按式(3)计算两种树脂对三萜的解吸率。
式中,为吸附容量,mg/g;0为初始三萜浓度,mg/mL;1为吸附滤液中三萜浓度,mg/mL;1为溶液体积,mL;为大孔吸附树脂的质量,g;1为吸附率,%。2为解吸率,%;2为洗脱滤液中三萜浓度,mg/mL;2为洗脱溶液体积,mL。
2.3 AB-8大孔吸附树脂静态吸附-解吸
(1)AB-8大孔吸附树脂静态吸附-解吸动力学曲线。称取AB-8大孔树脂5 g置于具塞磨口三角瓶中,加入30 mL桦褐孔菌三萜溶液,置于摇床 中,在室温下以100 r/min振荡,每1 h定时取样,测定吸光值并计算溶液中三萜的含量,绘制静态吸附动力学曲线。将已吸附饱和的树脂放入具塞磨口三角瓶中,加无水乙醇30 mL,置于摇床中,在室温下以100 r/min振荡,每1 h取样计算溶液中三萜的含量,绘制静态解吸动力学曲线。
(2)AB-8大孔树脂动态吸附与解吸的具体操作步骤:
(a)上样浓度的选择。配制浓度为0.1、0.5、1.0、1.5、2.0、2.5 mg/mL的桦褐孔菌三萜粗提物溶液,上样量0.75 BV(柱体积),上样流速1.0 mL/min,收集流出液,测定其三萜浓度,确定最佳上样浓度。
(b)上样量的选择。上样浓度为1.5 mg/mL,上样量分别为0.5、1.0、1.5、2.0、2.5、3.0 BV,上样流速1.0 mL/min,收集流出液,测定其三萜含量,确定最佳上样量。
(c)上样流速的选择。上样浓度为1.5 mg/mL,上样量1.5 BV,选择不同流速0.25、0.5、1.0、1.5、2.0、2.5 mL/min进行上样,收集流出液,测定其三萜含量,确定最佳上样流速。
(d)上样pH值的选择。用HCl溶液和NaOH溶液配成pH值为3.0、4.0、5.0、6.0、7.0、8.0、9.0的三萜溶液,上样浓度为1.5 mg/mL,上样量1.5 BV,上样流速1.5 mL/min,收集流出液,测定其三萜含量,确定最佳上样pH值。
(e)洗脱液浓度的选择。上样浓度为1.5 mg/mL,上样量1.5 BV,上样流速1.5 mL/min,分别用不同乙醇含量(30%、40%、50%、60%、75%、95%)的溶液进行洗脱,洗脱体积为10 BV,收集各组分的洗脱液,浓缩后测定其三萜含量。
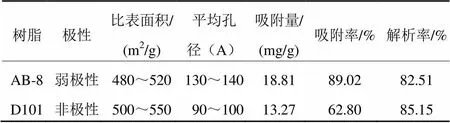
表1 大孔吸附树脂的结构性能参数及静态吸附-解吸结果
(f)洗脱液用量的选择。上样浓度为1.5 mg/mL,上样量1.5 BV,上样流速1.5 mL/min,先用60%乙醇洗脱,最后用95%乙醇洗脱,洗脱流速为1.5 mL/min,每10 mL收集一管,以吸光值为纵坐标,管数为横坐标绘制洗脱曲线。
2.4 桦褐孔菌三萜类化合物纯度的测定
(1)三萜类化合物标准曲线的绘制。参考蔡亚玲等的实验方法[10],略有修改。称取干燥至恒重的白桦脂酸标准品5.0 mg,用甲醇溶解,并在25 mL容量瓶中定容,得到200 μg/mL溶液标准液。量取0.10、0.20、0.30、0.40、0.50、0.60、0.70、0.80 mL标准品甲醇溶液,分别加入具塞试管中,水浴蒸干溶剂,向各管加入0.4 mL冰醋酸-香草醛溶液和1.5 mL高氯酸,70 ℃水浴15 min后,加入5 mL无水乙醇,充分振荡后在554 nm处测OD值。以白桦脂酸的含量为横坐标,吸光值为纵坐标,绘制标准曲线。由标准曲线获得回归方程:=0.0054 4-0.0247 9,2=0.999 7。式中:为吸光值;为白桦脂酸含量,μg/mL。
(2)桦褐孔菌三萜类化合物的测定。对提取过程中和最优条件下桦褐孔菌三萜类化合物的纯度进行测定,依据三萜类化合物的标准曲线,计算其纯度。
3 结果与分析
3.1 大孔树脂静态吸附及解吸性能比较与筛选
本研究选取AB-8型和D101型大孔吸附树脂,在相同的实验条件下,进行静态吸附-解吸试验,筛选出最佳树脂。结果表明:AB-8大孔树脂的吸附率为89.02%,明显高于D101大孔树脂(表1)。樊君等报道大孔吸附树脂的吸附作用主要是通过物理吸附来实现的,其吸附量大小与树脂的结构性能及被吸附物质的物理化学性质有着重要的关系。桦褐孔菌三萜的极性与AB-8大孔树脂极性比较相近,具有特异性吸附[13]。AB-8大孔树脂平均孔径较大,促进了其对桦褐孔菌三萜类 物质的吸收。D101大孔树脂的解吸率为85.15%,虽略高于AB-8大孔树脂的解析率82.51%,但考虑到实际生产过程的工作效率,最终选取AB-8大孔树脂纯化桦褐孔菌三萜类化合物。
3.2 AB-8大孔吸附树脂静态吸附-解吸动力学 曲线
图1表明,大孔树脂在前2 h三萜的吸附速率较快,2 h后逐渐减缓,到4 h,吸附基本达到平衡。考虑到实际生产情况吸附时间可选择4 h。
图2表明,0~2 h内,解吸液中的三萜类化合物浓度迅速升高,2 h后,升高缓慢且渐趋于稳定。说明此时桦褐孔菌三萜已达解吸平衡。在实际生产中,解吸时间可选择2 h。
3.3 AB-8大孔树脂动态吸附与解吸
(1)上样浓度。理论上,上样液浓度越高,质量浓度差就较大,吸附率也应越高。而实际上若上样液浓度太高,黏度随之增大,反会阻碍目标物扩散,导致吸收率降低[14]。当流出液浓度为上样液浓度的10%时便会出现泄漏。由图3可知,在浓度为1.5 mg/mL时,流出液浓度为上样液浓度的9.1%;而浓度为2.0 mg/mL时,流出液浓度为上样液浓度的12.7%,超过10%。可见选择上样浓度以1.5 mg/mL较为合适。
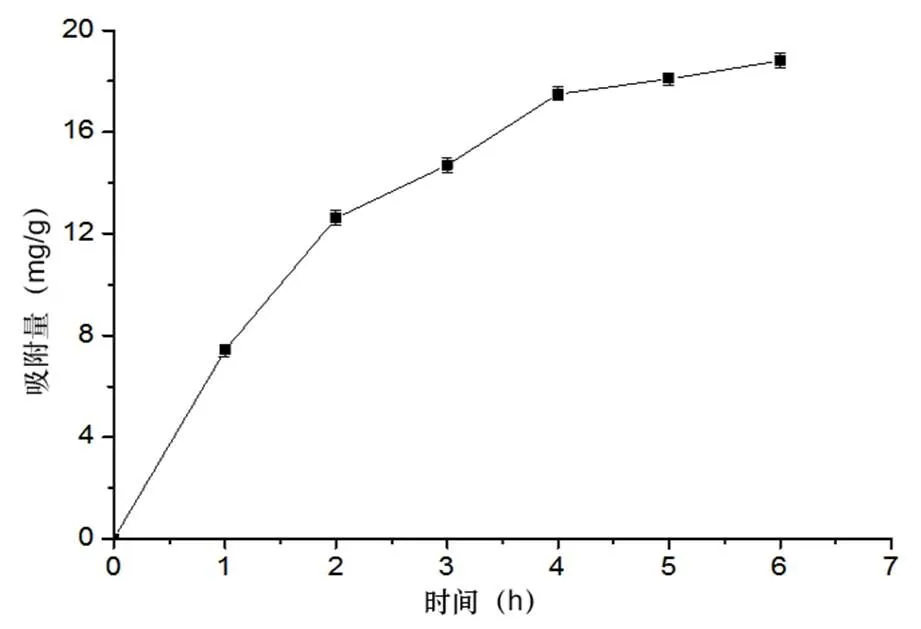
图1 桦褐孔菌三萜静态吸附动力学曲线
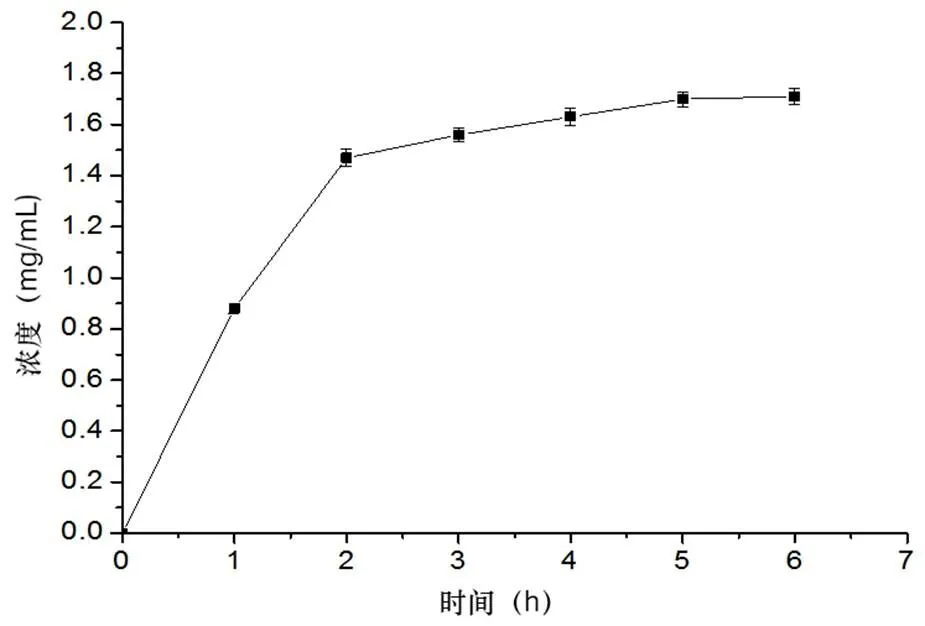
图2 桦褐孔菌三萜静态解吸动力学曲线

图3 浓度对吸附量的影响

图4 上样量对吸附量的影响
(2)上样量。从图4可以看出,上样量愈大,流出液中的三萜化合物含量也愈多。而实际上当上样量小于1.5 BV时,流出液中三萜浓度较小,此时AB-8大孔吸附树脂吸附效果较好;而当上样液体积达到2 BV时,流出液中的三萜浓度为0.26 mg/mL,明显超过了上样液三萜浓度的10%。此后随着上样液体积的增加,三萜泄漏愈来愈多,表明上样体积为1.5 BV时,大孔吸附树脂已经达到吸附平衡。可见选择1.5倍柱体积为最佳上样液体积。
(3)上样流速。如图5所示,随着流速增加,吸附量减小,泄漏的三萜也随之增加。原因是流速较大时阻碍了溶质向大孔树脂表面扩散,不利于互相吸附,从而降低了吸附率;反之,流速越慢,总三萜在树脂中停留的时间越久,越利于两者的相互吸附;但如果流速过小,则会使吸附过程周期过长,降低生产效率[15]。因此,从要有较高的吸附率和缩短工作周期两个方面综合评价,桦褐孔菌三萜溶液的最佳上样流速应为1.5 mL/min。

图5 上样流速对吸附量的影响
(4)上样pH值的选择。pH值对树脂吸附效果的影响主要取决于被吸附物质的酸碱性,酸性物质在酸性溶剂中较易吸附,碱性物质在碱性溶剂中较易吸附[16]。如图6所示,大孔树脂的吸附量在pH 8时为最大。不过不同pH环境,其吸附量相差不多,说明溶液的pH值对AB-8型大孔吸附树脂吸附桦褐孔菌三萜能力影响不大。为方便实际操作,可选择溶液本身的pH进行实验。

图6 上样pH值对吸附量的影响
(5)洗脱液浓度的选择。洗脱液中三萜纯度随洗脱液乙醇浓度的增大而加大(表2)。在乙醇浓度小于60%时,洗脱液经浓缩冻干后呈褐色,杂质较多,而95%的乙醇洗脱液洗脱出来的三萜固形物为淡黄色,且三萜含量较高。因此可先用浓度为60%乙醇进行洗脱,弃去非目标部分,然后用95%乙醇进行洗脱,收集目标部分。

表2 洗脱液乙醇浓度对洗脱效果的影响
(6)洗脱液用量的选择。由图7可知,洗脱峰较窄且集中,并无拖尾现象,在前25管,洗脱液基本不含三萜,三萜物质主要集中在25至40管。收集到40管时,所用的洗脱液为600 mL,约为5 BV。故确定其最佳洗脱液用量为5 BV。

图7 大孔树脂洗脱曲线
3.4 最优条件下富集的三萜纯度
在上样浓度1.5 mg/mL,上样体积1.5 BV,流速1.5 mL/min,上样溶液pH为溶液本身pH值条件下上样,然后先用60%乙醇洗脱去除杂质,收集95%乙醇洗脱下的溶液,浓缩冻干后,测得三萜纯度为69.96%。
4 结 论
AB-8大孔吸附树脂更适合用于桦褐孔菌三萜的纯化。确定AB-8大孔吸附树脂纯化桦褐孔 菌三萜的最优条件:上样样品浓度1.5 mg/mL,上样体积1.5 BV,上样流速1.5 mL/min,上样pH为溶液本身pH值,洗脱液为95%乙醇,体积5 BV。在此条件下,桦褐孔菌三萜纯度可达到69.96%。采用大孔树脂富集桦褐孔菌三萜不仅避免了使用有毒的有机溶剂,而且大孔吸附树脂可再生,重复利用率高、经济、安全、简单,可在工业生产中大规模使用,具有良好的应用前景。
[1] 赵芬琴, 朴惠善. 桦褐孔菌的研究进展[J]. 中国中医药信息杂志, 2005, 12(2): 96-98.
[2] 杜秀菊, 徐伟, 穆红梅, 等. 桦褐孔菌多糖的药理活性与化学结构研究进展[J]. 食用菌学报, 2012, 19(1): 100-104.
[3] 刘迎秋, 包海鹰. 桦褐孔菌化学成分及药理作用[J]. 中国食用菌, 2008, 27(4): 34-39.
[4] 许泓瑜, 孙军恩, 陆震鸣, 等. 桦褐孔菌菌粉多糖提取工艺的优化[J]. 食品与发酵工业, 2008, 34(11): 175-177.
[5] 赵芬琴, 严琳, 崔仙红, 等. 桦褐孔菌三萜对CCl4致小鼠氧化应激损伤的保护作用[J]. 药学学报, 2012, 47 (5): 680−684.
[6] 楼嵩, 刘永峰, 白清清, 等. 大孔吸附树脂的吸附机理[J]. 化学进展2008, 24(8): 1427-1435.
[7] 周桃英, 罗登宏, 李国庆, 等. AB-8大孔树脂纯化荷叶总黄酮的工艺研究[J]. 中国食品添加剂, 2009(5): 113-118.
[8] 孟宪军, 朱力杰, 李斌, 等. 大孔树脂纯化北五味子藤茎中总三萜的研究[J]. 食品工业科技, 2012, 33(4): 339-342.
[9] 钱竹, 徐鹏, 章克昌, 等. 大孔树脂分离提取发酵液中灵芝三萜类物质[J]. 食品与生物技术学报, 2006, 25(6): 111-114.
[10] 蔡亚玲, 阮金兰, 苏群, 等. 紫背鼠尾草中总三萜酸的含量测定[J]. 中药材, 2008, 31(5): 692-693.
[11] 袁怀波, 凌庆枝, 马嫄, 等. 大孔树脂分离纯化山楂总三萜酸的研究[J]. 食品科学, 2008, 29(2): 155-157.
[12] 丁轲, 崔莹, 陆晶晶, 等. SP700大孔树脂纯化酸枣仁中三萜总皂苷的研究[J]. 离子交换与吸附, 2011, 27(1): 33- 42.
[13] 樊君, 高续春, 郭璞, 等. 大孔吸附树脂分离纯化枣渣中三萜酸的研究[J]. 离子交换与吸附, 2008, 24(5): 426-433.
[14] 尹忠平, 上官新晨, 张月红, 等. 大孔树脂吸附纯化青钱柳叶三萜化合物[J]. 食品科学, 2011, 32(6):61-65.
[15] 杨晓艳, 马骥, 彭飞, 等. 大孔树脂法分离纯化荚果蕨总三萜[J]. 食品工业科技, 2015, 36(2): 238-242.
[16] 李洋, 曹珊珊, 张媛, 等. 大孔树脂分离纯化褚果总黄酮优化工艺研究[J]. 离子交换与吸附, 2013, 29(4): 323-333.
Study on the purification of triterpenes with AB-8 macroporous resin from the fruiting body of
Liu Xiaoqing1Li Guanglin1Qu Liang2Wang Xingli2Sun Peilong1Zhang Anqiang1*
(1. Department of Food Science and Technology, Zhejiang University of Technology, Hangzhou 310014, China; 2. Hangzhou Baishanzu Biological Technology Co., Ltd, Hangzhou, 310026, China)
In order to obtain triterpenes with high purity from, macroporous resins were used to purify triterpenes and confirm optimum process parameters. According to the static adsorption and desorption experiments, AB-8 macroporous resin was more suitable for enriching triterpenes from, it’s adsorption capacity, adsorption rate and desorption rate were 18.81 mg/g, 89.02% and 82.51%, respectively. Besides, through the dynamic adsorption and desorption experiments, the optimum process parameters as followed: the sample concentration 1.5 mg/mL, the volume of sample 1.5 BV, flow rate 1.5 mL/min, sample solution pH at natural pH level, elution solution was 95% ethanol and eluent volume 5 BV. Under this condition, the purity of triterpenes fromreached 69.96%.
; macroporous resin; triterpenes; isolation and purification
S646
B
2095-0934(2017)01-040-06
国家十二五科技支撑项目“食用菌深加工产品开发与产业化”(2013BAD16B07)
刘晓庆(1992-),女,研究生
张安强,男,副教授,E-mail:zhanganqiang@zjut.edu.cn

