JAM—A在甲状腺乳头状癌诊断及临床预后中的应用价值
傅燕萍 范乘龙 孟丽


[摘要] 目的 观察连接黏附分子A(junctional adhesion molecule A,JAM-A)在人甲状腺乳头状癌和正常甲状腺组织中的表达情况,初步探讨其表达与临床病理特征之间的关系,进一步观察其表达与淋巴转移的关系。 方法 通过免疫组织化学染色法检测120例甲状腺乳头状癌组织和60例正常甲状腺组织中JAM-A蛋白的表达情况。结果 JAM-A在正常甲状腺组织、不伴有淋巴结转移的原发甲状腺癌组织、伴随有淋巴结转移的原发甲状腺癌组织中的阳性表达率逐渐降低。JAM-A在甲状腺乳头状癌组织和正常甲状腺组织间比较,差异有统计学意义(P<0.05);JAM-A在伴随有淋巴结转移的原发甲状腺癌组织和不伴有淋巴结转移的原发甲状腺乳头状癌组间比较,差异有统计学意义(P<0.05)。 结论 JAM-A的表达与甲状腺乳头状癌恶性程度密切相关,随着出现淋巴结的转移,其表达逐渐降低,与其呈负相关,因此JAM-A在甲状腺乳头状癌的治疗决策、预后评估中具有重要的应用价值。
[关键词] 甲状腺乳头状癌;连接黏附分子A;转移;预后
[中图分类号] R736.1 [文献标识码] A [文章编号] 1673-9701(2016)31-0005-05
目前甲状腺乳头状癌并颈部淋巴结转移是决定外科医生甲状腺癌手术方式的重要因素之一。而近来不同种细胞黏附分子在不同恶性肿瘤浸润、侵袭和转移中所扮演的角色不同,连接黏附分子(junction adhesion molecule,JAM)在细胞间的连接有极其重要的意义,国外研究表明JAM在体内外保持细胞内环境稳态、新生血管生成、肿瘤侵袭、远处转移及周边浸润等众多病理生理过程中均扮演着极其重要的角色[1]。然而目前JAM在原发性甲状腺乳头状癌中的表达及其重要临床预后意义仍未被阐述清楚,JAM表达是否与淋巴结转移或远处转移有关系仍然未知。本文主要目的是通过免疫组化检测法进一步阐明连接黏附分子A(junctional adhesion molecule A,JAM-A)在原发性甲状腺乳头状癌中的蛋白表达情况,并且进一步分析JAM-A表达与甲状腺乳头状癌是否伴有淋巴转移之间的联系。现报道如下。
1 资料与方法
1.1一般资料
通过回顾性收集绍兴市中心医院(中国医科大学绍兴医院)病理科2010年1月~2015年12月期间诊断的甲状腺病变组织180例,均为病理科存档标本,180例样本中包括120例甲状腺乳头状癌和60例正常甲状腺组织。本研究经过绍兴市中心医院伦理委员会集体讨论通过,获得患者的知情同意并且签署知情同意书。60例正常甲状腺组织的患者中,男30例,女30例,年龄<45岁30例,年龄≥45岁30例,JAM-A在不同年龄组与性别组间比较,差异无统计学意义(P>0.05)。120例甲状腺乳头状癌中,女92例,男28例;年龄18~76岁,中位年龄48岁;肿瘤直径0.1~5.0 cm,其中瘤体直径<3.0 cm者96例,瘤體直径≥3.0 cm者24例;24例肿瘤合并包膜浸润;40例同时伴有颈部或中央区淋巴结转移,另外80例乳头状癌患者无淋巴结转移;按照肿瘤国际临床疾病分期进行重新分类,肿瘤的TNM分期按照AJCC提出的标准进行确定。患者处于TNMⅠ期54例,TNMⅡ期26例,TNM Ⅲ期40例,JAM-A在不同年龄组、性别、肿瘤直径、是否包膜侵犯、癌灶数量、与临床分期比较,差异无统计学意义(P>0.05),具有可比性。
1.2 实验方法
采用免疫组织化学SP染色方法,进行染色标记JAM-A抗体。具体操作过程如下:(1)标本均经过石蜡切片、脱蜡和水化三重HE标本制作全部标准流程后,利用新配置的蒸馏水冲洗3次已经制备好的切片,每次冲洗玻片3 min;(2)使用3%过氧化氢阻断内源性过氧化物酶,室温下孵育8 min或水浴箱孵育3 min左右;(3)接着以上步骤用新配置的蒸馏水冲洗2次,每次大约5 min,然后放置在高温压力锅中进行组织抗原的修复,用新配置的PBS液体(pH 7.4)冲洗3遍,每次冲洗3 min;(4)在室温下在玻片上小心滴加4%羊血清封闭 30 min,尽量减少组织的非特异性染色;(5)载玻片上滴加一抗,室温孵育60 min;(6)然后用新配置的PBS缓冲液体冲洗3次,每次冲洗4 min,利用滴加二步的方法MaxvisionTM/HPR孵育15 min;(7)利用PBS缓冲液体冲洗载玻片3次,平均每次5 min。(8)轻轻甩去PBS液体,滴加新鲜配制的DAB显色液2~5 min左右,最后在光学显微镜下观察染色情况,抗体的阳性信号为棕黄色或棕褐色颗粒着色,着色定位在细胞胞质中。染色显色的时间为3 min左右,然后终止该反应,用自来水充分冲洗切片。进行苏木素复染后,用0.1%盐酸酒精分化,然后自来水冲洗5 min左右。通过不同梯度的酒精进行脱水,二甲苯液体进行透明,最后利用中性树胶进行封片。高年资病理医师阅片并判读确定染色的最终结果,然后讨论并分析JAM-A在不同组种的表达情况及其不同组间的相互关系。
1.3结果判定与分析
免疫组织化学染色标记的结果最后由本单位2位副主任医师和外单位病理科2位主任医师分别进行双盲阅片,按照给定的评分标准评分,最终统计4位医师的结果均一致者作为最后的统计结果。免疫组织化学评分标准主要有两种,分别按照阳性强度评分和阳性细胞占所有细胞的比例进行评分。JAM-A蛋白免疫组化染色定位在细胞胞质中着色,免疫组化结果判定按照Sun W等[3]文献中给出的评分方法:(1)根据细胞的染色强度评分:病变区域细胞无染色为 0分;呈淡黄色颗粒染色、明显高于切片组织背景着色评分为 1分;病变组织呈浅棕黄色颗粒时将其结果评分为2分;病变组织中存在大量深棕黄色颗粒时将其免疫组化结果评分为3分;(2)按照阳性细胞数的计数评分:将每张制作的切片不同观察者间随机观察至少10个左右的高倍视野(10个/HPF),计数染色细胞数的阳性百分比例,1%~24%评分为1分;25%~49%评分为2分;50%~75%评分为3分;>75%评分为4分。(3)结合以上两个步骤后,将染色强度评分与阳性细胞数比例的评分取其之和,如果总评分相加评分<2分为阴性(-),评分2~3分为弱阳性(+),最终评分结果4~5分者为中度阳性(++),最终评分结果6~7分者为强阳性(+++)。
1.4 统计学分析
通过采用 SPSS 13.0统计学软件进行数据分析。本文所有统计资料均为计数资料,采用χ2检验,当P<0.05时差异有统计学意义。
2 结果
2.1 JAM-A在正常甲状腺组织和乳头状癌中的表达
SP免疫组化判读结果最终表明JAM-A在正常甲状腺组织滤泡腺上皮细胞中和乳头状癌细胞的胞膜上均显示有不同程度的蛋白表达,经过严格的统计得知JAM-A在正常甲状腺组织的阳性表达率为90.0%(54/60),(++)~(+++)的表达率为77.8%(42/54);JAM-A在甲状腺乳头状癌中的表达率为60.0%(72/120)。以上结果显示:JAM-A在正常甲状腺组织中的阳性表达率明显高于甲状腺乳头状癌组;JAM-A在正常甲状腺组织、甲状腺乳头状癌组织间比较,差异有统计学意义(P<0.05)。JAM-A在不合并淋巴结转移性甲状腺乳头状癌组织中的阳性表达率为70.0%(56/80),(++)~(+++)的表达率为71.4 %(40/56);JAM-A在合并有颈部中央区淋巴结甲状腺乳头状癌转移的癌组织中的阳性表达率为40.0%(16/40),其中(++)~(+++)的表达率为50.0%(8/16),JAM-A蛋白在伴随有淋巴结转移的原发甲状腺癌组织和不伴随有淋巴结转移的甲状腺癌组织中进行两组组间比较,差异有统计学意义(P<0.05)。
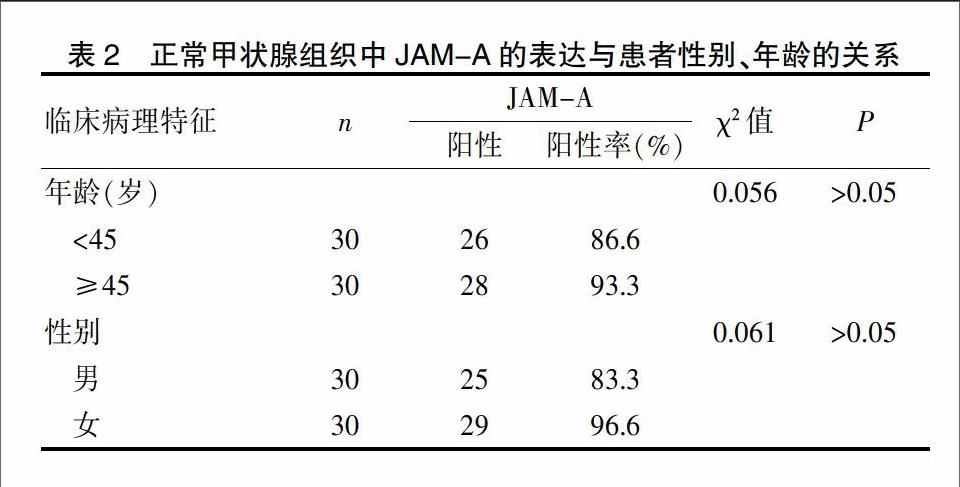
总之,JAM-A在正常甲状腺组织、无淋巴结癌转移的甲状腺乳头状癌组织、有淋巴结转移的甲状腺乳头状癌组织中阳性表达率依次降低,组间比较差异有统计学意义(P<0.05)。JAM-A在甲状腺不同组织中的表达情况见表1、封三图4~7,其表达与患者的性别、年龄无关,差异无统计学意义(P>0.05),见表2。
2.2 JAM-A表达与不同组患者的临床病理特征联系
最终通过免疫组织化学染色结果判读分析表明:120例甲状腺乳头状癌中,JAM-A在合并有淋巴结转移的组织中的阳性表达率为40.0%(16/40),在不合并淋巴结转移组织中的阳性表达率为70.0%(56/80),两者比较差异有统计学意义(P<0.05);然而JAM-A蛋白在正常甲状腺滤泡组织、伴有淋巴结转移的研究组和不伴随有淋巴结转移的研究组间的表达,与患者的年龄、性别及瘤体的大小、是否同时合并包膜浸润累犯情况、病灶数目的多少和TNM临床分期均无相关性(表3)。以上结果表明JAM-A蛋白可能参与甲状腺乳头状癌的侵袭、浸润和转移过程。
3 讨论
甲状腺乳头状癌是甲状腺恶性肿瘤中最常见的肿瘤之一,尽管与其他器官的恶性肿瘤相比较,其恶性程度较低,然而甲状腺乳头状癌容易发生局部复发和远处转移,有些乳头状癌的患者在疾病发现的早期甚至即可发生颈部淋巴结的多发转移浸润。因此,阐明甲状腺乳头状癌容易发生侵袭、转移发生的致病机制与病因,是目前根治甲状腺癌的最关键举措之一。目前伴随细胞间黏附分子的发现,给肿瘤的治疗和阐明其致病机制提供了重要的成果,近来大量的国外研究表明不同的细胞间黏附分子在维持人体内正常细胞间内环境的稳态过程中发挥十分重要的作用,扮演着相当重要的角色,细胞间黏附分子的不同程度表达与多种恶性肿瘤的浸润、侵袭转移和肿瘤原发部位的随后短期复发有着相当密切的关系[2-5],主要是由这些黏附分子扮演重要的角色,因此,科研工作者从基因蛋白的水平寻找发现可靠的、有临床应用价值的甲状腺乳头状癌的分子蛋白标志物,不仅能够协助病理医师诊断甲状腺乳头状癌,而且对于临床医师选择合理的外科手术方式有重要的意义;因此,发现新的有价值的标记物,并对于判断患者的临床预后就显得更加重要。
恶性肿瘤细胞的浸润、侵袭与转移过程相当复杂。首先,许多上皮性恶性肿瘤中,癌细胞与癌细胞之间黏附分子的减少或丢失,或某种蛋白的表达缺失,或基因突变导致蛋白改变,是肿瘤侵袭浸润转移的关键步骤之一。癌细胞与癌细胞之间的黏附性降低,从而使癌细胞很容易脱离癌巢,从而脱离肿瘤发生的原始部位,这为癌细胞的远处游走、周边浸润及侵袭和远处转移提供了便利的条件之一。目前国外的部分研究表明恶性肿瘤中,瘤细胞之间紧密连接的关键性通路遭到破坏是导致恶性肿瘤细胞发生早期侵袭、迁移及扩散的重要条件之一[6]。陈兆峰等[7]的研究结果表明,胃癌瘤细胞中COX-2可通过NF-κB/Snail信号通路,进一步下调钙黏附分子(E-cadherin)的表达,从而促进胃癌细胞的浸润侵袭并发生远处转移。另外,亦有研究发现JAM属于免疫球蛋白超家族类的一员,是一种细胞间紧密连接的黏附分子,目前研究表明其主要包含JAM-A、JAM-B、JAM-C三个家族成员。许多研究证实JAM-A最先出现在细胞间接触位点并能召集其他紧密连接蛋白从而启动紧密连接的形成,这种特性赋予其能够促进同型细胞间的连接[8-9]。JAM-A蛋白通常可直接作用于瘤体邻近的恶性肿瘤细胞,通过诱导促进基质蛋白酶释放降解基质,并且通过水解肿瘤细胞表面的黏附分子而有助于肿瘤细胞的迁移和侵袭。另外,JAM-A蛋白能在信使RNA水平和蛋白表达水平直接反馈影响血管内皮生长因子、促血管生长因子的表达,从而进一步引起肿瘤新生血管的大量生成,从而增加恶性肿瘤的侵袭性及转移能力。
多数研究表明恶性肿瘤细胞发生迁移这一导火线是恶性肿瘤发生浸润和转移必不可少的前提条件之一。JAM-A蛋白由于其能够影响恶性肿瘤细胞的迁移,目前被广泛应用于各种恶性肿瘤的侵袭、浸润机制的基础研究中,这可能为肿瘤发生转移浸润提供基础支撑[10-11]。JAM-A蛋白通过不同途径可促进恶性肿瘤的迁移转移。李殿友等[12]研究發现人参皂苷Rh2可抑制小鼠肿瘤生长,可能与JAM-A低表达和JAM-B低表达密切相关,而对照组JAM-A和JAM-B明显上调。另外JAM-A的表达下调可以促进某些肿瘤的转移。例如在对肺的原发性鳞状上皮细胞癌、乳腺浸润性导管癌、子宫内膜样腺癌和肾透明细胞癌等研究中发现,这些肿瘤中 JAM-A蛋白的表达下调,并与多种恶性肿瘤的恶性程度和转移能力呈负相关[13]。当然亦有文献报道,JAM-A蛋白表达上调同样可以促进某些恶性肿瘤的迁移转移,促进其恶性转换,JAM-A可通过调节GTP Rap1酶的活性和β1-integrin的表达水平,进一步导致细胞极性的改变和癌变部位新生血管的生成,最终会导致乳腺癌、前列腺腺癌的扩散与转移。由此可见,无论JAM-A的表达是上调还是下调,都可能会促进恶性肿瘤的浸润与转移[13-19],而我们的研究中发现JAM-A的表达逐渐下降,与多数研究结果一致,说明其下调可能促进恶性肿瘤的进一步进展或恶性转移。
本研究经过慎密的统计分析,结果表明:JAM-A蛋白在正常甲状腺组织、不合并淋巴结转移的甲状腺乳头状癌组织、合并有淋巴结转移的甲状腺乳头状癌组织中阳性表达率呈现逐渐降低的趋势,这一研究结果与当今绝大多数的研究成果相一致,具有非常重要的临床意义。表明随着甲状腺乳头状癌疾病的恶性进展,JAM-A蛋白表达的下降可能引起紧密连接复合体减少或消失,信号通路进一步发生变化,内环境改变,进一步促进增加开放淋巴管的连接数目,为甲状腺乳头状癌细胞的淋巴道或血道转移创造了双重便利条件,研究结果进一步表明JAM-A蛋白有希望成为判定人类甲状腺乳头状癌转移预后的重要指标之一,这为外科选择合理的治疗提供有力的理论依据,进一步为临床辅助其后续治疗提供便利条件。
总之,人体内正常细胞发生癌变是一个相当复杂的不断进展的过程,要经过不断的外在和内在刺激,超出了正常机体的修复范围,另外与肿瘤细胞分裂过程中细胞周期的变化、不同信号转导途经的异常、细胞内环境的改变、细胞骨架改变及异常基因突变等多个方面密切相关,而膜联蛋白家族的所有成员几乎被牵涉到恶性肿瘤中不同种瘤细胞的病理生理过程的多个环节[18-20]。近来有研究表明JAM-A作为膜联蛋白家族一个极其特殊成员之一,在不同恶性肿瘤的多方面研究中受到國内外学者们的高度重视,很有可能成为原发性甲状腺乳头状癌诊断与治疗的靶点之一,为提高患者的生存率提供可靠的理论依据,但JAM-A在甲状腺乳头状癌中的细胞水平的具体机制还需我们进一步去深入研究与发现,最终从机制上阐明其内在原因。
[参考文献]
[1] Wu M,Ji S,Xiao S,et al. JAM-A promotes wound healing by enhancing both homing and secretory activities of mesenchymal stem cells[J]. Clin Sci(Lond),2015,129(7):575-588.
[2] Mitchell LA,Ward C,Kwon M. Junctional adhesion molecule A promotes epithelial tight junction assembly to augment lung barrier function[J]. Am J Pathol,2015,185(2):372-386.
[3] Sun W,Li FS,Zhang YH,et al. Association of susceptibility to septic shock with platelet endothelial cell adhesion molecule-1 gene Leu125Val polymorphism and serum sPECAM-1 levels in sepsis patients[J]. Int J Clin Exp Med,2015,8(11):20490-20498.
[4] Binmadi N,Elsissi A,Elsissi N. Expression of cell adhesion molecule CD44 in mucoepidermoid carcinoma and its association with the tumor behavior[J]. Head Face Med,2016,12(1):8-12.
[5] Tuncay H,Brinkmann BF,Steinbacher T,et al. JAM-A regulates cortical dynein localization through Cdc42 to control planar spindle orientation during mitosis[J]. Nat Commun,2015,6:8128-8131.
[6] Zhao H,Yu H,Martin TA,et al. Effect of junctional adhesion molecule-2 expression on cell growth,invasion and migration in human colorectal cancer[J]. Int J Oncol,2016, 48(3):929-936.
[7] 陈兆峰,黄珊珊,刘敏,等. 胃癌细胞COX-2通过NF-κB/Snail信号通路调控 E-cadherin表达的机制[J]. 实用肿瘤学杂志,2014,29(2),118-122.
[8] Kelly KR,Espitia CM,Zhao W,et al. Junctional adhesion molecule-A is overexpressed in advanced multiple myeloma and determines response to oncolytic reovirus[J]. Oncotarget,2015,6(38):41275-41289.
[9] Scott DW,Tolbert CE,Graham DM,et al. N-glycosylation controls the function of junctional adhesion molecule-A[J]. Mol Biol Cell,2015,26(18):3205-3214.
[10] Zuo H,Gandhi M,Edreira MM,et al. Downregulation of Rap1GAP through epigenetic silencing and loss of heterozygosity promotes invasion and progression of thyroid tumors[J]. Cancer Res,2010,70(4): 1389-1397.
[11] Murakami M,Francavilla C,Torselli I,et al. Inactivationof junctional adhesion molecule-A enhances antitumoral immune response by promoting dendritic cell and T lymphocyte infiltration[J]. Cancer Res, 2010,70(5):1759-1765
[12] 李殿友,羅毅男,杨红,等. 人参皂甙 Rh2 对细胞间连接黏附分子在小鼠移植瘤淋巴管表达的影响[J]. 解剖学研究,2007,29(1): 29- 32.
[13] Liu C,Wang M,Jiang S,et al. A novel junctional adhesion molecule A(CgJAM-A-L)from oyster(Crassostrea gigas)functions as pattern recognition receptor and opsonin[J].Dev Comp Immunol,2016,55(6):211-220.
[14] Ikeo K,Oshima T,Shan J,et al. Junctional adhesion molecule-A promotes proliferation and inhibits apoptosis of gastric cancer[J]. Hepatogastroenterology,2015,62(138):540-545.
[15] Karshovska E,Zhao Z,Blanchet X,et al. Hyperreactivity of junctional adhesion molecule A-deficient platelets accelerates atherosclerosis in hyperlipidemic mice[J]. Circ Res,2015,116(4):587-599.
[16] Akimoto T,Takasawa A,Murata M,et al. Analysis of the expression and localization of tight junction transmembrane proteins,claudin-1,-4,-7,occludin and JAM-A,in human cervical adenocarcinoma[J]. Histol Histopathol,2016,31(8):921-931.
[17] Tuncay H,Brinkmann BF,Ebnet K. Mitotic spindle orientation: JAM-A can fix it[J]. Cell Cycle,2015,14(24):3773-3774.
[18] Liu X,Sun W,Zhao Y,et al. Ginkgolide B Inhibits JAM-A,Cx43, and VE-Cadherin Expression and Reduces Monocyte Transmigration in Oxidized LDL-Stimulated Human Umbilical Vein Endothelial Cells[J]. Oxid Med Cell Longev,2015,8(7):917-926.
[19] Tuncay H,Ebnet K. Cell adhesion molecule control of planar spindle orientation[J]. Cell Mol Life Sci,2016,73(6):1195-1207.
[20] Kurose M,Kakuki T,Takano K,et al. Junctional Adhesion Molecule-A in Head and Neck Squamous Cell Carcinoma[J]. Adv Otorhinolaryngol,2016,77(2):92-97.
(收稿日期:2016-07-05)

