利用辅助发酵剂生产水果风味Cheddar干酪
宋云花,刘美玉,罗洁,葛绍阳,姜陈波,王静,杨子彪,任发政
利用辅助发酵剂生产水果风味Cheddar干酪
宋云花1,2,刘美玉2,罗洁1,葛绍阳3,姜陈波1,王静1,杨子彪4,任发政1
(1.中国农业大学食品科学与营养工程学院/教育部功能乳品实验室,北京 100083;2.河北工程大学生命科学学院,邯郸 056000;3.北京资源亚太饲料科技有限公司博士后科研工作站,北京 102600;4.云南皇氏来思尔乳业有限公司,大理 671000)
水果风味是我国消费者喜爱的干酪风味,可以利用辅助发酵剂增强干酪的水果风味。本研究从云南特色乳制品中分离筛选出乳酸菌作为辅助发酵剂,对其在培养液和Cheddar干酪内合成水果风味物质丁酸乙酯的能力进行了研究。20株乳酸菌(LAB)在液体环境中合成丁酸乙酯的气相结果显示,嗜热链球菌相对于干酪乳杆菌、副干酪乳杆菌、鼠李糖乳杆菌等产酯酶能力较高。进一步利用气相色谱-质谱联用仪定量检测的结果显示,嗜热链球菌H069-B-01、M4-1、H069-B-06相对于其他乳酸菌产酯酶能力显著增加(P<0.05)。将筛选得到的三株菌作为辅助发酵剂添加到Cheddar干酪的制作中,在成熟90d后发现,添加辅助发酵剂菌株的干酪与对照组在干酪组成成分之间差别不显著(P>0.05),但添加辅助发酵剂菌株后的干酪相对于对照组水果风味有所增强,其中添加嗜热链球菌H069-B-01的干酪水果风味增加最为明显。
丁酸乙酯;嗜热链球菌;气相色谱-质谱联用仪GC-MS;Cheddar干酪
干酪是世界乳制品消费的一种重要形式,但是中国人均干酪消费水平远低于西方国家,究其原因就是干酪的风味不太适合国人的饮食习惯[1]。从中国人现在普遍接受的酸奶来看,水果风味被大多数国人接受[2]。所以增强干酪的水果风味,对提高中国干酪的消费量有重大意义。水果风味物质主要为干酪中的酯类[3]。酯以各种形式存在于干酪中,特别是C2-C8的乙基酯。研究表明,干酪中水果风味主要是一定浓度的丁酸乙酯和乙酸乙酯富集所产生的[4]。当丁酸乙酯和己酸乙酯在高达0.004‰(w/w)的水平时,会呈现显著的水果风味[4]。
对于酯的产生机理,前人认为是由游离脂肪酸和醇通过酯酶和脂肪酶酯化合成的[5]。最近的研究证明,干酪中酯的形成是通过酯酶和脂肪酶催化发生了酯交换(醇解),其中原料奶脂肪中甘油酯上的脂肪酰基被直接传递到醇上[6,7]。在这些反应中底物乙醇以及脂肪酶和酯酶是由干酪中的微生物产生的。这些微生物除了可作为干酪生产所必需的发酵剂外,还可以是一些非发酵剂乳酸菌,即辅助发酵剂。非发酵剂乳酸菌是一类在干酪成熟过程中处于优势并对其风味的形成具有重要作用的乳酸菌群[8~10],所以筛选出一株高产酯酶的菌株作为辅助发酵剂添加在干酪中有助于干酪水果风味的产生。Hosono等人[11,12]研究了乳酸菌形成五种酯的能力,结果发现所有菌株都能够酯化形成丁酸乙酯和己酸乙酯。而Liu等人[13,14]的研究表明,在乳酸菌菌株中嗜热链球菌相对于其他菌株产酯酶能力要高。
本研究通过气相色谱(GC)与气相色谱-质谱联用仪(GC-MS)两种方法,从20株乳酸菌中筛选出一株高产酯酶的乳酸菌菌株,并将该菌株作为辅助发酵剂应用到Cheddar干酪中,以期增强干酪的水果风味。
1 材料与方法
1.1 实验材料
本试验所筛选的菌株均来自于云南特色乳制品。
1.2 试验方法
1.2.1 丁酸乙酯反应体系制备
GC检测的反应体系:将保存的菌种以1%(V/V)传两代,第三代以1%(V/V)接种到10mL培养基,静态培养24h,将菌液离心,菌泥用于烘干称量菌株的干物质(75℃下烘12h)以及作为反应物[13,14]。将菌泥转移到含有0.3~0.4g玻璃珠的离心管内,同时加入400μL的乙醇和100μL的三丁酸甘油酯,采用破碎机破碎45s后,放到培养箱温育12h,取出转移到15mL尖底螺口离心管内,同时加入2mL乙醚,涡旋振荡5min,离心(8000g,5min,4℃),取上层液体到气相小瓶中,处理好的样品4℃保存。
GC-MS检测的反应体系:在顶空瓶内加入4mL培养基(嗜热链球菌M17培养基,其他LAB是MRS培养基),同时加入50mmol/L的乙醇11.66μL和3.3mmol/L的三丁酸甘油酯3.86μL,同时以2%(V/ V)接入二代菌,没有加入乙醇的为空白对照。嗜热链球菌M17培养基43℃培养24h,其他LAB在37℃培养24h。
1.2.2 色谱分析条件
1.2.2.1 GC分析条件
采用岛津气相进行分析。柱箱的温度程序是45℃5min,随后以5℃/min的速度升到50℃,然后以20℃/ min的速度升到230℃,在230℃保持5min。进样量为2μL。喷射器和氢火焰离子化检测器(FID)温度均为230℃。
1.2.2.2 GC-MS分析条件
参考高文俊[15,16]HS-SPME条件:三相萃取头(DVB/CAR/PDMS, 50/30μm),50℃预热10min,吸附萃取45min,GC解吸5min。
G C条件[13,14]:仪器T h e r m o,气相型号Trace1310,质谱ISQ,色谱柱:TG-WAXMS(30m×0.25mm×0.25μm);升温程序:初始温度40℃,保持1min,然后以0.5℃/min升温至45℃,以1℃/min升温至50℃,以20℃/min升温至220℃;进样量2μL;以100mL/min分流进样;进样口和检测器温度均为250℃;载气为He,流速1mL/min。
MS条件:EI电离源;离子源温度:230℃;电子轰击能量:70eV;扫描范围:35~350amu。
1.2.3 Cheddar干酪制作
具体制作方法参考Cheddar干酪标准加工工艺[17]。将筛选出的菌株作为辅助发酵剂添加到干酪制作中,并以不添加辅助发酵剂的Cheddar干酪作为对照组,真空包装后于4℃成熟90d。
1.2.4 干酪组成成分测定
蛋白测定采用凯氏定氮法[18];脂肪含量测定采用罗里-哥特里(Rose-GottIieb)法(AOAC,2000);水分参照IDF(1982);所有样品重复3次,计算平均值。挥发物质采用固相微萃取(SPME)结合GC-MS联用进行检测。
1.2.5 统计学分析
试验结果数据用均值±标准差(±SD)表示。不同处理方法之间均值比较采用单因素方差分析进行差异显著性检验,所有的统计分析都采用统计软件 SPSS17.0版,显著性水平为P<0.05。
2 结果与讨论
2.1 气相试验结果利用GC检测10株嗜热链球菌、3株副干酪乳杆菌、3株干酪乳杆菌、4株鼠李糖乳杆菌的丁酸乙酯产生情况时,发现并不是每一株菌都能用气相检测到丁酸乙酯,这可能是因为一些菌的丁酸乙酯产量很低(见表1)。其中,嗜热链球菌产酯酶的能力要高于其他菌株,这与Liu等人[13,14]的研究结果相一致。
2.2 气相色谱-质谱(GC-MS)试验结果
2.2.1 质谱峰值比较结果
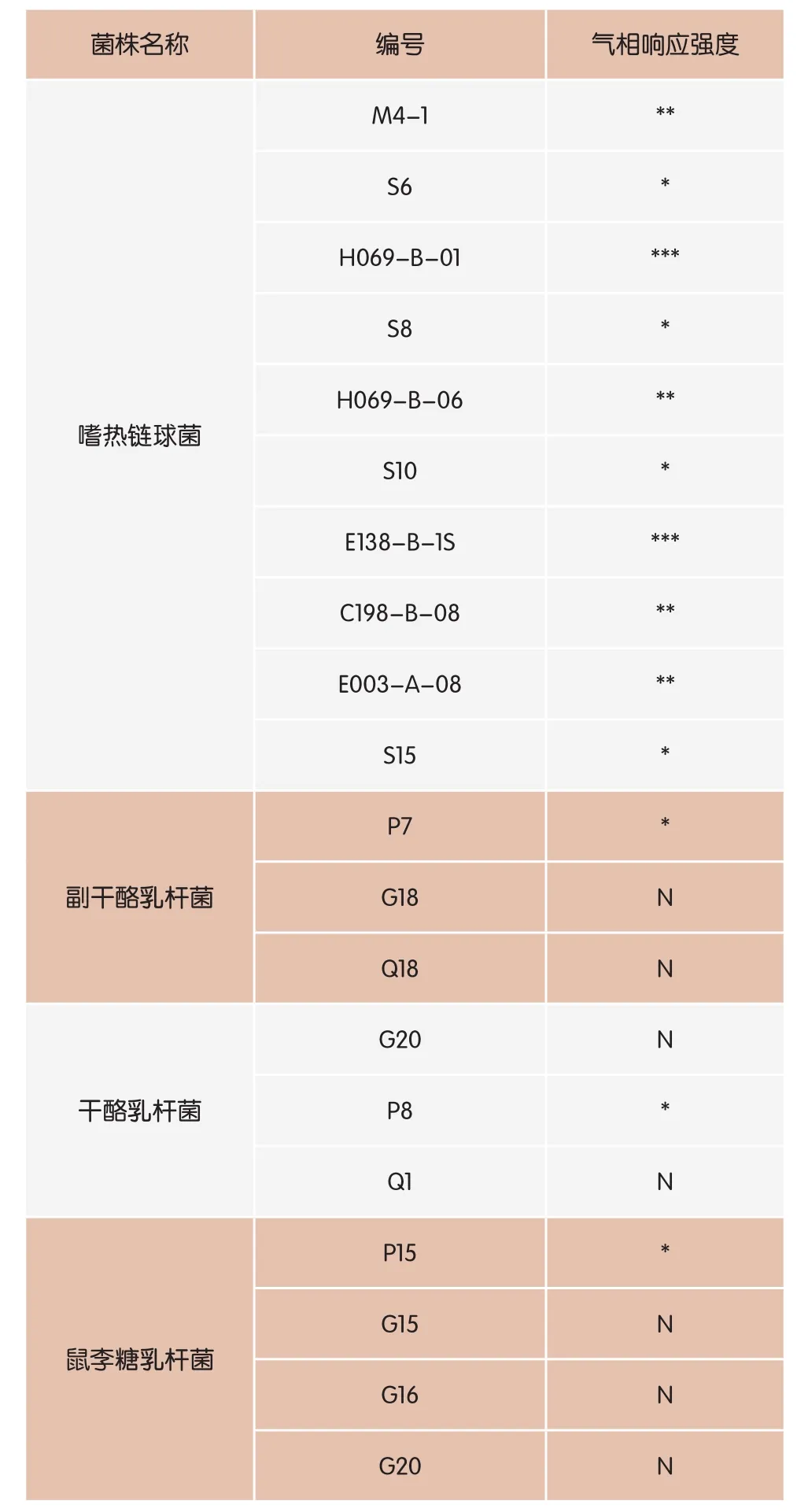
表1 不同菌株气相试验结果
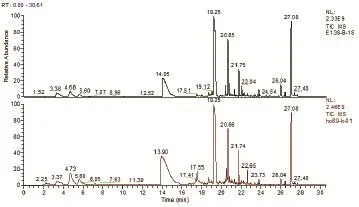
图1 不同菌株的GC-MS质谱峰比较

表2 质谱峰中不同峰物质
由于气相实验需经过繁琐的前期处理,并且丁酸乙酯极易挥发,所以通过SPME直接萃取吸附菌液中产生的丁酸乙酯定量更为准确,所以进一步采用SPME固相微萃取结合气相色谱-质谱(GC-MS)准确定量,见表2。从图1 E138-B-1S和H069-B-01两株菌的质谱峰比较中可以看出,在保留时间5.4 min左右(即丁酸乙酯的峰),H069-B-01要比E138-B-1S产丁酸乙酯的峰面积显著增加。
2.2.2 定量分析丁酸乙酯产量结果
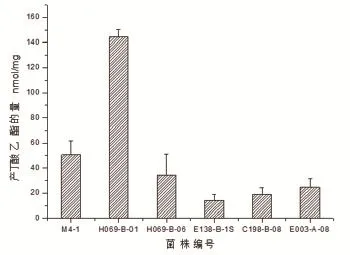
图2 不同菌株催化产丁酸乙酯的量的比较注:不同字母的数据间具有显著性差异(P < 0.05)。
如图2所示,采用GC-MS定量分析6株气相检测丁酸乙酯的产量较高的菌株中,产量最高的是H069-B-01,最低的是E138-B-1S,并且H069-B-01菌株比Liu 等人[13]筛选的菌株高产40多倍。方差分析结果显示H069-B-01的产量与其他各个菌株之间产丁酸乙酯的量差异极显著(P<0.01),H069-B-06、E138-B-1S、C198-B-08、E003-A-08这四株菌之间产丁酸乙酯的量差异不显著(P>0.05)。H069-B-01与M4-1之间产丁酸乙酯的量差异不显著(P>0.05)。气质分析结果与气相定性分析结果相一致。
2.3 添加辅助发酵剂对Cheddar干酪组分的影响
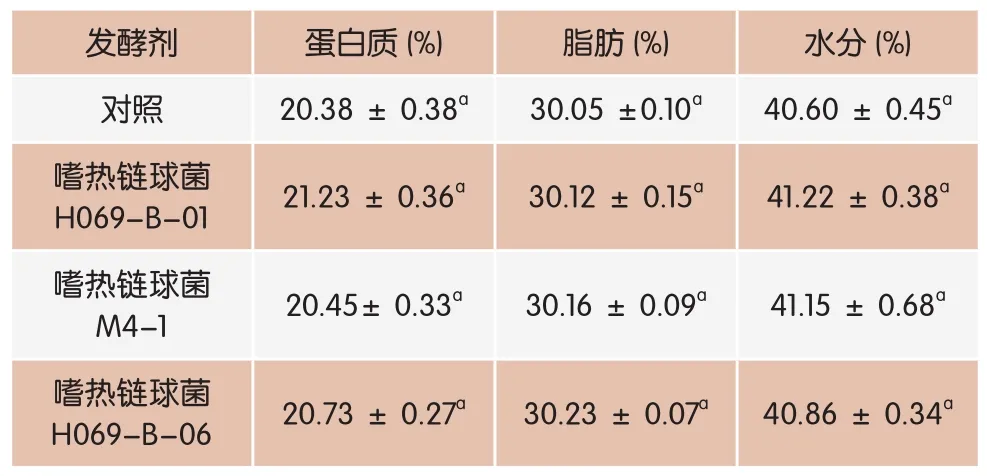
表3 添加辅助发酵剂对cheddar干酪组分的影响
添加附属发酵剂的Cheddar干酪组分如表3所示。试验组干酪在水分、蛋白和脂肪含量上与对照组相比无显著性差异(P>0.05),表明添加辅助发酵剂不影响干酪的组分。
2.4 添加辅助发酵剂对Cheddar干酪水果风味的影响
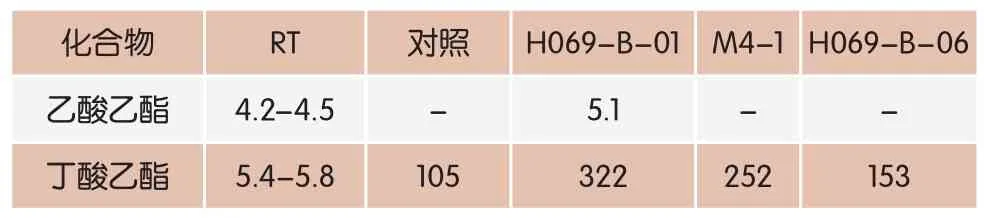
表4 成熟90d时,不同辅助发酵剂干酪中的挥发性水果风味化合物(峰面积/1000)
如表4所示,不同辅助发酵剂添加到Cheddar干酪中,干酪中的酯类主要是乙酸乙酯和丁酸乙酯,这两种酯类是使干酪呈现水果风味的重要物质[19]。其中丁酸乙酯在对照组与添加辅助发酵剂的试验组中都普遍存在,但是添加辅助发酵剂后相对于对照组丁酸乙酯的量都有所增加。其中添加嗜热链球菌H069-B-06这株菌株的干酪相对于对照组的干酪丁酸乙酯的量增加了3倍左右,但是乙酸乙酯只在添加嗜热链球菌H069-B-06干酪中产生。所以综合以上试验结果,在干酪中添加嗜热链球菌H069-B-06作为辅助发酵剂有助于干酪水果风味产生。
3 结论
本文对20株乳酸菌(LAB)在液体环境中合成丁酸乙酯的能力进行了研究。发现嗜热链球菌相对于干酪乳杆菌、副干酪乳杆菌、鼠李糖乳杆菌产酯酶能力较高。将产量较高的三株菌作为辅助发酵添加到干酪中成熟90d后,不会影响干酪的组成成分。其中,嗜热链球菌H069-B-01产酯酶能力较对照组高产40多倍,并可使Cheddar干酪的水果风味增强3倍。
[1] 张晓莹, 孙文峰, 曹雪,等.6种进口干酪理化指标分析及北京市中青年对其喜好度的调查[J]中国乳业, 2008, 6: 20-22.
[2] 田洪磊, 田呈瑞. 几种不同果酱酸奶质量的比较[J]. 食品科技, 2004, 22(6): 72-74.
[3] Urbach, G. The flavour of milk and dairy products: II.Cheese: contribution of volatile compounds [J]. International Journal of Dairy technology,1997,50(3):79-89.
[4] McGugan, W.A., Blais, J.A., Boulet, M, et al. Ethanol, ethyl esters, and volatile fatty acids in fruity Cheddar cheese [J].Canadian Journal of Food Science and Technology, 1975, 8(4):196-8.
[5] Fox, P.F., Guinee, T.P., Cogan, T.M, et al."Cheese flavor", in Fundamentals of Cheese Science [M]. Aspen Publishers, Gaithersburg, MD, 2000, 282-384.
[6] Holland, R., Liu, S.-Q., Crow, V.L, et al.Esterases of lactic acid bacteria and cheese flavor: Milk fat hydrolysis, alcoholysis and esterification [J]. International Dairy Journal, 2005, 15(6-9):711-718.
[7] Liu, S.-Q., Holland, R. and Crow, V.L. Esters and their biosynthesis in dairy products: a review [J].International Dairy Journal, 2004, 14(11): 923-945.
[8] Crow V., Curry B., Hayes M. The ecology of non-starter lactic acid bacteria (NSLAB) and their use as adjuncts in New Zealand Cheddar [J]. International Dairy Journal, 2001, 11(4-7):275-283.
[9] Crow V., Curry B., Christison M., et al. Raw milk flora andNSLAB as adjuncts [J]. Australian Journal of Dairy Technology,2002,57(2):99-105.
[10] Crow V.L., Coolbear T., Gopal P.K., et al. The role ofautolysis of lactic acid bacteria in the ripening of cheese [J]. International Dairy Journal, 1995, 5(8):855-875.
[11] Hosono, A. and Elliottt, J. A. Properties of crude ethylesterforming enzyme preparations fromsome lactic acidand psychrotrophic bacteria [J]. Journal of Dairy Science, 1974,57(12):1432-1437.
[12] Hosono, A., Elliottt, J. A. and McGugan, W. A. Production of ethyl esters by some lactic acid and psychrotrophicbacteria [J].Journal of Dairy Science, 1974, 57(5):535-539.
[13] Liu S-Q, Holland R, Crow V L.Ethylbutanoate formation bydairy lactic acid bacteria [J]. International Dairy Journal, 1998, 8(7):651-657.
[14] Liu S-Q, Holland R, Crow V L.Ester synthesis in an aqueous environment by Streptococcusthermophilesand other dairy lactic acid bacteria [J]. Applied microbiology and biotechnology, 2003, 63(1):81-88.
[15] 高文俊.青稞酒重要风味成分及其酒醅中香气物质研究[D].无锡:江南大学,2014.
[16] 范文来,胡光源, 徐岩. 顶空固相微萃取-气相色谱-质谱法测定药香型白酒中萜烯类化合物[J]. 食品科学, 2012, 33(14): 110-116.
[17] Kosikowski F.V,Misty V.V.Origins and Principles .Cheese and Fermented Milk Foods 1.1997.
[18] Lynch J M,Barbano D M, Fleming J R.Indirect and direct determination of the casein content of milk by Kjeldahl nitrogen analysis: collaborative study[J]. Journal of AOAC International,1998. 81:763-774.
[19] Ayad E., Verheul A., Wouters J.T.M., et al. Application of wild starter cultures forflavor development in pilot plant cheese making [J]. International Dairy Journal, 2000,10(3):169-179.
Production of Fruit- flavored Cheddar Cheese using a Supplementary Starter
SONG Yun-hua1,2, LIU Mei-yu2, LUO Jie1, GE Shao-yang3, JIANG Chen-bo1, WANG Jing1, YANG Zi-biao4, REN Fa-zheng1
(1. Key Laboratory of Functional Dairy, Co-constructed by Ministry of Education and Beijing Government, China Agricultural University, Beijing 100083; 2. Hebei University of Engineering, Handan 056000; 3. Postdoctoral Working Station, Beijing Resources Asia-Pacifc Feed Technology Co. Ltd., Beijing 102600; 4.Yunnan Huangshi Lesson Dairy Co. Ltd., Dali 671000)
Adjunct cultures play an important role in the formation of cheese typical flavor, but the effects of diferent adjunct cultures on cheese favor is distinct. Chinese consumers’ favorite is the fruit favor of cheese. The key to the development of Chinese cheese industry is the use of adjunct cultures to enhance cheese fruit favor and the research of cheese products to suit to Chinese market. In this study, the ability of 20 strains of Lactobacillus (LAB) to synthesize ethyl butyrate in liquid environment was studied. Gas phase results showed that ethyl butyrate was not detected in every strain, and Lactobacillus paracasei, Lactobacillus paracasei and Lactobacillus rhamnosus had higher esterase activity than Streptococcus thermophilus. The results of GC-MS showed that the ability of H069-B-01 to produce etlyl butyrate was signifcantly higher than that of other lactic acid bacteria (P<0.05). The three strains of H069-B-01, M4-1 and H069-B-06 were selected as the co-starter for the production of Cheddar cheese. After ripening 90 days, the cheeses of the adjuvant fermenter strains were compared with the control group. The composition of cheese didn’t have signifcant diference among all (P>0.05), however, the cheeses with the addition of the starter strain had a stronger fruit favor than the control, and the H069-B-01 contributed the most (P<0.05).
Ethyl butyrate; Streptococcus thermophilus; Gas Chromatography-Mass Spectrometer (GC-MS); Cheddar cheese
TS251.1
A
1004-4264(2017)01-0047-05
10.19305/j.cnki.11-3009/s.2017.01.013
2016-07-22
本研究受云南省科技计划生物重大专项(奶业专项)(2014ZA001),以及北京市教育委员会中央在京高校重大成果转化项目“益生菌生产关键技术科技成果转化”项目支持。
宋云花(1992-),女,汉族,硕士。
任发政(1962-),男,汉族,教授,研究方向为乳品科学。

