双歧杆菌A6对健康青年人群肠道菌群的影响
葛绍阳,王娜,刘治麟,杨子彪,武永超,桑跃,赵亮
(1.北京资源亚太饲料科技有限公司博士后科研工作站,北京 102600;2.中国农业大学食品科学与营养工程学院,北京市高等学校畜产品工程研究中心,北京 100083;3.北京和益源生物技术有限公司,北京 100089;4.云南皇氏来思尔乳业有限公司,大理 671000)
双歧杆菌A6对健康青年人群肠道菌群的影响
葛绍阳1,王娜2,刘治麟3,杨子彪4,武永超3,桑跃3,赵亮2
(1.北京资源亚太饲料科技有限公司博士后科研工作站,北京 102600;2.中国农业大学食品科学与营养工程学院,北京市高等学校畜产品工程研究中心,北京 100083;3.北京和益源生物技术有限公司,北京 100089;4.云南皇氏来思尔乳业有限公司,大理 671000)
益生菌的重要功能之一是对肠道菌群的调节。动物双歧杆菌乳亚种A6(Bifidobacteirum animalis subsp. lactis A6)菌株已被证实具有良好的生理功能,为进一步评价该菌株对青年人群肠道菌群的影响,本研究募集52名18~26岁的健康青年志愿者,将其随机等分为两组,开展人群口服试验:两组先服用1周安慰剂;组A继续服用安慰剂4周,组B服用A6样品(添加有A6活菌牛奶,活菌浓度约为1010CFU/50mL)4周;停服2周;组A服用A6样品4周,组B服用安慰剂4周。服用剂量为每天50mL。在每一阶段末期采集一次粪便样品(共5次),以种属特异性引物定量PCR检测其中的肠道菌群数量。肠道菌群数量的检测结果表明,与基线期和对照期相比,连续口服A6 4周后,肠道中潜在致病性大肠杆菌的数量显著下降(P<0.01),有益菌乳酸菌、双歧杆菌的数量则出现上升(P<0.01)。试验表明,LC-01样品对健康青年人群肠道菌群具有调节作用,有利于肠道健康的维持与改善。
双歧杆菌A6;健康青年人群;肠道菌群
近年来,随着生活节奏的加快、生活压力的加大,亚健康人群比例逐步增大。亚健康及相关疾病成为当今社会的重大问题。人们对健康的追求已经从疾病的治疗转为预防,保健品及功能性食品的需求也越来越大。其中益生菌类食品及保健品得到了飞速的发展。乳制品是益生菌良好的载体,含有益生菌的发酵酸乳和发酵乳饮料在乳制品中的比重在逐年上升。
益生菌最重要的作用是调节肠道菌群、改善肠道环境。肠道菌群能够影响人体的营养代谢和能量供应。肠道菌群主要通过发酵、甲烷化硫还原和甲烷化进行物质和能量代谢,具有促进食物消化吸收、生成维生素等基本营养作用[1]。2008 年,Li等人的研究发现肠道菌群结构的变化和人体代谢水平的变化形成响应,并报道了肠道菌群中多个可对人体多条代谢通路有影响的成员[2]。也有研究表明,肠道菌群是人体代谢过程的直接参与者,是人体正常生命活动不可或缺的部分[3]。其次,肠道菌群能维持人体肠道内环境的稳态。多项研究表明,相对普通动物,无菌动物的肠壁血管、膜细胞结构、肌肉层结构、消化道酶活性、细胞因子产量等都出现不同程度的发育不良或损伤。而同等体重条件下,无菌动物需要摄入更多能量才能维持基本生命活动,对各类疾病的抵抗力也更差[4]。同时,正常肠道菌群的动物可以通过竞争和分泌细菌素等方式对外源致病性微生物的侵入起到屏障作用[5]。第三,肠道菌群对人体免疫功能很可能具有重要的调节作用。肠道黏膜被认为是人体最大的免疫系统,肠道也是人体最大的免疫器官,在外源致病物质入侵时,肠道菌群可以诱导黏膜免疫反应的发生,参与多位置、多种功能的免疫相关基因的激活或者关闭,诱导免疫细胞的活化[6]。还有研究发现,肠道菌群具有正负向调节炎症反应的潜能[7]。因此肠道菌群与正常免疫功能的维持和运行紧密相关。近年来的研究显示,肠道菌群结构还与人类的衰老、肥胖、糖尿病、心血管疾病、肿瘤甚至心理疾病的发生、发展和治疗有关[8,9]。虽然现有的研究并未完全了解肠道菌群与宿主之间错综复杂的互作方式,但不可否认的是,肠道菌群与人体健康状况是密切相关的。
本研究通过用高灵敏度、高通量和高特异性的实时荧光定量PCR技术,检测连续摄入双歧杆菌A6四周后,受试者粪便中多种肠道微生物的数量变化情况,寻找发生显著性变化的细菌,探究A6对肠道菌群的调节效果。
1 材料与方法
1.1 菌株
动物双歧杆菌乳亚种A6(Bifidobacterium animalis subsp. lactis A6)(CGMCC No.9273) ,由中国农业大学功能乳品实验室提供。
1.2 主要仪器设备
低温高速离心机(Sigma 3K30),德国Satorious公司;紫外可见分光光度计(UV-2102PC),尤尼柯上海仪器有限公司;PCR仪(PTC-200),美国BIORAD公司;万分之一电子天平(TP-214),美国丹佛仪器公司。
1.3 主要试剂与耗材
琼脂糖凝胶DNA回收试剂盒,电泳级SYBR Green I荧光染料(10000×)、DL2000 DNA Marker、RNAse A(10mg/mL),购自北京天根生化公司;SYBR Premix Ex Taq荧光定量PCR试剂、Premix Ex Taq PCR试剂、λDNA溶液(0.31μg/μL),购自大连TaKaRa宝生物工程公司;Tris饱和酚、酚/仿/异丙醇(25∶24∶1)、乙醇(分析纯),购自蓝弋公司;其余未注明试剂为国产生化或分析纯试剂;
定量PCR专用96孔板,香港帝恩生物科技公司;直径分别为0.1mm和2~3mm的玻璃珠,世纪华林公司;50mL带勺采样管,上海好迪公司。
1.4 培养基与试剂配制
MRS培养基、PBS、RAN later、TE、50xTAE、Tris-SDS、3mol/L乙酸钠按试验规格配制。
1.5 试验设计
1.5.1 志愿者招募和人群试验情况
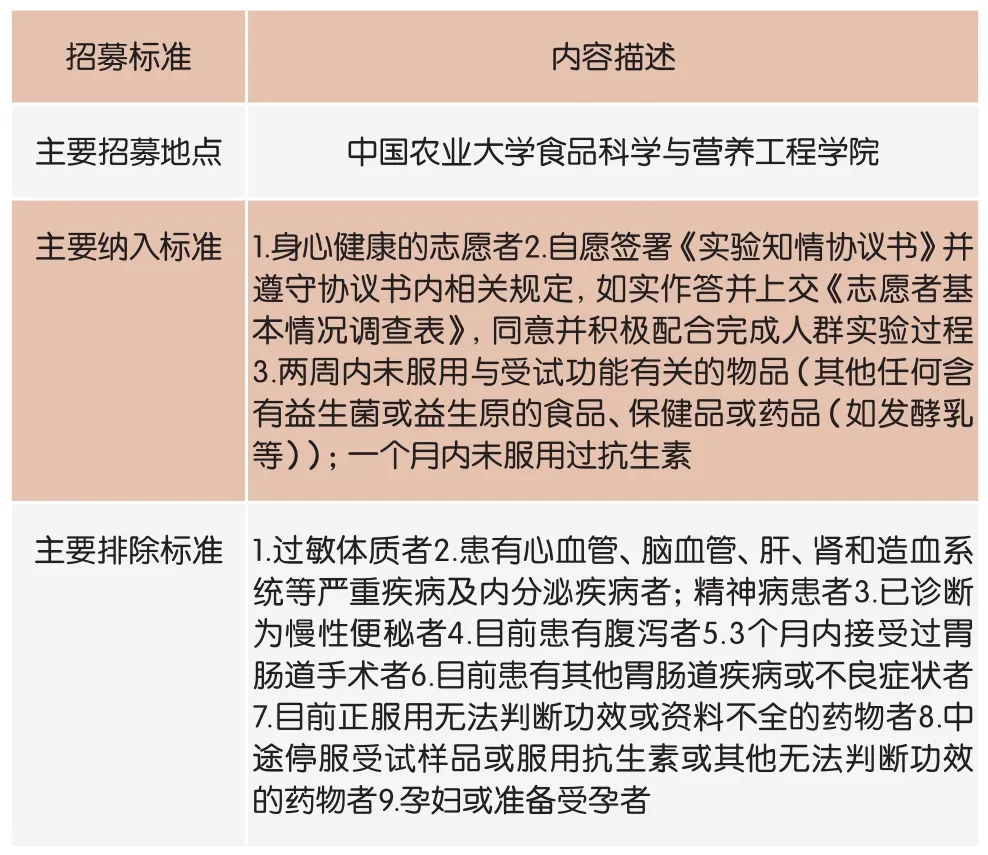
表1 志愿者招募标准
将招募的60名志愿者(招募标准见表1)以BMI [体重(kg)/身高2(m2)]为标准,随机分为人数均等的两组(组A和组B),并保证年龄、性别比例基本一致。按照图1的设计进行随机、平行、安慰剂对照的交叉人群试验。第1周为导入期,两组志愿者均服用安慰剂(无益生菌添加的植物蛋白饮料);第2周至第5周为试验期I,组A依然服用安慰剂,组B服用A6样品;第6、7周为洗脱期,两组志愿者停止服用任何受试样品;第8周至第11周为试验期II,组A服用A6样品,组B服用安慰剂。服用剂量均为50mL /次,1次/d。A6活菌制剂存放于-20℃冰箱。A6样品和安慰剂在每天上午同一时刻制备,并在4℃冰箱存放。监督志愿者服用饮料时设立为双盲,志愿者和服务人员均无法区分A6样品和安慰剂。
采样前向每名志愿者发放经编号、称重、灭菌的50mL采样管各两只(A管和B管),A管装有7mL RNA later。在试验开始前(T0)和每个试验周期结束时(T1、T2、T3和T4)各采集一次志愿者的粪便样品,每次每人采集两管,4h内交试验室保存。A管存放于4℃并在一周内提取DNA,B管存放于-80℃用于其他指标的检测。共采集5次。
本试验采用临床上常用的交叉试验(cross-over trial)设计,这是结合了自身比较和组间比较的一种经典设计思路[10],该设计属于双处理、双序列、双时期的2×2交叉试验。导入期的设置是为了使受试者更好地适应试验流程、观察有无不良反应和排除试验前有关行为的干扰;洗脱期的设置是为了尽量排除前一阶段的“残留”(residual)影响。与一般的试验组加对照组的平行试验设计相比,交叉实验能够更有效地消除实验时期差异和个体差异对结果的影响,可以节省样本量,或在样本容量相同时增加试验结果的精度与效能[11]。
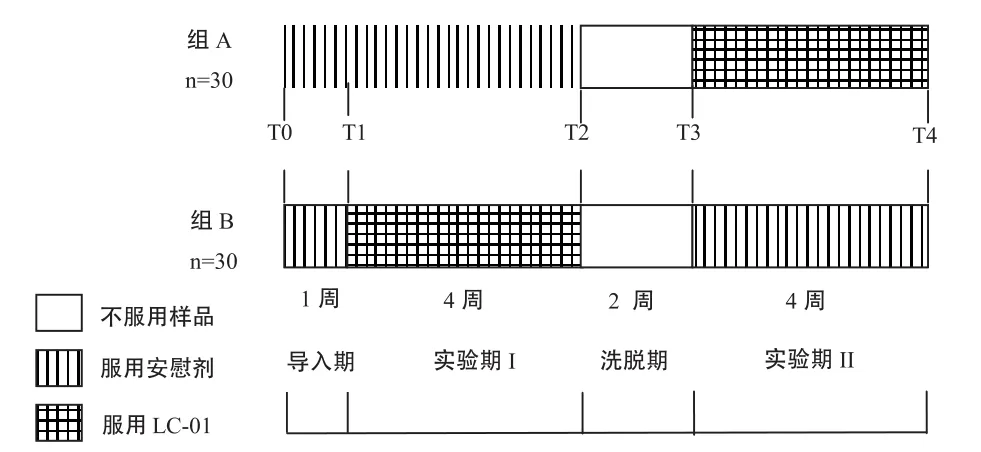
图1 人群实验流程
1.5.2 肠道菌群检测

表2 各PCR组所用引物序列、产物大小和退火温度
1.5.2.1 粪便样品DNA的提取
将上交的粪便采集管称重,用漩涡振荡器匀浆后,按试验规程进行DNA的提取。
1.5.2.2 特异性引物和定量PCR条件的确立
试验中涉及的肠道微生物组见表2的“PCR组”一栏。根据参考文献查找对应组的特异性引物,并结合普通PCR、琼脂糖凝胶电泳检测、荧光定量PCR等技术进行验证,确立引物序列和定量PCR反应条件。
PCR反应体系见表3。

表3 荧光定量PCR反应体系
反应体系为20μL。随机选择多个已提出的粪便DNA样品作为模板,分别将9个PCR组的特异性引物按照表2加样完毕后,将96孔板置于专用离心机离心30s混匀并除去气泡,小心放入Quantica荧光定量PCR仪,按照以下程序进行定量PCR反应:95℃预变性5 min;95℃ 15s、退火30s、72℃延伸30s,80℃~85℃5s检测SYBR Green及ROX(校正染料)荧光信号,进行40次循环。
为了检测PCR产物特异性,在进行定量PCR时设置从60℃逐渐升温至95℃(每个循环0.5℃),每次循环过程末期检测SYBR Green信号,绘制融解曲线。每个样品重复三次。Ct值阈值线统一设定为第3~8个循环荧光信号标准偏差的10倍。将得到的终产物用EB染色,经2%的琼脂糖凝胶电泳后,用紫外凝胶成像仪对产物进行进一步检验。
1.5.2.3 标准DNA模板的获得及拷贝数浓度的确定
使用确认的特异性引物对粪便样品DNA进行实时荧光定量PCR,将产物上样进行2%的琼脂糖凝胶电泳,用无菌手术刀将单一的目的DNA条带从琼脂糖凝胶中切下,放入干净的2mL离心管中,用洁净的移液器吸头小心地将凝胶捣碎,用琼脂糖凝胶DNA回收试剂盒进行胶回收,即可获得对应PCR组的标准DNA模板。
获得标准DNA模板后,使用SYBR Green I荧光染料,以λDNA为标准品,于荧光仪测定标准DNA模板的浓度,再根据其大小(碱基数),计算对应的拷贝数。
SYBR Green I工作液的配置:10mL TE缓冲液中加入2μL 10000× SYBR Green I荧光染料,室温避光保存,24h内使用完毕。
标准曲线的测定:将Green模块(激发波长495-525nm)安装在Modulus 9200荧光仪中。将λDNA溶液以TE缓冲液进行梯度稀释,分别制成3.875ng/mL、7.75ng/mL、15.5ng/mL、31ng/mL、77.5ng/mL、155ng/mL、310 ng/mL和775ng/mL的稀释度标品,每个浓度设三个平行。依次取50μL不同稀释度的标品于荧光比色皿中,加入50μL SYBR Green I工作液,移液器混匀,立即测定荧光值。用TE缓冲液代替标品液作为空白。测定结束后,以λDNA终浓度为横坐标,荧光值为纵坐标绘制标准曲线。
标准DNA模板拷贝数的测定:将各标准PCR组的标准DNA模板用TE缓冲液稀释至合适浓度,测定其荧光值,利用标准曲线计算DNA的质量浓度。根据1μg 1000 bp 双链DNA = 1.52 pmol = 9.1 × 1011拷贝数[18]以及标准DNA大小,计算出每个PCR组的标准DNA模板的拷贝数浓度,即对应菌的相对数量。
1.5.2.4 粪便样品中肠道菌群数量的测定和分析
分别以不同的特异性引物,将志愿者的粪便DNA样品和标准DNA模板,用荧光定量PCR仪同时进行扩增和检测。以标准DNA模版拷贝数浓度的log值和Ct值建立标准曲线及线性方程,同时计算扩增效率。根据粪便DNA样品的Ct值,由标准曲线方程计算得出对应菌的拷贝数浓度。
1.5.2.5 数据统计分析
使用Office Excel 2007软件计算每克粪便样品中各细菌组和总菌的拷贝数,同时计算不同志愿者组的平均值及标准差。利用SPSS17.0软件对结果进行统计分析,用Kolmogorov-Smirnow test对每组数据进行正态性检验,用重复测量方差分析法比较安慰剂和LC-01干预对受试者肠道菌群的影响,用t检验比较志愿者组内肠道菌群的变化,显著性水平定为P<0.05。
2 结果
2.1 志愿者招募和人群试验情况
于2015年3月在中国农业大学食品学院招募志愿者共60名。 采样人群的分组情况见表4。
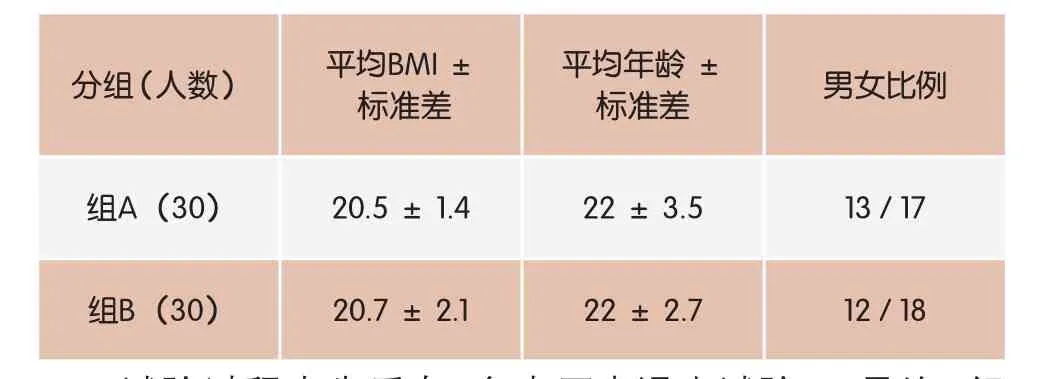
表4 采样人群分组情况
试验过程中先后有8名志愿者退出试验, 最终A组25人,B组27人。
2.2 特异性引物和定量PCR条件的确立
用9组特异性引物对粪便样品DNA进行定量PCR反应预实验,定量PCR产物电泳结果见图2。
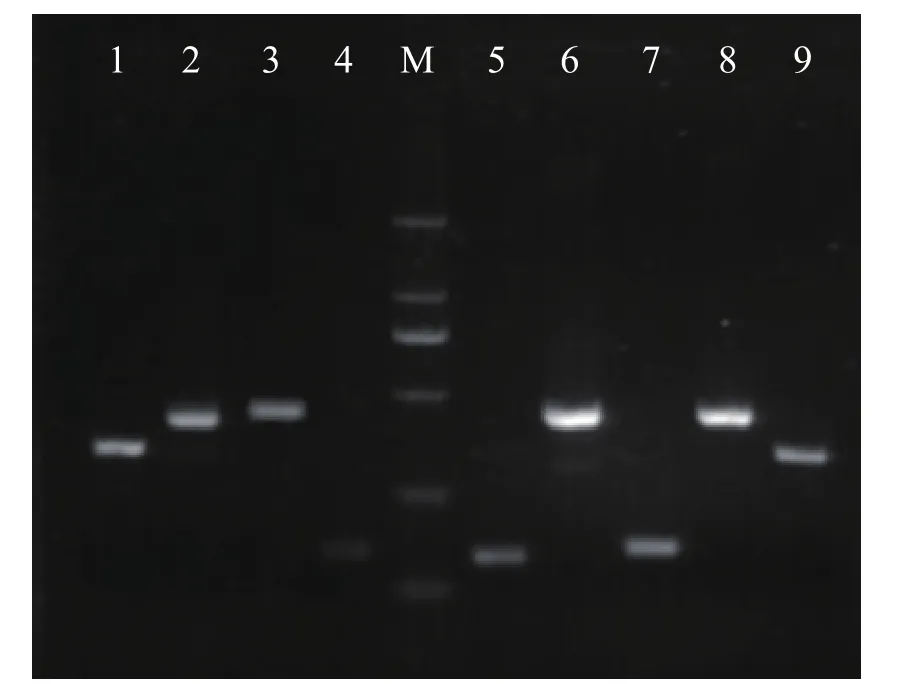
图2 9组特异性引物的PCR产物琼脂糖凝胶电泳图
如图2所示,9种引物对粪便DNA样品PCR产物的电泳条带单一、清晰;参照D2000 DNA Marker条带,产物的分子量大小也和表2中所列相符,说明引物对肠道菌群相应种属基因组的扩增碱基区段具有特异性,PCR条件满足扩增要求。
2.3 标准DNA模板的获得及拷贝数浓度的确定
SYBR Green I荧光法绘制梯度稀释的标品λDNA的荧光值,以λDNA浓度为横坐标,扣除0浓度的校准荧光值为纵坐标,绘制标准曲线,如图3所示。

图3 λDNA标准曲线
标准曲线相关系数为0.999,说明在标准液浓度范围内,DNA浓度和荧光值线性关系良好。
2.4 标准DNA模板定量PCR标准曲线的建立
以Ct值为纵坐标,拷贝数浓度为横坐标,绘制各组标准DNA模板的定量PCR反应标准曲线,并计算扩增效率。相关情况见表5。
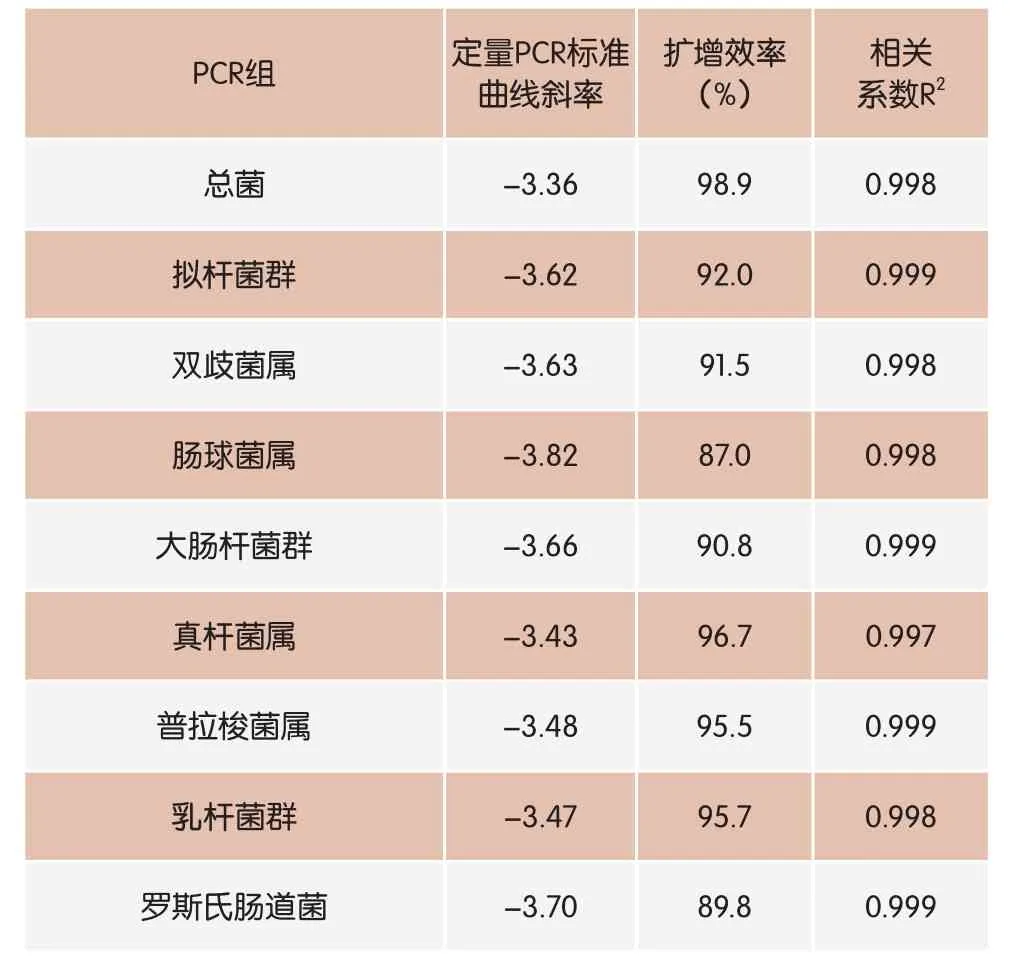
表5 定量PCR扩增效率及标准曲线相关系数
本研究中,9个PCR组的扩增效率在87.0%~98.9%之间,Rinttila等在对肠道菌群的研究中同样报道过,不同PCR组引物可能会出现扩增效率差异较大的情况,如其研究的菌群中Atopobium组的扩增效率仅有78%,但并不影响定量分析[18]。本研究中,所使用各个特异性引物均在文献被大量引用或有明确的特异性研究报道,且在正式定量之前,已经在普通PCR反应中进行了条件优化及特异性检验,定量PCR标准曲线的相关系数均在0.995以上,完全满足对肠道菌群的定量需求。
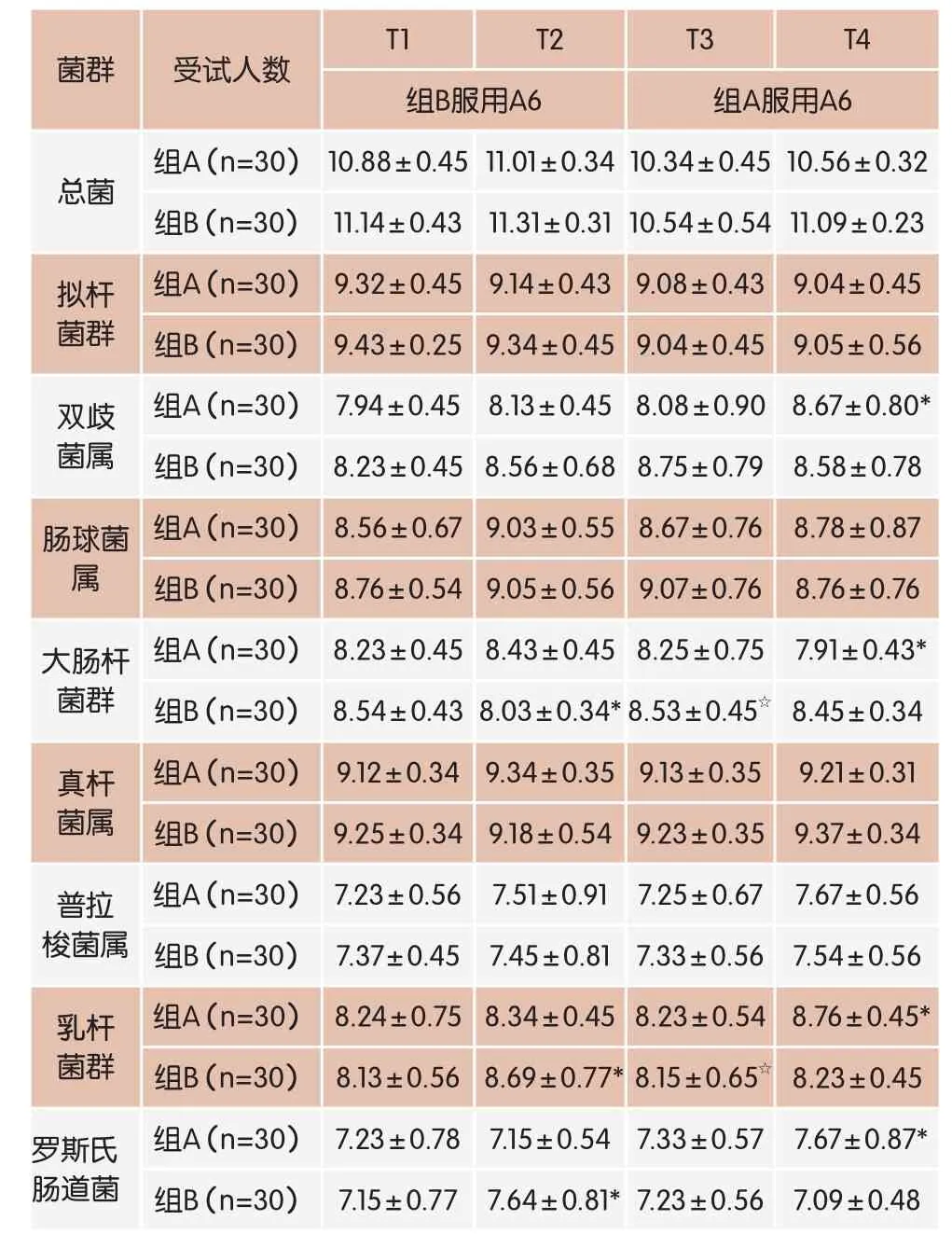
表6 两组受试人群粪便中菌群变化情况
采用配对t检验,分别比较试验期I前后(T1期与T2期)、洗脱期前后(T2期和T3期)和试验期II前后(T3期和T4期),同一组内受试者粪便中各细菌组的拷贝数浓度的均值。结果见表6。
结果发现,组A和组B的受试者在服用安慰剂前后(组A的T1期与T2期,组B的T3期与T4期)粪便中各细菌组的数量均未出现显著性的变化(P>0.05),而在服用A6样品前后(组A的T3期与T4期,组B的T1期与T2期),粪便中的大肠杆菌、乳酸菌和罗斯氏肠道菌三个细菌组的数量均出现了显著性的差异,说明服用A6样品对肠道中上述三个细菌组数量的影响显著;组A和组B的受试者粪便中双歧杆菌的数量变化趋势一致,组A由8.08 lgc/g升高到8.67 lgc/g,有显著性差异;组B则由7.94 lgc/g 升高到8.13 lgc/g,说明服用A6提升肠道中双歧杆菌的数量。
3 讨论
本研究显示,相比基线期,服用A6样品四周后,受试者粪便中Lactobacillus和Bifid obacterium的数量显著上升,Escherichia coli的数量则显著下降,已有研究表明,肠道内的Lactobacillus和Bifidobacterium对维持良好的肠道环境起着关键作用,而大肠杆菌等潜在致病菌比例的提高则会给宿主健康带来潜在危害。本研究结果说明连续口服A6四周可以调节人体肠道菌群,这种调节作用对人体健康有利。
肠道菌群的平衡与变化是十分复杂的,其与益生菌和人体环境之间的互作关系尚未探明。短链脂肪酸和氨都是肠道菌群中的特征代谢物质,是通过肠道菌群的代谢过程产生的,肠道菌群的改变对短链脂肪酸和胺的影响可能是肠道菌群对肠道环境改变的原因。肠道内的短链脂肪酸主要来自肠道菌群对碳水化合物的发酵降解,而氨既属于某些菌群成员对内源性蛋白质和尿素的降解产物,也可以作为氮源被大部分肠道菌群利用。肠道内短链脂肪酸浓度升高引起的酸度上升,可以促进以氨为氮源的肠道菌群对氨的利用,从而引起氨浓度降低肠道内的Bifidobacterium 和Lactobacillus以碳水化合物作为主要的发酵底物,代谢产物为多种短链脂肪酸,主要是乳酸。肠道内的Escherichia coli以蛋白质类物质作为主要的发酵底物,是人体内的氨产生菌之一;而Bifidobacterium的代谢主要以氨作为氮源,可以减少肠道中的氨。本研究显示,服用A6样品四周后,受试者粪便中Bifidobacterium的数量有一定程度的提高,Escherichia coli的数量和氨的浓度则出现了显著下降。此结果说明,肠道中Bifidobacterium 数量的上升和Escherichia coli数量的下降,可能降低肠道中氨的浓度。本研究发现引用A6能改变肠道菌群组成,肠道菌群对肠道环境的影响有待进一步研究。
[1] Ley R E, Peterson D A, Gordon J I. Ecological and evolutionary forces shaping microbial diversity in the human intestine[J]. Cell, 2006, 124(4): 837-48.
[2] Li M,Wang B, Zhang M, et al. Symbiotic gut microbes modulate human metabolic phenotypes[J]. Proc Natl Acad Sci U S A, 2008,105(6):2117-22.
[3] Van Hylckama Vlieg J E, Veiga P,Zhang C,et al. Impact of microbial transformation of food on health-from fermented foods to fermentation in the gastro-intestinal tract[J]. Curr Opin Biotechnol, 2011.
[4] Hooper L V,Gordon J I. Commensal host-bacterial relationships in the gut[J]. Science, 2001,292(5519):1115-8.
[5] Uronis J M, Muhlbauer M,Herfarth H H, et tal. Modulation of the intestinal microbiota alters colitis-associated colorectal cancer susceptibility[J]. PLoS One, 2009, 4(6):e6026.
[6] Shanahan F. Nutrient tasting and signaling mechanisms in the gut V. Mechanisms of immunologic sensation of intestinal contents[J]. Am J Physiol Gastrointest Liver Physiol, 2000, 278(2): G191-6.
[7] Macpherson A J,Harris N L. Interactions between commensal intestinal bacteria and the immune system[J]. Nature Rev.Immunol, 2004,4478-485.
[8] Madden J A,Hunter J O. A review of the role of the gut microflora in irritable bowel syndrome and the effects of probiotics [J] . Br J Nutr,2002, 88(Sup pl1):s67-s72.
[9] Hooper, L. V., Midtvedt, T. & Gordon, J. I. How host-microbial interactions shape the nutrient environment of the mammalian intestine. Annu. Rev. Nutr. 22, 283-307(2002).
[10] 苏炳华, 何清波. 交叉试验计量资料分析的SAS 程序[ J] .中国卫生统计, 1997; 14: 52- 55
[11] 王炳顺,王筱金,张伟明,等. 交叉临床试验中的Williams设计及检验效能分析[J]. 中国卫生统计,2009,26(1):41-44.
[12] Nadkarni M A., Martin, F. E., Jacques, N. A.,et al. Determination of bacterial load by real-time PCR using a broad-range(universal) probe and primers set[J]. Microbiology-Sgm, 2002,148,257-266.
[13] Bartosch, S.,Fite, A., Macfarlane, et al. Characterization of bacterial communities in feces from healthy elderly volunteers and hospitalized elderly patients by using real-time PCR and effects of antibiotic treatment on the fecal microbiota[J]. Applied and Environmental Microbiology, 2014,70, 3575-3581.
[14] Rinttila, T., Kassinen, A., Malinen, E., et al. Development of an extensive set of 16S rDNA-targeted primers for quantification of pathogenic and indigenous bacteria in faecal samples by real-time PCR[J]. Journal of Applied Microbiology,2004,97, 1166-1177.
[15] Malinen, E.,Kassinen, A.,Rinttila, T., et al. Comparison of realtime PCR with SYBR Green I or 5 '-nuclease assays and dotblot hybridization with rDNA-targeted oligonucleotide probes in quantification of selected faecal bacteria. Microbiology-Sgm, 2003,149,269-277.
[16] Heilig, H.,Zoetendal, E. G., Vaughan, E. E., et al. Molecular diversity of Lactobacillus spp. and other lactic acid bacteria in the human intestine as determined by specific amplification of 16S ribosomal DNA[J]. Applied and Environmental Microbiology, 2002,68, 114-123.
[17] Makivuokko, H., Forssten, S., Saarinen, M., et al. Synbiotic effects of lactitol and Lactobacillus acidophilus NCFM (TM)in a semi-continuous colon fermentation model[J]. Beneficial Microbes, 2010,1, 131-137.
[18] Fogel G B, Collins C R, Li J, et al. Prokaryotic genome size and SSU rDNA copy number: Estimation of microbial relative abundance from a mixed population[J]. Microbial Ecology,1999, 38:93-113.
Efects of Bifdobacteirum Animalis Subsp Lactis A6 on Intestinal Flora in Healthy Young Adults
GE Shao-yang1, WANG Na2, LIU Zhi-lin3, YANG Zi-biao4, WU Yong-chao3, SANG Yue3, ZHAO Liang2
(1.Postdoctoral Working Station, Beijing Resources Asia-Pacifc Feed Technology Co. Ltd. , Beijing 102600; 2.College of Food Science and Nutritional Engineering, China Agricultural University, Beijing Higher Institution Engineering Research Center of Animal Product, Beijing 100083;3 Beijing Heyiyuan Biotechnology Co. Ltd., Beijing 100089;4. Yunnan Huangshi Lesson Dairy Co. Ltd., Dali 671000)
One of the key beneficial functions of probiotics is to modulate the human intestinal microflora. Bifidobacteirum animalis subsp. lactis A6 has good physiological function activity. To evaluate the effect of the bacterium on young human intestinal microfora, a human administration trial was carried out. Totally 52 healthy adult (18~26 years old) volunteers were randomized equally to two groups. After a 1-week placebo-runin period, one group consumed vegetable protein drink supplemented with 1010colony forming units of A6 each day for the 4-week treatment period, then consumed placebo in the next treatment period, separated by a 2-week washout. The other group followed the reverse order. Group-specifc real-time PCR was used in analyses of fecal samples collected at the end of every period, to determine intestinal bacterial composition. Compared to baseline and placebo period, a signifcant inhibition in potentially pathogenic fecal Escherichia coli (P<0.001) and increase in benefcial Lactobacillus, Bifidobacterium and Roseburia intestinalis (P=0.006; 0.098; 0.010, respectively) were observed after consumption of A6. The results indicated a modulation efect of A6 on intestinal microfora of young adults, suggesting a benefcial efect on bowel health.
Bifdobacterium animalis subsp. lactis A6; Healthy young people; Intestinal fora
TS252.1
A
1004-4264(2017)01-0052-07
10.19305/j.cnki.11-3009/s.2017.01.014

第二届“牛人”摄影大赛作品 《美丽园区》——谢井林 首农畜牧
2016-12-10
云南省科技计划生物重大专项(奶业专项)(2014ZA001);北京市教育委员会中央在京高校重大成果转化项目“益生菌生产关键技术科技成果转化”项目。
葛绍阳(1986-),男,汉族,博士后。
赵亮(1983-),男,汉族,副教授,研究方向为益生菌科学。

