巴什拜羊与其杂交羊对绵羊肺炎支原体感染的比较
杜智慧,沈 文,刘海燕,王继雪,杨 义,孙延鸣
(石河子大学动物科技学院,新疆石河子 832003)
巴什拜羊与其杂交羊对绵羊肺炎支原体感染的比较
杜智慧,沈 文,刘海燕,王继雪,杨 义,孙延鸣*
(石河子大学动物科技学院,新疆石河子 832003)
为了比较巴什拜羊与其杂交羊对绵羊肺炎支原体(MO)感染的差异,将6只巴什拜羊和6只杂交羊人工感染MO,分别观察其临床症状和病理解剖变化,用ELISA方法分别检测血清中IL-1β、IL-6、IL-9及IFN-γ的浓度,制作肺部组织切片观察组织病理学变化,并进行组织病理学评分。结果显示,感染后杂交羊比巴什拜羊表现出更严重的、典型的支原体肺炎的临床症状和病理剖检变化。组织病理学评分结果显示,杂交羊的评分显著高于巴什拜羊。相关细胞因子检测结果显示,杂交羊血清中IL-1β、IL-6、IL-9及IFN-γ的浓度均显著高于巴什拜羊。结果表明,巴氏拜羊对MO感染具有一定的抗性,而杂交羊对MO较易感。
巴什拜羊;盘羊杂交羊;绵羊肺炎支原体;人工感染
羊支原体肺炎(Mycoplasmal pneumonia of sheep and goats)又称羊传染性胸膜肺炎,是由支原体感染引起的一种高度接触性传染病,其临床特征为高热,咳嗽,胸和胸膜发生浆液性和纤维素性炎症,取急性和慢性经过,病死率较高。绵羊肺炎支原体(Mycoplasmaovipneumoniae,MO)主要危害幼龄羔羊,是引起绵羊和山羊特别是羔羊增生性间质性肺炎的主要病原体,羊感染后以咳嗽、喘气、流鼻汁、贫血、生长发育迟缓、消瘦及间质性肺炎等为临床症状[1]。目前,我国大部分地区均有绵羊支原体肺炎的发生与流行,该病发病率高,死亡率逐渐上升。
巴什拜羊是新疆优秀的地方品种资源,原产中国新疆裕民县。该羊毛色以红棕色为主,体形呈方圆形,角呈棱形,颈中等长,背平直,具有生长发育速度快、产肉性能高、抗病力强等特征[2]。
盘羊(Ovisammon)又称为大角羊、大头羊、大头弯羊、亚洲巨野羊等,是体形最大的野生羊类,为国家二级保护野生动物。盘羊与巴什拜羊杂交为种间杂交,其杂交后代羔羊在早期生长发育速度很快[3]。但在以后的饲养管理中发现杂交羊大量死亡,通过对发病杂交羊的流行病学调查与MO ELISA抗体检测试剂盒诊断发现,75.5%的死亡杂交羊为MO感染,而在相同条件下饲养的巴什拜羔羊则未发现有发病与死亡情况。说明巴什拜羊和杂交羊对MO的感染易感性可能有所差异。
本试验通过对巴什拜羔羊和杂交羔羊人工感染MO,分别观察其临床症状,检测血清中相关细胞因子水平,观察病理剖检变化和组织病理学变化,从而比较巴什拜羊与其杂交羊对MO感染的差异,为进一步深入研究绵羊的抗病机理奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株和试验用动物 绵羊肺炎支原体菌株由石河子大学动物科技学院预防兽医学教研室剡根强教授赠予,与Y-98标准株的同源性为98%。6只巴什拜羊购自塔城裕民县羊场,6只杂交羊(盘羊♂×巴什拜羊♀)购自第九师170团种羊场,均为2月龄~3月龄,体重为10 kg~15 kg,MO ELISA抗体检测均为阴性。
1.1.2 主要试剂 MO专用培养基,兰州兽医研究所储岳峰研究员赠予;MO ELISA 诊断试剂盒及绵羊IL-1β、IL-6、IL-9、IFN-γ ELISA试剂盒,美国RD公司产品。
1.2 方法
1.2.1 试验羊分组与感染 体外培养MO及人工感染按参考文献[4]方法进行,采用气管内注射感染所有试验羊。感染时所使用的MO浓度约为 CCU=106/mL,2 mL/只,试验过程中饲料中均不添加抗生素。将6只巴什拜羊设为A组,6只杂交羊设为B组。
1.2.2 临床观察与MO抗体检测 每天清晨定时测量体温,并观察临床症状,直至试验结束。试验结束后宰杀试验羊,检查肺脏病变。在感染前和感染2周后,采血分离血清,使用MO ELISA诊断试剂盒检测抗体水平,按试剂盒说明书操作。
1.2.3 人工感染前后血清细胞因子的ELISA检测 在感染前(第0 d)及感染后第2、5、7、14、21天颈静脉采集所有羊的静脉血,室温倾斜放置2 h,3 000 r/min离心15 min,取上清,置-20℃保存备用。参照ELISA试剂盒说明书检测细胞因子IL-1β、IL-6、IL-9及IFN-γ的浓度。
1.2.4 病变组织观察及组织病理学评分 两组羊宰杀之后,观察肺组织病变,记录、照相。取每只羊的左右肺组织用100 mL/L福尔马林固定,进行梯度乙醇脱水、组织透明处理、浸蜡、石蜡包埋切片、HE染色,光镜下观察组织学变化,参照张慧[5]对急性支原体肺炎动物模型的组织病理学评分系统,以0~26分的组织病理学评分来确定肺部的炎症反应程度,评分包括支气管/细支气管周围浸润部位的百分比、支气管/细支气管管腔炎性细胞浸润的多少、支气管/细支气管管腔炎性渗出的严重程度、血管周围炎性细胞浸润的百分比、实质性肺炎严重程度五方面。每一侧肺的评分相加之后除以2而构成每只动物的评分。

2 结果
2.1 临床观察与MO抗体检测结果
A组巴什拜羊在感染后2 d ~3 d表现为食欲减退、体温一过性升高(40℃~41℃)、咳嗽,呼吸啰音,之后体温基本恢复正常,无死亡病例。B组杂交羊感染后表现为严重咳嗽、流浆液性鼻涕,体温升高(40℃~42℃)并持续不下,食欲减退,头颈伸直,腰背拱起,个别羊出现严重腹泻和呼吸啰音,在感染后第23天和第25天各死亡1只(共死亡2只),死亡率为33%。用MO ELISA抗体检测试剂盒检测所有试验羊血清,结果发现感染前两组羊均为阴性,感染2周后均为阳性,说明人工感染成功。
2.2 肺病变组织观察与组织病理学评分结果
在人工感染后第26天,屠宰两组试验羊,剖检后发现A组巴什拜羊的肺表面有轻微出血点(图1),个别羊胸腔有少量淡黄色液体;B组杂交羊的肺表面有黑红色至灰色不等的肝变区,稍凸出于肺表面,有出血点、出血斑及表面凸出结节(图2),切面呈大理石样,胸膜有黄白色纤维素层附着,胸膜与肋膜发生黏连,胸腔有大量淡黄色液体。
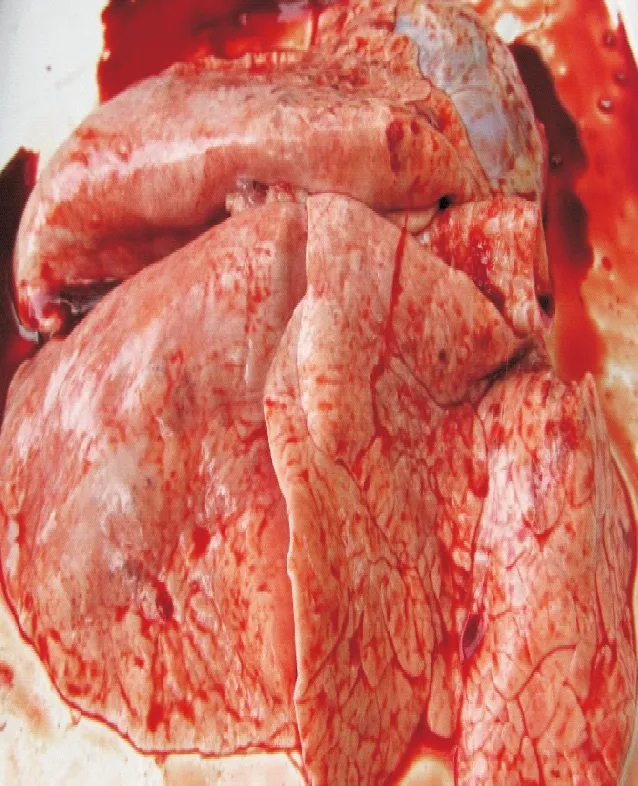
图1 感染巴什拜羊肺部表面有轻微出血点

图2 杂交羊肺部严重肉变、肝变、出血点和出血斑
肺脏组织病理学观察结果,A组巴什拜羊表现为轻度病变,肺组织结构清晰,局部视野肺间质增宽,其间有淋巴细胞、巨噬细胞及淡粉色渗出液浸润。细支气管上皮细胞排列尚规则,管腔的周围有少量炎症细胞浸润(图3)。B组杂交羊肺脏均表现重度病变,其病变范围广泛,大部分视野可见肺间质明显变宽,压迫肺间质致使连成片,肺泡腔消失,间隔内有大量淋巴细胞浸润,细支气管上皮破坏,脱落,管腔内有明显渗出,肺间质毛细血管、支气管旁小静脉淤血突出(图4)。对两个组绵羊肺部组织病理学评分,结果A组平均分为9.4,B组平均分19.9,B组评分显著高于A组的(P<0.05)。
2.3 IL-1β检测结果
人工感染MO前后两组羊血清中IL-1β水平检测结果如表1所示,感染后巴什拜羊和杂交羊血清中的IL-1β含量均高于感染前的,杂交羊血清中IL-1β含量相应高于巴什拜羊的。第21天,巴什拜羊血清中IL-1β含量降低,且显著低于杂交羊的(P<0.05)。

A.10×;B.40×

A.10×;B.40×
2.4 IL-6检测结果
如表2所示。感染后第2天至第5天,巴氏拜羊血清中IL-6的浓度显著低于杂交羊的(P<0.05),感染后第7天至第21天,巴氏拜羊极显著低于杂交羊(P<0.01)。杂交羊在感染后血清IL-6水平逐渐升高,而巴氏拜羊在感染后第5天血清IL-6水平有逐渐降低的趋势,说明杂交羊体内的炎症程度明显高于巴氏拜羊。

表1 MO感染前后两组羊血清IL-1β水平检测结果
注:同一行中,不同小写字母表示差异显著(P<0.05)。
Note:In the same line,different small letters indicate significant difference(P<0.05).

表2 MO感染前后两组羊血清中IL-6水平检测结果
注:同一行中,不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。
Note:In the same line,different small letters indicate significant difference(P<0.05); different capital letters indicate highly significant difference (P<0.01).
2.5 IL-9检测结果
如表3所示,感染后两组羊血清中IL-9水平均升高,第7天,两组羊血清中IL-9水平分别达到最高,其中巴什拜羊血清中IL-9含量极显著低于杂交羊(P<0.01)。第14天至第21天两组羊血清中IL-9含量开始下降,第14天和第21天巴什拜羊血清中IL-9含量极显著(P<0.01)和显著(P<0.05)低于杂交羊。
2.6 IFN-γ检测结果
如表4所示,感染MO后,两组羊血清中IFN-γ含量逐渐升高,且均高于感染前的水平。感染后第14天至第21天,巴什拜羊血清中IFN-γ含量开始下降,而杂交羊的则继续升高,并且杂交羊的显著和极显著高于巴什拜羊(P<0.05;P<0.01)。

表3 MO感染前后两组羊IL-9的血清浓度
注:同一行中,不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。
Note:In the same line,different small letters indicate significant difference(P<0.05); different capital letters indicate highly significant difference (P<0.01).

表4 MO感染前后两组羊IFN-γ的血清浓度
注:同一行中,不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。
Note:In the same line,different small letters indicate significant difference(P<0.05); different capital letters indicate highly significant difference (P<0.01).
3 讨论
本试验选择巴什拜羊及其杂交羊为研究对象,人工感染MO建立疾病模型,采用观察临床症状,剖检病理变化,肺部组织学病理变化,外周血中相关细胞因子变化检测,比较深入地比较了巴什拜羊及其杂交羊对MO感染的差异。
人工感染试验中,均能从两组羊血清中检测到MO抗体,说明MO人工感染成功。据海拉提·库尔曼报道[6],巴什拜羊与盘羊的杂交后代适应性差,杂交羊因呼吸道和其他疾病的死亡率与巴什拜羊的相比差异极显著(P<0.01)。试验中,A组巴什拜羊出现体温一过性升高、咳嗽和流鼻液等较轻症状,剖检症状不典型。B组杂交羊有体温升高且持续较久,咳嗽、流浆液性鼻涕、严重呼吸啰音及腹泻症状,剖检肺部出现明显的肝变和肉变以及大量出血点,死亡率33.3%。这一结果与海拉提·库尔曼的结果相似。
研究表明,肺炎支原体感染后,是通过细胞因子的诱导作用,激活内皮细胞和粒细胞,继而调节黏附因子的合成及其在细胞表面的表达,从而导致炎症的发生,并认为这些细胞因子可能是肺炎支原体致病机制之一[7]。
IL-1β是一种生物学功能非常复杂的多肽类细胞因子,是参与免疫反应与炎症反应的重要调节剂。 Yang J等[8-9]在研究肺炎支原体感染过程中发现人外周血单核细胞、人肺上皮肿瘤细胞A549、人髓单核系细胞等都表达高水平的IL-1β。在Balb/c小鼠支原体肺炎模型中,小鼠在感染初期和后期IL-1β mRNA表达水平增加[10]。本试验中,杂交羊血清中IL-1β浓度均高于巴什拜羊的,说明杂交羊感染MO更严重。
有研究表明[11],IL-6的血清浓度与患者炎症反应程度及感染的严重程度呈正相关,可作为判断病情严重程度的指标。本试验中,杂交羊血清中IL-6浓度显著或极显著地高于巴什拜羊的,说明杂交羊的炎症程度显著高于巴氏拜羊的。
IL-9是TH9细胞的效应分子,介导JAK/STAT信号通路,是参与免疫应答和免疫调节的重要细胞因子[12]。在患有支原体肺炎的儿童中发现,支原体肺炎患儿外周血Th9细胞百分率及其IL-9水平均高于健康对照组的,推测Th9细胞及IL-9的异常高表达可能参与了儿童肺炎支原体感染的过程,并可作为肺炎支原体感染患儿病情发展、转归的评价指标[13-14]。邵莉等[15]利用小鼠支原体肺炎模型研究发现,支原体哮喘组IL-9水平显著高于哮喘组和对照组的,提示支原体感染可能导致Th1/Th9的偏移,IL-9参与了炎症的发展。本试验研究结果显示,感染MO后,两组羊血清中IL-9浓度均开始升高,感染第7天至21天,杂交羊血清中IL-9浓度始终明显高于巴什拜羊的,这可能是杂交羊易感MO,故表现出典型支原体肺炎症状的原因之一,巴什拜羊在感染后第14天至第21天血清IL-9浓度开始下降,这也可能是巴什拜羊感染MO后症状轻微,表现出抗性的原因。
IFN-γ为Th1型促炎细胞因子,能抑制病毒复制、增强巨噬细胞吞噬作用。有研究表明,肺炎支原体感染的小鼠模型及支原体肺炎病人中都可以检测到IFN-γ水平升高[16-17],本试验的结果也与其相一致。在感染初期,两组羊的IFN-γ浓度都随时间延长而升高,杂交羊的在整个21 d的试验期内都是升高的,而巴什拜羊在感染后第7天就逐渐降低,趋于感染前水平,这与高伟[18]观察到感染支原体肺炎的大鼠在感染初期IFN-γ升高在恢复期降低的是一致的,说明巴什拜羊感染MO后,在短时间内可逐渐恢复,而杂交羊则不能自行恢复。
通过人工感染MO,巴什拜羊和其杂交羊在临床症状,剖检病理变化,肺部组织学病理变化,以及相关细胞因子相比有明显差异,说明巴什拜羊对MO感染具有一定的抗性,而杂交羊对MO较易感,对造成此结果具体原因,有待进一步深入研究。
[1] 鲍兴智,严 军.绵羊肺炎支原体的研究进展[J].青海畜牧兽医杂志,2009,39(6):45-46.
[2] 决肯·阿尼瓦尔,韩业东,李齐发,等.巴什拜羊微卫星标记多态性及其与生长指标关联性分析[J].中国农业科学,2010,43(16):3425-3432.
[3] 马长宾,孙延鸣,朱晓光,等.新疆野生盘羊与巴什拜羊杂交一代生产性能测定[J].畜禽业,2009(2):44-45
[4] 姜方配,沈 文,鲁海富,等.ISG15 蛋白对感染绵羊肺炎支原体的盘羊杂交羊的免疫调节作用[J].中国预防兽医学报,2013,35(11):925-928.
[5] 张 慧,赵宗胜,赵 凤,等.绵羊支原体肺炎中不同甘露 (聚) 糖结合凝集素基因型对肺组织病变的影响[J].中国预防兽医学报,2012,34(4):293-296.
[6] 海拉提·库尔曼,依明·苏来曼,杜 曼,等.巴什拜羊与野生盘羊后代杂种的适应性分析[J].新疆农业大学学报,2012,35(2):129-131.
[7] 郭海英,王明哲,陈冬梅,等.绵羊肺炎支原体感染羊细胞因子的动态变化[J].畜牧与兽医,2015,47(8):1-4.
[8] Yang J,Hooper W C,Phillips D J,et al.Regulation of proinflammatory cytokines in human lung epithelial cells infected withMycoplasmapneumoniae[J].Infect Immun,2002,70:3649-3655.
[9] Yang J,Hooper W C,Phillips D J,et al.Interleukin-1beta responses toMycoplasmapneumoniaeinfection are cell-type specific[J].Microb Pathog,2003,34:17-25.
[10] Pietsch K,Ehlers S,Jacobs E. Cytokine gene expression in the lungs of BALB/c mice during primary and secondary intranasal infection withMycoplasmapneumoniae[J].Microbiology,1994,140(8):2043-2048.
[11] Reinhart K,Menges T,Cardlund B,et al.Randomized,placebo-controlled trial of the antitumor necrosis factor antibody fragment a felmiomab in hyper inflammatory response during severe sepsis:The RAM SES Study [ J].Crit Care Med,2001,(29):765- 769.
[12] Veldhoen M, Uyttenhove C, van Snick J,et al.Transforming growth factor-beta 'reprograms' the differentiation of T helper 2 cells and promotes an interleukin 9-producing subset[J].Nat Immunol,2008,9(12):1341-1346.
[13] Shao L,Cong Z,Li X ,et al.Changes in levels of IL-9,IL-17,IFN-γ,dendritic cell numbers and TLR expression in peripheral blood in asthmatic children withMycoplasmapneumoniaeinfection[J].Int J Clin Exp Pathol,2014,8(5):5263-5272.
[14] 王建勇,郑 静,邢海燕,等.Th9细胞与IL-9在肺炎支原体感染患儿中的检测及其临床意义[J].中国当代儿科杂志,2015(4):308-311.
[15] 邵 莉,曹兰芳,李晓丽,等.支气管哮喘合并肺炎支原体感染小鼠模型白介素9、白介素17、γ 干扰素的变化[J].内科理论与实践,2016,11(1):47-51.
[16] Tanaka H,Narita M,Teramoto S,et al.Role of interleukin-18 and T-helper type 1 cytokines in the development ofMycoplasmapneumoniaepneumonia in adults[J].Chest,2002,121:1493-1497.
[17] Yang J,Hooper W C,Phillips D J,et al.Cytokines inMycoplasmapneumoniaeinfections[J].Cytokine & Growth Factor Reviews,2004,15(2):157-168.
[18] 高 伟.肺炎支原体感染的临床治疗分析及免疫学致病机制研究[D].天津:天津医科大学,2011.
Comparison ofMycoplasmaovipneumoniaeInfection between Bashbay Sheep and Its Crossbred Sheep
DU Zhi-hui ,SHEN Wen,LIU Hai-yan,WANG Ji-xue,YANG Yi,SUN Yan-ming
(CollegeofAnimalScienceandTechnology,ShiheziUniversity,Shihezi,Xinjiang,832003,China)
In order to compare the difference ofMycoplasmaovipneumoniae(MO) infection between Bashbay sheep and its crossbred sheep,6 Bashbay sheep and 6 hybrid sheep were infected with MO,and their clinical symptoms and pathological lesions were observed.IL-1β,IL-6,IL-9 and IFN-γ concentrations in sera were measured by ELISA.Histopathological lesions of lung tissues were observed by pathological sections and histopathological scores were obtained.The results showed that the post-infection hybrid sheep represented more severe,typical mycoplasma pneumonia clinical symptoms and pathological lesions than Bashbay sheep.The results of histopathological scoring found that the hybrid sheep was significantly higher than Bashbay sheep.The results of cytokine test showed that the concentrations of IL-1β,IL-6,IL-9 and IFN-γ in sera of hybrid sheep were significantly higher than those of Bashbay sheep.Bashbay sheep has certain resistance to MO infection,while hybrid sheep was more susceptible to MO.
Bashbay sheep;argali hybrid sheep;Mycoplasmaovipneumoniae;artificial infection
2016-10-25
国家自然科学基金项目 (31460686)
杜智慧(1991-),女,湖南邵东人,硕士研究生,主要从事临床兽医学研究。*通讯作者
S852.62
A
1007-5038(2017)01-0069-05