PKA信号通路影响D-半乳糖诱导老化心肌细胞舒张功能障碍的机制
刘静 郭妍
PKA信号通路影响D-半乳糖诱导老化心肌细胞舒张功能障碍的机制
刘静 郭妍
目的 探讨D-半乳糖诱导老化的心肌细胞舒张功能障碍的机制。 方法 实验用药物预处理后予以D-半乳糖建立鼠心肌细胞老化模型。分为4组:正常对照组(C组)、D-半乳糖组(D-G组)、cAMP依赖蛋白激酶A(PKA)预激动组(D-G+cAMP组)和PKA预抑制组(D-G+H-89组);测定心肌细胞肌浆网钙摄取能力,肌浆网Ca2+-ATP酶(SERCA,心脏主要是SERCA2a)活性以及Western blot 检测第16 位丝氨酸磷酸化受磷蛋白(Ser16phosphorylated phospholamban,Ser16-PLN)的含量。 结果 与C组相比,D-G组、D-G+H-89组舒张期钙离子浓度[([Ca2+]i)D]升高,钙离子回摄时间(tβ)延长,给予咖啡因刺激后,钙离子增幅(△[Ca2+]i)减少;细胞内SERCA2a活性下降以及Ser16-PLN表达下调(P<0.05)。 与D-G组相比,D-G-H-89组([Ca2+]i)D水平进一步升高,tβ进一步延长,给予咖啡因刺激后,△[Ca2+]i明显降低,SERCA2a活性下降,Ser16-PLN表达下调。而D-G+cAMP组([Ca2+]i)D水平明显降低, tβ缩短,△[Ca2+]i增高,细胞内SERCA2a明显提高,Ser16-PLN表达增加。 结论 D-半乳糖可能是通过抑制PKA通路,下调Ser16-PLN的磷酸化水平,增加对SERCA2a活性的抑制,从而引起老化心肌细胞舒张功能障碍。
蛋白激酶A; Ser16-PLN; 肌浆网Ca2+-ATP酶; 肌浆网钙失调; 心肌老化
舒张性心力衰竭(DHF)最常见于老年病人和糖尿病、高血压、肥胖等人群。DHF的主要原因是心脏衰老,随着年龄增长导致心脏泵功能的急剧下降,从而导致舒张功能障碍[1]。心肌细胞内钙失衡是心肌收缩舒张功能失调的共同原因。肌浆网(sarcoplasmic reticulum,SR)是哺乳动物心脏细胞内最重要的储存钙库,参与心脏收缩舒张的钙循环过程[2]。收缩期钙释放通道兰诺丁受体(ryanodine receptor,RyR)将SR内大量储存Ca2+释放进入胞浆,舒张期心肌细胞在受磷蛋白(phospholamban,PLN)的调节下,肌浆网Ca2+-ATP酶(sarcoplasmic reticulum Ca2+/-ATPase,SERCA)消耗ATP主动将Ca2+摄入SR[3-5]。心肌细胞内主要存在3条磷酸化通路调节心肌细胞钙转运蛋白功能,分别是cAMP依赖蛋白激酶A (cAMP-dependent protein kinase A,PKA) 、钙-钙调素依赖蛋白激酶Ⅱ (Ca2+-calmodulin dependent kinase Ⅱ, Ca2+-CaMKⅡ)及蛋白激酶C(protein kinase C, PKC) 信号通路。其中前2种途径被认为占主要作用。PKA是一种cAMP依赖性蛋白激酶,当cAMP含量增加时,PKA 被激活并从第16 位丝氨酸(Ser16)磷酸化PLN,从而解除对SERCA2a 的抑制,增强SERCA2a 的活性,从而改善心肌舒张功能障碍[6]。
D-半乳糖衰老模型的原理是D-半乳糖与蛋白质和肽中氨基酸的游离胺在体外和体内反应,引发非酶糖基化反应,形成晚期糖基化终产物(AGEs),其反应产物可进一步诱导自由基损伤,放大非酶糖基化效应,从而导致心肌细胞舒张功能减退[7]。我们前期的动物模型已证实了这一过程,本实验在细胞水平,继续以D-半乳糖诱导乳鼠心肌细胞衰老模型,并给予PKA信号通路的激活剂和抑制剂干预该信号通路,通过观察衰老心肌细胞SR钙摄取功能以及Ser16磷酸化PLN蛋白的表达,寻找D-半乳糖致心肌细胞衰老作用的胞内上游信号传导途径。
1 材料和方法
1.1 材料 SD乳大鼠(出生3 d内)由南京医科大学实验动物中心提供,动物合格证号:SCxK(苏)20020031。D-半乳糖、咖啡因、牛血清白蛋白(Sigma);DMEM培养基(GIBCO);胎牛血清(杭州四季青公司);Fura-2/AM(Invitrogen);细胞裂解液(碧云天公司,P0013B);H-89(LC Labs, Woburn, MA);cAMP(Santa Cruz,sc201564);兔抗鼠p-PLN(Ser16)抗体(abcam, ab15000 1:1000);辣根过氧化物酶标记羊抗兔二抗(abcam,ab6721 1:5000);蛋白Marker(Fermentas);PVDF膜(millipore);Supersignal West Pico-blot化学发光底物(ECL液)(Pierce)。
1.2 方法
1.2.1 原代乳鼠心肌细胞分离和培养:乳大鼠心室肌细胞的培养参照Xu等[8]的方法,无菌条件下将出生1~3 d SD乳大鼠心脏取出,留取心室,充分剪碎,多次0.06%胰酶消化完全后,差速贴壁法去除大部分成纤维细胞,随后用含20%新生牛血清及100 U/ml青霉素/链霉素的DMEM培养液将心肌细胞悬浮,以(3~4)×106/cm2接种于六孔板,37 ℃,5% CO2培养箱中培养, 48 h后可见心肌细胞成团搏动后待用。
1.2.2 实验分组和干预:将培养48 h后的原代心肌细胞分为4组:正常对照组(C组),正常培养的心肌细胞,未予任何干预; D-半乳糖组(D-G组),正常培养心肌细胞,培养48 h后,加入5 g/L D-半乳糖;PKA预激动处理组(D-G+cAMP组),在D-半乳糖诱导老化前2 h加入终浓度为1 μmol/L的PKA激动剂cAMP; PKA预抑制处理组(D-G+H-89组),在D-半乳糖诱导老化前2 h加入终浓度为10 μmol/L的PKA抑制剂H-89;各组处理完后继续培养24 h收集细胞进行指标测定。
1.2.3 Fura-2/AM荧光测定心肌细胞SR游离钙离子浓度:SR钙负荷Fura-2/AM 荧光测定[Ca2+]i的方法和浓度计算参照文献[9]。在激光共聚焦培养皿中,用Fura-2/AM荧光37 ℃孵育心肌细胞30 min后,选择搏动的心肌细胞,由图像放大的CCD(TILL成像系统,德国)采集细胞的荧光图像,并传送到计算机分析系统(Imaging Software Till 4.0)。测定发射波长340 nm与380 nm时细胞内平均荧光强度值,该比率(F340/380)被用来表示细胞内[Ca2+]i,同时扣除背景的影响。继续用Fura-2/AM荧光37 ℃孵育另一批心肌细胞30 min后,选择搏动的心肌细胞,在共聚焦培养皿中,快速加入10 mmol/L咖啡因5 μl,测定[Ca2+]i。
([Ca2+]i)D为舒张期细胞内[Ca2+]i(基线的平均值);SR钙回摄时间tβ为[Ca2+]i由峰值下降至基线所需的时间,([Ca2+]i)B为加入咖啡因10 mmol/L前[Ca2+]i的平均值;([Ca2+]i)max为加入咖啡因后[Ca2+]i的最高值,△[Ca2+]i(%)=[([Ca2+]i)max-([Ca2+]i)B]/([Ca2+]i)B×100%。至少有3批独立的实验,每批实验至少测量20个单个细胞。
1.2.4 SERCA2a 活性检测:SERCA2a 活性检测采用改良的4-硝基酚磷酸二钠(p-NPP)法[10]。收集4组培养的心肌细胞,加入4 ℃的匀浆缓冲液(20 mmol/L Hepes,2 mmol/L EDTA,250 mmol/L 蔗糖),12 000 r/min离心20 min 后收集上清进行蛋白定量及SERCA2a活性检测。10 μl上清液加入80 μl反应体系(1.25 mmol/L MgCl2,0.00125% TritonX-100,0.125 mol/L KCl,1.25 mmol/L EGTA,10 mmol/L Hepes,含或不含1 mmol/L CaCl2)中,37 ℃孵育10 min 后加入100 mmol/L p-NPP 10 μl,再孵育30 min 后加入100 μl反应终止液(500 mmol/L Tris,55 mmol/L EDTA),用分光光度计在波长405 nm 处阅读反应产生的4-硝基酚(p-NP)光密度值,并通过p-NP 标准曲线进行换算。SERCA2a 活性用每分钟每克蛋白产生的p-NP 的微摩尔数[μmol/(g·min)]表示。
1.2.5 Western blotting 检测Ser16-PLN蛋白表达量:用细胞裂解液提取细胞总蛋白,BCA法测定蛋白浓度。SDS-聚丙烯酰胺凝胶电泳(上样量为30 μg,30 mA恒流电泳),转膜(200 mA恒流电转),5%脱脂牛奶37 ℃摇床封闭2 h,一抗(Ser16-PLN)抗体1:1000, 37 ℃振动反应2 h,TBST缓冲液洗膜10 min×3次,二抗37 ℃摇床孵育2 h,TBST缓冲液洗膜10 min×3次,ECL发光液5 min,曝光。UVI自动成像分析系统(Bio-Rad公司)扫描采集图像,Gel-Pro Analyzer 软件分析Ser16-PLN蛋白和内参GAPDH的显色灰度比值,半定量检测。
2 结果
2.1 D-半乳糖诱导老化的心肌细胞SR钙摄取能力 与正常对照组比较,D-G组、D-G+H-89组([Ca2+]i)D水平明显升高,tβ明显延长,再给予咖啡因刺激后,△[Ca2+]i(%)明显降低,而D-G+cAMP组无明显差异;与D-G组比较,D-G+H-89组([Ca2+]i)D水平进一步升高,tβ进一步延长,再给予咖啡因刺激后,△[Ca2+]i(%)明显降低,而D-G+cAMP组([Ca2+]i)D水平明显降低,tβ明显缩短,咖啡因刺激后,△[Ca2+]i(%)明显增高,说明D-半乳糖可通过抑制PKA信号通路,使舒张期心肌细胞内钙超载,肌浆网摄取钙能力及钙离子储备能力显著降低(P<0.05)。见表1。
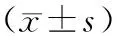
表1 心肌细胞舒张期钙离子浓度、钙离子回摄时间及钙瞬变增幅
注:与C组比较,*P<0.05;与D-G组比较,△P<0.05
2.2 D-半乳糖诱导老化的心肌细胞SERCA2a活性 与C组比较,D-G组、D-G+H-89组SERCA2a 活性均明显降低,D-G+cAMP组无明显差异;与D-G组比较,D-G+H-89组SERCA2a 活性进一步降低,D-G+cAMP组SERCA2a明显提高(P<0.05),见图1。
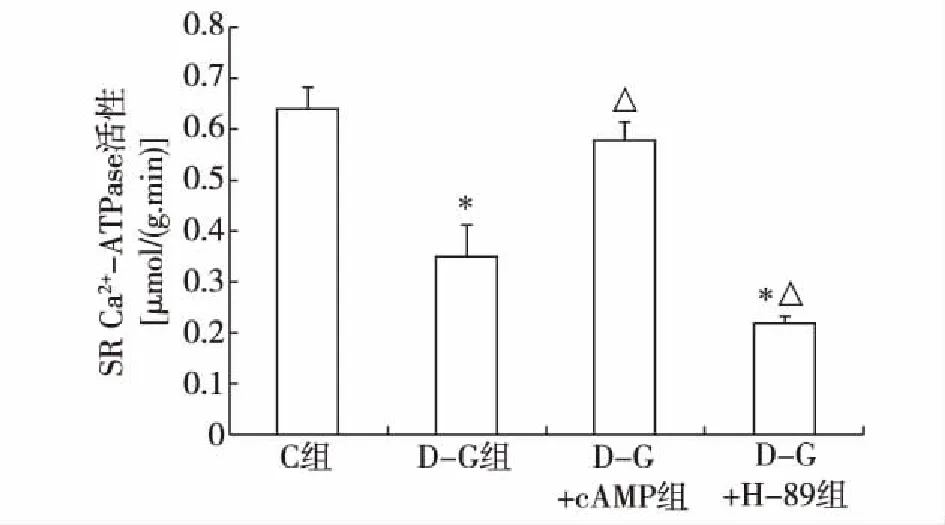
注:与C组比较,*P<0.05;与D-G组比较,△P<0.05图1 心肌细胞SERCA2a 活性检测(n=5)
2.3 D-半乳糖对心肌细胞Ser16-PLN蛋白表达的影响 与C组比较,D-G组、D-G+H-89组Ser16-PLN蛋白表达量分别下降约54%和65%,差异有统计学意义(P<0.05),与D-G+cAMP组比较,D-G、D-G+H-89组Ser16-PLN蛋白表达量分别下调51%和63%,差异有统计学意义(P<0.01),见图2。

A:Ser16-PLN 及GAPDH 蛋白Western blot 检测条带;B:Ser16-PLN 蛋白半定量结果注:与C组比较,*P<0.05;与D-G+cAMP组比较,△P<0.05图2 心肌细胞Ser16-PLN 蛋白表达变化(n=5)
3 讨论
目前心肌细胞老化机制尚未完全阐明, 但可能与非酶糖基化反应有关。非酶糖基化反应是还原糖和生物大分子在没有酶参与的条件下自发地与葡萄糖及其它还原糖反应,形成早期糖基化产物,再进一步反应生成AGEs[11]。有研究报道,AGEs增多可通过破坏细胞内钙平衡、活化信号转录子和转录激活子及信号通路等作用促使心肌细胞老化[12]。D-半乳糖是一种还原糖,我国学者王琳早在2005年就用D-半乳糖诱导心肌细胞衰老并成功建立离体心肌细胞的衰老模型[13]。本课题组在前期细胞水平实验中已证实,D-半乳糖组的AGEs含量比正常对照组增加了7倍,提示D-半乳糖诱导可促进心肌细胞的非酶糖基化反应,从而导致心肌细胞衰老。课题组进一步研究发现,老化组的钙摄取能力明显下降,说明老化的心肌细胞SR受到一定程度的损坏,且机制可能与下调SERCA2a 的活性及表达有关[14],但尚无关于SERCA2a 上游调控机制的研究。因PKA信号通路可以通过Ser16磷酸化PLN,进而增强SERCA2a 的功能,故本研究欲证实D-半乳糖是否是通过PKA信号途径调控SERCA2a,导致SR钙摄取能力降低,进一步引起心肌细胞舒张功能障碍。
本实验通过D-半乳糖建立心肌细胞老化模型,探讨在D-半乳糖致衰老心肌细胞舒张功能障碍中PKA信号通路的调节作用。结果发现,与C组相比,D-G组、D-G+H-89组([Ca2+]i)D水平明显升高,tβ明显延长,再给予咖啡因刺激后,△[Ca2+]i(%)明显降低,而D-G+cAMP组无明显差异;与D-G组相比,D-G+H-89组([Ca2+]i)D水平进一步升高,tβ进一步延长,再给予咖啡因刺激后,△[Ca2+]i(%)明显降低,而D-G+cAMP组([Ca2+]i)D水平明显降低,tβ明显缩短,咖啡因刺激后,△[Ca2+]i(%)明显增高。这与Petrova等[15]在过度表达RAGE的转基因小鼠模型上的发现有一致性,而我们的实验在细胞水平上进一步证实了老化心肌细胞可通过抑制PKA信号通路,使SR钙摄取能力及钙离子储备能力显著降低,SR受到一定程度的损坏。
接着,我们进一步检测SERCA2a的活性及PLN的磷酸化信号通路,选择PLN最主要的磷酸化位点Ser16,利用特异性磷酸化位点的抗体,计算磷酸化PLN的蛋白含量。我们发现,与C组相比, D-G组、D-G+H-89组SERCA2a 活性和Ser16-PLN蛋白表达量均明显降低,而D-G+cAMP组明显提高D-半乳糖降低的心肌细胞内SERCA2a的活性和Ser16-PLN蛋白表达量。由此,我们可以初步得出结论:PKA信号通路是参与心肌老化的一个重要过程,主要是通过抑制ser16-PLN的磷酸化水平,调节肌浆网钙调节蛋白SERCA2a的活性来影响心肌细胞内钙的分布,从而影响心肌细胞静息张力,导致心肌舒张功能障碍。
当然,我们的研究尚存在一些不足之处,例如D-半乳糖诱导的心肌细胞老化模型中可能除调节SERCA活性、抑制ser16-PLN的磷酸化水平之外还有其他作用机制有待进一步明确;此外,PLN存在3个磷酸化位点:Ser10(受PKC信号通路调节),Ser16(受PKA信号通路调节)和Thr17(受CaMKII信号通路调节),是否还可能通过CaMKⅡ或者PKC通路导老化致心肌舒张功能障碍有待进一步研究[16]。
[1] SilbermanGA, Fan TH, Liu H, et al. Uncoupled cardiac nitric oxide synthase mediates diastolic dysfunction[J]. Circulation, 2010,121(4): 519-528.
[2] Xin W, Li X, Lu X, et al. Improved cardiac function after sarcoplasmic reticulum Ca (2+)-ATPase gene transfer in a heart failure model induced by chronic myocardial ischaemia[J]. Acta cardiol, 2011, 66(1): 57-64.
[3] Bers DM. Altered cardiac myocyte Ca regulation in heart failure[J]. Physiology (Bethesda), 2006, 21: 380-387.
[4] Kranias EG, Hajjar RJ. Modulation of cardiac contractility by the phospholamban/SERCA2a regulatome[J].Circ Res. 2012, 110(12):1646-1660.
[5] Periasamy M, Bhupathy P, Babu GJ. Regulation of sarcoplasmic reticulum Ca2+ATPase pump expression and its relevance to cardiac muscle physiology and pathology[J]. Cardiovasc Res, 2008, 77(2): 265-273.
[7] Song X,Bao M,Li D, et al.Advanced glycation in D-galactose induced mouse aging model[J]. Mech Ageing Dev,1999, 108(3): 239-251.
[8] Xu XL, Chen XJ, Ji H, et al. Astragaloside Ⅳ improved intracellular calcium handling in hypoxia-reoxygenated cardiomyocytes via the sarcoplasmic reticulum Ca-ATPase[J]. Pharmacology, 2008, 81(4): 325-332.
[9] Nielsen JM, Kristiansen SB, Nørregaard R, et al. Blockage of receptor for advanced glycation end products prevents development of cardiac dysfunction in db/db type 2 diabetic mice[J]. Eur J Heart Fail, 2009, 11(7): 638-647.
[10]Krüger M, Linke WA.Titin-based mechanical signalling in normal and failing myocardium[J]. J Mol Cell Cardiol, 2009, 46(4): 490-498.
[11]Chen Y, Zhao CT, Zhen Z, et al. Association of myocardial dysfunction with vitamin D deficiency in patients with type 2 diabetes mellitus[J]. J Diabetes Complications, 2014, 28(3):286-290.
[12]Czuriga D, Paulus WJ, Czuriga I, et al. Cellular mechanisms for diastolic dysfunction in the human heart[J]. Curr Pharm Biotechnol, 2012, 13(13): 2532-2538.
[13]王琳,丁秀云, 刘漠熔,等. D-半乳糖对幼鼠心肌细胞拟衰老作用的实验[J]. 中国临床康复, 2005, 9(39):25-27.
[14]刘静, 郭妍,陈相健. 银杏叶提取物对D-半乳糖诱导心肌细胞老化的肌浆网钙摄取及 SERCA 活性的影响[J]. 江苏医药, 2011, 37(8): 869-872.
[15]Petrova R, Yamamoto Y, Muraki K, et al. Advanced glycation endproduct-induced calcium handling impairment in mouse cardiac myocytes[J]. J Mol Cell Cardiol, 2002, 34(10): 1425-1431.
[16]Mazzocchi G, Sommese L, Palomeque J, et al. Phospholamban ablation rescues the enhanced propensity to arrhythmias of mice with CaMKII-constitutive phosphorylation of RyR2 at site S2814[J]. J Physiol, 2016, 594(11):3005-3030.
Mechanism of aging-associated diastolic dysfunction in cardiomyocytes induced by D-galactose via PKA pathway
LIUJing.
DepartmentofCardiology;
GUOYan.
DepartmentofGeriatrics;theFirstAffiliatedHospitalofNanjingMedicalUniversity,Nanjing210029,China
Objective To investigate the mechanism of aging-associated diastolic dysfunction in cardiomyocytes induced by D-galactose. Methods Aging cardiomyocytes model was established by D-galactose after medication pretreatment. The cardiomyocytes were divided into four groups: normal group (group C), D-galactose group (D-G group), cAMP-dependent protein kniase A(PKA) pre-agonist group (D-G+cAMP group) and PKA pre-inhibit group (D-G+H-89 group). Cardiac sarcoplasmic reticulum calcium uptake ability of sarcoplasmic reticulum(SR), myocardial SERCA2a activity and Ser16phosphorylated phospholamban(Ser16-PLN)protein expression level were detected respectively. Results Compared with group C, increased diastolic [Ca2+]i, curtailment of the time from the maximum concentration of Ca2+to the baseline level and decreased reuptake of Ca2+stores in the SR were observed in D-G group and D-G+H-89 group. In addition, the levels of Ser16-PLN protein as well as SERCA2a activity were significantly decreased (P<0.05).Compared with D-G group, the levels of diastolic [Ca2+]iincreased, the time from the maximum concentration of Ca2+to the baseline level prolonged in D-G-89 group; The levels of diastolic[Ca2+]idecreased, the time from the maximum concentration of Ca2+to the baseline level shortened in D-G+cAMP group. After stimulated by caffeine, reuptake of Ca2+, the level of SERCA2a and Ser16-PLN deeereased in D-G-H-89 group and increased in D-G-cAMP group. Conclusions D-galactose can induce aging-associated diastolic dysfunction in cardiomyocytes through inhibiting PKA pathway, decreasing the amount of Ser16-PLN phosphorylation, and further inhibiting SERCA2a activity.
protein kinase A; Ser16-phosphorylated phospholamban; sarcoplasmic reticulum calcium ATPase; calcium homeostasis; cardiomyocyte aging
江苏省卫生厅科技项目(Z201301)
210029江苏省南京市,南京医科大学第一附属医院心血管内科(刘静),老年医学科(郭妍)
郭妍,Email:guoyan51@hotmail.com
R 737
A
10.3969/j.issn.1003-9198.2017.02.007
2016-07-19)

