白蛋白过载加重阿霉素肾病小鼠肾损害及辛伐他汀的肾脏保护作用*
李 瑶, 魏心怡, 闫俊丽, 王 墨, 吴道奇, 张高福, 阳海平, 李 秋
(重庆医科大学附属儿童医院肾脏内科,儿童发育疾病研究教育部重点实验室,儿童感染免疫重庆市重点实验室,儿童发育重大疾病国家国际科技合作基地,重庆 400014)
白蛋白过载加重阿霉素肾病小鼠肾损害及辛伐他汀的肾脏保护作用*
李 瑶, 魏心怡, 闫俊丽, 王 墨, 吴道奇, 张高福, 阳海平△, 李 秋△
(重庆医科大学附属儿童医院肾脏内科,儿童发育疾病研究教育部重点实验室,儿童感染免疫重庆市重点实验室,儿童发育重大疾病国家国际科技合作基地,重庆 400014)
目的: 探讨白蛋白过载是否可以通过脂质肾毒性加重阿霉素肾病小鼠肾脏损害及辛伐他汀的肾脏保护作用。方法: 雄性BALB/c小鼠随机分为对照组、阿霉素肾病组(ADR组)、白蛋白过载阿霉素肾病组(ADR+BSA组)和白蛋白过载阿霉素肾病辛伐他汀治疗组(ADR+BSA+SIMV组),所有小鼠行左肾切除术,第2周末构建阿霉素肾病模型,第6周末开始构建白蛋白过载模型。0、2、6、10、14周末检测24 h尿蛋白;14周末收集标本,检测血清生化指标;光镜和电镜观察肾脏组织病理;酶比色法和油红O染色法检测肾脏组织脂质水平;real-time PCR法检测肾组织IL-1β、TGF-β1和低密度脂蛋白受体(LDLr)的mRNA表达;免疫组化法检测IL-1β和IL-17的蛋白水平;ELISA检测肾组织匀浆上清IL-17的分泌。结果: 与对照组相比,ADR组肾组织IL-1β、TGF-β1、IL-17和LDLr的表达增高(P<0.05),肾组织内胆固醇含量升高(P<0.05)。ADR+BSA组较ADR组尿蛋白及血清肌酐水平增加,IL-1β、IL-17及LDLr表达均显著增加(P<0.05),肾组织脂滴沉积及肾小球硬化加重。而ADR+BSA+SIMV治疗组上述炎症因子表达下调,肾组织内胆固醇含量减少,肾小球硬化程度降低。结论: 阿霉素肾病小鼠肾组织内炎症介质可能通过上调LDLr导致肾脏局部脂质沉积,加重肾脏损害;白蛋白过载可进一步加重这一进程;而辛伐他汀可通过降低炎症介质及LDLr的表达减少脂质沉积,对肾脏起保护作用。
蛋白尿; 炎症; 阿霉素肾病; 低密度脂蛋白受体; 脂质; 辛伐他汀
蛋白尿是包括原发性肾病综合征(primary nephrotic syndrome,PNS)在内的多种肾小球疾病的主要临床表现,它是肾脏疾病的标志物之一,也可作为独立危险因素加重肾脏损害。蛋白尿造成肾脏损伤的机制可能为直接小管毒性、补体激活、氧化应激等等[1],但其具体分子机制目前仍不清楚。研究证实,蛋白尿的主要成分白蛋白可通过多种路径引起肾脏局部炎症因子的分泌[2]。而炎症与脂代谢紊乱密切相关,炎症细胞和炎症介质可通过各种信号通路参与脂质肾毒性的发生发展,在加重肾脏疾病的进程中有重要作用[3]。他汀类药物作为经典的降脂药物被广泛应用,近年来报道它可以通过降血脂以外独立的抗炎作用而起到肾脏保护[4]。
本实验拟在复制阿霉素肾病小鼠基础上,构建白蛋白过载肾病模型,旨在观察持续大量蛋白尿是否可通过对肾脏局部炎症因子及脂质的调节而加重肾脏病变,探讨蛋白尿加重肾脏损害及辛伐他汀肾脏保护作用的可能机制。
材 料 和 方 法
1 动物与试剂
SPF级雄性健康BALB/c小鼠,6~7周龄,22~23 g,由重庆医科大学实验动物中心提供,许可证号为SYXK(渝)2012-0001。
阿霉素购自Pharmacia;牛血清白蛋白(bovine serum albumin, BSA)和ELISA试剂盒购自Sigma;抗IL-17抗体购自Abcam;抗IL-1β抗体购自Santa Cruz;辛伐他汀购自杭州默沙东公司;考马斯亮蓝试剂盒购自北京天根生化科技公司;油红O试剂购自北京鼎国昌盛生物技术有限责任公司;总胆固醇测试盒购自南京建成生物工程研究所。
2 方法
2.1 模型的建立及处理方案 所有小鼠随机分为对照(control, CTL)组、阿霉素肾病(adriamycin neph-ropathy, ADR)组、白蛋白过载阿霉素肾病组(ADR+BSA组)和白蛋白过载阿霉素肾病辛伐他汀(simvastatin, SIMV)治疗组(ADR+BSA+SIMV组),每组各8只。根据前期研究方法复制阿霉素肾病小鼠模型[5]及白蛋白过载阿霉素肾病小鼠模型[6]。第2周末,ADR组及ADR+BSA组一次性尾静脉注射阿霉素(10.5 mg/kg),其余以生理盐水代替。第6周末,ADR+BSA组腹腔注射牛血清白蛋白(10 mg/g体重,5次/周,共4周),其余3组用生理盐水代替。ADR+BSA+SIMV组在ADR+BSA组相同干预方式基础上,建模4周起每天给予辛伐他汀(10 mg/kg)灌胃,共8周,其余以等量生理盐水替代,于注射阿霉素后第12周末结束实验,实验周期为14周。2.2 24 h尿蛋白的定量测定 第0、2、6、10、14周末应用小鼠代谢笼收集小鼠24 h 尿液,考马斯亮蓝法检测24 h 尿蛋白定量。
2.3 血清生化指标检测 于第14周末收集小鼠血清,全自动生化分析仪(Dimension Rxl)直接法检测小鼠血清总胆固醇(total cholesterol,TC)、白蛋白(albumin,ALB)、肌酐(creatinine,Cr)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)和高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)水平。
2.4 光镜和电镜观察肾组织的病理学改变 各组肾组织常规固定、脱水、石蜡包埋及切片(厚度3 μm)后行HE和PAS染色。根据文献[7],统计肾小球硬化指数(glomerulosclerotic index,GSI)。取肾组织约1 mm×1 mm×1 mm用3%戊二醛固定,经染色、脱水、浸透、包埋等步骤后,应用Hitachi透射电镜进行观察。
2.5 酶比色法和油红O检测肾组织胆固醇 按总胆固醇测试盒说明书利用酶比色法检测肾组织匀浆上清总胆固醇,计算出相应胆固醇含量。油红O染色是将新鲜肾组织制成15 μm厚的冰冻切片,经过固定、染色、60%异丙醇漂洗、苏木素复染等步骤后,甘油明胶封片,光镜下观察脂质沉积。
2.6 Real-time PCR检测IL-1β、TGF-β1和低密度脂蛋白受体(low density lipoprotein receptor,LDLr)的mRNA水平 RNA提取及逆转录等具体方法均按操作说明进行。用于real-time PCR扩增的引物序列见表1。

表1 引物序列
2.7 免疫组织化学法检测IL-17和IL-1β的蛋白表达 肾脏石蜡切片经常规脱蜡、水化、抗原修复、封闭内源性过氧化物酶、山羊血清封闭后,滴加对应抗体,4 ℃孵育过夜,滴加Ⅱ抗,显微镜控制下 DAB 显色。封片后采集图片。
2.8 ELISA 法检测肾组织匀浆上清的IL-17浓度 取肾组织匀浆液上清,按照小鼠 IL-17 ELISA 试剂盒操作步骤,计算小鼠肾组织匀浆上清IL-17质量浓度。
3 统计学处理
用GraphPad 5.01统计软件进行分析。统计值采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(one-way ANOVA),以P<0.05为差异有统计学意义。
结 果
1 24小时尿蛋白定量
ADR组小鼠自实验6周开始较对照组出现蛋白尿,6~14周尿蛋白均较对照组增高(P<0.01);ADR+BSA组小鼠6周以后出现尿蛋白较其余各组显著升高(P<0.01),并持续到实验结束;ADR+BSA+SIMV组小鼠尿蛋白水平较对照组增高(P<0.01),但低于ADR+BSA组,见图1。
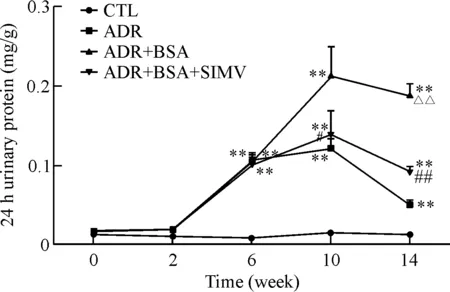
Figure 1.The 24 h urinary protein levels at different periods. Mean±SD.n=8.**P<0.01vsCTL group;△△P<0.01vsADR group;#P<0.05,##P<0.01vsADR+BSA group.
图1 24 h尿蛋白定量
2 血清生化指标
相比于对照组,ADR组小鼠血清白蛋白有所降低,肌酐增加(P<0.01),总胆固醇及低密度脂蛋白增加(P<0.05);相比于ADR组,ADR+BSA组血清白蛋白和肌酐增高,而总胆固醇降低(P<0.01);ADR+BSA+SIMV组较ADR+BSA组血清白蛋白及总胆固醇无显著差异,肌酐显著下降(P<0.01),见表2。
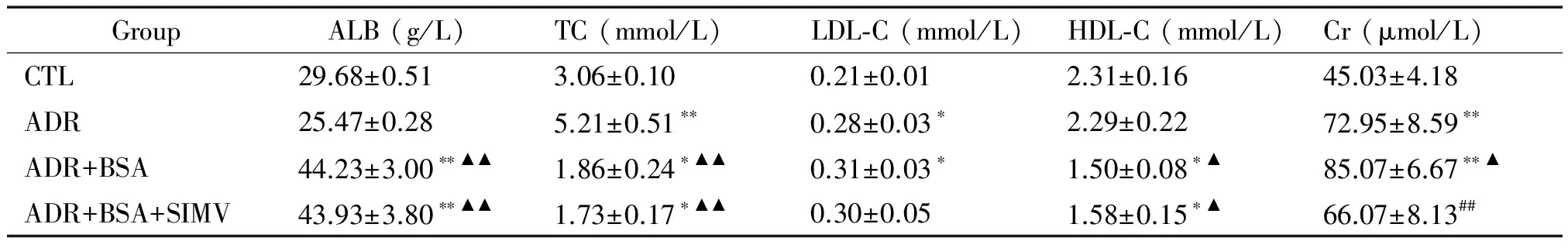
表2 血清生化指标检测结果的比较
*P<0.05,**P<0.01vsCTL group;▲P<0.05,▲▲P<0.01vsADR group;##P<0.01vsADR+BSA group.
3 肾脏组织病理改变及GSI的比较
对照组肾小球及肾小管形态结构正常,ADR组光镜下球囊粘连,部分血管袢血管腔缩小或闭塞;系膜增生,肾间质见较多炎症细胞浸润;电镜下可见肾小球足突局部融合,基底膜局部增厚,肾小管可见少量脂滴。ADR+BSA组肾小球及肾小管不同程度萎缩,肾小球及肾间质大量炎症细胞浸润,系膜基质增宽,基底膜广泛增厚,电镜下肾小球足突广泛融合,肾小管上皮细胞脂滴沉积增多,病变程度较 ADR 组加重。ADR+BSA+SIMV组的病变明显减轻,见图2、3。ADR组的GSI为(1.05±0.12)%,ADR+BSA组的GSI为(2.43±0.43)%,ADR+BSA+SIMV组的GSI为(1.37±0.28)%,均明显高于对照组[(0.25±0.12)%](P<0.01);ADR+BSA组的GSI高于ADR组和ADR+BSA+SIMV组(P<0.01),见图4。
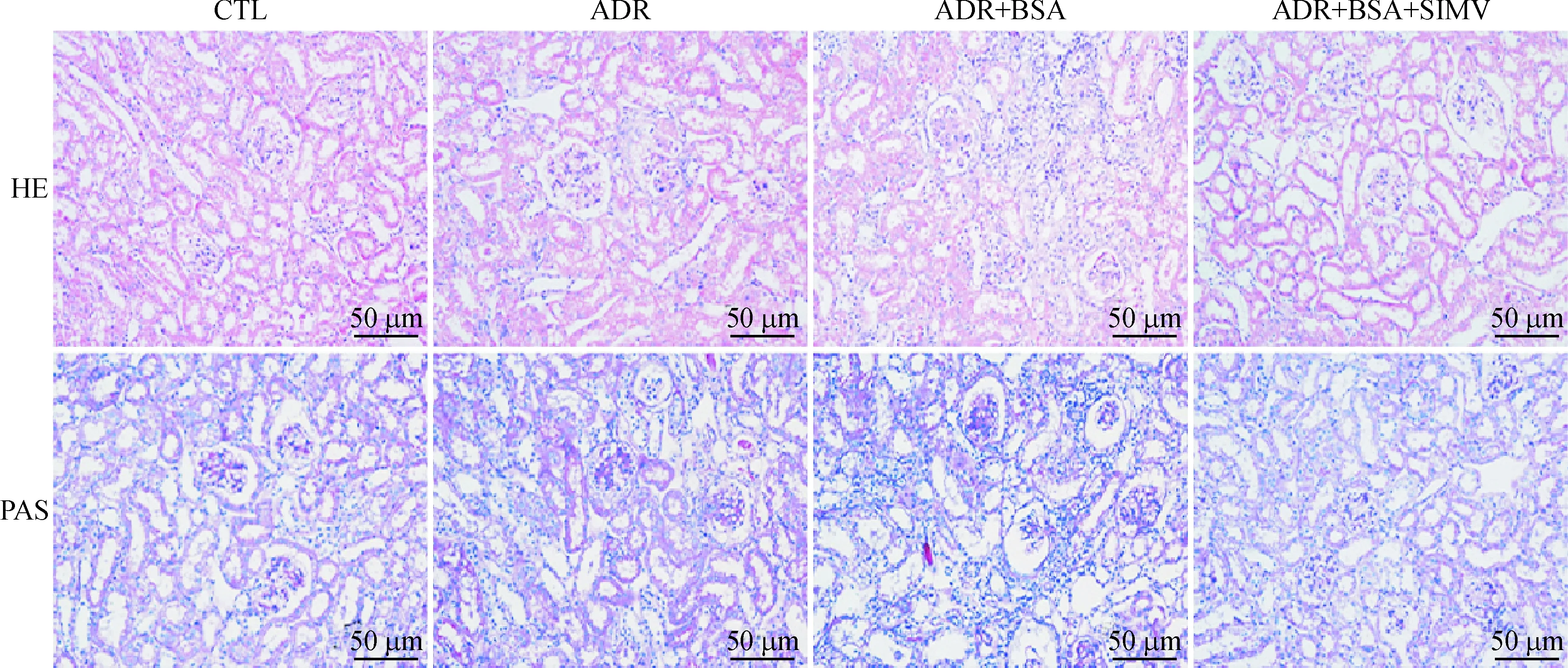
Figure 2HE staining and PAS staining of renal tissues at the 14th week (×200).
图2 小鼠肾脏HE和PAS染色结果
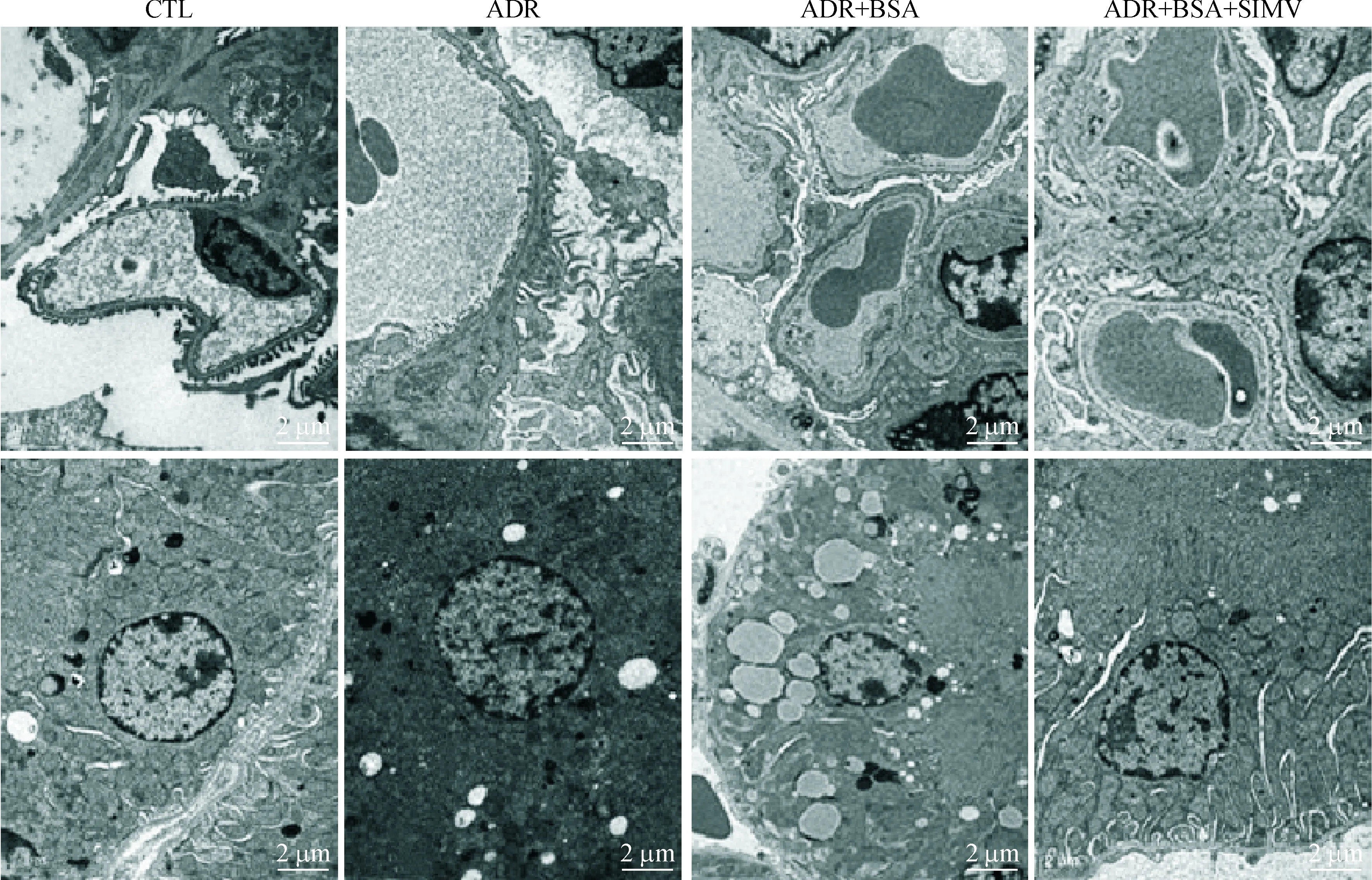
Figure 3.The morphological changes of the renal tissues under transmission electron microscope at the 14th week (×8 000).
图3 肾脏组织透射电镜观察
4 肾组织匀浆的胆固醇含量
与对照组肾匀浆胆固醇含量相比,ADR组及ADR+BSA组均显著升高(P<0.01),治疗组较ADR+BSA组显著降低(P<0.01),见图5。
5 肾脏组织油红O染色
对照组肾组织内未见脂滴沉积,ADR组可见少量细小红色脂滴沉积于肾小球和肾小管细胞内,ADR+BSA组可见大量红色脂滴,较ADR组明显,治疗组脂滴较模型组减少,见图6。
6 肾脏组织IL-1β、TGF-β1和LDLr mRNA的表达
与对照组相比,ADR组的IL-1β、TGF-β1与LDLr的mRNA表达水平显著升高(P<0.05);ADR+BSA组IL-1β和LDLr的mRNA表达水平高于ADR组(P<0.05);ADR+BSA+SIMV组IL-1β、TGF-β1和LDLr的mRNA水平低于ADR+BSA组,差异有统计学意义(P<0.05),见图7。
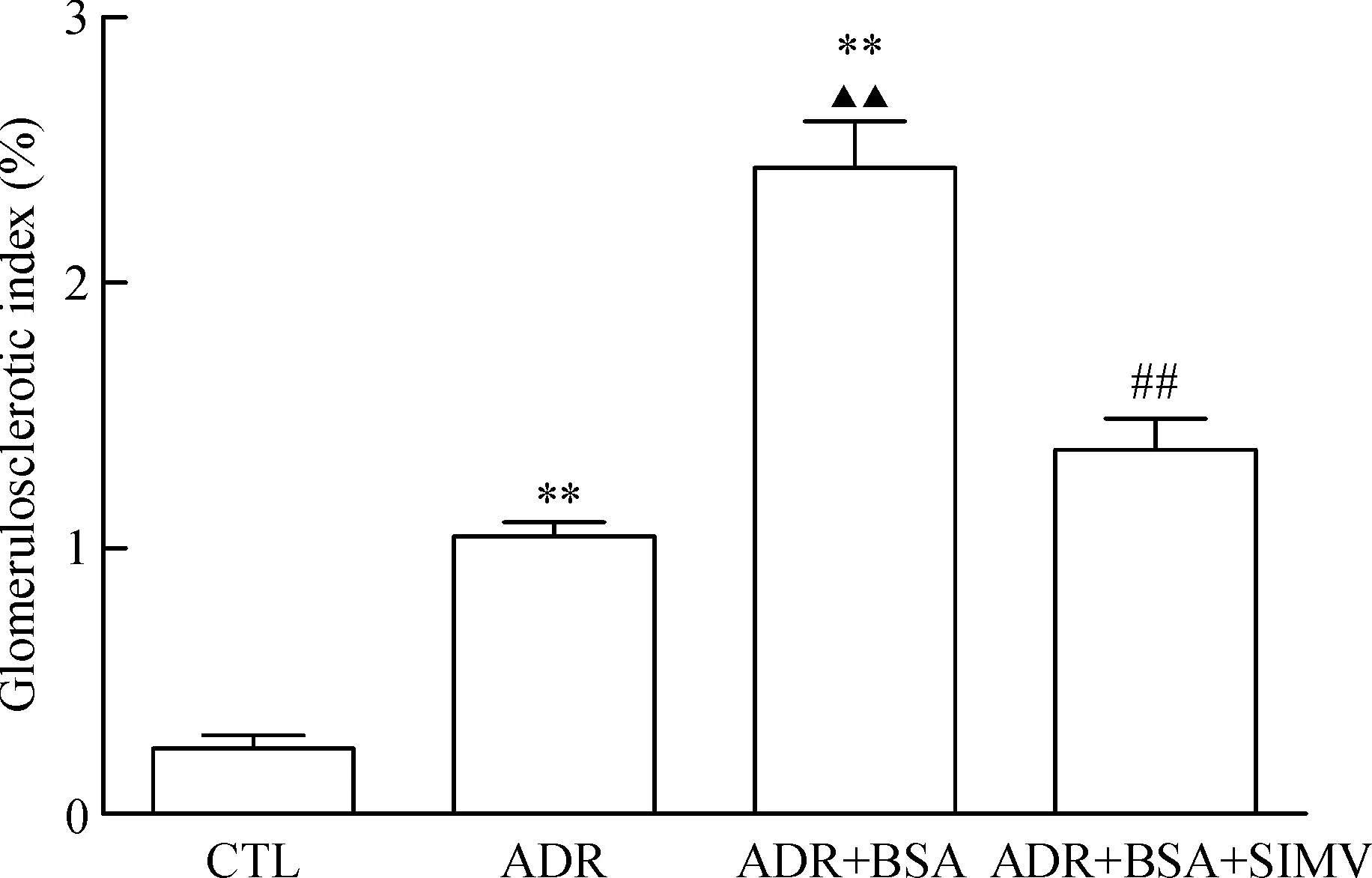
Figure 4.The glomerulosclerotic index of the renal tissues at the 14th week. Mean±SD.n=8.**P<0.01vsCTL group;▲▲P<0.01vsADR group;##P<0.01vsADR+BSA group.
图4 肾小球硬化指数检测

Figure 5.The changes of the cholesterol levels in the kidney. Mean±SD.n=8.*P<0.05vsCTL group;▲P<0.05vsADR group;#P<0.05vsADR+BSA group.
图5 肾组织匀浆胆固醇含量的比较
7 肾脏免疫组化
与对照组相比,ADR组的IL-1β升高,IL-17表达上调(P<0.01);与ADR组比较,ADR+BSA组的IL-1β及IL-17表达显著升高(P<0.01),表达于肾小球及肾小管间质。ADR+BSA+SIMV组的IL-1β及IL-17表达减少(P<0.01),见图8。
8 ELISA 法检测肾组织匀浆上清的IL-17 浓度
ADR+BSA组的IL-17浓度较ADR组显著升高(P<0.01),ADR+BSA+SIMV组的IL-17较ADR+BSA组显著降低(P<0.01),见图9。
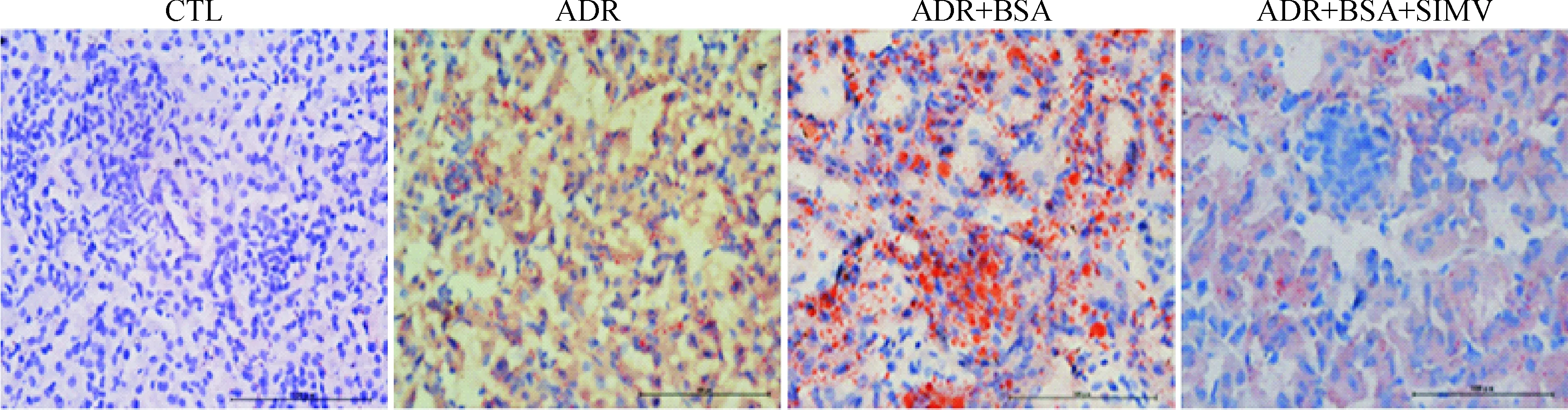
Figure 6.Oil red O staining of the renal tissues at the 14th week (×400).
图6 各组肾组织油红O染色观察
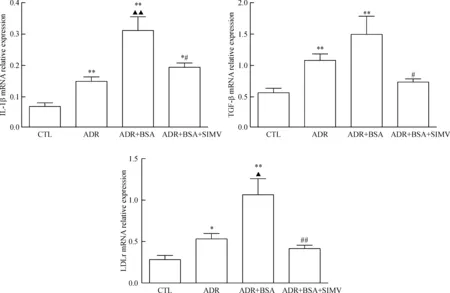
Figure 7.The mRNA expression of IL-1β, TGF-β1 and LDLr in the renal tissues detected by real-time PCR. Mean±SD.n=8.*P<0.05,**P<0.01vsCTL group;▲P<0.05,▲▲P<0.01vsADR group;#P<0.05,##P<0.01vsADR+BSA group.
图7 Real-time PCR 检测各组肾脏组织IL-1β、TGF-β1和LDLr的mRNA表达
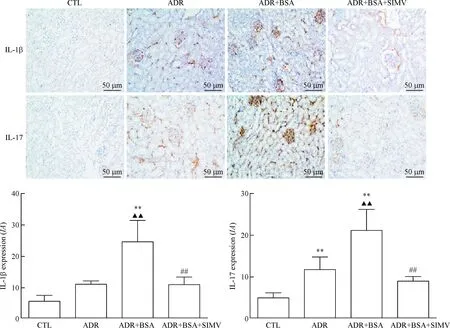
Figure 8.Immunohistochemical observation of IL-1β and IL-17 in the renal tissues (×400). Mean±SD.n=8.**P<0.01vsCTL group;▲▲P<0.01vsADR group;##P<0.01vsADR+BSA group.
图8 肾组织IL-1β和IL-17的表达
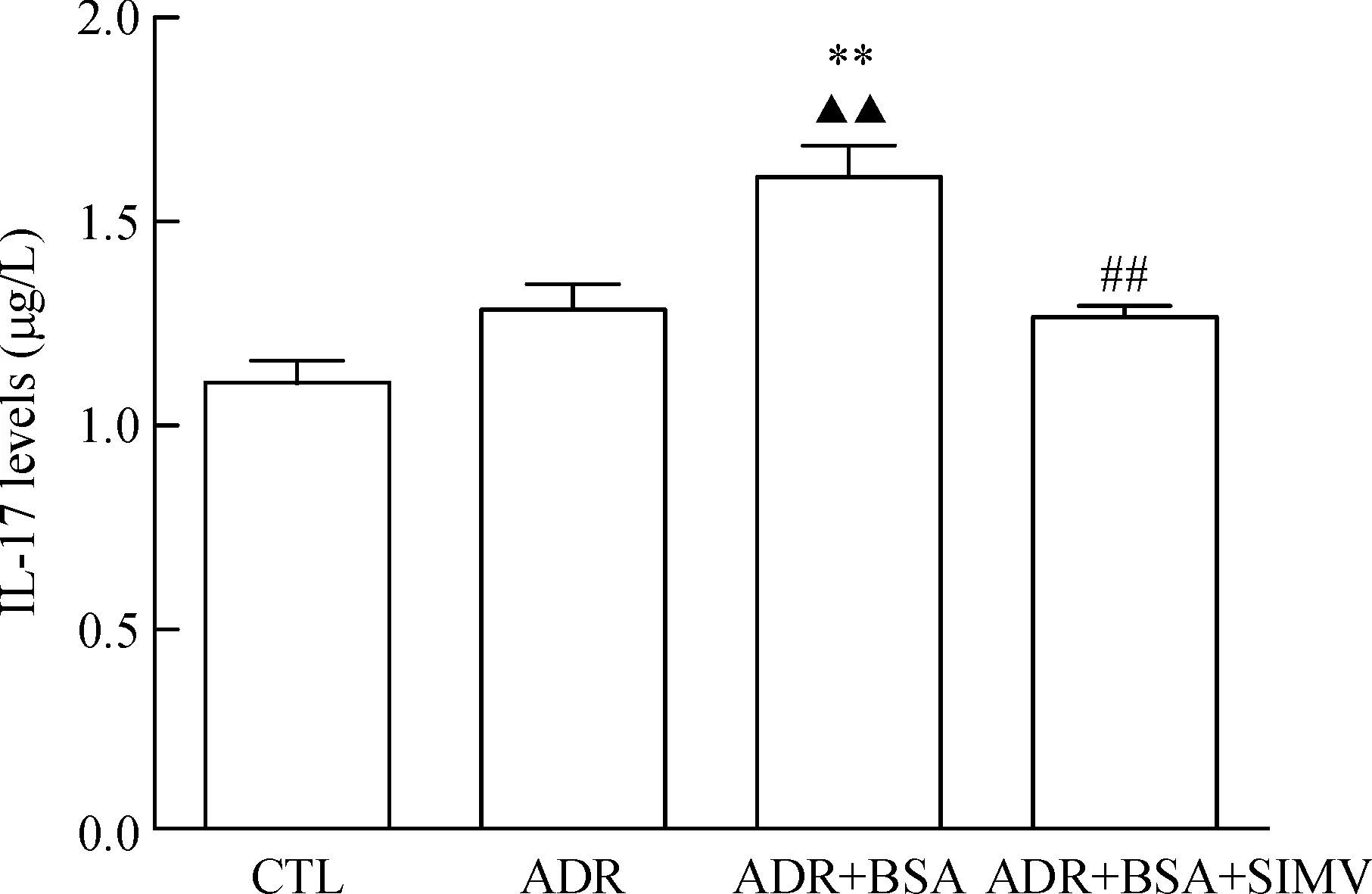
Figure 9.The IL-17 levels in the supurnatants of renal tissue homogenates. Mean±SD.n=8.**P<0.01vsCTL group;▲▲P<0.01vsADR group;##P<0.01vsADR+BSA group.
图9 ELISA 法检测肾组织匀浆上清IL-17表达
9 相关性分析
肾组织胆固醇表达与肾小球硬化指数呈正相关(r=0.8146,P<0.01)。肾脏局部LDLr的表达与肾组织胆固醇含量呈显著正相关(r=0.4428,P<0.01)。肾脏组织内 IL-1β(r=0.7314)、TGF-β1(r=0.4458)和IL-17(r=0.5100)的表达与LDLr呈显著正相关(P<0.05)。
讨 论
PNS是儿童最常见的慢性肾脏疾病,也是引起我国儿童慢性肾功能衰竭的重要原发疾病之一,目前儿童PNS的病因和发病机制尚不清楚。大量蛋白尿是PNS的重要特征,它不仅是肾小球损伤严重程度的指标,其本身更是引起肾脏病变持续进展的独立危险因素。所以,探明蛋白尿引起肾脏损伤的机制对保护肾脏至关重要。
本课题组前期已成功建立了阿霉素肾病小鼠模型及白蛋白过载阿霉素肾病小鼠模型,本实验成功复制了以上模型,为后续研究奠定了基础。
尿蛋白可通过多种途径加重肾脏损害和促进慢性肾病的进展[8]。研究表明,白蛋白过载可引起肾脏近端小管细胞和足细胞内质网应激和凋亡发生[9];通过激活补体系统旁路途径,攻膜复合物C5b-9直接造成小管损伤[10];同时,蛋白尿中超滤蛋白可引起如趋化因子、黏附因子和前炎症细胞因子的一系列生物标志物表达改变造成肾脏毒性作用[11]。本实验发现了ADR+BSA组症性因子IL-1β、TGF-β1和IL-17的高表达,提示白蛋白过载导致的大量蛋白尿可引起炎症因子的高表达。
课题组前期已证实,炎症介质可能作为导致肾脏局部脂代谢异常的启动因素,通过抑制细胞本身存在的胆固醇代谢反馈调节机制干扰破坏胆固醇稳态平衡,上调LDLr表达,从而使胆固醇在细胞内异常积聚形成泡沫细胞,促进脂质在细胞的沉积[12]。脂质在肾脏固有细胞沉积造成脂质肾毒性是发生肾脏损害的重要危险因素[13]。但是,蛋白尿是否可以通过刺激炎症反应造成脂质肾毒性目前未见报道。本实验结果显示,ADR组IL-1β、TGF-β及IL-17等炎症介质升高,ADR+BSA组进一步升高,同时LDLr表达上调、脂质沉积明显,肾小球硬化加重,肾组织LDLr与IL-1β、TGF-β1和IL-17表达呈正相关,提示蛋白尿可通过刺激炎症反应造成脂质沉积进一步加重肾脏损伤,但ADR+BSA组血清LDL-C和HDL-C水平较ADR组并无显著性差异,提示判断肾脏损伤程度可能需结合外周血胆固醇水平与肾脏局部炎症状态等因素综合考虑。
辛伐他汀属于3-羟基-3-甲基戊二酰辅酶A还原酶抑制剂,通过阻断甲羟戊酸途径而降低血浆胆固醇水平。除此之外,甲羟戊酸是细胞内一些信号蛋白的前体物质,参与细胞的信号转导、转录因子的活化等重要的生理过程[14],因此他汀类药物的非调脂作用日益受到重视。本课题组既往已报道,辛伐他汀在不影响阿霉素肾病大鼠血脂的情况下可显著改善肾小球硬化程度[15]。本研究发现,辛伐他汀治疗组对血浆总胆固醇无显著影响,而显著降低尿蛋白、肾脏局部炎症介质及脂质沉积。
综上所述,本研究提示在阿霉素肾病模型,炎症通过LDLr途径介导肾脏脂质沉积导致的脂质肾毒性是肾小球硬化的重要危险因素,白蛋白过载导致的持续大量蛋白尿可进一步上调肾脏局部炎症因子和LDLr的表达,辛伐他汀可以主要通过肾脏局部抗炎效应降低LDLr表达,减少肾脏脂质沉积,从而达到肾脏保护作用。
[1] Abbate M, Zoja C, Remuzzi G. How does proteinuria cause progressive renal damage?[J]. J Am Soc Nephrol, 2006, 17(11): 2974-2984.
[2] Ding LH, Liu D, Xu M, et al. Enalapril inhibits tubulointerstitial inflammation and NLRP3-inflammasome expression in BSA-overload nephropathy of rats[J]. Acta Pharmacol Sin, 2014, 35(10):1293-1301.
[3] Wahl P, Ducasa GM, Fornoni A. Systemic and renal li-pids in kidney disease development-and progression[J]. Am J Physiol Renal Physiol, 2016, 310(6):F433-F445.
[4] Athyros VG, Katsiki N, Karagiannis A, et al. Statins can improve proteinuria and glomerular filtration rate loss in chronic kidney disease patients, further reducing cardiovascular risk. Fact or fiction?[J]. Expert Opin Pharmacother, 2015, 16(10):1449-1461.
[5] 刘 练, 张高福, 李 秋, 等. 阿霉素肾病小鼠的肾脏病理转变过程[J]. 中国实验动物学报, 2014, 22(2):13-16.
[6] 魏心怡, 阳海平, 李 秋, 等. 白蛋白过载对阿霉素肾病小鼠肾脏C3a-C3aR信号通路及IL-17的影响[J]. 免疫学杂志, 2015, 31(5):369-374.
[7] Rodriguez-Iturbe B, Quiroz Y, Shahkarami A, et al. Mycophenolate mofetil ameliorates nephropathy in the obese Zucker rat[J]. Kidney Int, 2005, 68(3):1041-1047.
[8] Lee VW, Harris DC. Adriamycin nephropathy: a model of focal segmental glomerulosclerosis [J]. Nephrology, 2011, 16(1):30-38.
[9] Cheng YC, Chen CA, Chang JM, et al. Albumin overload down-regulates integrin-β1 through reactive oxygen species-endoplasmic reticulum stress pathway in podocytes[J]. J Biochem, 2015, 158 (2):101-108.
[10]Bagnasco S, Racusen L. Proteinuria and epithelial-to-me-senchymal transition: the role of complement[J]. J Am Soc Nephrol, 2009, 20(3):459-460.
[11]Zoja C, Morigi M, Remuzzi G. Proteinuria and phenotypic change of proximal tubular cells[J]. J Am Soc Nephrol, 2003, 14(1):36-41.
[12]Zhang G, Li Q, Wang L, et al. The effects of inflammation on lipid accumulation in the kidneys of children with primary nephrotic syndrome[J]. Inflammation, 2010, 34 (6):645-652.
[13]施 静, 崔晶晶, 李 秋, 等. IL-1β通过加重脂质诱导的内质网应激导致人系膜细胞损伤[J]. 中国病理生理杂志, 2013, 29(7):1230-1234.
[14]Satirapoj B, Promrattanakun A, Supasyndh O, et al. The effects of simvastatin on proteinuria and renal function in patients with chronic kidney disease[J]. Int J Nephrol, 2015:485839.
[15]Zhang W, Li Q, Wang L, et al. Simvastatin ameliorates glomerulosclerosis in adriamycin-induced nephropathy rats[J]. Pediatr Nephrol, 2008, 23(12):2185-2194.
(责任编辑: 陈妙玲, 罗 森)
Albumin overload aggravates kidney injury and renoprotective effect of simvastatin in adriamycin nephropathy mice
LI Yao, WEI Xin-yi, YAN Jun-li, WANG Mo, WU Dao-qi, ZHANG Gao-fu, YANG Hai-ping, LI Qiu
(DepartmentofNephrology,Children’sHospitalofChongqingMedicalUniversity,MinistryofEducationKeyLaboratoryofChildDevelopmentandDisorders,ChongqingKeyLaboratoryofChildInfectionandImmunity,ChinaInternationalScienceandTechnologyCooperationBaseofChildDevelopmentandCriticalDisorders,Chongqing400014,China.E-mail:oyhp0708@163.com;liqiu809@126.com)
AIM: To investigate the aggravating effect of albumin overload on the kidney injury induced by lipid nephrotoxicity, and to observe the renoprotective effect of simvastatin (SIMV) on adriamycin nephropathy (ADR) mice. METHODS: SPF healthy male BALB/c mice were randomly divided into control group, ADR group, ADR with bovine serum albumin (BSA) overload (ADR+BSA) group, and ADR with both BSA overload and SIMV treatment (ADR+BSA+SIMV) group. All mice were uninephrectomized under general anesthesia 2 weeks before setting up ADR model. ADR+BSA model started to be set up 4 weeks later. At the end of the 0th, 2nd, 6th, 10th and 14th weeks, 24 h urinary protein was evaluated. At the end of the 14th week, the serum biochemical indexes and the kidney pathological changes were observed, and glomerulosclerotic index (GSI) was also evaluated. The cholesterol in the kidney was measured by enzymic colorimetric method and oil red O staining. The expression of IL-1β, TGF-β1 and low-density lipoprotein receptor (LDLr) in the kidney tissues was determined by real-time PCR. The expression of IL-1β and IL-17 was measured by immunohistochemistry and the expression of IL-17 in the kidney was measured by ELISA. RESULTS: Compared with control group, the expression of IL-1β, TGF-β1, IL-17 and LDLr, and cholesterol content in the kidney and the GSI were all significantly increased in ADR group (P<0.05). Compared with ADR group, 24 h urinary protein, serum creatinine, the expression of IL-1β, IL-17 and LDLr, and cholesterol content in the kidney were all significantly increased in ADR+BSA group (P<0.05). Treatment with SIMV significantly decreased the expression of IL-1β, TGF-β1, IL-17 and LDLr. The accumulation of cholesterol in the kidney and the GSI were also decreased (allP<0.05). CONCLUSION: Inflammation aggravates the lipid deposition and glomerular sclerosis by increasing the expression of LDLr in ADR mice. Albumin overload further accelerates the progressive kidney damage by regulating the expression of IL-1β, TGF-β1 and IL-17, which promotes the increase in LDLr. The beneficial effect of SIMV might be mediated by its anti-inflammatory effect.
Proteinuria; Inflammation; Adriamycin nephropathy; Low-density lipoprotein receptor; Lipid; Simvastatin
1000- 4718(2017)02- 0308- 07
2016- 08- 25
2016- 11- 03
国家自然科学基金资助项目(No. 81270802);国家自然科学基金青年科学基金资助项目(No. 81200520)
R692.6; R363
A
10.3969/j.issn.1000- 4718.2017.02.019
杂志网址: http://www.cjpp.net
△通讯作者 阳海平 Tel: 023-63709645; E-mail: oyhp0708@163.com; 李 秋 Tel: 023-63603929; E-mail: liqiu809@126.com

