HCMV感染对人THP-1细胞HLA-G及其受体表达的影响*
赖媚媚, 周秋菊, 楼韵燕, 郭彬瀚, 王慧燕, 郑晓群△
(1温州医科大学附属第二医院、附属育英儿童医院检验科,浙江 温州325027; 2温州医科大学检验医学院, 检验医学教育部重点实验室,浙江 温州325035)
HCMV感染对人THP-1细胞HLA-G及其受体表达的影响*
赖媚媚1, 2, 周秋菊1, 2, 楼韵燕1, 2, 郭彬瀚1, 2, 王慧燕1, 2, 郑晓群1, 2△
(1温州医科大学附属第二医院、附属育英儿童医院检验科,浙江 温州325027;2温州医科大学检验医学院, 检验医学教育部重点实验室,浙江 温州325035)
目的: 研究人巨细胞病毒(HCMV)感染对人THP-1细胞人类白细胞抗原G(HLA-G)异构体及其受体表达的影响,探讨HLA-G在HCMV逃逸宿主免疫应答中的作用。方法: HCMV Towne株感染THP-1细胞后,采用RT-PCR和Western blot 检测HLA-G异构体mRNA和蛋白水平,流式细胞术检测THP-1细胞HLA-G及其表面受体ILT2、ILT4的表达,ELISA检测细胞培养上清中IL-10及可溶性HLA-G(sHLA-G)水平,同时检测细胞存活率。结果: HCMV感染后细胞未出现明显凋亡,细胞存活率高。 HCMV感染THP-1细胞1 d后HLA-G1、-G3、-G4和-G5的mRNA表达明显上调,HLA-G1和HLA-G5的蛋白表达明显上调。THP-1 细胞HLA-G、ILT2和ILT4的表达在感染1 d后明显上调。 sHLA-G水平在感染1 d后显著升高,与对照组比较,差异有统计学意义(P<0.01)。THP-1细胞培养上清液IL-10水平在感染1 d后明显上调,与对照组比较,差异有统计学意义(P<0.05)。结论: HCMV感染THP-1细胞能诱导HLA-G异构体的差异表达,以HLA-G1和HLA-G5为主,且上调其表面受体ILT2/ILT4的表达。同时,HCMV感染能诱导THP-1细胞分泌IL-10。该研究为进一步探讨HCMV逃避机体免疫应答的机制提供实验依据。
人巨细胞病毒; 人类白细胞抗原G; 抑制性受体; 感染
人巨细胞病毒(human cytomegalovirus,HCMV)属于疱疹病毒科β亚科的DNA病毒,是一种机会性病原体[1-2]。病毒感染后,机体快速启动的固有免疫和获得性免疫能有效地清除病毒。但HCMV形成了多种机制来逃避机体免疫系统的监视和防御,并在体内长期潜伏[3-4],如抑制NK细胞杀伤功能、编码细胞因子和趋化因子的类似物、干扰MHCⅠ类分子的功能和调节MHCⅡ类分子的表达等。
人类白细胞抗原G(human leukocyte antigen-G,HLA-G)属于非经典HLA-I类分子,是体内一种重要的免疫耐受分子。初级转录产物经选择性剪接,产生7种异构体,即膜结合型分子(HLA-G1、-G2、-G3、-G4)和可溶型分子(HLA-G5、-G6、-G7)。其主要通过与多种免疫细胞表达的特异性受体(ILT2/CD85j、ILT4/CD85d、KIR2DL4/CD158d)结合发挥免疫抑制作用,包括抑制CD4+T细胞的增殖和树突状细胞的抗原提呈,抑制NK细胞和CTL细胞的杀伤功能,刺激抗原提呈细胞分泌TGF-β、IL-10等细胞因子,上调抑制性受体的表达[5]。
近年来,虽在HCMV感染免疫逃逸方面取得了显著进展,但迄今为止其持续感染的分子免疫调控机制仍不明确。经典MHC分子参与抗原的递呈机制,一直是病毒感染免疫的研究重点。但有研究显示:非经典的MHCⅠ类分子HLA-G在病毒感染后免疫逃逸机制中亦发挥了关键作用,HCMV诱导HLA-G的表达已有报道,但仍不全面或存在争议[6-7],因此,我们用HCMV感染THP-1细胞后,研究HCMV感染THP-1细胞对HLA-G异构体及其受体表达的影响,以进一步发现和了解HLA-G在HCMV感染后持续潜伏中的作用。
材 料 和 方 法
1 细胞株及病毒株
HCMV Towne株购自中国典型培养物保藏中心,THP-1细胞株购自中国科学院上海细胞库。
2 主要试剂
RPMI-1640培养液及胎牛血清购自Gibco;RevertAid First Strand cDNA Synthesis Kit购自Thermo;SDS-PAGE配胶试剂、RIPA裂解液、PMSF和BCA试剂盒购自碧云天生物技术研究所;HLA-G (4H84)I抗购自Abcam;HLA-G (MEM-G/9)I抗购自Exbio;ILT2 (CD85j)和ILT4 (CD85d)抗体购自eBioscience;人IL-10和可溶性HLA-G(soluble HLA-G, sHLA-G)ELISA试剂盒购自联科生物技术有限公司;Annexin V-FITC/PI细胞凋亡检测试剂盒购自Life Technologies;PCR引物由生工生物工程(上海)股份有限公司合成,详见表1。

表1 HLA-G PCR扩增所需引物的序列
3 方法
3.1 细胞感染模型的建立 纯化后的HCMV Towne株感染THP-1细胞(1×109/L,MOI=5),置于37 ℃、5% CO2饱和湿度的培养箱中培养1~4 d后,每天半量换液,模型建立及确定与我们之前的研究相符合[8]。
3.2 HLA-G异构体 mRNA表达水平的检测 提取感染组和未感染组THP-1细胞的总 RNA并测定其浓度,按照Thermo的cDNA合成试剂盒说明进行逆转录操作,PCR扩增后进行琼脂糖电泳验证。
3.3 Western blot实验 提取感染组和未感染组THP-1细胞的总蛋白,按照BCA法进行蛋白浓度测定,蛋白样品加热变性后将不同蛋白样品之间的浓度调到一致,上样进行Western blot检测,使用抗HLA-G (4H84)检测HLA-G蛋白水平。4H84是用HLA-G α1结构域61~83位氨基酸片段免疫小鼠BALB/c而获得的,所有的HLA-G亚型都包含α1结构域,因此,4H84可以识别所有的HLA-G亚型。
3.4 流式细胞术检测THP-1细胞HLA-G及其受体ILT2、ILT4的表达 收集未感染组和感染组THP-1细胞,分别往两管中加入5 μL抗HLA-G(MEM-G/9)和同型对照/CD85j和同型对照/CD85d和同型对照,混匀后,避光30 min,30 min内上机,流式细胞术检测THP-1细胞HLA-G、ILT2和ILT4的表达。
3.5 ELISA检测细胞培养上清中sHLA-G和IL-10水平 根据人sHLA-G和IL-10 ELISA试剂盒使用说明书的步骤检测细胞培养上清中sHLA-G和IL-10。
1) 采样。按前述药效试验处理和药剂喷施方法,于各重复小区取一芽2叶茶青混合装入保鲜袋,药前采样记录为CK;药液喷施完毕,叶片表面药液水分挥发后采集的样品记为0 d,其他采样时间分别为药后1 d、3 d、5 d、7 d、10 d、15 d、21 d和30 d。
4 统计学处理
所有实验重复 3 次,结果用SPSS 20.0 统计软件进行分析。两组间比较采用t检验,多组间比较采用单因素方差分析(one-way ANOVA)。以P<0.05为差异有统计学意义。
结 果
1 Annexin V-FITC/PI检测THP-1细胞的存活率
HCMV感染THP-1细胞1~4 d后,用Annexin V-FITC/PI检测THP-1细胞的存活率及凋亡率,结果显示HCMV感染THP-1细胞后,细胞的存活率较高,细胞未出现明显凋亡,与对照组比较,无显著差异,见图1。这说明HCMV感染THP-1细胞后,THP-1仍保持生存状态,病毒感染不对细胞造成明显损伤,所建立的细胞模型是可取的。
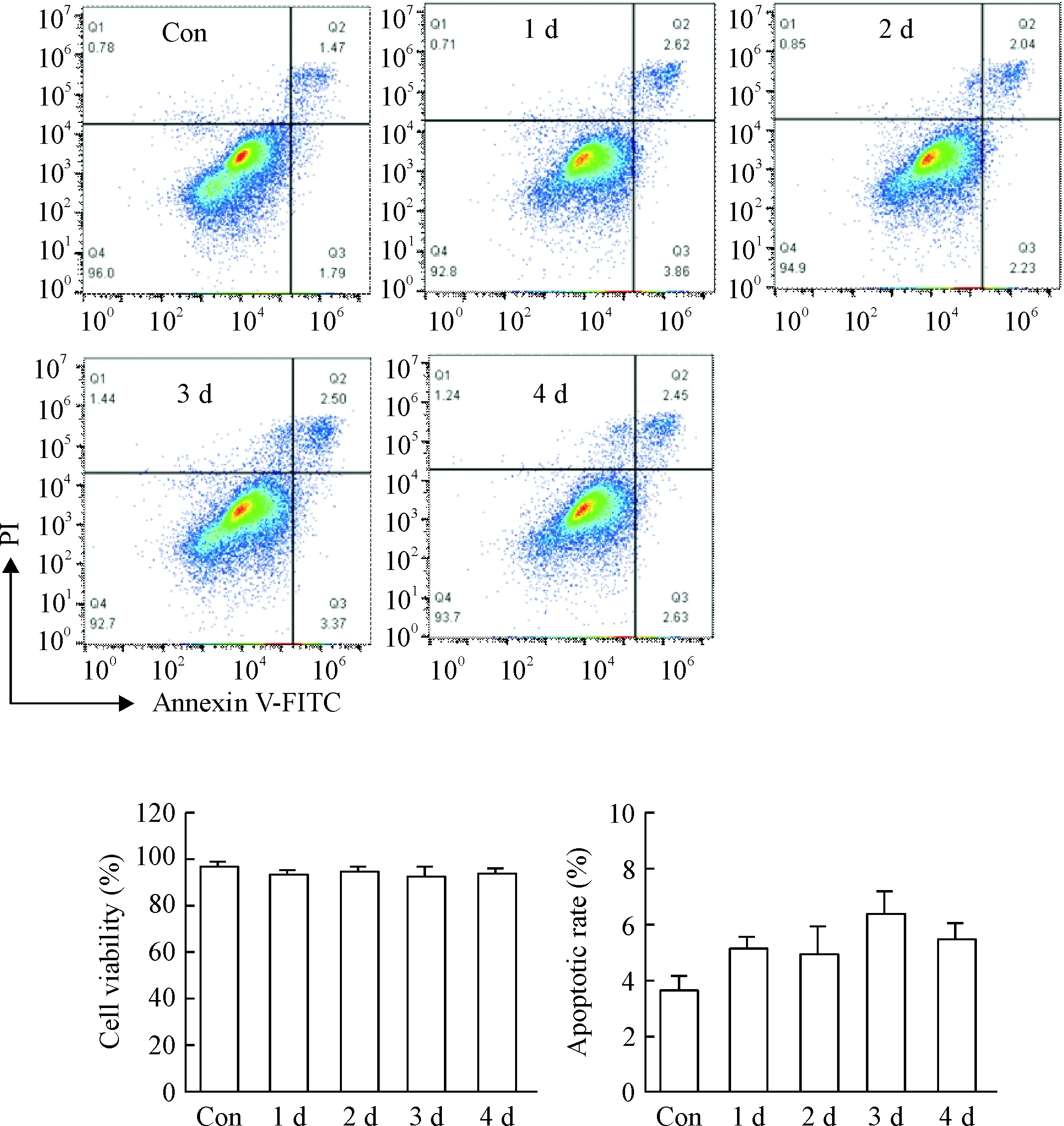
Figure 1.The viability of THP-1 cells infected with HCMV. Con: control group; Q1: necrotic cells; Q2: non-viable apoptotic cells; Q3: viable apoptotic cells; Q4: normal cells. Mean±SD.n=3.
图1 HCMV感染对THP-1细胞存活率的影响
2 HCMV感染THP-1细胞诱导HLA-G 异构体的表达
HCMV感染THP-1细胞1~4 d后,无论是RNA水平还是蛋白水平,均能诱导HLA-G异构体的差异表达。结果显示HLA-G异构体mRNA的表达以HLA-G1、-G3、-G4和-G5为主,相较对照组,以感染后1 d表达上调最为明显。Western blot实验结果显示HLA-G蛋白的表达以HLA-G1和HLA-G5为主。感染1 d后HLA-G1和HLA-G5 蛋白的表达明显上调,见图2。
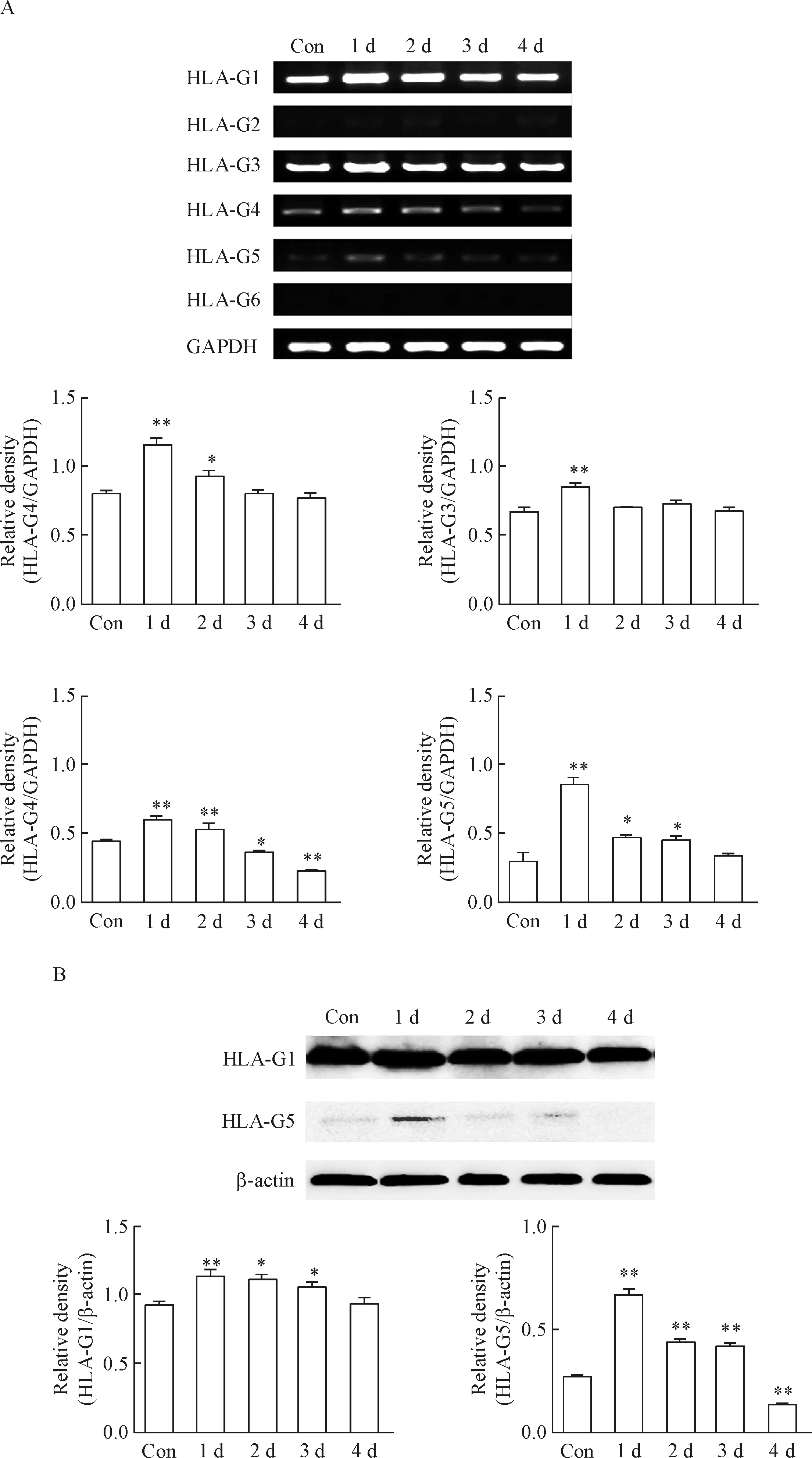
Figure 2. HCMV induced expression of HLA-G isoforms in the THP-1 cells. A: the expression of HLA-G isoforms at mRNA level; B: the expression of HLA-G isoforms at protein level. Mean±SD.n=3.*P<0.05**P<0.01vscontrol (Con) group.
图2 HCMV感染THP-1细胞诱导HLA-G异构体的表达
3 HCMV感染THP-1细胞诱导HLA-G、ILT2和ILT4的表达
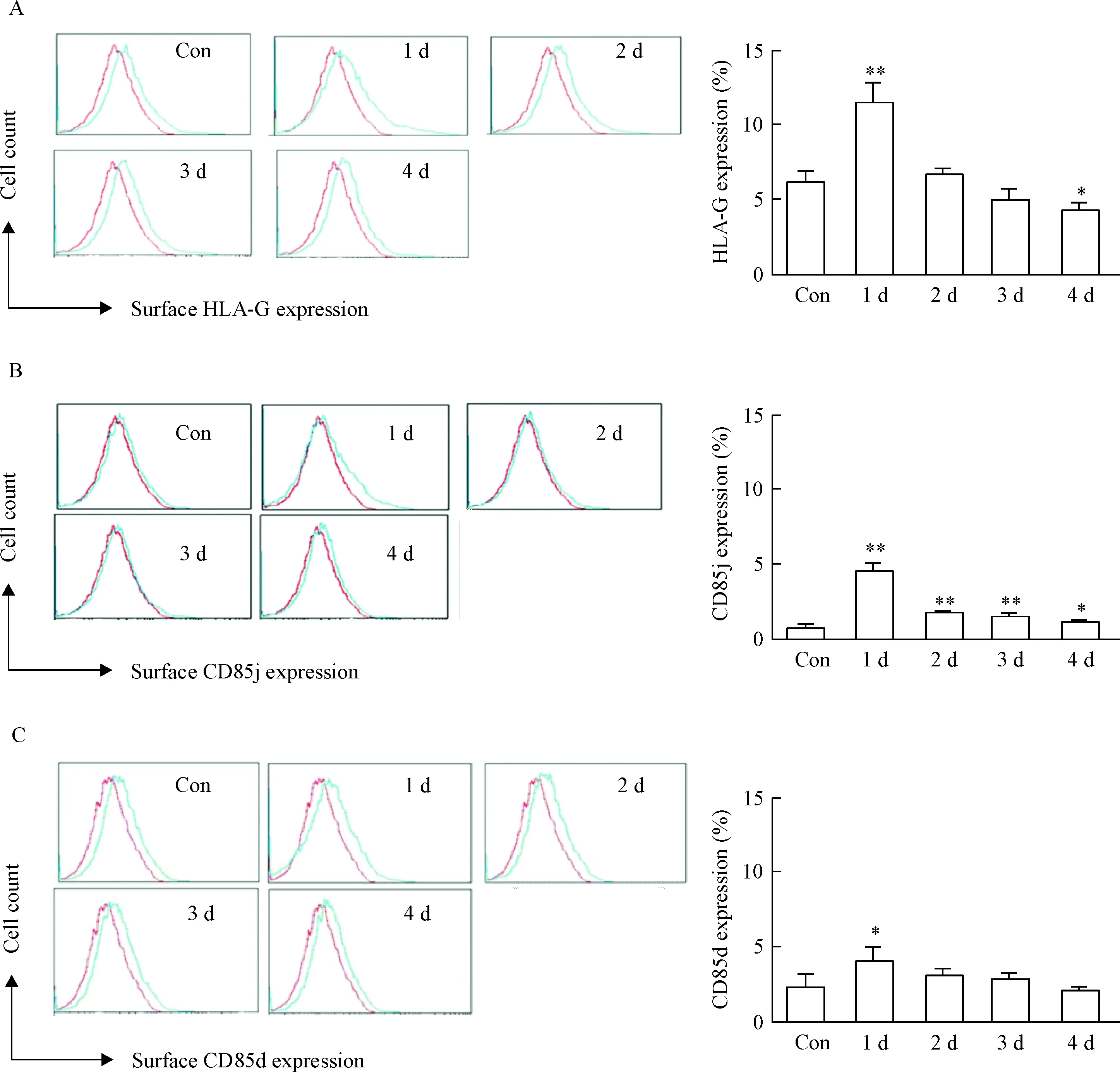
Figure 3. The expression of HLA-G (A), ILT2 (B) and ILT4 (C) in the THP-1 cells induced by HCMV infection. Blue lines: MEM-G/9, CD85 and CD85d; red lines: the same type control. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol (Con) group.
图3 HCMV感染THP-1 细胞诱导HLA-G、ILT2和ILT4的表达
4 HCMV感染THP-1细胞诱导sHLA-G的表达
HCMV感染THP-1细胞1~4 d后,用ELISA试剂盒检测THP-1细胞培养上清中sHLA-G(主要为sHLA-G1和HLA-G5)水平。结果显示感染1 d后,sHLA-G水平显著升高,与对照组比较,差异有统计学意义(P<0.01),见图4。
5 HCMV感染THP-1细胞诱导细胞因子IL-10的表达
HCMV感染THP-1细胞1~4 d后,用ELISA试剂盒检测THP-1细胞培养上清中细胞因子IL-10的表达水平。结果显示,感染1 d后IL-10水平显著升高,与对照组比较,差异有统计学意义(P<0.05),见图5。
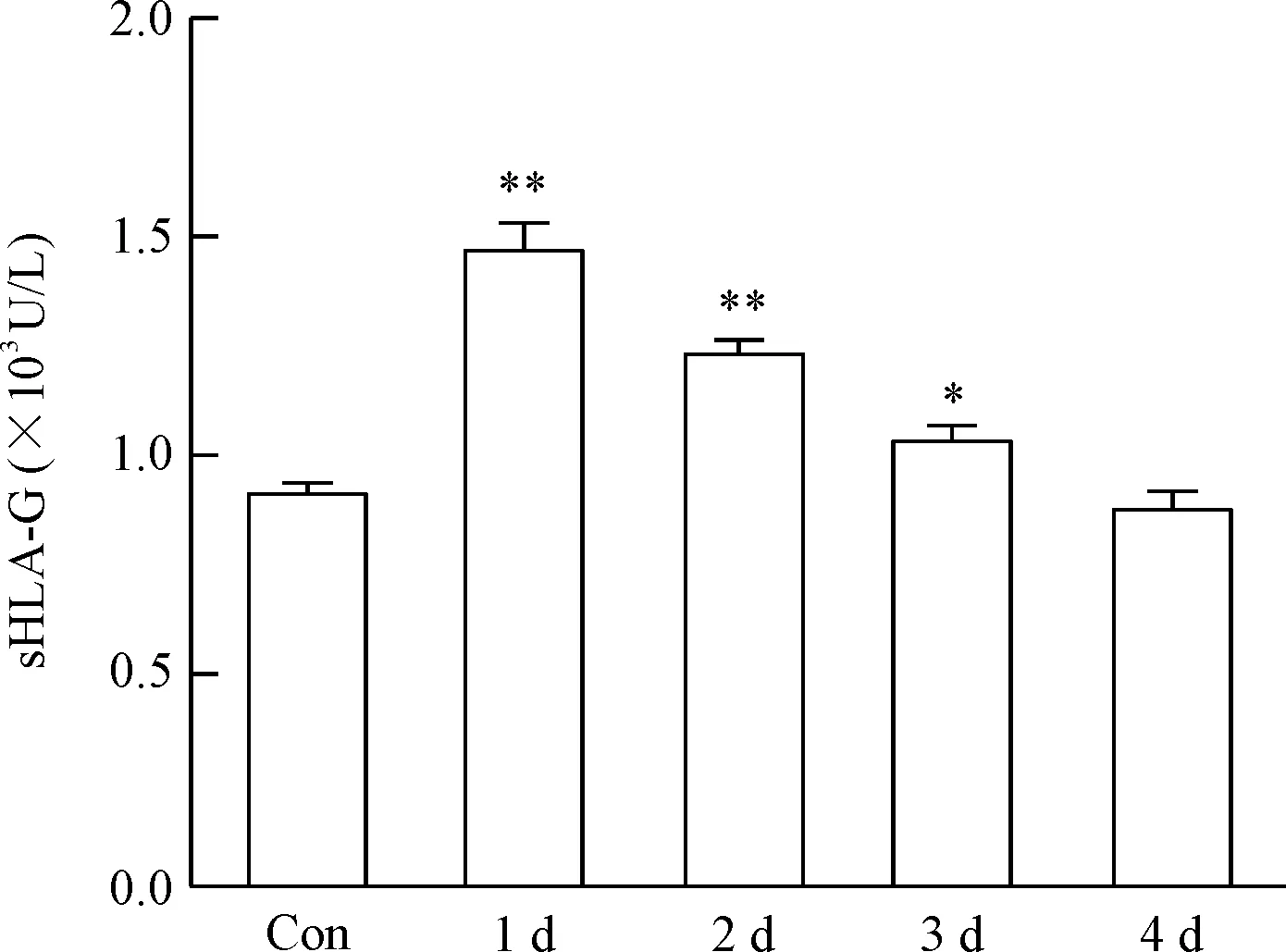
Figure 4.Expression of sHLA-G in the THP-1 cell culture supernatant. Con: control group. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group.
图4 THP-1细胞培养上清中sHLA-G的水平
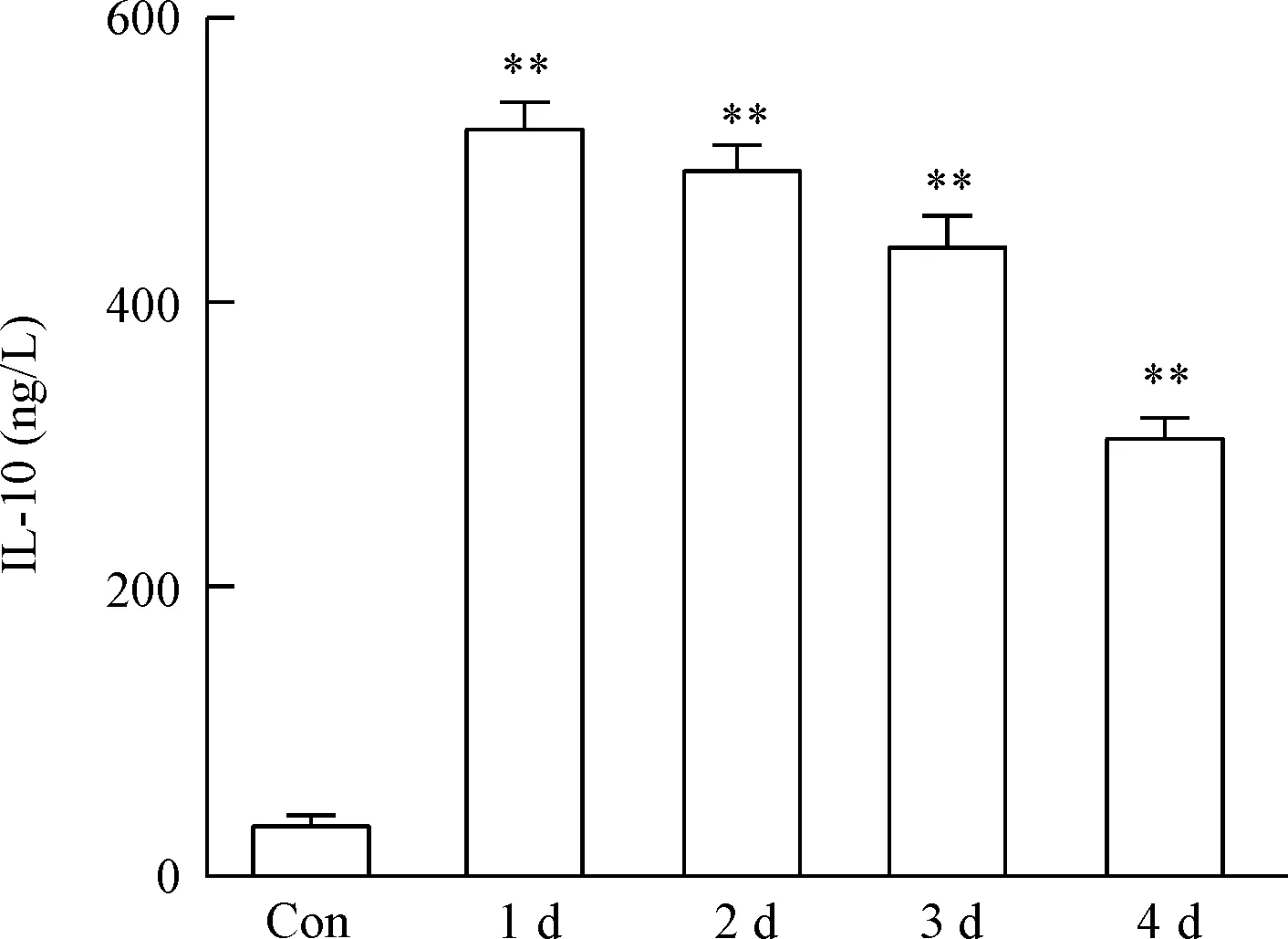
Figure 5.The level of IL-10 in the THP-1 cell culture supernatant. Con: control group. Mean±SD.n=3.**P<0.01vscontrol group.
图5 THP-1细胞培养上清中IL-10水平的变化
讨 论
HCMV感染机体后,形成了多种机制来逃避机体免疫系统的监视和防御,如改变MHC的功能,干扰APC的抗原提呈功能以及抑制NK细胞和CD8+CTL细胞的杀伤作用等。近年研究数据显示,HLA-G在病毒感染后的免疫逃逸中发挥了关键作用。
生理条件下,HLA-G的表达主要局限于滋养层细胞、角膜、胰岛细胞和干细胞等。但病理情况如恶性肿瘤、器官移植、炎症性疾病和病毒感染等均能诱导HLA-G分子异常表达[9]。HLA-G初级转录产物经选择性剪接,产生7种异构体,即膜结合型分子(HLA-G1、-G2、-G3、-G4)和可溶型分子(HLA-G5、-G6、-G7)。膜结合型HLA-G蛋白能在它表达的局部发挥作用,而sHLA-G除在局部发生作用外,还可通过循环系统发挥远端效应。HLA-G主要通过与多种免疫细胞表达的特异性受体(ILT2/CD85j、ILT4/CD85d和KIR2DL4/CD158d)结合发挥免疫抑制作用。 ILT2/4抑制性受体胞质区含有免疫受体酪氨酸抑制基序,HLA-G与ILT2/4相互作用,引起SHP-2、STAT5、p70S6K的磷酸化/去磷酸化,导致下游基因沉默。有研究表明,HLA-G在肿瘤细胞免疫逃逸及肿瘤发生发展过程中起重要作用[10]。我们前期研究结果也表明,HLA-G 14bp 插入/缺失多态性可能是HCMV活动性感染的一个潜在易感因素[11],但对其在HCMV逃避宿主免疫应答中的作用尚不清楚。
病毒感染诱导HLA-G的异常表达能影响宿主的抗病毒免疫机制,利于病毒的复制和传播[12]。据报道HIV、狂犬病毒(RABV)、HSV-1、HCV、HBV、甲型流感病毒等均能诱导表达HLA-G。Lozano 等[13]研究发现HIV阳性患者血液中的CD8+T细胞和单核细胞能高表达HLA-G,同时发现HIV长期进展者血清中sHLA-G的水平明显高于不进展者,表明HLA-G的异常表达是HIV逃避机体免疫系统攻击的重要机制之一。有研究报道,不同病毒感染能上调HLA-G不同异构体的表达。Lafon等[14]证实嗜神经病毒(HSV-1和RABV)感染可使神经细胞(包括受感染的神经细胞和未感染的神经细胞)HLA-G表达增加,其中RABV主要上调HLA-G1,而HSV-1上调HLA-G3和HLA-G5的表达。国内外也有研究表明,HCMV感染影响HLA-G的表达,Yan等[15]发现HCMV活动性感染患者体内外周血单个核细胞中膜结合型和可溶性HLA-G的表达明显升高,但具体机制尚不明确。在本研究中,我们以THP-1为细胞模型建立HCMV 潜伏感染,分析了HCMV感染THP-1细胞后HLA-G异构体的差异表达。THP-1细胞属于髓系细胞,是HCMV 潜伏感染的主要靶细胞且免疫功能明确,感染HCMV后,细胞状态无明显变化,细胞基本为存活细胞,有利于病毒的持续复制且病毒感染不对细胞造成明显损伤。数据显示HCMV感染THP-1细胞后上调HLA-G的表达,以HLA-G1和HLA-G5为主。这表明HLA-G的异常表达可能是HCMV感染后免疫逃逸的关键,且HLA-G1和HLA-G5在HCMV免疫逃逸中发挥的作用优于其它HLA-G异构体。
HLA-G可直接与抑制性受体结合发挥重要的生物学功能。其中,ILT2表达在所有的单核、树突状细胞和B细胞以及部分T细胞和NK细胞;ILT4仅分布在单核和树突状细胞等髓样细胞,这些抑制性受体在初始型免疫细胞中处于低水平表达状态,但在活化的免疫细胞或病理条件下表达上调[16]。已有研究报道ILT2/HLA-G相互作用活化的信号转导途径主要参与调控T细胞生物学功能,在T细胞趋化受体的表达及T 细胞周期等方面起重要作用。HLA-G与单核细胞上的抑制性受体ILT2或ILT4结合后,可刺激细胞分泌TGF-β、IL-10 等细胞因子,使Th1/Th2 平衡移向Th2,同时增加抑制性受体ILT2或ILT4的表达[17]。本研究显示HCMV感染使细胞表面ILT2和ILT-4表达明显增加,这说明,HCMV感染THP-1细胞以后,HLA-G异常表达,结合抑制性受体ILT2/ILT4后发挥免疫抑制效应,HLA-G与ILT2/ILT4相互作用从而可能影响单核细胞的免疫功能,但具体机制尚不明确,有待进一步研究。
细胞因子可调控HLA-G的表达。有研究报道,细胞因子IL-10、IFN-γ和IFN-α能上调HLA-G的表达[18]。IL-10是一种重要的Th2型细胞因子,除具有重要的免疫抑制作用外,还具有免疫刺激作用[19]。本研究中,HCMV感染THP-1后IL-10分泌增加且HLA-G表达上调。两者相互作用,一方面,HLA-G能促进IL-10的分泌,使Th1/Th2平衡向Th2偏移;另一方面,IL-10又能上调HLA-G的表达,之间形成的正反馈在病毒免疫逃逸中起着重要调控作用[20]。
综上所述,HCMV感染THP-1细胞能影响HLA-G异构体及抑制性受体ILT2/ILT4的表达,这可能是HCMV逃避机体免疫应答的重要机制之一。但HCMV感染后HLA-G及其抑制性受体ILT2/ILT4的异常表达对THP-1细胞免疫功能的影响目前研究较少,机制尚不清楚,值得进一步研究和探讨。
[1] Slobedman B, Cao JZ, Avdic S, et al. Human cytomegalovirus latent infection and associated viral gene expression[J]. Futur Microbiol, 2010, 5(6):883-900.
[2] Manicklal S, Emery VC, Lazzarotto T, et al. The “silent” global burden of congenital cytomegalovirus[J]. Clin Microbiol Rev, 2013,26(1):86-102.
[3] Ploegh HL. Viral strategies of immune evasion[J]. Science, 1998, 280(5361):249-253.
[4] Seliger B, Ritz U, Ferrone S. Molecular mechanisms of HLA class I antigen abnormalities following viral infection and transformation[J]. Int J Cancer, 2006, 118(1):129-138.
[5] Yan WH. HLA-G expression in hematologic malignancies[J]. Expert Rev Hematol, 2010, 3(1):67-80.
[6] Onno M, Pangault C, Le Friec G, et al. Modulation of HLA-G antigens expression by human cytomegalovirus: specific induction in activated macrophages harboring human cytomegalovirus infection[J]. J Immunol, 2000, 164(12):6426-6434.
[7] Pizzato N, Garmy-Susini B, Le Bouteiller P, et al. Differential down-modulation of HLA-G and HLA-A2 or -A3 cell surface expression following human cytomegalovirus infection[J]. J Reprod Immunol, 2004, 62(1-2):3-15.
[8] Zheng XQ, Gao Y, Zahng Q, et al. Identification of transcription factor AML-1 binding site upstream of human cytomegalovirusUL111Agene[J]. PLoS One, 2015, 10(2):e0117773.
[9] 颜卫华, 范丽安. 人类白细胞抗原与人类巨细胞病毒[J]. 免疫学杂志, 2002, 18(2):153-157.
[10]徐丹萍, 林爱芬, 颜卫华. HLA-G 在肿瘤细胞中的表达调控机制研究进展[J]. 中华微生物学和免疫学杂志,2012,32(8):755-760.
[11]Zheng XQ, Zhu F, Shi WW, et al. The HLA-G 14 bp insertion/deletion polymorphism is a putative susceptible factor for active human cytomegalovirus infection in children[J]. Tissue Antigens, 2009, 74(4):317-321.
[12]Tripathi P, Agrawal S. The role of human leukocyte antigen E and G in HIV infection[J]. AIDS, 2007, 21(11):1395-1404.
[13]Lozano JM, Gonzalez R, Kindela JM, et al. Monocytes and T lymphocytes in HIV-1-positive patients express HLA-G molecule[J]. AIDS, 2002, 16(3):347-351.
[14]Lafon M, Prehaud C, Megret F, et al. Modulation of HLA-G expression in human neural cells after neurotropic viral infections[J]. J Virol, 2005, 79(24):15226-15237.
[15]Yan WH, Lin A, Chen BG, et al. Induction of both membrane-bound and soluble HLA-G expression in active human cytomegalovirus infection[J]. J Infect Dis, 2009, 200(5):820-826.
[16]Nakajima H, Asai A, Okada A. Transcriptional regulation of ILT family receptors[J]. J Immunol, 2003, 171(12):6611-6620.
[17]LeMaoult J, Zafaranloo K, Le Danff C, et al. HLA-G upregulates ILT2,ILT3, ILT4, and KIR2DL4 in antigen presenting cells, NK cells, and T cells[J]. FASEB J, 2005,19(6):662-664.
[18]Ugurel S, Rebmann V, Ferrone S, et al. Soluble human leukocyte antigen-G serum level is elevated in melanoma patients and is further increased by interferon-alpha immunotherapy[J]. Cancer, 2001, 92(2): 369-376.
[19]郭锦锦, 孙万邦. IL-10受体及其信号转导研究进展[J]. 临床医学工程, 2012,19(1):135-137.
[20]Urosevic M, Dummer R. HLA-G and IL-10 expression in human cancer different stories with the same message[J]. Semin Cancer Biol, 2003, 13(5): 337-342.
(责任编辑: 卢 萍, 罗 森)
HCMV-infected human THP-1 cells induce expression of HLA-G and its receptors
LAI Mei-mei1, 2,ZHOU Qiu-ju1, 2,LOU Yun-yan1, 2, GUO Bin-han1, 2, WANG Hui-yan1, 2, ZHENG Xiao-qun1, 2
(1DepartmentofLaboratoryMedicine,TheSecondAffiliatedHospital&YuyingChildren’sHospitalofWenzhouMedicalUniversity,Wenzhou325027,China;2SchoolofLaboratoryMedicalScience,WenzhouMedicalUniversity,TheKeyLaboratoryofLaboratoryMedicine,MinistryofEducationofChina,Wenzhou325035,China.E-mail:jszhengxq@163.com)
AIM: To investigate the differential expression of human leukocyte antigen-G (HLA-G) isoforms and its receptors in human monocyte line THP-1 after human cytomegalovirus (HCMV) infection for exploring the role of HLA-G in HCMV escaping the immune response of the organism. METHODS: THP-1 cells were infected with HCMV Towne strain. The expression of HLA-G isoforms at mRNA and protein levels was determined by RT-PCR and Western blot, respectively. The surface expression of HLA-G and its receptors ILT2/ILT4 and the cell viability were analyzed by flow cytometry. The levels of soluble HLA-G (sHLA-G) and IL-10 were measured by ELISA. RESULTS: After infection of the THP-1 cells with HCMV, no obvious apoptosis in the cells was observed, and the viability of the cells was high. A significant up-regulation of HLA-G1, -G3, -G4 and -G5 at mRNA expression level 1 d after infection was found, while the protein expression of HLA-G1 and HLA-G5 isoforms was mainly detected. The expression of HLA-G/ILT2/ILT4 was evidently up-regulated 1 d after infection. The level of sHLA-G was significantly increased 1 d after infection as compared with control group (P<0.01). The expression of IL-10 was obviously up-regulated 1 d post-infection as compared with control group. CONCLUSION: The differential expression of HLA-G isoforms and secretion of the receptors ILT2/ILT4 and IL-10 in the THP-1 cells are induced after HCMV infection. This study provides experimental evidence for evaluating the immune mechanism of HCMV infection.
Human cytomegalovirus; Human leukocyte antigen-G; Inhibitory receptor; Infection
1000- 4718(2017)02- 0329- 07
2016- 09- 09
2016- 11- 21
浙江省医药卫生课题项目(No.2017KY474);温州市科技计划项目(No. Y20150304)
R392.32
A
10.3969/j.issn.1000- 4718.2017.02.022
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0577-86699196; E-mail: jszhengxq@163.com

