ALEX1在乳腺癌中的表达及其临床意义*
高 月 , 黄 艺
(重庆市北碚区中医院检验科,重庆 400700)
ALEX1在乳腺癌中的表达及其临床意义*
高 月△, 黄 艺
(重庆市北碚区中医院检验科,重庆 400700)
目的: 检测乳腺癌组织中ALEX1的表达水平,明确ALEX1与其临床病理特征是否具有相关性。方法: 应用real-time PCR、免疫组化方法检测乳腺癌组织中ALEX1含量。结果: 乳腺癌组织ALEX1蛋白的表达水平低于癌旁组织(P<0.01);ALEX1的表达与乳腺癌病理分级、临床分期和分子分型有关(P<0.05),而与病人年龄、肿瘤大小和肿瘤类型无关。此外,real-time PCR结果表明,乳腺癌组织中ALEX1的mRNA表达明显低于对应的癌旁组织(P<0.01)。结论: ALEX1在乳腺癌组织中的表达明显低于相应的癌旁组织,乳腺癌的病理分级、临床分期越高,ALEX1的表达水平越低。
ALEX1; 乳腺癌; 病理分级; 临床分期
乳腺癌是常见的恶性肿瘤之一,严重危害女性身心健康。统计数据显示:乳腺癌位居女性恶性肿瘤发病率的首位,占所有女性新发恶性肿瘤的29%。而且乳腺癌死亡率位居第2,占死于恶性肿瘤女性的14%[1]。ALEX1作为上皮来源肿瘤中缺失的一种蛋白,在大多数正常组织中高表达,而在上皮来源的肿瘤如肺癌、结肠癌、胰腺癌、前列腺癌和卵巢癌等组织中低表达或不表达[2],但在乳腺癌中的表达情况如何,目前仍不清楚。本文运用real-time PCR和免疫组化等技术检测乳腺癌临床标本中ALEX1的mRNA和蛋白表达水平,分析ALEX1蛋白表达水平与乳腺癌的病理分级、临床分期等临床资料之间的关系。
材 料 和 方 法
1 材料
乳腺癌组织和同一病例的癌旁组织共62对标本,均收集于重庆市肿瘤医院。所有标本的病理资料见表1。
表1 乳腺癌患者的临床病理资料
Table 1.Clinicopathological parameters of the breast cancer patients
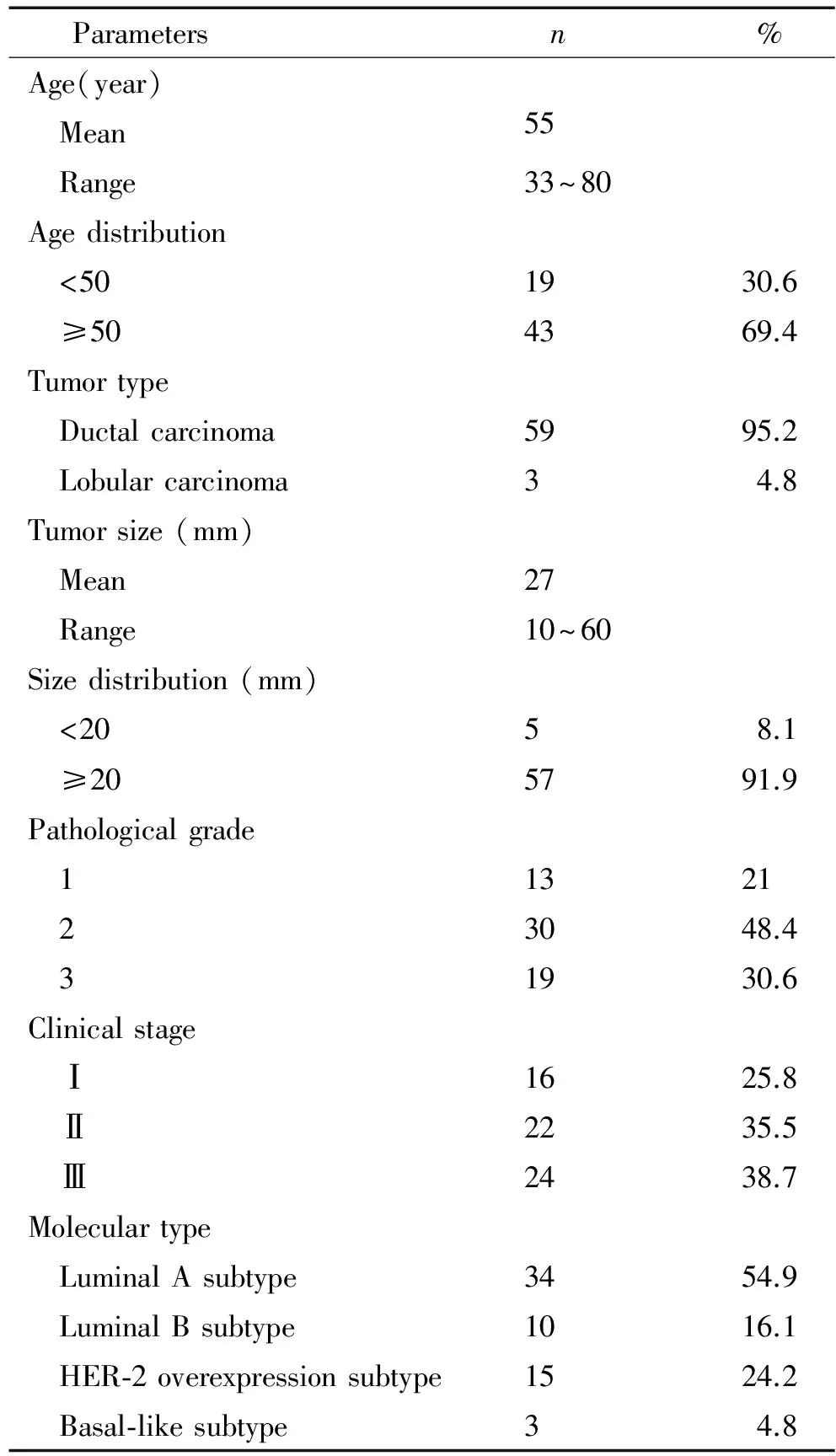
Parametersn %Age(year) Mean55 Range33~80Agedistribution <501930.6 ≥504369.4Tumortype Ductalcarcinoma5995.2 Lobularcarcinoma34.8Tumorsize(mm) Mean27 Range10~60Sizedistribution(mm) <20 58.1 ≥205791.9Pathologicalgrade 11321 23048.4 31930.6Clinicalstage Ⅰ1625.8 Ⅱ2235.5 Ⅲ2438.7Moleculartype LuminalAsubtype3454.9 LuminalBsubtype1016.1 HER⁃2overexpressionsubtype1524.2 Basal⁃likesubtype34.8
2 主要试剂
TRIzol购自Invitrogen;柠檬酸抗原修复液购自北京鼎国昌盛生物技术有限责任公司;DAB底物显色试剂盒、IP细胞裂解液及BCA蛋白浓度测定试剂盒购自上海碧云天公司;cDNA 逆转录试剂盒及实时荧光定量PCR试剂盒购自TaKaRa;SP9002免疫组化染色试剂购自北京中杉金桥生物技术有限公司;鼠抗人ALEX1单克隆抗体及兔抗人β-actin多克隆抗体购自Santa Cruz。所用引物由TaKaRa设计合成,具体序列见表2。
3 主要方法
3.1 Real-time PCR实验 取30 mg组织标本液氮研磨后,加入1 mL TRIzol溶液按照操作说明提取总RNA并测定RNA浓度。以1 μg RNA为模板,按照RT-PCR逆转试剂盒操作说明,经基因组DNA的去除反应和逆转录反应合成cDNA;以1 μL cDNA为模板,进行real-time PCR反应。反应体系为10 μL ,包括SYBR®Premix Ex TaqTMII(2×) 5.0 μL、引物0.2 μL、cDNA 1.0 μL、ddH2O 3.8 μL;反应条件为:95 ℃ 10 s;95 ℃ 5 s,60 ℃ 15 s,72 ℃ 15 s,40个循环。
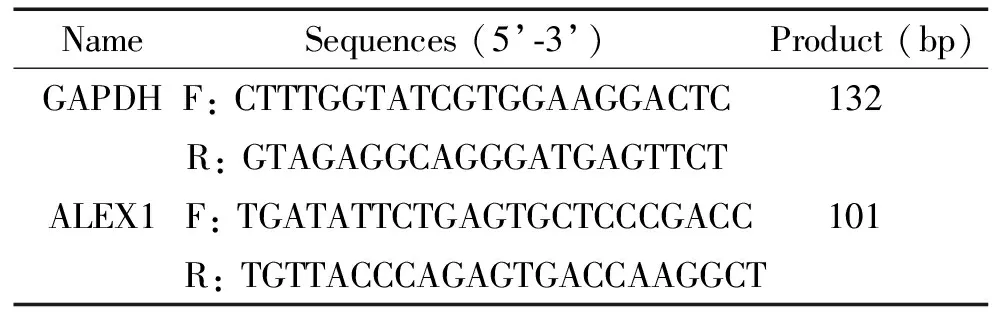
表2 引物序列
F: forward; R: reverse.
3.2 免疫组织化学(immunohistochemistry,IHC)实验 将切下的小块乳腺组织于4%的多聚甲醛中浸泡24 h固定、脱水、石蜡包埋及切片。进而烘片、脱蜡、水化、封闭,加 I 抗4 ℃过夜,加 II 抗TBST冲洗 5 min、3次,DAB 显色、镜检。根据组织的染色强度和染色阳性细胞比例进行量化评分。染色强度评分标准:阴性(-)为0分;弱阳性(1+)为1分;中等阳性(2+)为2分;强阳性(3+)为3分。染色阳性细胞比例评分标准:未染色细胞为0分;染色阳性细胞比例< 10%计1分;染色阳性细胞比例为10%~50%计2分;染色阳性细胞比例>50%计3分。总分值=染色强度分值+染色阳性细胞比例分值。对量化评分结果进行统计分析。
4 统计学处理
应用SPSS 17.0 统计软件分析。以均数±标准差(mean±SD)表示计量资料数据,利用t检验统计分析;以百分比表示计数资料数据,釆用卡方检验进行统计分析。以P<0.05为差异有统计学意义。
结 果
1 免疫组化检测ALEX1在乳腺癌组织中的表达
免疫组化染色结果表明,ALEX1在乳腺癌及癌旁组织中主要定位于胞浆表达;乳腺癌旁组织中ALEX1蛋白的表达水平高于乳腺癌组织中ALEX1的表达,并且在乳腺癌Luminal A型(ER+/HER-2-)组织中ALEX1的表达水平高于乳腺癌人类表皮生长因子受体(human epidemal growth factor receptor, HER)-2过表达型(ER-/HER-2+)。免疫组化评分统计分析发现62例标本中49例(79%)乳腺癌组织ALEX1蛋白的表达水平低于配对的癌旁组织(P<0.01),见图1、2。
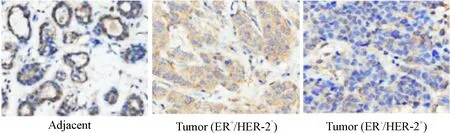
Figure 1.The expression of ALEX1 protein in the breast tissues by IHC (×200).
图1 免疫组化检测乳腺组织ALEX1蛋白的表达
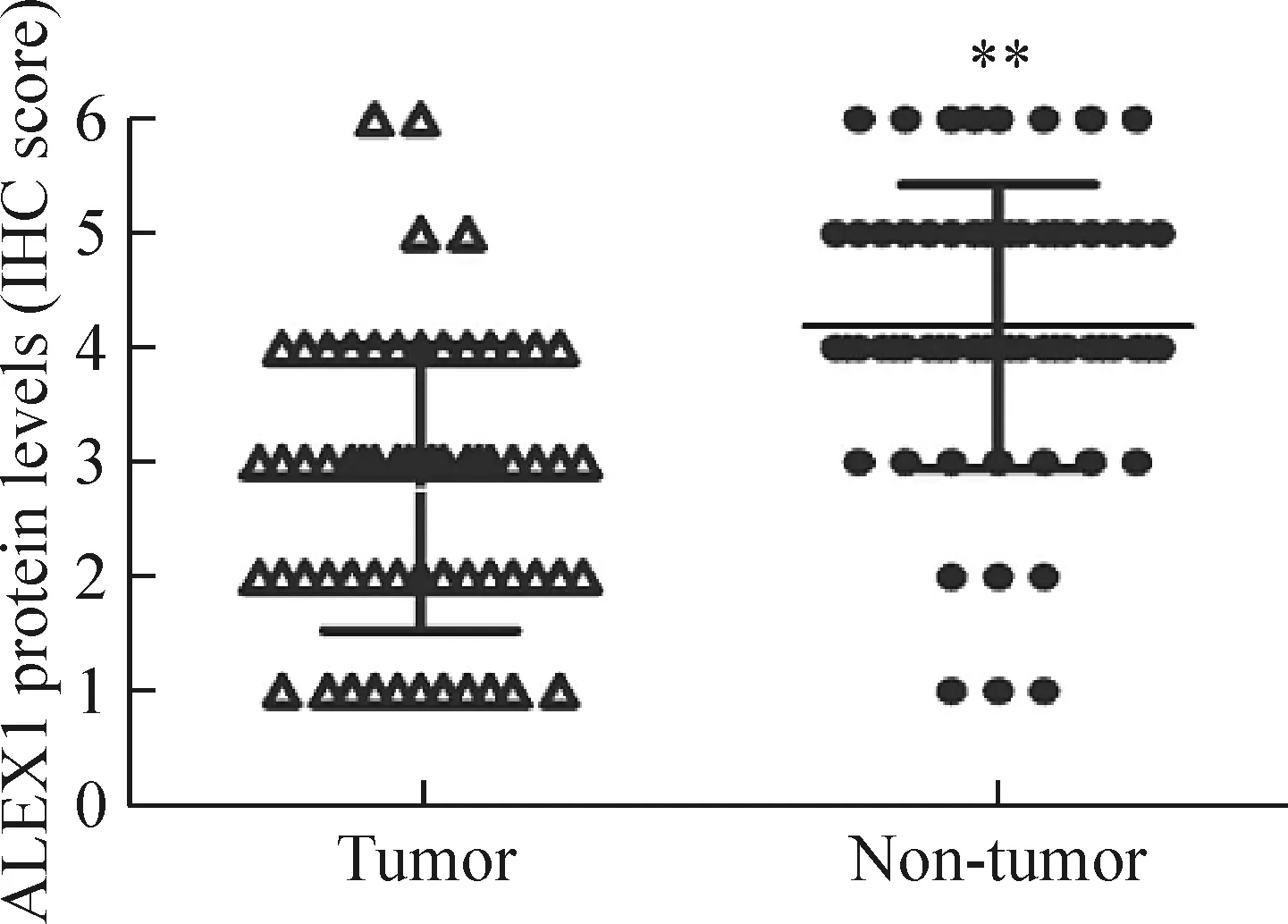
Figure 2.The expression of ALEX1 protein in the breast tissues. Mean±SD.n=62.**P<0.01vstumor.
图2 各乳腺标本ALEX1蛋白表达水平的比较
2 Real-time PCR检测ALEX1在乳腺癌组织中的表达
Real-time PCR检测30对乳腺组织中ALEX1的mRNA表达情况,结果显示在30例标本中有20 例(66.7%)乳腺癌组织标本ALEX1的mRNA表达量低于其癌旁组织,差异有统计学意义(P<0.01),见图3。
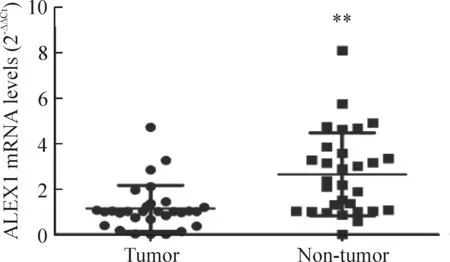
Figure 3.The mRNA expression of ALEX1 in the breast tissues. Mean±SD.n=30.**P<0.01vstumor.
图3 ALEX1 mRNA 在乳腺癌和癌旁组织中的表达
3 ALEX1的表达水平与乳腺癌患者临床病理特征的相关性
对ALEX1免疫组化染色评分分析发现,乳腺癌中ALEX1的表达与病理分级、临床分期、分子分型有关(P<0.05),而与病人年龄、肿瘤大小、肿瘤类型无关,见表3。
讨 论
乳腺癌是一种常见的恶性肿瘤,严重影响女性身心健康。自1999年美国国立癌症研究所提出肿瘤分子分型的概念,使得肿瘤的分类由形态学向分子分类转变,这一转变引起学者们对乳腺癌分子分型的广泛重视。目前,公认的乳腺癌分子分型有5种:luminal A型 (ER+或PR+且HER-2-)、luminal B型 (ER+或PR+且HER-2+)、HER-2过表达型 (ER-,PR-且HER-2+) 和basal-like型 (ER-,PR-且HER-2-)、正常乳腺样型[3]。
ALEX蛋白家族成员包括ALEX1[2]、ALEX2[4]和ALEX3[5]。生物信息学研究发现ALEX1,2,3均位于Xq21.33-q22.2,由一个外显子编码453个氨基酸而且N端具有跨膜结构域,还有几个Arm重复结构和DUF634(domain of unknown function 634)[2,4-5]。研究发现Arm蛋白家族参与细胞黏附、早期胚胎形成和肿瘤发生、发展等生物学进程[6]。但有关ALEX基因的研究报道较少。2009年Mou等[5]发现ALEX3通过Arm重复结构与转录因子SOX10直接作用,改变ALEX3亚细胞定位和转录活性。除此之外,ALEX3的Arm重复结构可以编码线粒体靶定蛋白,Wnt/PKC信号通路能够通过ALEX3蛋白的降解调控线粒体的分布[7]。基因表达分析显示ALEX1和ALEX2的mRNA在人类心脏、脑、卵巢、睾丸、前列腺、结肠等正常组织中高表达,而在肺癌、结肠癌、胰腺癌、前列腺癌和卵巢癌等组织中低表达或不表达;ALEX1的mRNA在骨肉瘤细胞系、胶质瘤细胞系中高表达,而在肺癌细胞系、乳腺癌细胞系中低表达[2]。我们的课题组前期工作成果显示过表达ALEX1能够抑制MCF-7乳腺癌细胞的增殖并诱导细胞凋亡。其诱导细胞凋亡机制很可能是ALEX1上调Bax、下调Bcl-2,进而激活caspase-3,诱导了细胞凋亡[8-9]。这些研究表明ALEX1在肿瘤的发生发展中可能作为一种抑癌基因发挥作用。由于乳腺癌是一种高度异质性疾病,具有不同的分子亚型,给治疗增加了难度。在中国,乳腺癌的发病率正呈逐年上升趋势,并趋于低龄化[10]。因此,明确ALEX1在乳腺组织中表达情况及其与病理分级、临床分期和分子分型等的关系,为乳腺癌的的诊断和分子生物治疗提供理论依据。
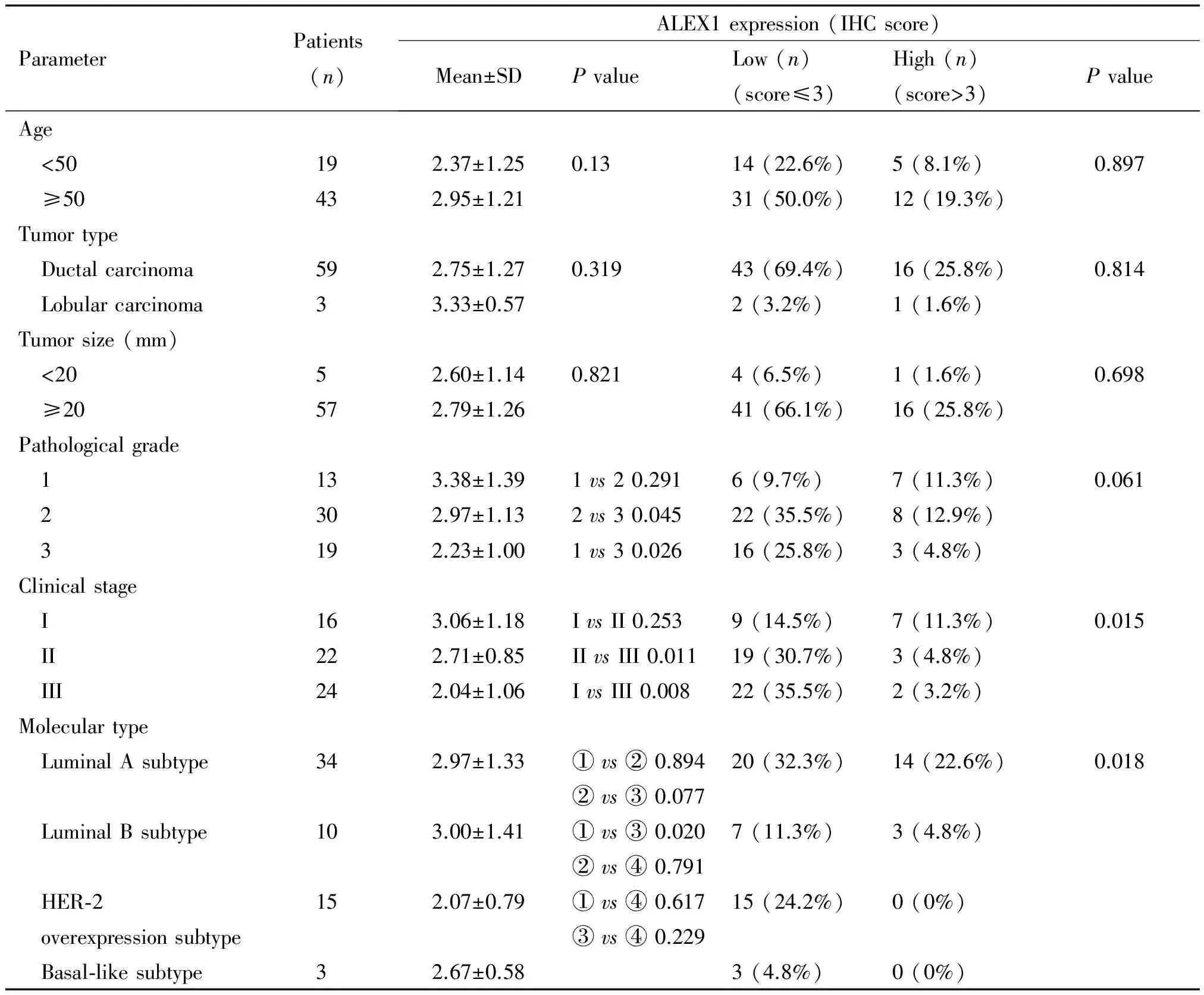
表3 ALEX1蛋白表达与临床病理资料的相关性分析
①: luminal A subtype; ②: luminal B subtype; ③: HER-2 overexpression subtype; ④: Basal-like subtype.
为明确ALEX1在乳腺癌中的表达情况及潜在的临床价值,我们首先通过免疫组化技术染色观察ALEX1在乳腺癌及癌旁组织中的表达情况。结果显示ALEX1主要定位于胞浆表达,在乳腺癌中的表达明显低于癌旁组织。此外,我们利用real-time PCR检测ALEX1在乳腺癌及癌旁组织中的表达情况。结果同样提示乳腺癌组织中ALEX1在mRNA水平表达均低于癌旁组织。这些结果充分说明ALEX1在乳腺癌中作为抑癌基因发挥作用。Iseki 等[11]于2012年报道ALEX1基因能够抑制人直肠癌细胞的克隆形成,其机制可能与ALEX1基因启动子区甲基化有关。说明ALEX1作为抑癌基因在直肠癌中发挥作用。除此之外,利用缺少P53和过表达MYC的永生化胚胎肝细胞进行小鼠体内干扰实验显示敲除ALEX1加速肝癌发展[12]。
进一步分析ALEX1表达水平与临床病理特征关系时发现乳腺癌中ALEX1的表达与病理分级、临床分期和分子分型有关,而与病人年龄、肿瘤大小、肿瘤类型无关。免疫组化染色评分结果也显示临床分期和病理分级越高,ALEX1染色评分下降幅度越大,提示ALEX1可能是乳腺癌恶性程度的一个重要标志。针对我们收集的62例乳腺临床标本进行资料统计发现乳腺癌的发病年龄在33~80岁之间,平均年龄55岁,<50岁的患者占30%,说明我国乳腺癌的发病正呈低龄化趋势发展。我们还发现在乳腺癌的分子分型中其中luminal A型和HER-2过表达型发病率偏高,分别为55%和24%,与文献[13-14]报道luminal A型发病率占乳腺癌的50%~70%和HER-2过表达型占乳腺癌的15%~20%基本一致。Luminal A型以ER+或/和PR+及HER-2-为特征,是乳腺癌最为常见的类型,较其它亚型预后最好[14]。正常情况下,乳腺存在孕激素受体(estrogen receptor,ER)和雌激素受体,当乳腺上皮发生癌变时,雌、孕激素受体(progesterone receptor,PR)缺失。如果在乳腺癌组织中这2种受体仍存在,说明该肿瘤能够受内分泌调节,内分泌治疗有效,预后效果较好。对于luminal A型治疗目前仍推荐单用内分泌治疗。而HER-2过表达型以ER-和PR-/HER-2+为特征,容易出现腋窝淋巴结转移,总生存率最差[15],对内分泌治疗不敏感,而化疗与生物靶向药物联合应用治疗较为普遍。文献报道,ER和PR均阳性的乳腺癌患者,术后采取内分泌治疗有效率达到80%;而ER和PR均阴性的患者,术后内分泌治疗有效率不到10%,说明内分泌治疗的疗效与ER和PR状况有关[15]。我们的研究结果发现ALEX1免疫组化染色评分在luminal A型乳腺癌组织中高于HER-2过表达型,说明luminal A型中ALEX1的蛋白表达水平高于HER-2过表达型,提示ALEX1的表达很可能与ER和PR表达呈正相关而与HER-2的表达呈负相关。在其它分子类型中ALEX1的表达却没发现有统计学显著性。这一结果表明在乳腺癌中ALEX1的表达与激素受体的表达密切相关。目前, 乳腺癌的治疗已进入针对分子亚型的个体化治疗阶段,对ALEX1基因功能和生物机制的透彻研究势必为乳腺癌的内分泌治疗及分子靶向治疗提供理论依据及指导作用。
由于本研究中收集的乳腺癌临床标本数量有限,而且缺少乳腺癌患者预后资料,故对ALEX1与临床相关的研究还需要进一步完善。对此部分中涉及的临床标本收集及检测工作仍在进行中。
[1] Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013[J]. CA Cancer J Clin, 2013, 63(1):11-30.
[2] Kurochkin IV, Yonemitsu N, Funahashi SI, et al. ALEX1, a novel human armadillo repeat protein that is expressed differentially in normal tissues and carcinomas[J]. Biochem Biophys Res Commun, 2001, 280(1):340-347.
[3] Lowery AJ, Kell MR, Glynn RW, et al. Locoregional recurrence after breast cancer surgery: a systematic review by receptor phenotype[J]. Breast Cancer Res Treat, 2012, 133(3):831-841.
[4] Smith CA, McClive PJ, Sinclair AH. Temporal and spatial expression profile of the novel armadillo-related gene,ALEX2, during testicular differentiation in the mouse embryo[J]. Dev Dyn, 2005, 233(1):188-193.
[5] Mou Z, Tapper AR, Gardner PD. The armadillo repeat-containing protein, ARMCX3, physically and functionally interacts with the developmental regulatory factor Sox10[J]. J Biol Chem, 2009, 284(20):13629-13640.
[6] Huber AH, Nelson WJ, Weis WI. Three-dimensional structure of the armadillo repeat region of beta-catenin[J]. Cell, 1997, 90(5):871-882.
[7] Serrat R, Lopez-Domenech G, Mirra S, et al. The non-canonical Wnt/PKC pathway regulates mitochondrial dynamics through degradation of the arm-like domain-containing protein Alex3[J]. PLoS One, 2013, 8(7):e67773.
[8] 曾 帆, 高 月, 伍家燕, 等. 过表达ALEX1 对乳腺癌MCF-7 细胞增殖和凋亡生物影响[J]. 中国免疫学杂志, 2015, 31(8):1066-1069.
[9] Gao Y, Wu JY, Zeng F, et al. ALEX1 regulates proliferation and apoptosis in breast cancer cells[J]. Asian Pac J Cancer Prev, 2015, 16(8):3293-3299.
[10]Forouzanfar MH, Foreman KJ, Delossantos AM, et al. Breast and cervical cancer in 187 countries between 1980 and 2010: a systematic analysis[J]. Lancet, 2011, 378 (9801):1461-1484.
[11]Iseki H, Takeda A, Andoh T. ALEX1 suppresses colony formation ability of human colorectal carcinoma cell lines[J]. Cancer Sci, 2012, 103 (7): 1267-1271.
[12]Zender L, Xue W, Zuber J, et al. An oncogenomics-basedin vivo RNAi screen identifies tumor suppressors in liver cancer[J]. Cell, 2008, 135(5):852-864.
[13]Dawood S, Hu R, Michelle D, et al. Defining breast cancer prognosis based on molecular phenotypes: results from a large cohort study[J]. Breast Cancer Res Treat, 2011, 126(1):185-192.
[14]Xue C, Wang X, Peng R, et al. Distribution, clinicopathologic features and survival of breast cancer subtypes in Southern China[J]. Cancer Sci, 2012, 103(9):1679-1687.
[15]Kurebayashi J. Current clinical trials of endocrine therapy for breast cancer[J]. Breast Cancer, 2007, 14(2):200-214.
(责任编辑: 陈妙玲, 余小慧)
Expression of ALEX1 in breast cancer and its clinical significance
GAO Yue, HUANG Yi
(DepartmentofClinicalLaboratory,TheChineseTraditionalMedicineHospitalofBeibeiDistrict,Chongqing400700,China.E-mail:moon19740000@163.com)
AIM: To detect the expression of ALEX1 in the breast cancer tissues in order to verify whether ALEX1 has correlation with clinical pathological features in breast cancer. METHODS: Real-time PCR and immmunohistochemistry were applied to detect the expression of ALEX1 at mRNA and protein levels in the breast tissues. The statistical analysis were performed for determining the correlation with the level of ALEX1 and the clinical pathological features in breast cancer. RESULTS: The protein levels of ALEX1 in the breast cancer tissues were lower than that in the non-breast cancer tissues (P<0.01). The expression of ALEX1 had correlations with pathological grade, clinical stage, molecular type (P<0.05) but had no correlation with the patients’ age, tumor size and tumor types in breast cancer. Furthermore, the result of real-time PCR showed that mRNA expression of ALEX1 was also significantly reduced in the breast cancer tissues (P<0.01). CONCLUSION: The expression of ALEX1 in the breast cancer tissues is lower than that in non-breast cancer tissues. The pathological grade and clinical stage in breast cancer are negatively correlated with the expression of ALEX1.
ALEX1; Breast cancer; Pathological grade; Clinical stage
1000- 4718(2017)02- 0353- 05
2016- 07- 22
2016- 10- 09
辽宁省科技厅项目(No. 2015020353)
R730.23
A
10.3969/j.issn.1000- 4718.2017.02.026
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 023-68355197; E-mail: moon19740000@163.com

