植物中miRNA响应非生物胁迫研究进展
刘玉凤王 孝陈海银刘 琨刘 阳齐明芳宁晓峰李天来*
(1沈阳农业大学园艺学院,设施园艺省部共建教育部重点实验室,环渤海湾地区设施蔬菜优质高效生产协同创新中心,辽宁沈阳 110866;2沈阳农业大学工程学院,辽宁沈阳 110866)
植物中miRNA响应非生物胁迫研究进展
刘玉凤1王 孝1陈海银1刘 琨1刘 阳1齐明芳1宁晓峰2李天来1*
(1沈阳农业大学园艺学院,设施园艺省部共建教育部重点实验室,环渤海湾地区设施蔬菜优质高效生产协同创新中心,辽宁沈阳 110866;2沈阳农业大学工程学院,辽宁沈阳 110866)
MicroRNA(miRNA)是一类长度为20~24 nt的非编码RNA,在植物遭受非生物胁迫时,通过介导靶基因mRNA发挥着非常重要的作用。本文就低温、外源ABA和干旱等非生物胁迫对miRNA的调控机制进行综述,进一步阐明miRNA响应非生物胁迫的机理。
miRNA;低温;外源ABA;干旱;综述
植物非生物胁迫是指对植物施加不利的环境因子,包括低温、植物激素脱落酸(ABA)、干旱、高盐、紫外线辐射等胁迫,对植物的生长、发育和结实产生严重的不良影响,特别是导致重要农作物减产(Wani et al.,2016)。由于非生物胁迫普遍存在于自然界中,且对植物生长、产量和品质产生影响,现已成为生产中亟待解决的问题(Shriram et al.,2016)。
研究发现,非生物胁迫下各种转录因子能够激活miRNAs等一些下游基因(Devi et al.,2013)。miRNA作为一种新型的调控基因表达的小分子RNA,在植物生长发育、抗逆境胁迫(低温、干旱、盐胁迫)、维持基因组完整性等生理过程中发挥着重要作用(Zhang,2015)。本文从miRNA的角度探究植物通过介导ABA信号途径在非生物胁迫条件下的作用机制,为阐明植物抗逆性机理和提高植物耐胁迫能力提供理论依据。
1 植物miRNA的发现、合成与作用机制
1.1miRNA的发现和合成
Ambros和Reinhart先后从秀丽隐杆线虫(Caenorhabditis elegans)中发现lin-4和let-7两种具有调控功能的小分子RNA(Lee et al.,1993;Denli et al.,2004)。 2001年,美国、德国等国家的3个研究小组通过大规模克隆试验,揭示了生物体中这些小分子RNA的调控作用,并将其命名为MicroRNA(miRNA)(Lagosquintnana et al.,2003)。
miRNA的核心结构由Ⅱ型聚合酶启动子、转录区域和终止子构成(Tang,2010)。合成过程如图1所示(Basel et al.,2012):首先,在PolⅡ酶作用下,miRNA基因被转录成1条长约几百个碱基的含有茎环结构的初始转录本(pri-miRNA)。随后,在Dicer-like1(DCL1)酶作用下,此茎环结构被剪切成含有发卡结构的较短前体miRNA(premiRNA);pre-miRNA进一步被剪切释放出miRNA/ miRNA*双链,然后由HASTY转运至细胞质中形成成熟的单链miRNA。最终,成熟的miRNA进入核糖核蛋白复合体(RNA-induced silencing complex,RISC)中发挥作用(Hofmann,2010)。
1.2miRNA的作用机制
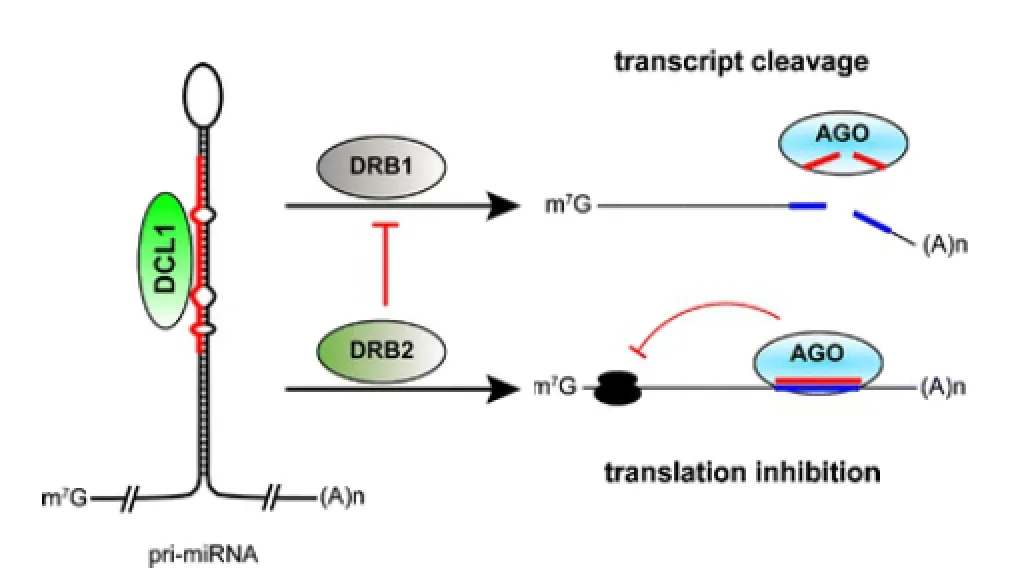
图2 miRNA的作用机制(Reis,2016)
在逆境胁迫下,植物miRNA本身并不具备核酸酶的功能,而是通过多种机制对基因进行转录后的表达调控(Li & Zhang,2015)。由图2所示 (Reis,2016),许多植物miRNA可以与靶基因的转录产物完全配对,介导RISC的AGO(ARGO-NAUTE)蛋白识别并切割靶基因的mRNA,然后被核糖核酸外切酶所降解;当miRNA与靶基因不完全配对时,miRNA通过抑制mRNA的翻译来调控蛋白质的表达(Li & Zhang,2015;Fu et al.,2016)。
2 植物miRNA与非生物胁迫
2.1低温胁迫
为了更深刻、系统地了解植物响应低温胁迫的机制,可将miRNAs与响应低温胁迫的基因网络相结合(Cao et al.,2014)。植物中miRNA可通过生长素、脱落酸(ABA)等信号途径来响应低温胁迫(Cheng et al.,2016)。
根据靶基因的不同作用方式,将响应低温胁迫的miRNAs分为3类(Liu et al.,2008)。第一类:其靶基因可以直接响应胁迫和外部刺激,包括 miR160、miR167、miR168、miR393、miR394、miR395。miR160的靶基因是生长素响应因子ARF。在低温胁迫下,抗miR160降解(mARF)的转基因种子对ABA过敏(吴涛,2012),而低夜温野生型(RR)番茄中的miR160表达水平上调(周迎春,2015),表明存在ABA-AUXIN关联,共同参与低温胁迫。前人通过对拟南芥幼苗进行脱水、高盐、低温和ABA胁迫处理后构建了小分子RNA文库,如miR393受到低温、脱水、高盐和ABA的正调控比较显著。研究发现,在低温胁迫下,E3(泛素连接酶)水解其靶蛋白受到抑制,进而使拟南芥miR393表达上调(Sunkar & Zhu,2004)。第二类:其靶基因间接响应胁迫,这些靶基因调控一些在胁迫应答中起作用的蛋白转录因子,包括 miR156、miR165、miR169、miR171、miR172、miR319、miR396。王冰等(2013)对小麦进行低温处理后,采用qRT-PCR对miR156家族成员进行分析,发现miR156d的表达显著下调,miR156a的表达表现出明显的上升趋势,说明它们参与低温胁迫调控网络;Bernal和Kramer(2012)研究表明,miR156靶基因SPL(SQUAMOSA promoter-binding protein)含有ABA响应元件,推测其可能通过ABA信号途径响应低温胁迫。第三类:可响应多种胁迫,其靶基因是水解酶或氧化还原酶的编码基因,包括miR397、miR408。Sun等(2015)研究表明,葡萄在低温胁迫下,miR156、miR397的表达量下调;拟南芥miR397b通过介导靶基因Laccase(漆酶蛋白)控制种子产量和木质素的合成(Wang et al.,2014),过表达该基因,植株耐寒性和耐冻性增强,说明miR397响应冷害胁迫(Dong & Pei,2014);王丽丽等(2015)研究发现,毛竹经过GA3和ABA处理后,诱导phe-miR397的表达,降低对干旱、高温、低温等胁迫的抑制作用,推测其可能通过ABA信号途径响应低温。
植物遭受低温胁迫后,诱导COR(coldresponse)相关基因表达。包括CBF(C-repeat/ dehydration-responsive element binding factor)、bLHL(basic helix-loop-helix)、miR166的靶基因ZIP(basic leucine zipper)、miR159的靶基因MYC/MYB等都是与抗逆相关的转录因子,它们依赖ABA在植物低温信号转导过程中起着非常重要的作用(计淑霞 等,2010)。当暴露在低温胁迫条件下,植物体内的ABA含量有一个短暂的上升,这与抗寒性的启动有关(Heidarvand & Amiri,2010)。同时也会诱导与低温响应的基因表达,这些基因的启动子区域含有脱落酸响应元件ABREs(ABA response elements)。bZIP类转录因子、ABFS(ABRE binding proteins),可以结合到ABRE以激活ABA依赖基因的表达。
2.2外源ABA胁迫
ABA是植物的“胁迫激素”,通常被认为是抑制型植物激素,与植株衰老和器官(叶、蕾、茎)脱落有密切联系(Cheng et al.,2016)。种子成熟、萌发,植株气孔关闭等生理过程都受ABA调控(Kang,2015)。ABA是保卫细胞信号转导的关键信号因子,不仅参与生物胁迫,而且在植物低温以及干旱、高盐等非生物胁迫条件下也起重要作用。
前人在研究拟南芥的脱落酸受体时发现,ABA是由PYR/PYL/RCARs、蛋白磷酸酶2C(PP2Cs)以及SNF1相关蛋白激酶2s(SnRK2s)这3个蛋白家族组成的核心信号产生的(Agawal & Jha,2010)。其中ABA的受体是PYR/PYL/RCARs,PP2Cs为ABA信号通路的负调控者(Hubbard et al.,2010),SnRK2s为ABA下游信号通路的正调控者。当ABA缺失时,PP2Cs的活性增强,SnRK2的活性受抑制,下游信号转导被阻断。而当ABA大量合成时,PYR/RCARs与PP2Cs产生互作,蛋白磷酸酶活性被抑制,但SnRK2活性不受影响,SnRK2s会与ABRE相结合,诱导ABA依赖型的相关基因的表达,最终引起一系列的生理生化反应。信号分子ABA是植物逆境胁迫下miRNA的作用靶标之一,miRNA通过表达量的变化调控基因表达,参与依赖ABA调控的气孔运动。ABA缺失情况下植株长势较弱,株型矮小且易染病(杨洪强和接玉玲,2001)。
ABRE是依赖于ABA信号传导的重要顺式作用元件,属于bZIP转录因子。Choi等(2000)运用酵母单杂交方法分离了ABRE结合蛋白AREB或ABFs。当植物受到ABA、干旱和高盐胁迫时,AREB1/ABF2、AREB2/ABF4和ABF3的表达上调(Uno et al.,2000)。研究表明,活化的SnPK2蛋白激酶能够作用于AREB/ABF类因子的保守结构域,并使其磷酸化(Furihata et al.,2006)。miR166的靶基因属于bZIP类转录因子,参与ABA信号转录过程(Ouellet et al.,1998)。
与拟南芥相同,大豆中GmbZIP基因结合在ABRE元件上,结合后传给下游的识别位点MYBRS/MYCRS(位于rd22启动子MYB/MYC),而后进行mRNA的转录(Phang et al.,2008)。Mei等(2013)研究表明,AtMYB20蛋白可以与AtPP2CA基因启动子上的MYB识别序列(TAACTG)结合,降低ABI1、ABI2和AtPP2CA基因的表达水平,使ABA信号途径增强以抵抗盐胁迫。Reyes和Chua(2007)研究表明,miR159靶向MYB,ABA能够诱导miR159依赖ABI3并部分依赖ABI5途径增加自身表达量。Li和Lu(2013)研究发现,SmMYB80主要在花中表达,它由miR159/319和miR858共同调控。
当喷施外源ABA时,番茄中miR159的表达量下调,对应靶基因MYB上调(Cheng et al.,2016)。MYB上调表达可以提高植物对逆境的抵抗能力(Ambawat et al.,2013)。张颖等(2012)研究发现,毛果杨遭受ABA胁迫诱导后,miR398的表达经历先上调、后下调、再上调的与拟南芥相反的动态变化,这可能是由于不同物种应答ABA胁迫的方式不同导致(Sunkar et al.,2012)。但无论在拟南芥还是在毛果杨中,miR398的表达与其靶基因超氧化物歧化酶基因(CSD)的表达均呈负相关(Jia et al.,2009)。
2.3干旱胁迫
miRNA可通过调控ABA依赖型和ABA非依赖型两类靶基因响应干旱胁迫(Niu et al.,2016)。在干旱胁迫下,对13个物种的34个miRNAs进行芯片杂交试验,发现这些miRNAs的靶基因中大部分都含有ABA响应元件(Liya & Zuxin,2009)。miR159靶基因是MYB转录因子,干旱胁迫处理后,抑制miR159降解的MYB33和MYB101以及miR159都上调表达(Song et al.,2011)。干旱胁迫下,miR528和miR167靶基因POD、PLD的表达量上调,启动ABA诱导的气孔运动和抗氧化防御(Cheng et al.,2016)。
利用PEG6000模拟干旱胁迫诱导试验发现,水稻中miR169g是唯一一个被干旱诱导的miR169成员,也是最早发现的与干旱相关的miRNA,家族中包含17个成员(Zhao et al.,2007)。并且miR169g在根部的表达量远远高于嫩枝,说明同一家族中基因序列虽然相似,但在生理学上各成员却有不同的作用。Zhang等(2011)研究发现,在干旱胁迫下番茄叶片中的miR169c通过靶向SIMRP1调控气孔运动。miR169的靶基因GmNFYA3受ABA、干旱等非生物胁迫的诱导,拟南芥GmNFYA3过表达植株中参与ABA 合成、ABA信号通路和干旱响应的基因均上调表达,从而减轻叶片失水,增强抗旱能力,增加对高盐和外源ABA的敏感性(Ni et al.,2013)。干旱使miR168通过靶基因MAPK在种子中上调表达,说明miR168参与了种子体内的新陈代谢,进而调控耐干旱胁迫过程(Li & Lu,2013)。拟南芥的miR394超表达植株比野生植株更能抵抗干旱胁迫,在响应干旱胁迫中发挥重要作用(Song et al.,2013)。利用qRT-PCR分析番茄中的miR397,证明其响应干旱、ABA和盐害胁迫(向娟 等,2016),推测miR397可能通过ABA信号途径响应干旱胁迫。
2.4其他非生物胁迫
miRNA在高盐、重金属、紫外线照射等其他形式的非生物胁迫下,同样存在调节植物生长和生理活动的过程。例如,盐胁迫条件下,miR161和miR173在细胞质中稳定表达,在细胞核中负调控表达(Dolata et al.,2016)。土壤重金属含量过高时,miR398通过与靶基因CSD相互作用,调节植物体内的铜素平衡。同样,miR398也是植物响应氧化胁迫的主要miRNA,在氧化胁迫时下调表达,并与靶基因CSD相互作用行使功能(Sunkar et al.,2006)。柑橘中miR397通过调节LAC7(miR397的靶基因Laccase7,漆酶)减轻硼胁迫(Jin et al.,2016)。但miRNAs并不是直接参与非生物胁迫,而是通过调控靶基因发挥抗逆境的作用(表1)。
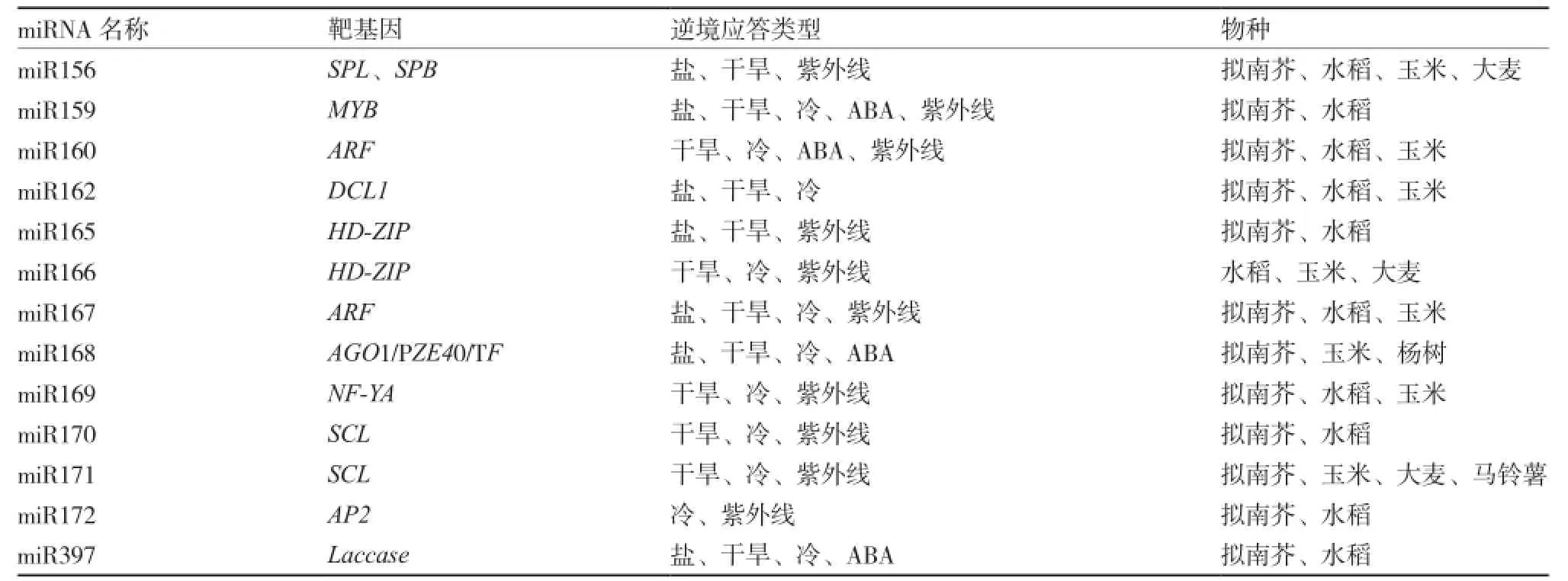
表1 植物miRNA对逆境胁迫的应答
3 启动子顺式作用元件分析
为验证这些miRNAs的靶基因与哪些非生物胁迫相关,笔者挑选番茄中4个miRNAs(miR160、miR162、miR166、miR397)的8个靶基因进行启动子分析,从Ensemble数据库(http://asia.ensembl. org/index.html)中提取这些靶基因上游启动子序列。将启动子提交PlantCARE(http://bioinformatics.psb. ugent.be/webtools/plantcare/html/),将其中的顺式作用元件进行分析。
利用PlantCARE将靶基因上游3 000 bp序列进行启动子元件分析(表2):8个靶基因上游均具有CAAT-box、TATA-box等启动子基本元件,说明这些基因可能都具有表达活性。但不同基因启动子区的顺式作用元件存在差异,这些基因可能在表达方式上出现分化,它们以不同方式参与逆境胁迫、光信号转导与光形态建成等不同生理过程的调控。例如:miR160和miR162的靶基因含有脱落酸响应元件ABRE,miR160、miR162、miR166和miR397都含有干旱响应元件MBS,miR160和miR162含有光响应元件Box 4,miR160、miR162、miR166和miR397都含有低温响应元件LTR,这都与前人的研究结果一致(Martin et al.,2010;马风勇 等,2012)。
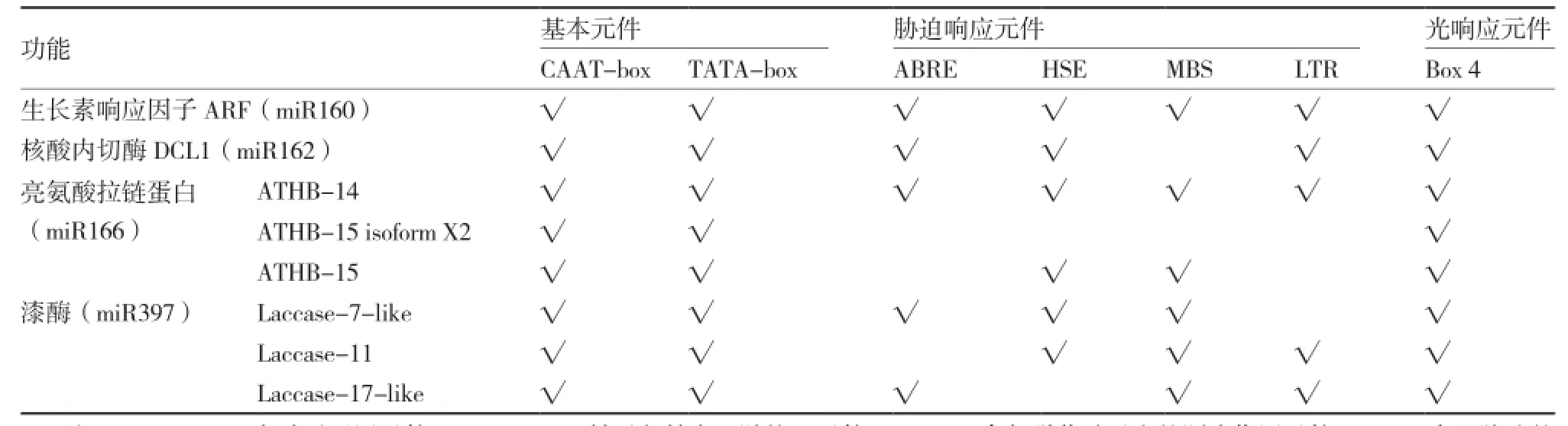
表2 番茄8个靶基因启动子中的顺式作用元件
但也有一些miRNA功能是未知的,如番茄中miR162的靶基因中含有ABA响应元件ABRE,但在拟南芥或其他物种中还没有证明它是如何响应ABA或参与ABA信号途径,有待于进一步验证。
4 展望
综上所述,有关miRNA在许多非生物胁迫下的研究取得了很大进展,但依赖ABA途径响应非生物胁迫的机制还不是很明确。miRNA是调控真核生物基因表达和探究基因功能的重要手段,对于逆境分子生物学领域的研究,发现响应逆境胁迫的植物miRNA成为一项重大突破,并为了解植物逆境胁迫下基因和基因表达调控本质提供强有力工具。通过对不同物种的探究,未来会挖掘出更多新的miRNAs及其对应的靶基因,并通过转基因技术来验证miRNAs和靶基因的功能及信号调控网络,为深入研究植物的基因水平和对逆境环境的抵抗能力提供理论依据,miRNA依赖ABA信号响应非生物胁迫也会得到进一步的验证和探究。
计淑霞,戴绍军,刘炜.2010.植物应答低温胁迫机制的研究进展.生命科学,22(10):1013-1019.
马风勇,朱永兴,石晓霞,许兴.2012.植物miRNA抗逆性研究进展.西北农林科技大学学报:自然科学版,40(5):217-223.
王冰,宋娜,孙燕飞,冯浩,王晓杰,康振生.2013.MircoRNA156家族在小麦非生物胁迫中的表达分析.植物病理学报,43(2):201-204.
王丽丽,赵韩生,孙化雨,董丽莉,娄永峰,高志民.2015.毛竹miR397和miR1432的克隆及其逆境胁迫响应表达分析.林业科学,51(6):63-70.
吴涛.2012.日本落叶松实生苗smallRNA测序,microRNA鉴定及其目标基因差异表达分析〔博士论文〕.北京:中国林业科学研究院.
向娟,林鹏,李兴盛,李双桃,刘梦云,张磊,郭仰东.2016.过表达番茄Sly-miR397基因增强拟南芥的耐旱性.中国农业大学学报,21(10):51-58.
杨洪强,接玉玲.2001.高等植物脱落酸生物合成及其信号转导研究进展.华中农业大学学报,20(1):92-98.
张颖,姜建福,孙海生,樊秀彩,刘崇怀.2012.植物抗非生物胁迫microRNA研究进展.生物技术通讯,23(3):452-455.
周迎春.2015.低夜温诱导ABA抑制番茄叶片气孔张开的miRNA差异表达分析〔硕士论文〕.沈阳:沈阳农业大学.
Agawal P K,Jha B.2010.Transcription factors in plants and ABA dependent and independent abiotic stress signaling.Biologia Plantarum,54(2):201-212.
Ambawat S,Sharma P,Yadav N R,Yadav R C.2013.MYB transcription factor genes as regulators for plant responses:an overview.Physiology & Molecular Biology of Plants,19(3):307-321.
Basel K,Zhu J K,Zhu J.2012.Role of miRNAs and siRNAs in biotic and abiotic stress responses of plants.Biochimica et Biophysica Acta,1819:137-148.
Bernal M,Kramer U.2012.Transcriptome sequencing identifies SPL7-regulated copper acquisition genes FRO4/FRO5 and the copper dependence of iron homeostasis in Arabidopsis.Plant Cell,24(2):738-761.
Cao X,Wu Z,Jiang F,Zhou R,Yang Z.2014.Identification of chilling stress-responsive tomato microRNAs and their target genes by high-throughput sequencing and degradome analysis.BMC Genomics,15(1):1130.
Cheng H Y,Yan W,Xiang T,Fan Y F,Dai Y,Hong Y,Ma X R.2016.Genomic profiling of exogenous abscisic acid-responsive microRNAs in tomato(Solanum lycopersicum).BMC Genomics,17(1):1-13.
Choi H,Hong J,Ha J,Kang J,Kim S.2000.ABFs,a family of ABA-responsive element binding factors.Journal of Biological Chemistry,275(3):1723-1730.
Denli A M,Tops B B,Plasterk R H,Ketting R F,Hannon G J.2004.Processing of primary microRNAs by the Microprocessor complex.Nature,432(7014):231-235.
Devi S J S R,Madhav M S,Kumar G R,Goel A K,Umakanth B,Jahnavi B,Viraktamath B C.2013.Identification of abiotic stress miRNA transcription factor binding motifs(TFBMs)in rice.Gene,531(1):15-22.
Dolata J,Bajczyk M,Bielewicz D,Niedojadlo K,Niedojadlo J,Pietrykowska H,Walczak W,Szweykowska-Kulinska Z,Jarmolowski A.2016.Salt stress reveals a new role for ARGONAUTE 1 in miRNA biogenesis at the transcriptional and post-transcriptional levels.Plant Physiology,172(1):297-312.
Dong C H,Pei H.2014.Over-expression of miR397,improves plant tolerance to cold stress in Arabidopsis thaliana.Journal of Plant Biology,57(4):209-217.
Fu M,Xu K,Xu W.2016.Research advances of Dicer in regulating reproductive function.Hereditas,38(7):612.
Furihata T,Maruyama K,Fujita Y,Umezawa T,Yoshida R,Shinozaki K,Yamaguchi-Shinozaki K.2006.Abscisic acid-dependent multisite phosphorylation regulates the activity of a transcription activator AREB1.Proceedings of the National Academy of Sciences,103(6):1988-1993.
Heidarvand L,Amiri R M.2010.What happens in plant molecular responses to cold stress? Acta Physiologiae Plantarum,32:419-431.
Hofmann N R.2010.MicroRNA evolution in the genus Arabidopsis.Plant Cell,22(4):994.
Hubbard K E,Nishimura N,Hitomi K,Getzoff E D,Schrieder J L.2010.Early abscisic acid signal transduction mechanisms:newly discovered components and newly emerging questions.Genes & Development,24(16):1695-1708.
Jia X,Wang W X,Ren L,Chen Q J,Mendu V,Willcut B,Dinkins R,Tang X,Tang G.2009.Differential and dynamic regulation of miR398 in response to ABA and salt stress in Populus tremula and Arabidopsis thaliana.Plant Molecular Biology,71(1-2):51-59.
Jin L F,Liu Y Z,Yin X X,Peng S A.2016.Transcript analysis of citrus miRNA397 and its target LAC7,reveals a possible role in response to boron toxicity.Acta Physiologiae Plantarum,38(1):1-7.
Kang J,Yim S,Choi H,Kim A,Lee K P,Lopezmolina L,Martinoia J,Lee Y.2015.Abscisic acid transporters cooperate to control seed germination.Nature Communications,6:8113.
Lagosquintana M,Rauhut R,Meye J,Borkhardt A,Tuschl T.2003.New microRNAs from mouse and human.Rna-A Publication of the Rna Society,9(2):175-179.
Lee R C,Feinbaum R L,Ambros V.1993.The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14.Cell,75(5):843-854.
Li C,Lu S.2013.Genome-wide characterization and comparative analysis of R2R3-MYB transcription factors shows the complexity of MYB-associated regulatory networks in Salvia miltiorrhiza.BMC Genomics,15(1):1-12.
Li C,Zhang B.2015.MicroRNAs in control of plant development.Journal of Cellular Physiology,231(2):303-313.
Liu H H,Tian X,Li Y J,Wu C A,Zheng C C. 2008. Microarraybased analysis of stress-regulated micrornas in Arabidopsis thaliana. Rna-a Publication of the Rna Society,14(5):836-843.
Liya W,Zuxin Z.2009.Differentially expressed miRNAs potentially involved in the regulation of defense mechanism to drought stress in maize seedlings.International Journal of Plant Sciences,170(8):979-989.
Martin R C,Liu P P,Goloviznina N A,Nonogaki H.2010.MicroRNA,seeds,and Darwin?:diverse function of miRNA in seed biology and plant responses to stress.Journal of Experimental Botany,61(9):2229-2234.
Mei H C,Yoo K S,Hyoung S,Nguyen H T K,Kim Y Y,Kim H J,Ok S H,Yoo S D,Shin J P.2013.An Arabidopsis R2R3-MYB transcription factor,AtMYB20,negatively regulates type 2C serine/ threonine protein phosphatases to enhance salt tolerance.Febs Letters,587(12):1773-1778.
Ni Z,Zheng H,Jiang Q,Hui Z.2013.GmNFYA3,a target gene of miR169,is a positive regulator of plant tolerance to drought stress.Plant Molecular Biology,82(1-2):113-129.
Niu S,Wang Y,Zhao Z,Deng M,Cao L,Yang L,Fan G.2016.Transcriptome and degradome of microRNAs and their targets in response to drought stress in the plants of a diploid and its autotetraploid paulownia australis.PlosOne,11(7):e0158750.
Ouellet F,Vazquez-Tello A,Sarhan F.1998.The wheat wcs120promoter is cold-inducible in both monocotyledonous and dicotyledonous species.Febs Letters,423(3):324-328.
Phang T H,Shao G,Lam H M.2008.Salt tolerance in Soybean.Journal of Integrative Plant Biology,50(10):1196-1212.
Reis R S.2016.The entangled history of animal and plant microRNAs.Functional & Integrative Genomics,DOI:10.1007/ s10142-016-0513-01-8.
Reyes J,Chua N H.2007.ABA induction of miR159 controls transcript levels of two MYB factors during Arabidopsis seed germination.Plant Journal,49(4):592-606.
Shriram V,Kumar V,Devarumath R M,KhareT S,Wani S H.2016.MicroRNAs as potential targets for abiotic stress tolerance in plants.Front Plant Sci,7:817.
Song J B,Gao S,Sun D,Li H,Shu X X,Yang Z M.2013.MiR394 and LCR are involved in Arabidopsis salt and drought stress responses in an abscisic acid-dependent manner.BMC Plant Biology,13(1):1-16.
Song Q X,Liu Y F,Hu X Y,Zhang W K,Ma B,Chen S Y,Zhang J S.2011.Identification of miRNAs and their target genes in developing soybean seeds by deep sequencing.BMC Plant Biology,11(1):1-16.
Sun X,Fan G,Su L,Wang W,Liang Z,Li S.2015.Identification of cold-inducible microRNAs in grapevine.Frontiers in Plant Science,6:595.
Sunkar R,Zhu J K.2004.Novel and stress-regulated microRNAs and other small RNAs from Arabidopsis.The Plant Cell,16(8):2001-2019.
Sunkar R,Kapoor A,Zhu J K.2006.Posttranscriptional induction of two Cu/Zn superoxide dismutase genes in Arabidopsis is mediated by downregulation of miR398 and important for oxidative stress tolerance.Plant Cell,18(8):2051-2065.
Sunkar R,Li Y F,Jagadeeswaran G.2012.Functions of microRNAs in plant stress responses.Trends in Plant Science,17(4):32-41.
Tang G.2010.Plant microRNAs:an insight into their gene structures and evolution.Seminars in Cell & Developmental Biology,21:782-789.
Uno Y,Furihata T,Abe H,Yoshida R,Shinozaki K,Yamaguchishinozaki K.2000.Arabidopsis basic leucine zipper transcription factors involved in an abscisic acid-dependent signal transduction pathway under drought and high-salinity conditions.Proceedings of the National Academy of Sciences,97(21):11632-11637.
Wang C Y,Zhang S,Yu Y,Luo Y C,Liu Q,Ju C,Zhang Y C,Qu L H,Lucas W J,Wang X,Chen Y Q.2014.MiR397b regulates both lignin content and seed number in Arabidopsis via modulating a laccase involved in lignin biosynthesis.Plant Biotechnology Journal,12(8):1132-1142.
Wani S H,Kumar V,Shriram V,Sah S K.2016.Phytohormones and their metabolic engineering for abiotic stress tolerance in crop plants.Crop Journal,4(3):162-176.
Zhang B.2015.MicroRNA:a new target for improving plant tolerance to abiotic stress.Journal of Experimental Botany,66(7):1749-1761.
Zhang X,Zhe Z,Gong P,Zhang J,Ziaf K,Li H,Xiao F,Ye Z.2011.Over-expression of microRNA169 confers enhanced drought tolerance to tomato.Biotechnology Letters,33(2):403-409.
Zhao B,Liang R,Ge L,Li W,Xiao H,Lin H,Ruan K,Jin Y.2007.Identification of drought-induced microRNAs in rice.Biochemical & Biophysical Research Communications,354:585-590.
The Research Advance of Plant miRNAs Response to Abiotic Stress
LIU Yu-feng1,WANG Xiao1,CHEN Hai-yin1,LIU Kun1,LIU Yang1,QI Ming-fang1,NING Xiaofeng2,LI Tian-lai1*
(1College of Horticulture,Shenyang Agricultural University,Key Lab of Protected,Ministry of Education,Collaborative Innovation Center of Protected Vegetable Surround Bohai Gulf Region,Shenyang 110866,Liaoning,China;2College of Engineering,Shenyang Agricultural University,Shenyang 110866,Liaoning,China)
MicroRNAs(miRNAs)are 20-24 nt non-coding RNA,which plays a very important role by targeting mRNA under abiotic stress. This paper focused on the low temperature,exogenous ABA and drought stress in the regulation mechanism of miRNA,and to further clarify the mechanism of miRNAs in response to abiotic stress.
miRNA;Low temperature;Exogenous ABA;Drought;Review
刘玉凤,女,博士,硕士生导师,主要从事设施蔬菜栽培生理研究,E-mail:lyf-3939@163.com
*通讯作者(Corresponding author):李天来,男,博士,博士生导师,主要从事设施蔬菜栽培生理研究,E-mail:tianlaili@126.com
2016-10-21;接受日期:2016-12-27
国家重点研发计划支持项目(2016YFD0201004),辽宁省农业领域青年科技创新人才培养计划项目(2015040),农业部现代农业产业体系建设专项(CARS-25),中央财政农业科技推广项目(GCNTLN-17)

