氢氧化钠提取-离子色谱法检测蘑菇中的二氧化硫
毛黎娟,吴筱丹,袁京群,李士敏
(浙江大学 农生环测试中心,浙江 杭州 310058)
氢氧化钠提取-离子色谱法检测蘑菇中的二氧化硫
毛黎娟,吴筱丹,袁京群,李士敏
(浙江大学 农生环测试中心,浙江 杭州 310058)
基于碱性溶液可以提取样品中的二氧化硫及其可逆结合亚硫酸盐的原理,建立1种测定蘑菇中二氧化硫残留的氢氧化钠提取-离子色谱法。以0.04 mol·L-1的氢氧化钠为提取溶剂、1.48%甲醛为保护剂提取蘑菇中的二氧化硫,通过RP小柱净化和0.074%甲醛稀释提取液,提高样品溶液中亚硫酸钠的稳定性及离子色谱检测的灵敏度和分离度。对蘑菇样品中二氧化硫残留量检测的线性范围为0.1~1.0 μg·mL-1,检测限为0.5 mg·kg-1,对2.5 g蘑菇样品测定的回收率为84.4%~100.4%,相对标准差为0.34%~1.58%,满足日常蘑菇样品中二氧化硫残留的测定要求。
蘑菇; 二氧化硫; 离子色谱法
二氧化硫作为一种食品添加剂,被广泛用于食品漂白剂、防腐剂、抗氧化剂和防褐变剂。在食品加工中,通常用燃烧硫磺的方法,一方面可以干燥食品,另一方面防止酶促褐变和非酶促褐变作用,提高食品成色,延长存放时间,从而达到干燥、漂白、防腐的目的[1-2]。
二氧化硫进入人体内后先生成亚硫酸盐,亚硫酸盐被氧化成为硫酸盐,最终由尿排出体外,因此,人体摄入少量的二氧化硫被认为是安全无害的。国家标准GB 2760—2011《食品添加剂使用卫生标准》中对二氧化硫在干制的食用菌和藻类中的最大使用量为0.05 g·kg-1[3],但食品中二氧化硫及亚硫酸盐超标情况十分严重,食品中二氧化硫及其衍生物超标将对人体器官组织产生不利的影响,如二氧化硫进入呼吸道后,在上呼吸道湿润的粘膜上生成具有腐蚀性的亚硫酸、硫酸和硫酸盐,损害支气管和肺,进而可以诱发各种呼吸道炎症,且对其他多种器官均具有多种毒性作用[4-5]。
国家标准GB/T 5009.34—2003《食品中亚硫酸盐的测定》规定的二氧化硫残留量的测定方法是盐酸副玫瑰苯胺法和蒸馏后碘量法,检出浓度1 mg·kg-1[6]。国标规定的这两种测定方法成熟可靠,但是分别用到毒性较大的含有汞和铅的试剂作为吸收液,容易造成环境污染[7]。离子色谱方法操作简便、灵敏度高、专属性强,能够比较准确的测定食品中二氧化硫的残留量,已被应用在食品分析领域[8-10],行业标准SN/T 2918—2011《出口食品中亚硫酸盐的检测方法-离子色谱法》规定了出口食品中亚硫酸盐残留量的离子色谱检测方法,适用于白砂糖等中亚硫酸盐残留量的检测[11]。应用氢氧化钠或碳酸钠提取后离子色谱法[12-13]、盐酸酸化蒸馏提取后离子色谱法[14]测定了香菇中的亚硫酸盐含量。本试验优化建立了蘑菇中二氧化硫残留的氢氧化钠提取后离子色谱法,并应用于实际样品的检测。
1 材料与方法
1.1 试材
供试材料为蘑菇(市售)。仪器有ICS-2000离子色谱仪(DIONEX, USA);高速万能粉碎机(天津市泰斯特仪器有限公司);分析天平(上海梅特勒—托利多仪器有限公司);超声波清洗器(上海科导超声仪器有限公司)。试剂有氢氧化钠、甲醛及亚硫酸钠,均为分析纯(上海国药集团),试验用水为Milli-Q超纯水。
1.2 方法
1.2.1 对照品储备液制备
准确称取0.196 9 g亚硫酸钠置100 mL容量瓶中,加水50 mL溶解,并吸取2.0 mL 37%甲醛水溶液于容量瓶中,加水定容至100 mL,即得对照品储备液(含二氧化硫1.0 mg·mL-1)。
1.2.2 供试品处理
取蘑菇500 g,去蒂。将可食用部分切碎,用组织粉碎机将样品加工成浆状,均匀分成若干份,分装入洁净盛样袋内,密闭并标识。准确称取2.5 g均匀试样置于50 mL的具塞刻度塑料离心管中,以少量水润湿,加入1.0 mol·L-1氢氧化钠溶液1.0 mL,摇匀,加入1.0 mL 37%甲醛溶液,以水稀释至25 mL。超声提取5 min,以10 000 r·min-1离心30 min,上清液待净化。取RP固相萃取柱(希波氏,1.0 mL,Tianjin Fuji Science & Technology Co.,Ltd),以10 mL甲醇、15 mL水活化,取样品上清液过RP小柱,弃去前面3 mL样品流出液,收集后10 mL样品溶液,0.22 μm滤膜过滤,弃去初滤液3 mL,取续滤液1.0 mL,加0.074%甲醛水溶液稀释至10.0 mL,即得供试品溶液。
1.3 离子色谱条件
保护柱RFICTM IonPac AG11-HC guard(4 mm×50 mm),分析柱IonPac AS11-HC Analytical(4 mm×250 mm),柱温30 ℃,淋洗液为Thermo Dionex EGC Ⅲ KOH Eluent Generator Cartridge Potassium Hydroxide RFICTM,KOH溶液浓度10~30 mmol·L-1,流速1.0 mL·min-1,进样体积50 μL。检测器名称和型号为DS6 HEATED CONDUCTIVITY CELL(电导检测器,DS6),温度35 ℃,抑制器为DIONEX®ASRS®300 4 mm,电流50 mA。梯度洗脱程序见下表1。

表1 梯度洗脱程序
1.4 测定方法
取对照品溶液及供试品溶液50 μL进行离子色谱分析,记录色谱图。采用标准曲线法计算样品中二氧化硫的含量。
2 结果与分析
2.1 保护剂
由于亚硫酸根离子不稳定,很容易被氧化,因此试验中分别加入甲醛和抗坏血酸作为保护剂进行筛选。结果显示,在相同浓度的二氧化硫溶液中加入抗坏血酸保护剂后,干扰二氧化硫的检测。加入1.48%甲醛水溶液作为保护剂,结果甲醛超载,色谱峰拖尾,与二氧化硫色谱峰未能达到基线分离,影响检测的灵敏度;将该样品溶液用0.074%甲醛水溶液稀释,结果峰型有改善,显示两者分离度达到要求。因此本试验采用1.48%甲醛作为保护剂进行二氧化硫提取,确保提取液中亚硫酸钠的稳定性,并以0.074%甲醛水溶液作为稀释剂,稀释进样,改善色谱条件,提高检测灵敏度。
2.2 色谱条件
淋洗液由氢氧化钾组成,随淋洗液浓度的增加,亚硫酸根保留时间减小,如果浓度太大,与杂质峰未能达到基线分离,如果浓度太低,峰宽变大。本试验对淋洗液的浓度、流速等条件进行筛选,最终采取梯度洗脱的方法。在该梯度条件下,杂质峰和二氧化硫色谱分离良好,且可减少数据采集时间,保护色谱柱。
2.3 专属性
在上述试验条件下,经预处理的蘑菇样品中其他物质不干扰二氧化硫的测定(图1),可见该方法专属性良好。
2.4 线性关系
分别精密移取对照品储备液适量,于100 mL容量瓶中,加0.074%甲醛水溶液定容至刻度,制备成浓度分别为0.05、0.10、0.20、0.50、0.80、1.00 μg·mL-1系列标准溶液,进行离子色谱分析。以峰面积为纵坐标,对照品溶液浓度为横坐标,绘制标准曲线,得线性回归方程为Y=7.539 3X+0.067 6,R2=0.998 2。结果表明,亚硫酸根离子浓度(以二氧化硫浓度计)在0.1~1.0 μg·mL-1线性关系良好。
2.5 检测限和定量限
以3倍信噪比所对应的浓度作为检测限,以10倍信噪比所对应的浓度作为定量限,本试验方法的检测限与定量限分别为0.05和0.10 μg·mL-1,相当于取样量为2.5 g时样品中二氧化硫含量为0.5和1.0 mg·kg-1。
2.6 精密度
取对照品溶液按照上述色谱条件连续进样,测定8次,峰面积分别为0.067 4、0.066 1、0.064 6、0.064 1、0.064 5、0.068 5、0.067 9、0.066 9 μS×min,计算峰面积的相对标准差为2.54%,表明亚硫酸根离子测定精密度良好。
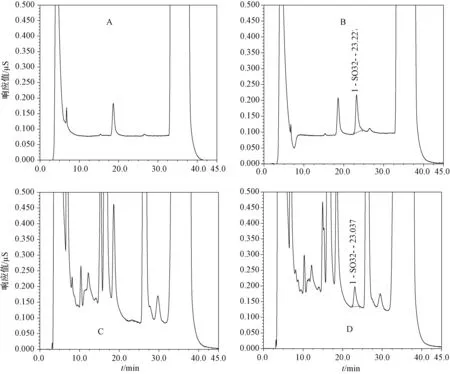
A,B,C,D分别为空白、对照、样品和样品加标图1 离子色谱法检测蘑菇中的二氧化硫
2.7 稳定性
取新制备的供试品溶液,分别在0、2、4、12、18、24 h进样,测定结果分别为0.448 5、0.450 1、0.436 8、0.444 3、0.403 6、0.395 3 μg·mL-1,计算浓度的相对标准差为5.60%,表明亚硫酸盐溶液稳定性良好,但尽快进样的测定结果更可靠。
2.8 重复性
分别称取同批号蘑菇约2.5 g,按1.2.2的方法平行制备6份供试品溶液,按照1.4的色谱条件进行测定,测定的二氧化硫含量分别为180、180、178、185、183、181 mg·kg-1,计算样品二氧化硫含量的相对标准差为1.29%。
2.9 回收率
取无二氧化硫残留的蘑菇空白样品各2.5 g,分别加入亚硫酸钠对照品溶液(相当于二氧化硫浓度为100 μg·mL-1)0.50、1.25、2.50 mL制成含低中高3种浓度的样品,每个浓度样品平行3份,按照上述方法测定,计算回收率。
蘑菇中二氧化硫的平均回收率分别为100.4%、84.9%和84.4%,相对标准差分别为1.44%、1.58%和0.34%(表2),表明在2.5 g蘑菇样品中加入相当于50、125、250 μg二氧化硫的回收率均符合检测要求,满足蘑菇样品中含低中高二氧化硫残留量的检测要求。
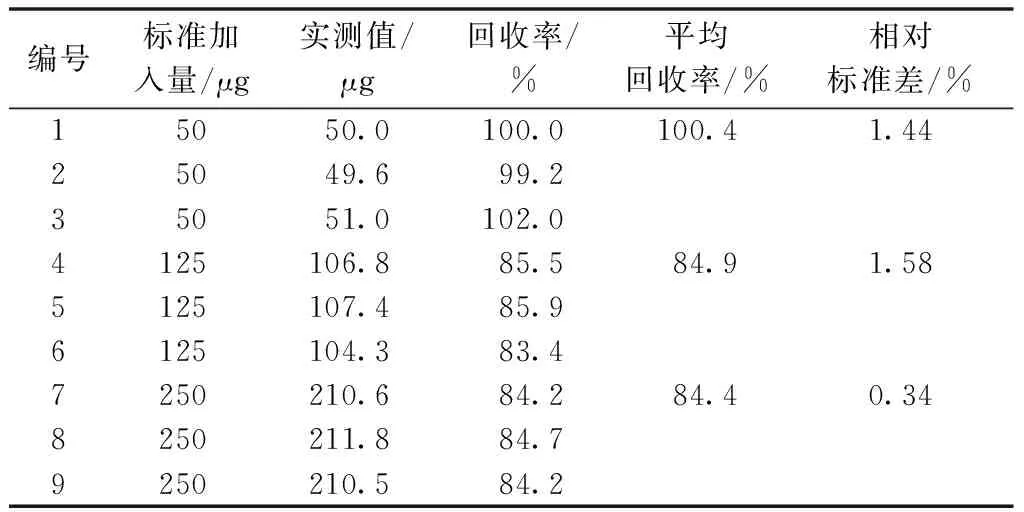
表2 蘑菇样品中二氧化硫加标回收率及精密度
3 讨论
试验建立了蘑菇中二氧化硫的氢氧化钠提取-离子色谱法测定方法,与国标的盐酸副玫瑰苯胺法和蒸馏后碘量法相比,操作简便、灵敏度高、专属性强,能较准确的测定食品中二氧化硫残留量。与王伟等[12]测定香菇的氢氧化钠提取-离子色谱法测定方法相比,本试验通过RP小柱净化和0.074%甲醛稀释提取液,提高供试品溶液亚硫酸钠的稳定性。本试验方法测定蘑菇中二氧化硫含量的线性范围为0.1~1.0 μg·mL-1,检测限为0.5 mg·kg-1,回收率84.4%~100.4%,对2.5 g蘑菇样品测定的相对标准差为0.34%~1.58%,可用于蘑菇样品中二氧化硫残留量的检测。
[1] 万素英,李琳,王慧君.食品防腐与食品防腐剂[M].北京:中国轻工业出版社,1998.
[2] 王丽丽,纪淑娟,李顺.食品中二氧化硫及亚硫酸盐的作用与检测方法[J].食品与药品,2007,9(2A):64-66.
[3] 中华人民共和国卫生部. 食品添加剂使用卫生标准:GB 2760—2011[S].2011.
[4] 李芳.食品中二氧化硫的危害及检测方法[J].职业与健康,2009,25(3):315-316.
[5] 孟紫强,张波,秦国华.二氧化硫对小鼠不同组织器官的氧化损伤作用[J].环境科学学报,2001,21(6):769-773.
[6] 中华人民共和国卫生部,中国国家标准化管理委员会. 食品中亚硫酸盐的测定:GB/T 5009.34—2003[S].2003.
[7] 吴敏,张志刚,王根芳,等.进出口食品中亚硫酸盐测定方法的探讨[J].福建分析测试,2003(1):1708-1711.
[8] 陈辰康,滕根发,虞雄华.离子色谱法测定干货制品中的二氧化硫[J]. 化学世界,2014(1):19-22.
[9] 杨一超,许春斌.离子色谱法测定食品中总二氧化硫含量[J].中国卫生检验杂志,2004,14(4):463-464.
[10] 钟志雄,梁春穗,杜达安,等.离子色谱法测定食品中亚硫酸盐的应用研究[J].中国卫生检验杂志,2003,13(1):29-39.
[11] 中华人民共和国国家质量监督检验检疫总局. 出口食品中亚硫酸盐的检测方法-离子色谱法:中华人民共和国出入境检验检疫行业标准SN/T 2918—2011[S]. 2011.

[13] 李素媛,胡艳.离子色谱法测定香菇中亚硫酸盐[J].分析试验室,2009,28(S2):170-171.
[14] 柴振林,祝新明,吴翠蓉.盐酸酸化─蒸馏─离子色谱法测定香菇亚硫酸盐含量研究[J].江西农业学报,2010,22(9):123-125.
(责任编辑:张瑞麟)
2016-09-09
浙江大学实验技术研究项目(SYB201611)
毛黎娟(1974—),女,浙江江山人,工程师,硕士,从事分析检测工作,E-mail: mlj105@163.com。
10.16178/j.issn.0528-9017.20170228
TS207.5
A
0528-9017(2017)02-0271-04
文献著录格式:毛黎娟,吴筱丹,袁京群,等. 氢氧化钠提取-离子色谱法检测蘑菇中的二氧化硫[J].浙江农业科学,2017,58(2):271-274.

