绒山羊母羔体外胚胎生产技术操作细则
豆兴堂(辽宁省畜牧科学研究院,辽阳 111000)
绒山羊母羔体外胚胎生产技术操作细则
豆兴堂
(辽宁省畜牧科学研究院,辽阳 111000)
文章详细介绍了辽宁绒山羊母羔体外胚胎生产技术的操作流程,包括实验室要求、母羔超排处理、公羊精液处理、卵母细胞采集、卵母细胞成熟培养、体外受精、早期胚胎体外发育培养、胚胎移植等,并附日程安排、SOF配方、记录表等,供相关科技人员参考。
绒山羊;母羔;体外胚胎;体外受精
幼畜体外胚胎生产技术(juvenile in vitro embryo transfer,JIVET),即幼畜超排、胚胎体外生产和移植技术,是提高良种家畜繁殖效率的核心技术。经过多年辽宁绒山羊母羔体外胚胎生产技术试验研究归纳总结,形成了该技术操作细则,供欲建立幼畜体外胚胎生产技术体系的科技人员参考。
本操作细则可供建立绒山羊JIVET技术体系参考。
1 实验室要求
1.1 实验室设计及环境
胚胎操作实验室应与其他的实验室完全分离。实验室内工作台的装修与仪器设备安装摆放要考虑到整体操作过程中的技术细节与流程,同时应考虑实验室的空间与人员,确保每一个操作步骤都能够按时完成而不会因为受实验室条件的限制而推迟。选择有设计和建造生物超净工作室经验的工程师,确保建筑材料无毒、环保。实验室最好配备通风系统,清楚周围环境中的污染物,提供高纯度的空气。试验室内温度应保持在25~30℃,相对湿度保持在40%~60%。室内通常不设洗手池以减少下水道可能带来的污染,设置空气消毒设备,如紫外线灯或者空气消毒机等。实验室启用前进行“热处理”[1],打开所有照明及其他设备电源,可应用附加电热器将室温调至30~35℃,打开通风系统并调到最大通风量,关闭实验室,热处理持续10~28 d。
1.2 实验室仪器设备
立体显微镜、CO2培养箱、CO2气体瓶、生物光学显微镜、倒置显微镜、超净工作台、离心机、水浴锅、冰箱、纯水仪(MiniQ)、电子分析天平(精度0.000 1 g),1 000μL、0~200μL(可调)、0~100μL(可调)、0~20μL(可调)移液枪至少各一把等。
1.3 实验室试剂耗材
需要耗材:5mL、10mL玻璃试管若干,50mL、15mL离心管若干,枪头若干,35mm、90mm培养皿若干,四孔板若干,玻璃巴氏管若干,酒精灯2个,2mL离心管若干,封口膜1卷,100mL、50mL烧杯若干,10mL注射器若干,0.22μm滤器若干等。试剂:TCM199(Sigma或者Gibco)、BSA、HEPES、Na-Lactate、Na-Pryuvate、L-Glutamine、NaCl、MgCl2、CaCl2、KCl、NaH2PO4、KH2PO4、NaHCO3、Nycillin、Heparin、FSH、LH、PMSG、E2、EGF、EAA、NAA、FBS、Hyaluronidase、Minera Oil等,以上试剂除注明外,均为Sigma试剂。
1.4 试剂配制
实验中所用试剂配制、培养液各组分试剂浓储液的配制和各试剂的使用注意事项可参照Andras Nagy[2]操作。
1.5 实验人员要求
熟练掌握胚胎操作,卵母细胞、受精卵、胚胎的鉴别。熟练掌握培养液配制和无菌操作技术等。实验室内操作时应穿无菌实验服,戴实验帽,做好手、手臂消毒等。
1.6 试验准备
按照以下各实验环节准备好母羔羊、受体母羊和实验仪器耗材,人员分工。制定实验工作日程和实验计划(见附件1)。
2 幼龄母羔超排处理
2.1 幼龄母羔选择
年龄4~8周龄、体质良好、出生体重4.5~8.0 kg、健康、喜好嬉戏、精神状态良好、有完整系谱档案的母羔。超排处理前最好与母羊同圈饲养。
2.2 幼龄母羔饲养管理
在超排处理前至少2周,幼龄母羔应该在试验圈饲养,最好与母羊同圈饲养,以期使其适应环境,减少应激。试验母羔只均日饲喂颗粒料0.15~0.20 kg,自由采食干苜蓿草、饮干净水。圈舍保持干燥、通风良好。
2.3 母羔超排
超排激素为FSH(加拿大)、PMSG。第一天上午7:30肌肉注射FSH 40mg、PMSG 333 IU,晚19:30肌肉注射FSH 40mg;第二天上午7:30肌肉注射FSH 40mg,晚19:30肌肉注射FSH 40mg。最后一针注射后12~16 h采集卵母细胞,同时超排处理母羔应禁食禁水,与母羊同圈饲养。
3 种公羊精液处理
3.1 种公羊要求
年龄2~5周岁,性欲良好,适应人工采精,本交配种母羊有产羔史,无疾病,等等。
3.2 采集精液
采集场所做好消毒处理。剪公羊腹毛,将采精公羊腹部的被毛用弯剪剪短,特别是尿道口和尿道口前端及两侧的被毛尽量剪短,使之在采精时减少或避免与采精工具接触。清洗种公羊包皮,将青霉素160万IU、链霉素100万IU,加入150mL的蒸馏水或生理盐水中全部溶解后,用20mL注射器吸入20mL的药液,然后用手捏住公羊包皮,将药液注入,再将包皮外口手捏封闭,用另一手反复推动包皮内的药液,使之流动,使其在包皮内不留死角,与药液充分接触,过2min后松开包皮外口,放出药液。冲洗2次。再用生理盐水冲洗1次。母羊臀部消毒处理,用75%的酒精对母台羊后躯的被毛及尾部、外阴进行喷雾消毒,一边喷一边用手按压母羊被毛,使消毒液充分渗入。假阴道、集精杯用生理盐水、酒精清洗消毒处理后备用。采精人员应采集1只公羊,换一副手套。精液采集方法按照假阴道采集种公羊精液规程进行。
3.3 冷冻精液制作
采集的种公羊精液,4倍稀释,显微镜下检查精子活力,慢速降温平衡,冷冻。解冻精液,活力需达0.3以上。
3.4 精液培养检测
按照IVF要求做四孔板,每孔加入IVF液。解冻后的精液检查活力,吸取少量加入到四孔板的IVF液中,5% CO2、38.5℃培养24 h,显微镜下观察精子存活时间、菌落生长情况。每批冻精每个种公羊重复培养2次。选择无菌落生长、存活时间12 h以上的种公羊冻精备用。
4 超排母羔采集卵母细胞
4.1 母羔手术前准备
按照常规手术的手术器械、器具、人员准备。母羔称重,做好记录。再保定于手术架上,腹部(乳头与脐之间)剃毛,术部用75%消毒,注射麻醉药(陆眠灵)0.015 mL/kg。
4.2 卵母细胞采集液配制
基础液为TCM199,采集液为TCM199+0.12mg/mL sodium pyruvate+5%EGS+0.01mg/mLHeparin+5.958mg/mL HEPES+10μL/mLmycillin,0.22μm滤器过滤,38.5℃、5% CO2下过夜平衡。手术采集卵母细胞前将采卵液转入50mL离心管,在37℃水浴中预热。
4.3 手术采集卵母细胞
手术打开腹腔,做好止血,扩开创口,观察卵巢位置和超排状况。用弯头止血钳轻轻夹住一侧卵巢韧带,将卵巢牵拉出体外,关闭创口,上盖敷料,将卵巢放于敷料上,用两个弯头带无毒橡胶套的大号弯头止血钳夹住卵巢下面的动静脉血管和韧带,调整手术架高度以便采集卵母细胞操作。采集人员选择较舒适姿势,医用10mL注射器先抽取约2mL采卵液,手持10mL注射器,以注射器针头斜面向下刺入卵泡,同时手指轻轻抽注射器针管,吸取卵泡内的卵母细胞和卵泡液,大卵泡直径约6mm,小卵泡直径约2mm。可以单个卵泡刺入采集,也可从单个卵泡刺入吸取后再以近水平方向继续刺入相邻卵泡内抽吸。卵巢表面大小卵泡都吸取完后,以另一只手拇指食指轻轻捏住卵巢,触摸卵巢里面手感似米粒的卵泡,再用注射器抽吸采集,直到触摸不到时为止。抽吸时尽量轻,防止因抽吸太剧烈导致形成裸卵。采集的卵母细胞液缓慢轻轻注入37℃水浴预热的15mL离心管中。采集完的卵巢表明撒止血敏药粉,再以氯霉素乳膏将整个卵巢包裹,轻轻松开卵巢下方的止血钳,清创,将卵巢送入腹腔。常规手术缝合,肌肉注射陆醒宁0.03mL/kg。采集的卵母细胞液送入实验室准备捡卵。
5 卵母细胞成熟培养
5.1 卵母细胞成熟培养液准备
卵母细胞IVM组成:基础液+10μg/mLFSH+20μg/mL LH+1μg/mL E2+10 ng/mL EGF+10%EGS+20 ng/mL EGF+ 10μL/mLmycillin等[3]。基础液:TCM199+0.12mg/mLsodium pyruvate。TCM199按照说明书配制并添加所需组分试剂。FSH、LH、L-glutamine等配制成所需浓度的浓缩储存液,现用现添加。0.22μm滤器过滤。分别往3个35mm培养液中各加入成熟液2mL,做卵母细胞洗涤液,并编号;将成熟液加入到四孔板中,每孔600μL成熟液,上覆矿物油,和洗涤液一起在38.5℃、5%CO2下平衡2 h以上。
5.2 捡取卵母细胞准备
室温25~30℃下,将直径90mm培养皿外部底面用剪刀头划出方格,以方便捡取卵母细胞。将高压消毒过的巴氏管在酒精灯下拉制成断端内径250~300μm,在酒精灯火焰下使断端钝圆。
5.3 卵母细胞捡取洗涤分级
在38.5℃加热板上,将装有采集卵母细胞的采卵液静置8~10min,若采卵液量多,可用注射器轻轻抽出上层液,弃掉。用注射器轻轻抽取底部采卵液,并轻轻注入到90mm培养皿,采卵液量正好平铺培养皿底部,立体显微镜下能清楚观察到卵母细胞为宜。将口吸管和巴氏捡卵针相连,调整立体显微镜放大倍率(一般20倍为宜),在立体显微镜下从一边的方格到对侧的方格捡取卵母细胞。将捡取的卵母细胞移到1号培养皿洗涤液中。再快速重复一次,以免有漏掉未捡到的卵母细胞。最后将盛采卵液的试管用采卵液洗一遍,再捡取卵母细胞。所以采卵液捡取完毕后,进行卵母细胞洗涤。将1号培养皿洗涤液中的卵母细胞转移到2号皿,再从2号皿转移到3号皿中,并按照卵丘颗粒细胞的多少分级。A级为卵丘细胞层完整而致密的卵母细胞;B级为卵丘细胞层部分脱落的卵母细胞;C级为卵丘细胞极少或全部脱落的裸卵。C级淘汰。
5.4 卵母细胞成熟培养
A级和B级卵母细胞用于成熟培养。将洗涤好的卵母细胞转移到四孔板成熟培养液中,每孔25~30枚卵母细胞,并紧密放置。将四孔板放入38.5℃、5%CO2培养箱培养,一般成熟培养24~27 h。记录卵母细胞入孵培养时间、数量、所用卵母细胞母羊号(见附件2)等,四孔板做好标注。
6 精子与卵母细胞体外受精
6.1 受精液配制
配制SOF(见附件3)基础液,受精液为SOF+1μg/mL hypotaurine+6mg/mLBSA+10μL/mLmycillin等。0.22μm滤器过滤,分别往3个35mm培养液中各加入受精液2mL,做卵母细胞洗涤液,并编号;四孔板每孔加入受精液400μL,上覆矿物油,38.5℃、5%CO2平衡2 h以上,备用。
6.2 卵母细胞准备
室温25~30℃下,在38.5℃加热板上,用内径250~300μm捡卵针将成熟培养24~26 h的卵母细胞转移到1号受精洗涤液中。取1mL受精液加入透明质酸酶使浓度为1%。将受精液中的卵母细胞转入1%透明质酸酶液中,作用2~3min,用内径200~250μm捡卵针轻轻反复吹吸,使颗粒细胞脱落。再将卵母细胞依次转移到2号、3号受精洗涤液中,最后转移到四孔板受精液中,每孔25~30枚卵母细胞。
6.3 精子获能液配制
配制SOF(见附件3)基础液,获能液为:SOF+2% EGS+25μg/mL heparin+10μL/mLmycillin等[4],0.22μm滤器过滤,38.5℃、5%CO2平衡2 h以上。每支无菌玻璃试管加入获能液800μL,38.5℃、5%CO2下备用。
6.4 精子获能处理
38.5 ~40℃水浴中解冻细管冻精或者颗粒冻精(用无菌预热的玻璃试管),检查精子活力。根据精子密度,取解冻的精液100~150μL轻轻加入到800μL获能液玻璃试管底部。38.5℃、5%CO2上浮处理20min,备用。
6.5 精子与卵母细胞体外受精
室温25~30℃下,在38.5℃加热板上,取微量上游获能处理的上清液显微镜下检查精子活力与密度,确定上清液精子加入量。一般每孔用微量移液枪取120~150μL上清液,显微镜下轻轻加入到四孔板卵母细胞受精液中,观察精子活动情况,精子应该能推动卵母细胞滚动。记录受精时的时间、所用卵母细胞的母羊号、所用精液的公羊号等,四孔板做好标注。放入38.5℃、5%CO2培养箱中培养22~24 h。
7 早期胚胎体外发育培养
7.1 发育培养液配制
配制SOF(见附件3)基础液,发育培养液为:SOF+8 mg/mL BSA+2%EAA+1%NAA+10μL/mL mycillin+ 0.5mg/mLmercaptoethanol等[5-6]。0.22μm滤器过滤,分别往3个35mm培养液各加入发育液2mL,做合子洗涤液,并编号;四孔板每孔加入发育液600μL,上覆矿物油,38.5℃、5%CO2平衡2 h以上,备用。
7.2 早期胚胎培养
室温25~30℃下,在38.5℃加热板上。精子与卵母细胞作用22~24 h后,用微量移液枪轻轻反复吹打假定合子,直到假定合子透明带外粘附的精子凝块脱落为止。立体显微镜下用内径200~250μm捡卵针分别将每孔假定合子转移到胚胎发育培养液中,再依次转移到2号、3号胚胎发育液中。立体显微镜40倍观察卵裂情况,并记录。将卵裂的2细胞胚胎挑选出来。最后,卵裂的2细胞胚胎转移到胚胎发育液四孔板的培养孔中,培养5~6 h。未卵裂假定合子分别转移到胚胎发育液四孔板相应的培养孔中,38.5℃、5%CO2培养24 h。记录培养时间、数量、羊号等,四孔板做好标注。
7.3 早期胚胎观察
已卵裂的2细胞胚胎培养5~6 h后,可移植到受体母羊输卵管中。未卵裂假定合子培养24 h后,立体显微镜下观察卵裂情况。挑选出未卵裂的假定合子,弃掉。2~4细胞胚胎可以挑选出来,进行输卵管移植;也可继续发育培养24 h后,换液继续培养直到发育至囊胚。换液成分为:SOF+10%EGS+2%EAA+1%NAA+10μL/mL mycillin等。
8 受体母羊同期发情处理
8.1 受体母羊选择
受体母羊应为年龄3~6岁,上一年度有生产史,发情正常,膘情适中,体重22.5~35.0 kg的健康经产母羊。
8.2 受体母羊同期发情处理
放置CIDR(新西兰),母羊外生殖器先用干净湿抹布擦拭,清除污物,再用酒精棉球擦拭,最后用生理盐水棉球擦拭,CIDR枪用酒精棉球消毒处理,放置CIDR时枪表面用酒精棉球擦拭消毒,装入CIDR,一手持枪,一手拇指食指打开生殖器,将CIDR枪轻轻送入,在不损伤母羊生殖道的前提下,尽可能深一些送入,推动枪的顶杆将CIDR顶入母羊生殖道。用酒精棉球擦拭枪表面消毒。放置CIDR第14天下午肌肉注射PMSG 250 IU,第15天上午撤栓,同时肌肉注射PG 1mL,第16、17天上下午用公羊试情。记录受体羊发情日期、时间等(见附件4)。受体母羊移植前24 h禁食禁水。
9 胚胎移植
9.1 胚胎与受体母羊匹配
输卵管移植2~4细胞胚胎时,受体母羊发情结束与2~4细胞胚胎匹配,或者受体母羊发情结束比2~4细胞胚胎晚12 h。
9.2 胚胎准备
在受体母羊与胚胎匹配的情况下,受体母羊准备好手术移植时,将2~4细胞胚胎转移出发育培养液,转入移植液。准备好移植针(带注射器)等,移植针可用购买的商品移植针,也可自制,将巴氏管拉制成尖端内径1 mm左右,在酒精灯火焰下使针头钝圆即可。需要远距离运输胚胎时,可将胚胎转入到2mL离心管中,放入保温瓶(37℃)即可。做好无菌措施。
9.3 胚胎装入移植针
当受体母羊黄体良好确认移植胚胎时,在立体显微镜下,用100μL移液枪将含有胚胎的液体从2mL离心管中移入35mm培养皿,检查胚胎数量,确保不丢失胚胎。胚胎装入移植针时,先吸取一段移植液于移植针中,留一段空气,再吸取移植液和3~4枚胚胎,留一段空气,再吸取一段移植液,将含有胚胎的液体置于两段液体之间。
9.4 胚胎移植
将与胚胎匹配的受体母羊保定于手术架上,术部剃毛,酒精消毒,肌肉注射陆眠灵0.015mL/kg。沿腹中线位置,切口皮肤约5 cm,钝性分离肌肉,剪开腹膜,食指与中指将子宫角牵拉出创口,暴露卵巢观察黄体情况。优良黄体为突出于卵巢表面火山口样的红色突起。选择卵巢有黄体侧进行胚胎移植,创口覆盖敷料,将子宫角、输卵管等置于其上,寻找输卵管伞口,可借助蘸有温生理盐水的敷料拨动输卵管伞,将装有胚胎的移植针头从输卵管伞口轻轻送入,湿敷料配合移植针向输卵管深部送入,移植针头通过输卵管2~3个生理弯后,轻轻推动注射器,将胚胎注入到输卵管中,可看到输卵管随着注射器推动而逐渐充盈且向深部充盈,表明胚胎已移植入输卵管中。在推动注射的同时将移植针缓慢轻轻抽出输卵管,胚胎移植结束。同时受体母羊每只肌肉注射黄体酮15mg。清创,受体母羊创口缝合,肌肉注射陆醒宁0.03mL/kg。
10 受体母羊早期妊娠诊断
10.1 血清孕酮检测
受体母羊胚胎移植45 d左右,采集受体母羊血液,制备血清,检测血清中孕酮含量。
10.2 B超检查
受体母羊胚胎移植45 d左右,使用兽用B超,检查子宫胚胎情况。
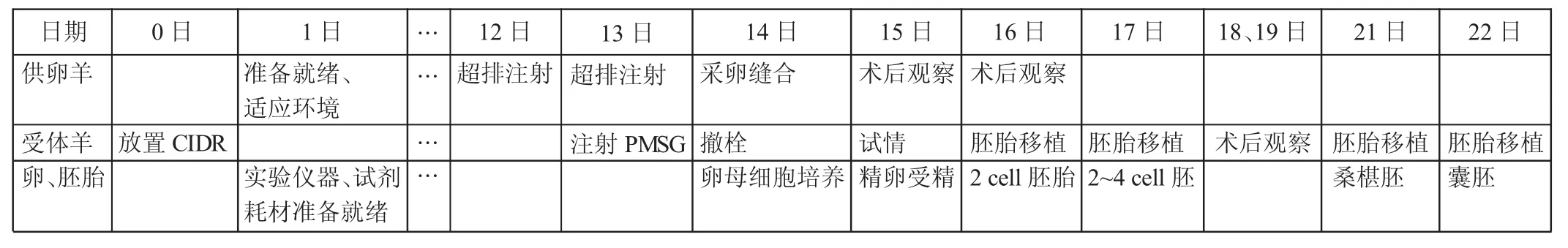
附件1 J I VET试验安排
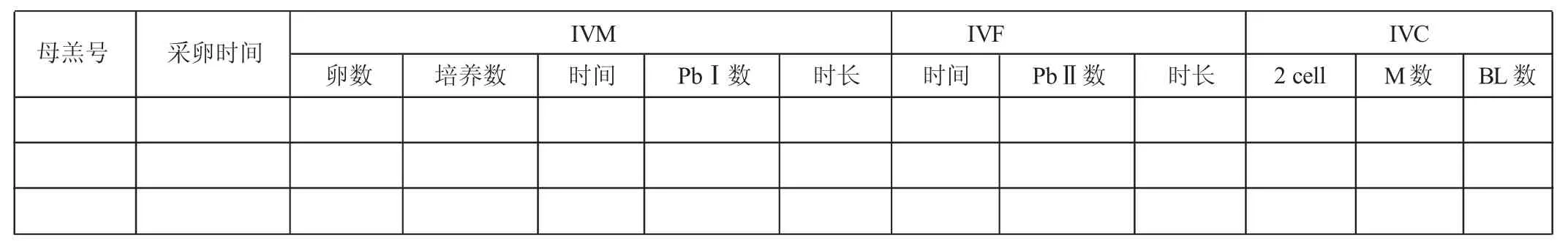
附件2 JIVET体外受精记录表
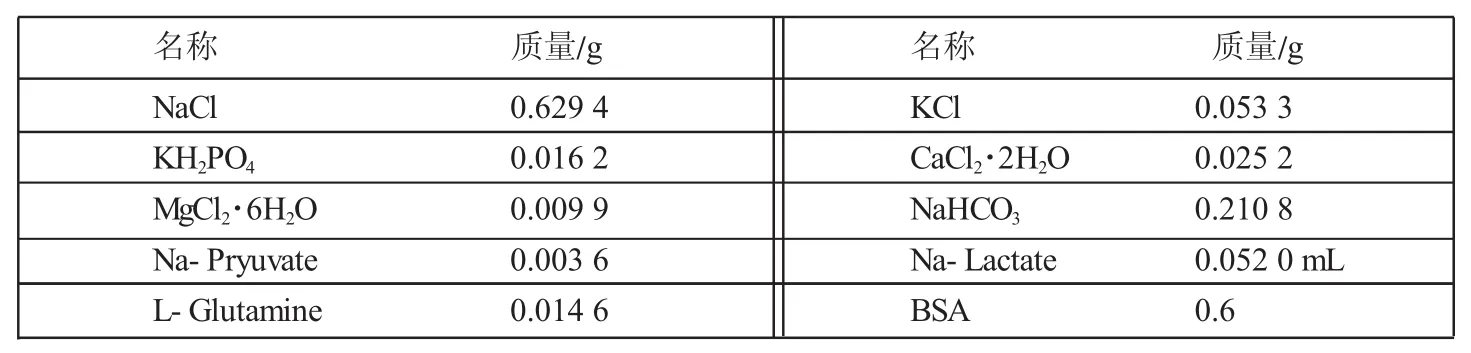
附件3 SOF液成分表(100m L)
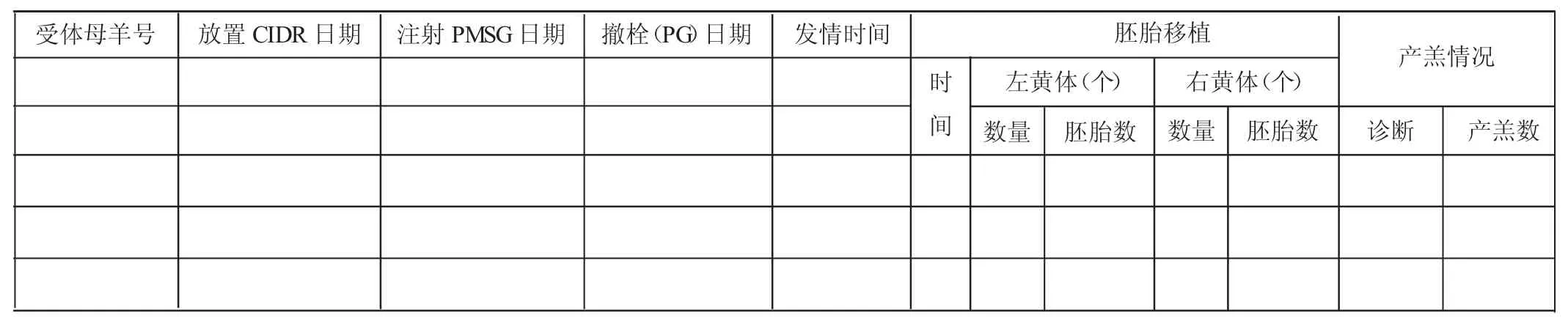
附件4受体母羊同期发情与胎胎移植记录表
[1]李媛.人类辅助生殖实验技术[M].北京:科学出版社,2008:42-49.
[2]Andras Nagy,Marina Gertsenstein,Kristina Vintersten,et al. 孙青原,陈大元.主译.小鼠胚胎操作实验手册[M].3版.北京:化学工业出版社,2006:135-160.
[3]豆兴堂,张兴会,郭丹,等.影响绒山羊母羔卵母细胞体外成熟因素的研究[J].黑龙江动物繁殖,2012,20(1):12-14.
[4]豆兴堂,宋先忱,张兴会,等.肝素浓度对辽宁绒山羊精子体外获能的影响[J].中国草食动物,2011,31(1):21-23.
[5]豆兴堂,宋先忱,郭丹,等.影响辽宁绒山羊母羔胚胎体外生产因素的研究[J].中国草食动物,2011,31(6):21-24.
[6]豆兴堂,宋先忱,高月,等.辽宁绒山羊母羔体外胚胎生产技术研究[J].黑龙江动物繁殖,2016,24(5):9-13.
Procedure for in Vitro Embryo Production of Cashmere Goat
Dou Xingtang
(Institute ofAnimal Husbandry of Liaoning Province,Liaoyang 111000,China)
cashmere goat;doe;in vitro embryo;in vitro fertilization
S827.3
A
2095-3887(2017)01-0019-05
10.3969/j.issn.2095-3887.2017.01.006
2016-12-08
豆兴堂(1978-),男,高级畜牧师,硕士,主要从事绒山羊繁殖育种与胚胎工程技术研究工作。
Abstrace:This text has given an introduction about the procedures for in vitro embryo production of cashmere goat,including requirement of lab,doe superovulation,sperm treatment,oocyte collection,maturation culture,in vitro fertilization,in vitro embryo culture,embryo transfer and so on,also appended time plan,compounding of SOF culture solution,record list and so on.

