Wnt7b/β-catenin信号通路在大鼠哮喘气道重塑中的作用
朱婷婷,翁翠叶,贾宵宵,曾泽宇,王磊,李昌崇,张维溪
(温州医科大学附属第二医院育英儿童医院儿童呼吸内科,浙江温州 325027)
·论 著·
Wnt7b/β-catenin信号通路在大鼠哮喘气道重塑中的作用
朱婷婷,翁翠叶,贾宵宵,曾泽宇,王磊,李昌崇,张维溪
(温州医科大学附属第二医院育英儿童医院儿童呼吸内科,浙江温州 325027)
目的:探讨Wnt7b/β-catenin信号通路在哮喘气道重塑中的作用。方法:选取无特定病原体(SPF)级健康雄性SD大鼠16只,随机分成哮喘组和对照组。哮喘组大鼠用鸡卵清白蛋白(OVA)作为致敏物建立哮喘气道重塑模型,对照组大鼠采用0.9%氯化钠溶液进行处理。肺组织标本予HE染色,观察大鼠肺组织的病理结构,图像分析技术测定大鼠支气管管壁厚度(Wat)和支气管平滑肌厚度(Wam),免疫组织化学法检测肺组织中Wnt7b、β-catenin和c-Myc蛋白的分布和表达,实时荧光定量反转录多聚酶链反应法(qRT-PCR)测定Wnt7b、β-catenin、c-Myc mRNA的表达。结果:哮喘组大鼠Wat和Wam均高于对照组。免疫组织化学法检测显示,哮喘组大鼠肺组织Wnt7b、β-catenin和c-Myc蛋白的表达均高于对照组,差异有统计学意义(P<0.01)。qRT-PCR法检测结果显示,哮喘组大鼠肺组织Wnt7b、β-catenin、c-Myc mRNA的表达均高于对照组,差异有统计学意义(P<0.01)。肺组织中Wat、Wam与Wnt7b、β-catenin、c-Myc的蛋白表达量成正相关。结论:Wnt7b、β-catenin和c-Myc参与哮喘气道重塑的形成。
哮喘;气道重塑;Wnt信号通路;β-catenin;大鼠
支气管哮喘(简称哮喘),是以慢性气道炎症为特征的异质性疾病[1]。气道重塑是哮喘最主要的病理学变化之一,表现为气道平滑肌的肥大增生、气道上皮破坏、气道壁增厚、管腔缩窄、细胞外基质改变、黏膜下新血管形成、黏液腺体肥厚增生和炎症细胞浸润等[2]。研究显示,细胞内存在着复杂的信号转导途径,通过调节各种细胞的代谢、生长、增殖、凋亡等生命活动,调控炎症介质、细胞因子以及黏附因子等对机体的作用,参与哮喘气道重塑[3]。Wnt信号通路是一条在进化上呈高度保守的信号途径,广泛参与体内多种组织细胞的增殖、分化、凋亡等生命过程。本研究通过建立哮喘大鼠气道重塑模型,检测Wnt7b、β-catenin及其下游产物c-Myc的表达,探讨wnt7b/β-catenin信号通路在哮喘气道重塑中的作用。
1 材料和方法
1.1 材料
1.1.1 实验动物:无特定病原体(SPF)级雄性Sprague-Dawley(SD)大鼠16只,年龄为8周,体质量180~200g,购自上海斯莱克实验动物有限公司,许可证编号:SCXK(沪)2012-0002,饲养于温州医科大学实验动物中心SPF级实验室。
1.1.2 主要试剂:卵清白蛋白(OVA,GrageV)购自美国Sigma公司;兔抗大鼠Wnt7b多克隆抗体购自美国SantaCruz公司;兔抗大鼠β-catenin单克隆抗体购自美国CellSingnalTechnology公司;兔抗大鼠c-Myc单克隆抗体购自美国CellSingnalTechnology公司;Trizol试剂购自美国Invitrogen公司;Lightcycle480SYBRGreenIMaster购自美国Roch公司;反转录-聚合酶链反应试剂盒购自美国Fermentas公司;引物由上海生工生物工程有限公司合成。
1.1.3 主要仪器设备:空气压缩雾化器(德国百瑞公司);显微镜(日本Olympus公司);LightCycler480实时荧光定量PCR仪(美国Roch公司);酶标仪(ELX808IU,美国Bio-Tek公司)。
1.2 方法
1.2.1 动物分组与模型建立:将16只SD大鼠按随机数字表法随机分成哮喘组和对照组,每组各8只。参照课题组既往成功建立模型的方法[4]复制哮喘气道重塑模型。模型的建立过程分为致敏和激发2个阶段,共10周。致敏阶段共2周,分别在每周第1天给哮喘组大鼠腹腔注射OVA、Al(OH)3和0.9%氯化钠溶液混合液1.5mL(内含OVA1mg,Al(OH)3100mg),相应给予对照组大鼠腹腔注射0.9%氯化钠溶液1.5mL。从第3周第1天开始,隔天使用超声雾化器向处于密闭塑料箱内的哮喘组大鼠用含1%OVA的0.9%氯化钠溶液进行雾化,每次30min,共持续8周,对照组大鼠相应予0.9%氯化钠溶液进行雾化。在末次激发后16~24h内用10%水合氯醛(4mL/kg)腹腔注射处死大鼠,剪开胸腔,迅速分离肺组织,将左肺组织分装存于冻存管后置入液氮,转移至-80℃低温冰箱备用。
1.2.2 肺组织标本病理学观察:剪取右肺肺门中上、中下段肺叶,浸入4%多聚甲醛予以固定。将固定后的肺组织常规石蜡包埋,4μm切片,HE染色观察肺组织病理结构。
1.2.3 支气管壁厚度(Wat)和平滑肌厚度(Wam)的检测:根据文献对各层气道的定义[5],每只大鼠均选取3支直径为1~1.5mm的支气管,使用ImageproPlus医学图像分析软件测定2组大鼠肺组织内支气管总面积(At)、支气管管腔面积(Ac)、支气管基底膜周径(Pbm)、平滑肌内缘内气管面积(AMi)和平滑肌外缘内气管面积(AMe),并用Pbm标准化处理。即Wat=(At-Ac)/Pbm,Wam=(AMe-AMi)/Pbm。
1.2.4 免疫组织化学法检测肺组织Wnt7b、βcatenin及c-Myc蛋白的表达:Wnt7b多克隆抗体、β-catenin单克隆抗体及c-Myc单克隆抗体的稀释度均为1:50,经抗体孵育,辣根酶标记的链霉卵白素工作液处理,DAB显色,苏木素复染等处理,将PBS代替一抗作为阴性对照,最终阳性结果呈棕黄色。在高倍镜下,应用Image-proPlus图像分析软件随机测定所选区域阳性部位的平均吸光度(meanopticaldensity,MOD)值,计算10个MOD值的平均值作为该片的MOD值。
1.2.5 实时荧光定量PCR(qRT-PCR)法检测Wnt7b、β-catenin及c-MycmRNA的表达:按照试剂盒说明,以Trizol法提取大鼠肺组织总RNA,并测定RNA浓度及纯度(A260/A280>1.8)。根据浓度取2μg总RNA,按照反转录试剂盒操作说明将RNA反转录为cDNA。取cDNA产物2μL,分别加入2×SYBRGreenPCRMasterMix10μL,10mmol/L上下游引物各0.5μL,去离子水7μL,以20μL反应体系进行PCR扩增。每个样本设3个复孔。反应程序:95℃预变性90s,95℃退火5s,58℃延伸30s,共40个循环,获得各样本待测基因的Ct值。采用2-ΔΔCt法进行数据处理[6],计算实验组相对于对照组的基因表达倍数变化。
1.3 统计学处理方法实验数据经SPSS19.0统计软件进行分析。计量资料以±s表示;均数比较采用独立样本t检验;方差齐性检验采用Levene检验;两变量之间的相关性分析采用直线相关分析法。P<0.05为差异有统计学意义。
2 结果
2.1 动物一般情况观察相较对照组大鼠,哮喘组大鼠雾化激发后明显更为烦躁不安、易被激惹,出现抓耳挠腮、呼吸加深加快、腹肌痉挛、口唇发绀等症状,雾化结束后大鼠多呈俯伏不动的姿态,密封雾化箱内的大小便排泄物明显较对照组大鼠增多。对照组大鼠在用0.9%氯化钠溶液雾化的过程中仍活动自如,无明显异常表现。经过多次激发之后,哮喘组大鼠体质量相较对照组增长缓慢,毛色苍黄、无光泽。
2.2 肺组织病理学改变对照组大鼠肺组织HE染色显示正常小气道和肺泡结构,肺组织结构完整,黏膜上皮完整,支气管管腔规则,支气管、血管周围未见炎性细胞浸润(见图1A)。哮喘组大鼠肺组织HE染色显示气道壁明显增厚,基底膜不规则增厚,黏膜褶皱增多,出现上皮杯状细胞增生和上皮细胞脱落,可见黏液腺增生、黏液栓形成和黏膜下水肿,管腔内可见渗出物和炎性细胞增多,支气管黏膜下、支气管和血管周围可见嗜酸性粒细胞、中性粒细胞和淋巴细胞等炎症细胞的广泛浸润(见图1B)。
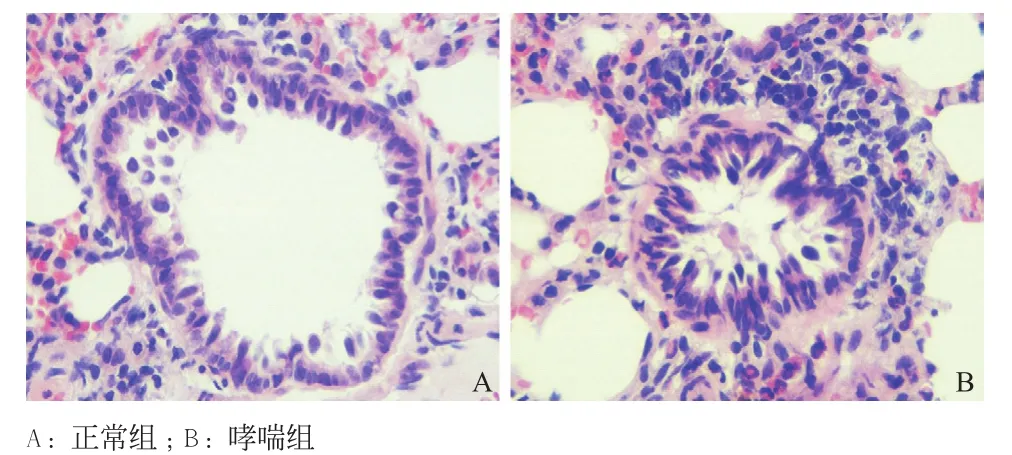
图1 大鼠肺组织HE染色结果(×400)

图2 大鼠肺组织Wnt7b表达情况(×400)
2.3 哮喘组和对照组Wat和Wam的变化与对照组相比,哮喘组Wat和wam显著增加,差异有统计学意义(均P<0.01),见表1。
表1 2组大鼠Wat及Wam比较(n=8,±s,μm2/μm)
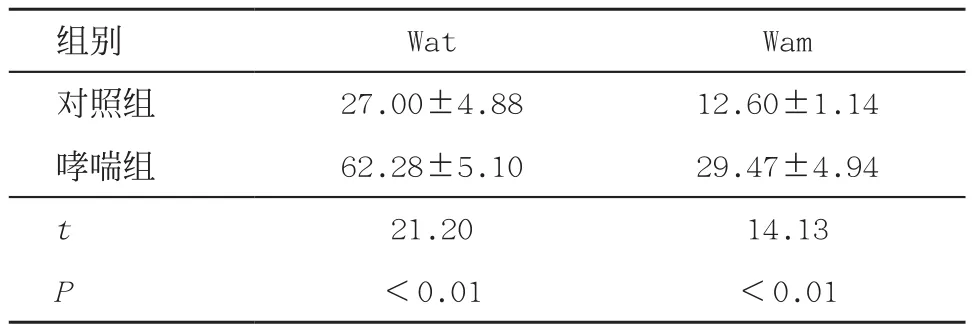
表1 2组大鼠Wat及Wam比较(n=8,±s,μm2/μm)
组别WatWam对照组27.00±4.8812.60±1.14哮喘组62.28±5.1029.47±4.94 t 21.2014.13 P<0.01<0.01
2.4 免疫组织化学法检测肺组织Wnt7b、β-catenin及c-Myc的表达情况结果显示,哮喘组大鼠肺组织中Wnt7b、β-catenin及c-Myc的蛋白表达均较对照组增加,差异有统计学意义(P<0.01),见表2,图2-4。
表2 2组大鼠肺组织Wnt7b、β-catenin和c-Myc蛋白表达比较(n=8,±s)
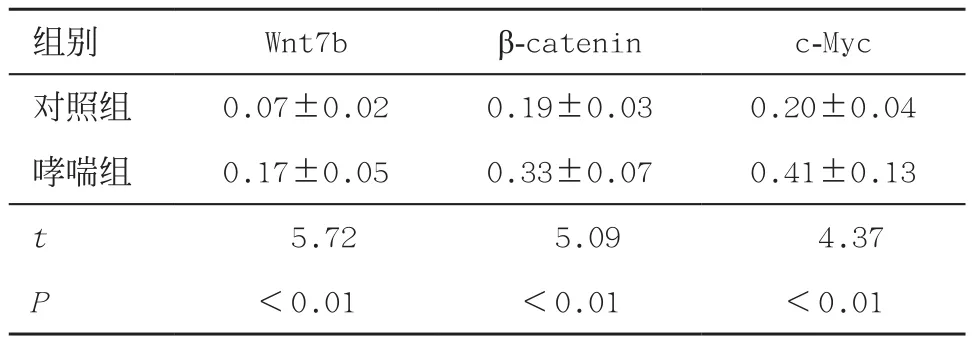
表2 2组大鼠肺组织Wnt7b、β-catenin和c-Myc蛋白表达比较(n=8,±s)
组别Wnt7bβ-cateninc-Myc对照组0.07±0.020.19±0.030.20±0.04哮喘组0.17±0.050.33±0.070.41±0.13 t 5.725.094.37 P<0.01<0.01<0.01
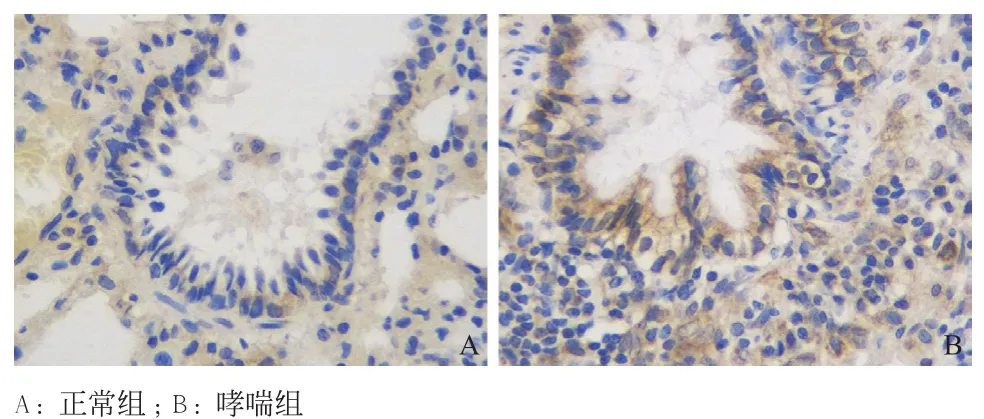
图3 大鼠肺组织β-catenin表达情况(×400)

图4 大鼠肺组织c-Myc表达情况(×400)
2.5 实时荧光定量PCR法检测肺组织Wnt7b、βcatenin及c-Myc mRNA表达情况结果显示,哮喘组大鼠肺组织中Wnt7b、β-catenin、c-MycmRNA的表达均较对照组增加,差异有统计学意义(P<0.01),见表3。
2.6 Wnt7b、β-catenin、c-Myc表达与Wat、Wam的相关性分析Wat、Wam均与Wnt7b蛋白的表达呈显著正相关(分别为r=0.811、0.847,均P<0.01),Wat、Wam均与大鼠肺组织β-catenin蛋白的表达呈显著正相关(分别为r=0.821、0.854,均P<0.01),Wat、Wam均与大鼠肺组织c-Myc蛋白的表达呈显著正相关(分别为r=0.787、0.853,均P<0.01)。大鼠肺组织中Wnt7b蛋白、β-catenin蛋白的表达与c-Myc蛋白的表达呈显著正相关(r=0.856、0.808,均P<0.01)。
表3 实时荧光定量PCR检测结果(n=8,±s)

表3 实时荧光定量PCR检测结果(n=8,±s)
Wnt7bmRNAβ-cateninmRNAc-MycmRNA△Ct2-△△Ct△Ct2-△△Ct△Ct2-△△Ct对照组13.28±0.441.00(0.74-1.36)11.67±0.331.00(0.80-1.26)8.10±0.151.00(0.90-1.10)哮喘组9.96±0.5010.03(7.11-14.18)10.70±0.091.95(1.84-2.06)6.81±0.252.44(2.05-2.91)t-14.249-7.602-12.470 P<0.01<0.01<0.01组别
3 讨论
Wnt信号通路普遍存在于从低等无脊椎动物至高等哺乳动物体内,是信号转导的重要通路之一,广泛参与组织细胞的增殖、分化、凋亡等多种生命过程。自1982年Wnt基因被发现以来,Wnt信号通路已得到广泛的研究。目前认为,Wnt信号通路主要通过Wnt蛋白、蛋白受体、胞内蛋白、核内转录因子等途径传递信号,激活下游靶基因的表达,参与调控过程。至今已发现19种Wnt信号蛋白家族成员,包括Wnt1、Wnt3、Wnt5a、Wnt7b、Wnt8等。Wnt信号通路包括经典型Wnt/β-catenin信号通路和非经典型信号通路。其中,Wnt7b是经典型信号途径的重要组成成员,通过与卷曲蛋白(frizzled,Frz)跨膜受体结合进行信号传递[7]。Wnt7b主要在肺上皮细胞中表达,在肺的发育和维持血管平滑肌的完整中起了重要作用[8]。研究[9-10]显示,Wnt7b能通过调节肺间叶细胞的分化过程调控肺部平滑肌细胞的发育,其表达失衡与多种肺部疾病,如支气管肺发育不良、肺动脉高压、肺纤维化等密切相关,而与哮喘及气道重塑的关系尚不明确。
β-catenin的作用主要是与钙黏附蛋白相结合固定在细胞骨架上,作为膜结合蛋白介导细胞之间的黏附[11],而胞质及细胞核内的β-catenin则是Wnt信号通路中最关键的激活因子。当信号通路被激活时,胞质内β-catenin的含量不断提高,开始转移入核,与T细胞因子(Tcellfactor,TCF)/淋巴样增强因子(lymphoidenhancerfactor,LEF)相结合,参与调控下游基因的表达[12]。近来研究表明,β-catenin在细胞的生长、增殖以及稳态的维持中具有重要作用。ZHU等[13]发现,β-catenin参与气道上皮细胞的损伤和修复过程。GIANGRECO等[14]研究显示,β-catenin的激活能促进肺上皮基底细胞的增殖。此外有研究[15-17]指出,β-catenin参与气道平滑肌细胞(airwaysmoathmusclecells,ASMC)的有丝分裂过程,其在胞内聚集和核内转移对维持ASMC的生长具有重要作用,并参与调控ASMC分泌细胞外基质的过程。另有研究[18]发现,β-catenin能调控气道平滑肌的张力变化,调控气道平滑肌的收缩功能。考虑到上述细胞以及生理现象在气道重塑中扮演重要角色,β-catenin的激活可能是产生气道重塑的一个关键机制。
Wnt信号通路靶基因丰富多样,1998年,HE等[19]研究发现,β-catenin与TCF4结合形成的复合体能与c-Myc基因启动子上的TCF位点相互作用从而激活其表达,首次证实c-Myc为Wnt信号通路的靶基因之一。原癌基因广泛参与信号通路的各个环节,其表达能促进细胞因子和炎症介质的表达和释放,广泛参与细胞的增殖、分化、凋亡等过程。有研究[20]显示,原癌基因的表达与气道炎症和气道重塑密切相关。
目前,国外学者主要通过培养ASMC来研究Wnt信号通路在哮喘气道重塑中的作用,而动物实验研究相对较少。本研究用过OVA致敏建立大鼠哮喘气道重塑模型,通过免疫组织化学法和Westernblot法检测Wnt7b、β-catenin、c-Myc在肺组织和肺组织匀浆中的表达,结果显示:哮喘组中Wnt7b、βcatenin、c-Myc的蛋白表达水平均较正常组显著升高,提示哮喘气道重塑大鼠存在Wnt7b/β-catenin信号通路的激活。此外,Wat、Wam均与Wnt7b、β-cantenin、c-Myc的表达均呈显著正相关,提示Wnt7b/β-cantenin信号通路参与气道重塑的形成。c-Myc的表达与Wnt7b、β-catenin均呈正相关,提示Wnt7b/β-catenin信号通路的激活可能增加c-Myc的表达,参与气道重塑。
Wnt信号通路在哮喘发生的作用研究尚处于起步阶段,下一步,我们将进行体外细胞培养,进一步通过抑制实验探究Wnt信号通路与气道重塑形成的关系。
[1] 中华医学会儿科学分会呼吸学组, 中华儿科杂志编辑委员会. 儿童支气管哮喘诊断与预防指南(2016年版)[J]. 中华儿科杂志, 2016, 54(3): 167-181.
[2] HOMER R J, ELIAS J A. Consequences of long-term infammation∶ Airway remodeling[J]. Clin Chest Med, 2000, 21(2)∶ 331-343.
[3] ZHANG W X, LI C C. Airway remodeling∶ a potential therapeutic target in asthma[J]. World J Pediatr, 2011, 7(2)∶ 124-128.
[4] ZHANG W X, LIANG Y F, WANG X M, et al. Urotensin upregulates transforming growth factor-β1 expression of asthma airway through ERK-dependent pathway[J]. Mol Cell Biochem, 2012, 364(1-2)∶ 291-298.
[5] BAI A, EIDELMAN D H, HOGG J C, et al. Proposed nomenclature for quantifying subdivision s of the bronchial wall[J]. J Appl Physio, 1994, 77(2)∶ 1011-1014.
[6] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△CTmethod[J]. Methods, 2001, 25(4)∶ 402-408.
[7] ZHENG Y, ZHANG K, ZHU P. Reviews and prospectives of signaling pathway analysis in idiopathic pulmonary fbrosis[J]. Autommun Rev, 2014, 13(10)∶ 1020-1025.
[8] SHU W, JIANG Y Q, LU M M, et al. Wnt7b regulates mesenchymal proliferation and vascular development in the lung [J]. Development, 2002, 129(20)∶ 4831-4842.
[9] COHEN E D, IHIDA-STANSBURY K, LU M M, et al. Wnt signaling regulates smooth muscle precursor development in the mouse lung via a tenascin C/PDGFR pathway[J]. J Clin Invest, 2009, 119(9)∶ 2538-2549.
[10] RAJAGOPAL J, CARROLL T J, GUSEH J S, et al. Wnt7b stimulates embryonic lung growth by coordinately increasing the replication of epithelium and mesenchyme[J]. Development, 2008, 135(9)∶ 1625-1634.
[11] VALENTA T, HAUSMANN G, BASLER K. The many faces and functions of beta-catenin[J]. EMBO J, 2012, 31(12)∶2714-2736.
[12] BAARSMA H A, KONIGSHOFF M, GOSENS R. The WNT signaling pathway from ligand secretion to gene transcripton∶ molecular mechanis ms and pharmacological targets[J]. Pharmacol Ther, 2013, 138(1)∶ 66-83.
[13] ZHU M, TIAN D, LI J, et al. Glycogen synthase kinase 3beta and beta-catenin are involved in the injury and repair of bronchial epithelial cellsinduced by scratching[J]. Exp Mol Pathol, 2007, 83(1)∶ 30-38.
[14] GIANGRECO A, LU L, VICKERS C, et al. β-Catenin determines upper airway progenitor cell fate and preinvasive squamous lung cancer progression bymodulating epithelialmesenchymal transition[J]. J Pathol, 2012, 226(4)∶ 575-587.
[15] GOSENS R, BAARSMA H A, HEIJINK I H, et al. De novo synthesis of β-catenin via H-Ras and MEK regulates airway smooth muscle growth[J]. FASEB J, 2010, 24(3)∶ 757-768.
[16] NUNES R O, SCHMIDT M, DUECK G, et al. GSK-3/βcatenin signaling axis in airway smooth muscle∶ role in mitogenic signaling[J]. Am J Physiol Lung Cell Mol Physiol, 2008, 294(6)∶ L1110-L1118.
[17] BAARSMA H A, MENZEN M H, HALAYKO A J, et al. β-Catenin signaling is required for TGF-β1-induced extracellular matrix production by airway smooth muscle cells[J]. Am J Physiol Lung Cell Mol Physiol, 2011, 301(6)∶ L956-L965.
[18] JANSEN S R, VAN ZIEL A M, BAARSMA H A, et al. {beta}-Catenin regulates airway smooth muscle contraction[J]. Am J Physiol Lung Cell Mol Physiol, 2010, 299(2)∶ L204-L214.
[19] HE T C, SPARKS A B, RAGO C, et al. Identifcation of c-MYC as target of the APC pathway[J]. Science, 1998, 281 (5382)∶ 1509-1512.
[20] 刘颖格, 戚好文, 李焕章. 原癌基因表达在哮喘气道重塑中的作用[J]. 第四军医大学学报, 2001, 22(5): 418-421.
(本文编辑:丁敏娇)
The role of Wnt7b/β-catenin signal pathway in the course of airway remodeling of asthma rats
ZHU Tingting, WENG Cuiye, JIA Xiaoxiao, ZENG Zeyu, WANG Lei, LI Changchong, ZHANG Weixi. Department of Pediatric Pulmonology, the Second Affiliated Hospital & Yuying Children’s Hospital of Wenzhou Medical University, Wenzhou, 325027
Objective:To explore the role of Wnt7b/β-catenin signaling pathway in airway remodeling in asthma.Methods:This study enrolled 16 8-week-old healthy male Sprague-Dawley (SD) rats (SPF grade), weighting from 180-200 g, without specifc pathogens, and assigned them into asthma group and normal control group. Asthmatic airway remodeling models were established in rats with ovalbumin while the normal control group was given spray of physiological saline. HE staining was used to observe pulmonary pathological structure of two groups of rats, and color medical image analysis was used to determine the thickness of bronchial wall (Wat) and the thickness of smooth muscles (Wam). Immunohistochemical method was used to detect the distribution and protein expression of Wnt7b, β-catenin and c-Myc in the lung tissues, qRT-PCR was used to determine the mRNA expressions of Wnt7b, β-catenin and c-Myc.Results:Wat and Wam of asthma group were signifcant higher than those in normal group. The protein expression of Wnt7b, β-catenin, c-Myc detected by IHC in asthma group were signifcant higher than those in normal group (P<0.01, respectively). The mRNA expression of Wnt7b, β-catenin, c-Myc detected by qRT-PCR in asthma group were signifcant higher than those in normal group (P<0.01, respectively). There were signifcantly positive correlation between Wat and the protein expression of Wnt7b, β-catenin and c-Myc, also between Wam and the protein expression of Wnt7b, β-catenin and c-Myc.Conclusion:Wnt7b, β-catenin and c-Myc play important roles in airway remodeling in asthma.
asthma; airway remodeling; Wnt signal pathway; β-catenin; rats
R562.2
A
10.3969/j.issn.2095-9400.2017.01.003
2016-03-31
浙江省自然科学基金资助项目(LY15H010006);温州市科技计划项目(Y20130234);浙江省科技厅科研基金资助项目(2016C33182);浙江省卫生高层次创新人才项目。
朱婷婷(1990-),女,浙江乐清人,住院医师,硕士。
张维溪,副教授,副主任医师,硕士生导师,Email:zhangweixi112@163.com。

