表柔比星联合环磷酰胺对乳腺癌MDA-MB-231细胞成瘤性及caveolin-1表达的影响
李金海,陈辉春,张海峰,翟华伟,林碎芳,戴华卫
(温州医科大学附属第三医院普通外科,浙江温州 325200)
·论 著·
表柔比星联合环磷酰胺对乳腺癌MDA-MB-231细胞成瘤性及caveolin-1表达的影响
李金海,陈辉春,张海峰,翟华伟,林碎芳,戴华卫
(温州医科大学附属第三医院普通外科,浙江温州 325200)
目的:探讨表柔比星联合环磷酰胺对MDA-MB-231细胞成瘤性及其对肿瘤中细胞质膜微囊蛋白-1(caveolin-1)表达的影响。方法:以乳腺癌MDA-MB-231细胞建立裸鼠移植瘤模型,实验分为表柔比星组、环磷酰胺组、表柔比星+环磷酰胺组(联合用药组)和对照组(注射等体积0.9%氯化钠溶液),采用免疫组织化学法检测移植瘤中caveolin-1表达,以图像信号采集与分析系统进行图像扫描分析。结果:表柔比星组、环磷酰胺组和联合用药组的抑瘤率分别为31.28%、33.42%和66.14%。免疫组织化学法显示给药组肿瘤组织中caveolin-1表达明显增强,caveolin-1在联合用药组(253.22±38.52)肿瘤组织中表达较对照组(31.73±2.28)和表柔比星组(157.52±32.69)、环磷酰胺组(148.23±41.66)明显增强,图像灰度值统计分析显示差异有统计学意义(P<0.05)。结论:表柔比星和环磷酰胺可抑制乳腺癌肿瘤细胞生长,二者联用抑瘤作用增强,肿瘤生长体积与caveolin-1的表达呈反向性,提示二者之间可能在抑瘤机制上存在相关性。
表柔比星;环磷酰胺;乳腺肿瘤;MDA-MB-231细胞;细胞质膜微囊蛋白
化疗已被证实是控制乳腺癌进展的有效治疗方案,尽管乳腺癌术后化疗方案在不断改进,但乳腺癌仍系女性恶性肿瘤之首,不断明确药物的作用机制,并改善恶性肿瘤的治疗策略已成为当今研究的重点[1]。细胞质膜微囊蛋白-1(caveolin-1)是细胞质膜微囊的功能蛋白,参与多种细胞内外物质的转运、细胞的内吞以及细胞信号通路的调节,其缺失与乳腺癌的发生及分化、浸润、转移过程密切相关[2]。本研究通过观察临床常用乳腺癌化疗药物对乳腺癌移植瘤中caveolin-1表达的影响,来探讨caveolin-1在乳腺癌中的作用及化疗机制。
1 材料和方法
1.1 实验细胞与动物人乳腺癌MDA-MB-231细胞株购自上海中科院细胞库,置于含有10%胎牛血清、100U/mL青霉素和100μg/mL链霉素的L-15培养液中培养,培养环境为37℃、5%CO2。BALBC裸鼠48只,雌性,体质量26~28g,购自南京君科生物工程有限公司。
1.2 药品与试剂L-15培养液与0.25%胰蛋白酶为美国Gibco公司产品;兔抗人caveolin-1蛋白多克隆抗体为美国SantaCruz公司产品,稀释度为1:500。免疫组织化学SP试剂盒与DAB显示剂购自日本TaKaRa公司。表柔比星、环磷酰胺均购自山东新时代药业有限公司。
1.3 建立裸鼠移植瘤模型
1.3.1 实验分组:48只裸鼠随机分为对照组(注射等体积0.9%氯化钠溶液)、表柔比星组、环磷酰胺组、表柔比星+环磷酰胺组(联合用药组),每组12只。
1.3.2 模型建立:人乳腺癌MDA-MB-231细胞株用L-15培养液置于37℃含5%CO2的培养箱内培养,细胞对数生长后,用胰酶消化,收集细胞后配制成4×106个细胞/mL的单细胞悬液,一次性注射器吸取细胞悬液0.2mL对健康雌性裸鼠右侧腋窝处进行皮下注射来构建乳腺癌模型(4×106个细胞/只)。隔日测量1次肿瘤大小,计算肿瘤体积(V),V=ab2/2(a为长度,b为宽度),以每组裸鼠移植瘤体积的平均值绘制移植瘤生长曲线。
1.3.3 药物干预:裸鼠乳腺癌模型建成后10d,大部分局部形成瘤体(肿瘤直径>5mm)。第10天分组进行腹腔注射药物。参照徐叔云主编的《药理实验方法学》[3]及药物使用说明书,予表柔比星组腹腔注射表柔比星(10mg/kg),环磷酰胺组腹腔注射环磷酰胺(30mg/kg),联合用药组腹腔注射表柔比星(10mg/kg)、环磷酰胺(30mg/kg),对照组腹腔注射与联合用药组等体积的0.9%氯化钠溶液。隔日给药1次,给药至第28天,共10次。
1.3.4 取材与固定:末次给药后第2天将裸鼠处死,切除瘤体,称体质量,甲醛固定切片。
1.4 免疫组织化学检测按照免疫组织化学试剂盒说明书步骤操作,将石蜡切片予二甲苯脱蜡,酒精脱水,用PBS冲洗3次,每次5min,3%H2O2孵育15min阻断内源性过氧化物酶;PBS再次洗涤3次后,滴加非免疫性动物血清,37℃孵育15min,弃去非免疫动物血清;滴加一抗,4℃过夜;PBS洗涤3次后再滴加二抗,37℃孵育10min;PBS洗涤3次后滴加链霉素抗生物素蛋白-过氧化酶复合物,37℃孵育15min,PBS洗涤3次后,用新鲜配制DAB显色,苏木精复染,梯度酒精脱水,二甲苯透明,中性树胶封片。利用病理图像分析系统进行灰度扫描定量分析。
1.5 统计学处理方法应用SPSS17.0统计学软件进行数据分析。计量资料采用±s表示,多样本均数比较采用完全随机设计的单因素方差分析,组间比较用Student-Newman-Kewls法。P<0.05为差异有统计学意义。
2 结果
2.1 裸鼠生长及成瘤情况整个实验过程中各组裸鼠生长状况良好,无其他异常发病。各组瘤体生长情况分别为:对照组成瘤12例,表柔比星组11例,环磷酰胺组10例,联合用药组11例。第10天各组间瘤体平均体积差异无统计学意义(P>0.05)。见表1。
表1 各组第10天平均瘤体体积比较(±s)
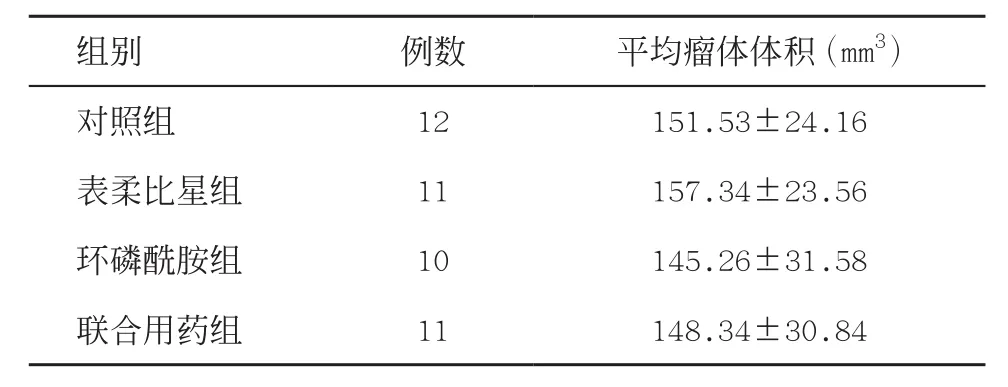
表1 各组第10天平均瘤体体积比较(±s)
组别例数平均瘤体体积(mm3)对照组12151.53±24.16表柔比星组11157.34±23.56环磷酰胺组10145.26±31.58联合用药组11148.34±30.84
2.2 化疗药物对人乳腺癌MDA-MB-231细胞成瘤性的影响
2.2.1 移植瘤生长曲线:从乳腺癌MDA-MB-231细胞接种后第10天起,隔日测量1次肿瘤大小,绘制移植瘤生长曲线。用药后肿瘤生长速度减缓明显,其中联合用药后肿瘤生长速度减缓最为显著。见图1。

图1 各组移植瘤生长情况
2.2.2抑瘤率:腹腔注射药物隔日给药10次,末次给药后的第2天处死裸鼠,瘤体称重(g),按如下公式计算抑瘤率:抑瘤率(%)=(1-治疗组平均肿瘤重量/对照组平均肿瘤重量)×100%。其中表柔比星+环磷酰胺组抑瘤率最高(P<0.05)。见表2。
表2 各组抑瘤率的比较(±s)

表2 各组抑瘤率的比较(±s)
与对照组比:aP<0.05;与表柔比星组、环磷酰胺组比:bP<0.05
组别例数瘤体平均质量(g)抑瘤率(%)对照组121.21±0.320.00表柔比星组110.73±0.1831.28a环磷酰胺组100.68±0.2333.42a联合用药组110.37±0.0866.14ab
2.3 表柔比星及环磷酰胺对caveolin-1表达的影响根据免疫组织化学检测结果,caveolin-1的表达于各组裸鼠乳腺癌移植瘤组织细胞中,呈现为棕黄色颗粒样着色。caveolin-1主要表现为胞质表达,此外,细胞核、细胞膜及细胞外基质中也有表达,见图2。图像灰度值统计分析显示,与对照组比较,表柔比星、环磷酰胺和联合用药组caveolin-1表达明显增强,差异均有统计学意义(均P<0.05),见表3。
表3 各组移植瘤中caveolin-1表达的比较(±s)
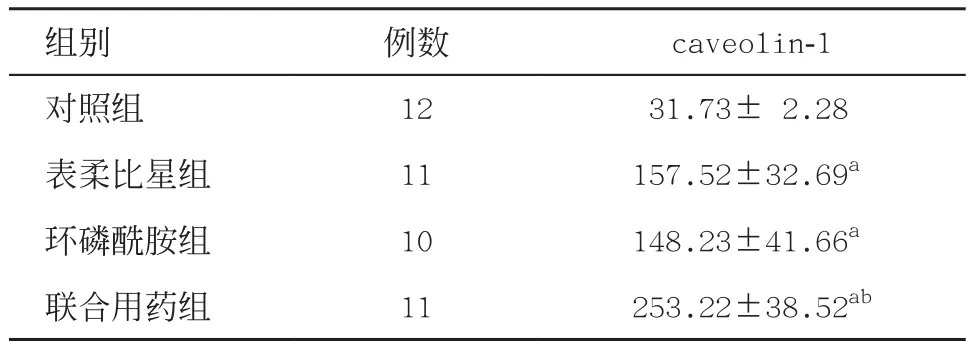
表3 各组移植瘤中caveolin-1表达的比较(±s)
与对照组比:aP<0.05;与表柔比星组、环磷酰胺组比:bP<0.05
组别例数caveolin-1对照组1231.73±2.28表柔比星组11157.52±32.69a环磷酰胺组10148.23±41.66a联合用药组11253.22±38.52ab

图2 各组移植瘤组织中caveolin-1的表达(SP,×200)
3 讨论
caveolins是细胞质膜中发夹样结构域的主要结构成分,不仅参与细胞损伤的修复反应,而且可调控细胞周期,并可通过参与调解肌动蛋白的活动,参与肿瘤细胞的分裂生殖、侵袭转移等过程[4]。caveolins作为信号转导通路中的支架蛋白,能与多种信号分子如G蛋白α亚基、酪氨酸激酶受体等相互作用。目前已发现的caveolins成员共3种,分别系caveolin-1、caveolin-2和caveolin-3,它们在不同组织中发挥各自作用[5]。已知caveolin-1与乳房上皮细胞增生的发病机制有关。研究[6]证实,caveolin-1在人类癌细胞中或经癌基因转化的细胞中表达下降,在宫颈癌、胰腺癌、肉瘤等多种恶性肿瘤组织中caveolin-1蛋白低表达。相关研究[7]证实,caveolin-1的缺失与乳腺癌细胞的分裂增殖、侵袭转移过程密切相关,caveolin-1的检测有望作为临床判断乳腺癌患者预后及转移潜能的重要指标应用于临床,并通过分析乳腺癌的发展及淋巴转移情况,为患者提供靶向治疗方案。
表柔比星联合环磷酰胺(EC方案)作为乳腺癌术后经典化疗方案之一已成熟应用于临床。表柔比星可直接嵌入DNA碱基对之间,干扰癌细胞转录,阻止mRNA的形成,并通过对拓朴异构酶I I的抑制发挥对肿瘤细胞的抑制作用[8];环磷酰胺为常见的烷化剂类抗肿瘤药,在体内微粒体功能氧化酶作用下转化为醛磷酰胺,进入肿瘤细胞内进而分解成酰胺氮芥及丙烯醛,其中酰胺氮芥对肿瘤细胞具有细胞毒性作用,从而发挥抗癌作用[9]。本研究中,表柔比星及环磷酰胺均可显著抑制人乳腺癌裸鼠移植瘤的生长,抑瘤率分别为31.28%和33.42%,单独用药抑瘤率差异无统计学意义。联合用药组结果显示,其对人乳腺癌裸鼠移植瘤的生长抑制作用明显加强,抑瘤率为66.14%(P<0.05)。
本研究结果显示,在表柔比星与环磷酰胺作用下,乳腺癌肿瘤细胞增殖能力明显减弱,二者联合给药后效果更为显著。caveolin-1在表柔比星和环磷酰胺单独用药组中表达显著增强,二者联合用药caveolin-1表达增强更为明显。通过对不同用药组的抑瘤率和肿瘤组织中caveolin-1的表达变化情况进行分析,可推断肿瘤的生长体积与caveolin-1表达具有异向性,提示肿瘤的生长与caveolin-1表达的降低密切相关。
[1] 徐正阳, 袁祖国, 周涛琪, 等. 长春瑞滨联合卡培他滨治疗晚期乳腺癌疗效观察[J]. 温州医科大学学报, 2014, 44(16): 441-444.
[2] RIWALDT S, BAUER J, PIETSCH J, et al. The importance of caveolin-1 as key-regulator of three-dimensional growth in thyroid cancer cells cultured under real and simulated microgravity conditions[J]. Int J Mol Sci, 2015, 16 (12)∶ 28296-28310.
[3] 徐叔云, 卞如濂, 陈修. 药理实验方法学[M]. 北京: 人民卫生出版社, 2002: 152-155.
[4] STRIPPOLI R, LOURRIRO J, MORENO V, et al. Caveolin-1 deficiency induces a MEK-ERK1/2-Snail-1-dependent epithelial-mesenchymal transition and fibrosis during peritoneal dialysis[J]. EMBO Mol Med, 2014, 7(1)∶ 102-123.
[5] LIM J S, NGUYEN K C, HAN J M, et al. Direct regulation of TLR5 expression by caveolin-1[J]. Mol Cells, 2015, 38 (12)∶ 1111-1117.
[6] RODRIGUEZ-WALKER M, VILCAES A A, GARBARINO-PICO E, et al. Role of plasma-membrane-bound sialidase NEU3 in clathrin-mediated endocytosis[J]. Biochem J, 2015, 470 (1)∶ 131-144.
[7] 徐炜, 顾栋桦, 平金良, 等. 细胞质膜微囊蛋白caveolin-1表达与乳腺癌侵袭转移的相关性[J]. 中华普通外科杂志, 2010, 25(12): 1015-1016.
[8] SUGAYA A, HYODO I, KOGA Y, et al. Utility of epirubicinincorporating micelle tagged with anti-tissue factor antibody clone with no anticoagulant effect[J]. Cancer Sci, 2016, 107 (3)∶ 335-340.
[9] RIOMNDO A, BRAMANTI S, CROCCHIOLO R, et al. Bone marrow donor-related variables associated with harvest outcome in HLA-haploidentical transplantation with postinfusion cyclophosphamide[J]. Vox Sang, 2016, 111(1)∶ 93-100.
(本文编辑:吴昔昔)
Effects of epirubicin combined with cyclophosphamide on tumor formation and caveolin-1 expression in MDA-MB-231 breast cancer cells
LI Jinhai, CHEN Huichun, ZHANG Haifeng, ZHAI Huawei, LIN Suifang,
DAI Huawei. Department of General Surgery, the Third Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325200
Objective:To investigate the effects of epirubicin combined with cyclophosphamide on tumor formation and the expression of caveolin-1 in MDA-MB-231 breast cancer cells.Methods:Human breast cancer xenografts in nude mice were established by using MDA-MB-231 cells. Epirubicin group, cyclophosphamide group, and epirubicin+cyclophosphamide group, and saline control group were set up. By using immunohistochemistry the expression of caveolin-1 was detected in xenografts. Image signal acquisition and analysis system was applied for image scanning analysis.Results:The rate of tumor suppressor in epirubicin group, cyclophosphamide group and epirubicin+cyclophosphamide group was 31.28%, 33.42% and 66.14% respectively. Immunohistochemistry demonstrated that the caveolin-1 expression in epirubicin+cyclophosphamide group (253.22±38.52) was signifcantly increased compared with saline control group (31.73±2.28), epirubicin group (157.52±32.69) and cyclophosphamide group (148.23±41.66) (P<0.05).Conclusion:Epirubicin and cyclophosphamide can inhibit the growth of MDA-MB-231 cells with a synergic effect. The caveolin-1 expression is increased signifcantly in epirubicin+cyclophosphamide group, indicating caveolin-1 protein may play an important role in tumor cells growth.
epirubicin; cyclophosphamide; breast neoplasms; MDA-MB-231; caveolins
R735.35
A
10.3969/j.issn.2095-9400.2017.01.007
2016-07-09
温州市科技计划项目(Y20160420)。
李金海(1983-),男,山东枣庄人,主治医师,硕士。

