热熔挤出法联合静电纺丝法制备新型抗炎缓释系统
王连嵩, 殷莉莉, 刘 冬, 郑玉强, 何 伟*
(1.辽宁何氏医学院 药学院,辽宁 沈阳 110163;2.中国中医科学院 眼科医院,北京 110040)
·快递论文·
热熔挤出法联合静电纺丝法制备新型抗炎缓释系统
王连嵩1,2, 殷莉莉1, 刘 冬1, 郑玉强1, 何 伟1*
(1.辽宁何氏医学院 药学院,辽宁 沈阳 110163;2.中国中医科学院 眼科医院,北京 110040)
报道了一种制备具有“核-壳”结构和双重释放过程的可降解抗炎缓释系统(3)的新方法。以聚(乙交酯-丙交酯)(PLGA50)为药物载体,先通过热熔挤出法将绿原酸(CA)与PLGA50共挤出得挤出物(1);利用静电纺丝法在1表面包裹一层“PLGA50+CA”静电纺丝膜(2),制得具备“核-壳”结构的材料(3)。采用SEM, TGA, DSC和LC-MS研究了CA的热稳定性,1的热力学性能,3的微观形态和体外药物释放行为。结果表明:3具有“核-壳”结构;引入CA,降低了PLGA50的玻璃化转变温度;3的药物释放为双重释放过程。
聚(乙交酯-丙交酯); 绿原酸; 热熔挤出法; 静电纺丝法; 核-壳结构; 制备; 双重释放
有效的眼内药物浓度是眼病治疗的关键。然而,由于“血-眼”屏障的存在,口服、局部滴眼、球周注射等传统给药方式往往不能满足临床需要。近年来,研究人员围绕眼内缓释给药系统进行了大量研究,并取得了较大进展。如脂质体[1]、纳米微球[2]、植入体[3]等。目前对眼内植入缓释体系的研究重点在于生物相容性和缓释方法,对药物使用前期需要较大药物浓度以控制炎症反应的问题研究较少。
本文报道了一种制备具有“核-壳”结构和双重释放过程的可降解抗炎缓释系统(3)的新方法。以聚(乙交酯-丙交酯)(PLGA50)为药物载体,先通过热熔挤出法将绿原酸[4-6](CA)与PLGA50共挤出得挤出物(1);利用静电纺丝法在1表面包裹一层“PLGA50+CA”静电纺丝膜(2),制得具备“核-壳”结构的(3)。采用SEM, TGA, DSC和HPLC研究了CA的热稳定性,1的热力学性能,3的微观形态和体外药物释放行为。
3的优点在于:以CA为抗炎药物,副作用较小,以聚(乙交酯-丙交酯)(PLGA50)为药物载体,安全性高,2中药物释放速度较快[7-9],1中药物释放速度较慢[10]。植入3后,可在短时间内先实现部分药物的快速释放过程,有效控制炎症,然后实现药物的缓慢持续释放,达到药物“双重释放”的目的。
1 实验部分
1.1 仪器与试剂
FEI Inspect型扫描电子显微镜;METTLER TOLEDO International Inc型热重分析仪(高纯氮气氛围,升温速度:10 ℃·min-1,升温范围:25~300 ℃);TA-Instruments-Waters Q20型差式扫描量热仪;SJZS-7AY型微型双锥双螺杆挤出机(螺杆直径7 mm);UltiMate 3000型高效液相色谱[Hypersil ODS色谱柱(4.6 mm×250 mm, 5 μm),流动相:V(甲醇) ∶V(水) ∶V(冰醋酸)=15 ∶85 ∶1,流速:1.0 mL·min-1,检测波长327 nm,柱温30 ℃];静电纺丝机,自制。
CA,分析纯,上海阿拉丁生化科技股份有限公司;PLGA50,济南岱罡生物科技有限公司,η=0.7(一点法),DPI=2.25(GPC),LA/GA=50.1/49.9(1HNMR);冰醋酸,分析纯,国药集团化学试剂有限公司;PBS缓冲溶液,优耐德引发剂上海有限公司;甲醇,色谱纯,国药集团化学试剂有限公司;其余所用试剂均为分析纯。
1.2 制备
(1) 1的制备
在粉碎机中加入PLGA50 9.0g,粉碎5min;于40 ℃真空干燥100h。将CA粉末1.0g与PLGA50预混,在氮气吹扫(通气速度30mL·min-1)下,利用双螺杆挤出机,于180 ℃, 12r·min-1挤出得1(d=0.5 mm)。
(2) 3的制备
在反应瓶中加入混合溶剂[V(丙酮)∶V(氯仿)=1∶2]100 mL, CA 0.5 g和PLGA50 4.5 g,搅拌使其溶解得混合溶液。快速转动1,利用静电纺丝机,将混合溶液电纺到1表面得3(转速180 r·mL-1,电压40 kV,喷嘴距接收板15 cm),3表面为电纺膜2。
1.3 性能测试
(1) 1的热力学性能
氮气保护下,将1 5 mg置于DSC样品盘中,先以10 ℃·min-1从室温升温至180 ℃,然后以降温至-20 ℃;最后升温至180 ℃。
(2) 3的微观形态
将3置于液氮中冷冻30 min后脆断,3表面和脆断面真空镀金,利用扫描电镜观察其微观结构,加速电压为25 kV。
(3) 体外药物释放行为
在3只离心管中加入7.8 mg·mL-1PBS缓冲溶液(pH 6.86)10 mL和3 0.50 g,在振荡培养箱中于37 ℃每隔50 min取样0.50 mL,取液后补充相同体积的PBS缓冲溶液,用HPLC测试药物深度并计算药物释放量。
2 结果与讨论
2.1 表征
(1) SEM
图1为3的SEM图片。由图1(A)可见,3表面包覆了一层2, 2主要由PLGA50纤维(d<10 μm)组成。由于在电纺过程中,1始终处于高速旋转状态,故2在平行于1断面方向有一定取向。由图1(B)~(D)可以看出3具有明显的“核-壳”结构特点。
(2) TGA和DSC
图2为CA的TGA(A)和DSC(B)曲线。由图2(A)可见,CA在50~90 ℃有一个明显的失重过程,此部分失重为CA的游离水挥发造成。100~120 ℃未出现明显失重,说明CA中无结晶水。温度超过207.7 ℃,CA出现急剧失重,这个失重过程为CA的热分解过程。此外,由图2(B)可见,CA在热分解之前,其DSC曲线出现了一个尖锐的吸热峰,此吸热峰为CA的熔融峰。综上可知:CA的热分解起始温度为207.7 ℃; CA的熔融温度为203 ℃。即CA的分解过程伴随着熔融。
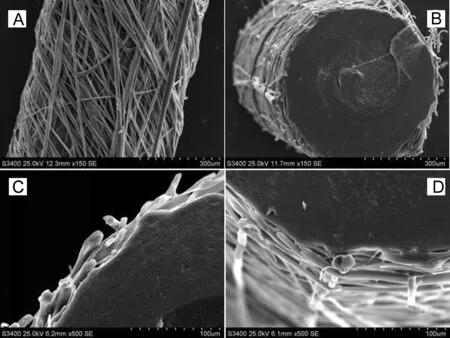
图1 3的SEM图片[(A)为表面形貌;(B)为脆断面 形貌;(C)和(D)为局部放大图]Figure 1 SEM images of 3[(A)surface morphology; (B)brittle fracture morphology; (C) and (D) partial enlarged detail]
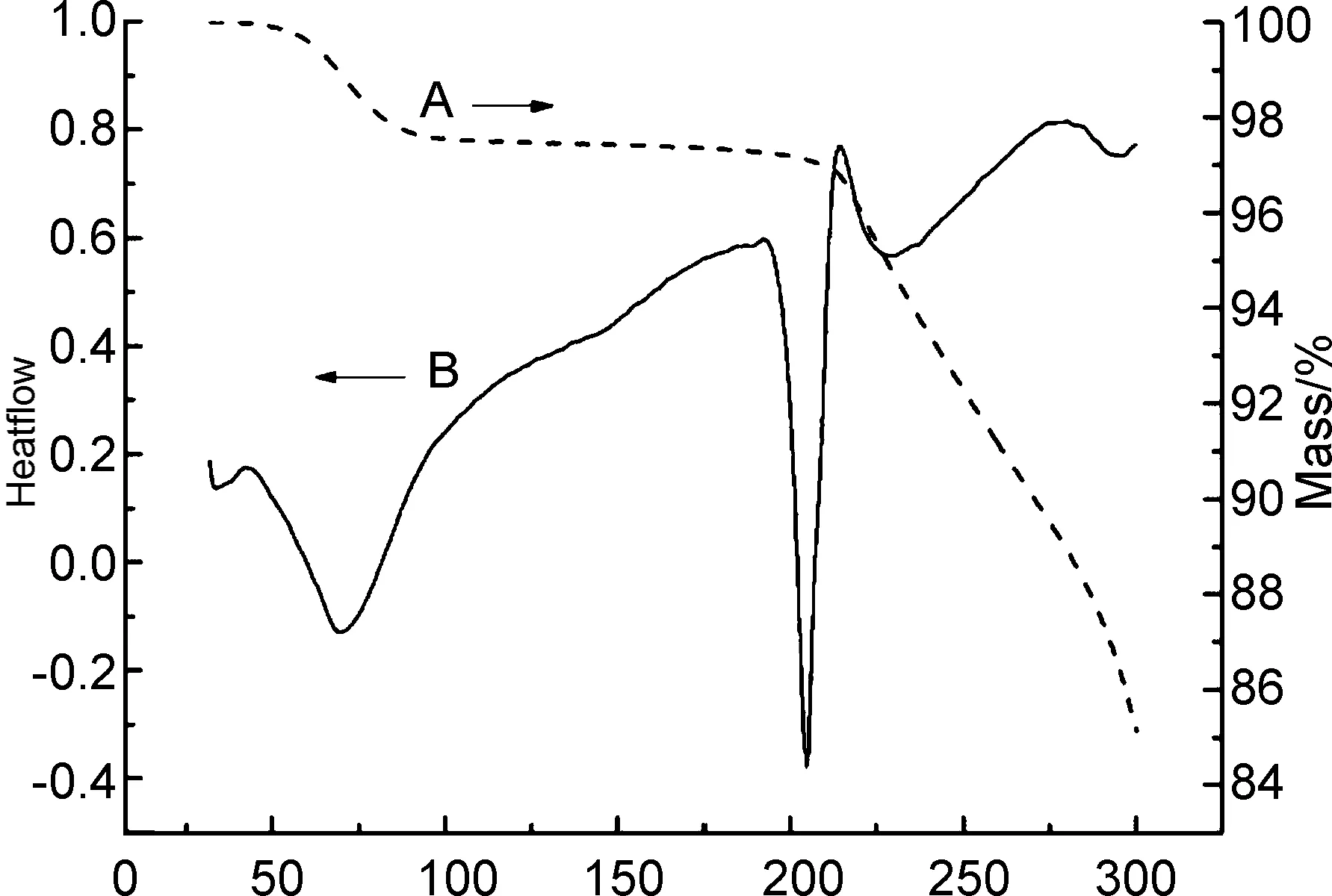
Temperature/℃图2 CA的TGA(A)和DSC(B)曲线Figure 2 TGA(A) and DSC(B) curves of CA
图3为基体PLGA50和1的DSC曲线。由图3可见,PLGA50的Tg为56 ℃,其玻璃化转变过程中有一个明显的吸热峰(可能为热焓松弛所致)。由图3还可见,1因热焓松弛导致的吸热峰明显减弱,Tg降低至49.5 ℃。由此可见,引入CA,对PLGA50的热力学性能有一定影响。其可能原因在于:热熔挤出加工过程中,由于加工温度未达到CA熔点,CA在双螺杆剪切作用下被分散为极细的结晶颗粒,均匀分散于基体PLGA50中。由于CA晶料的粒径较小,在基体中分散性较好,对于PLGA50分子链段的运动可以起到“润滑剂”的作用,促进了链段运动,从而降低了玻璃化温度。
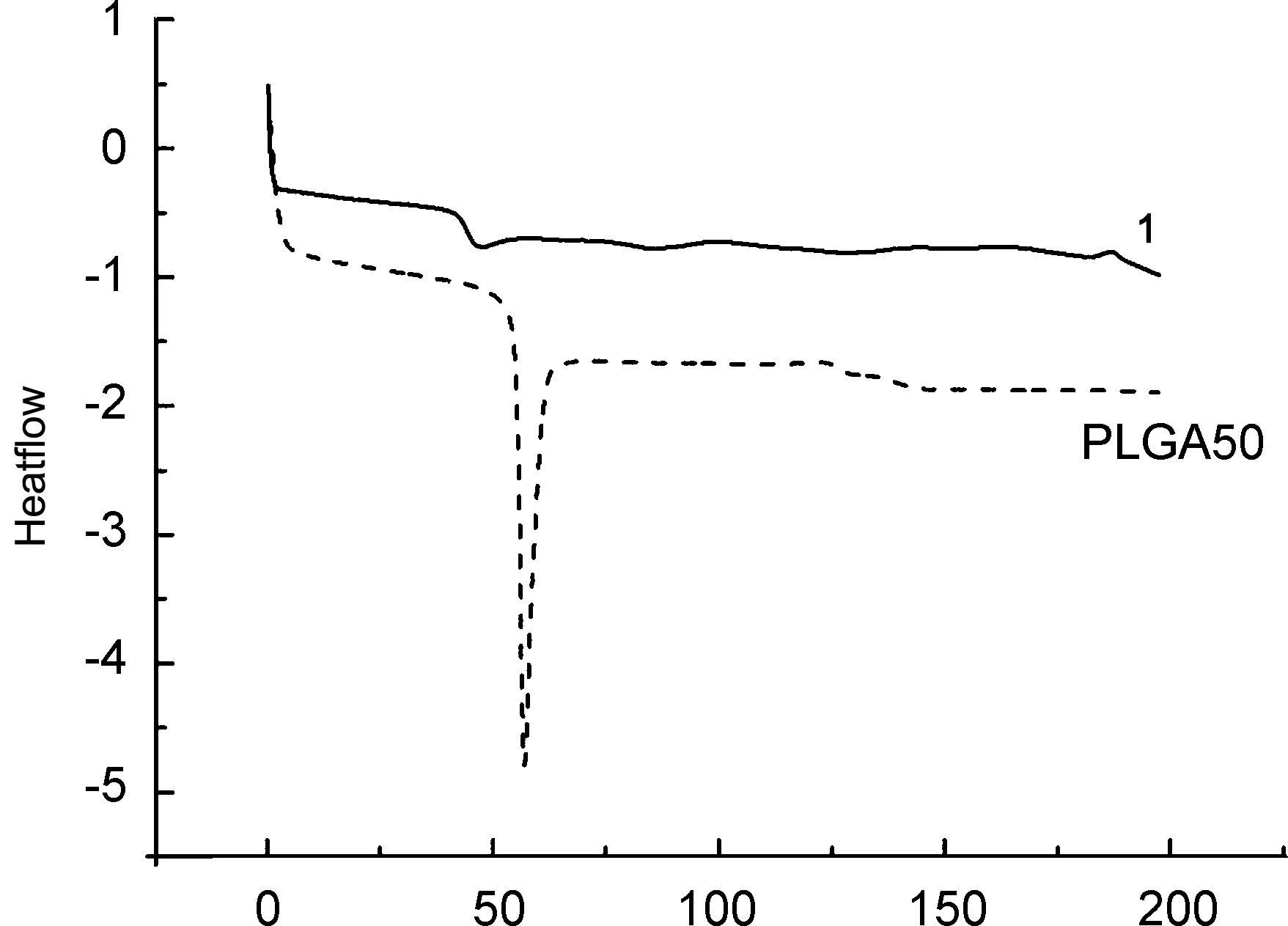
Temperature/℃图3 PLGA50和1的DSC曲线Figure 3 DSC curves of PLGA50 and 1
2.2 体外释放行为
图4为1和3的药物体外释放行为曲线。
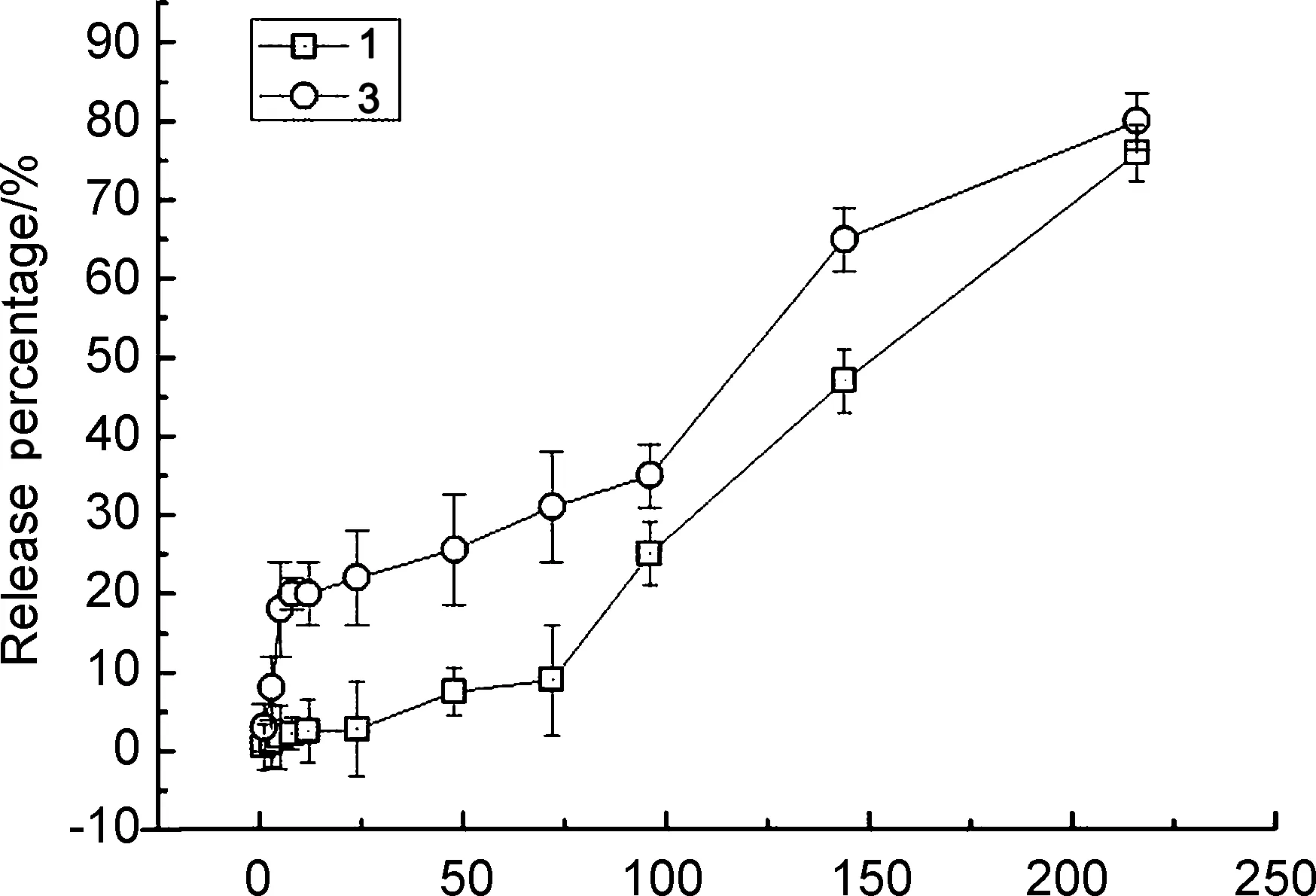
Time/h图4 1和3的药物释放行为曲线Figure 4 Releasing behavior curves of 1和3
由图4可见,1的初期药物释放速度很慢,72 h后累积释放量仍<10%。 3的初期药物释放速度较快(2中的药物在5 h内基本释放完全),随后“核”部分的CA再继续缓慢释放。这种具有“核-壳”结构的缓释体系,一方面可以在植入初期达到一定冲击浓度,另一方面可以实现持续释放。
[1] Chen H, Pan H, Li P,etal. The potential use of novel chitosan-coated deformable liposomes in an ocular drug delivery system[J].Colloid Surface B,2016,143:455-462.
[2] Alexander P, Mireia M, Beatriz C,etal. Design and elaboration of freeze-dried PLGA nanoparticles for the transcorneal permeation of carprofen:Ocular anti-inflammatory applications[J].Colloid Surface B,2015,136:935-943.
[3] Bratton M L, He Y G, Weakley D R. Dexamethasone intravitreal implant(Ozurdex) for the treatment of pediatric uveitis[J].J AAPOS,2014,18(2):110-113.
[4] Jin X H, Ohgami K, Shiratori K,etal. Effects of blue honeysuckle(Lonicera caerulea L) extract on lipopolysaccharide-induced inflammationinvitroandinvivoresearch[J].Exp Eye Res,2006,82(5):860-867.
[5] Santos M D D, Almeida M C, Lopes N P,etal. Evaluation of the anti-inflammatory,analgesic and antipyretic activities of the natural polyphenol chlorogenic acid[J].Biol Pharm Bull, 2006,29(11):2236-2240.
[6] Lee K H, Whang K S, Rhee K H. Effects of lonicera japonica thunb on dextran sulfate sodium-induced experimental colitis in mice[J].J Med Plants Res,2011,5(22):5437-5443.
[7] Nista S V G, D’ávila M A, Martinez E F,etal. Nanostructured membranes based on cellulose acetate obtained by electrospinning. Part II. Controlled release profile and microbiological behavior[J].J Appl Polym Sci,2013,130(4):2772-2779.
[8] Suganya S, Ram T S, Lakshmi B S,etal. Herbal drug incorporated antibacterial nanofibrous mat fabricated by electrospinning:An excellent matrix for wound dressings[J].J Appl Polym Sci,2011,121(5):2893-2899.
[9] Yang Y, Li X H, Cui W G,etal. Structural stability and release profiles of proteins from core-shell poly (DL-lactide) ultrafine fibers prepared by emulsion electrospinning[J].J Biomed Mater Res A, 2008,86A(2):374-385.
[10] Vynckier A K, Dierickx L, Voorspoels J,etal. Hot-melt co-extrusion:Requirements,challenges and opportunities for pharmaceutical applications[J].J Pharm Pharmacol,2013,66(2):167-179.
Preparation of A Novel Degradable Anti-inflammatory Sustain Release System By Combination of Hot Melt Extrusion and Electrospining Method
WANG Lian-song1,2, YIN Li-li1, LIU Dong1, ZHENG Yu-qiang1, HE Wei1*
(1. School of Pharmacy, He University, Shenyang 110163, China;2. Eye Hospital, China Academy of Chinese Medical Sciences, Beijing 110040, China)
A novel method of preparing degradable anti-inflammatory sustain release system with “core-shell” structure and double drug sustain release system(3) was reported. Extrude(1) was prepared by hot melt extrusion method, using PLGA50 and chlorogenic acid(CA) as the co-extrude. 3 was obtained by warping a “PLGA50+CA”layer(2) on the surface of 1viaelectrospining method. Thermostability of CA, thermoproperties of 1, microscopic morphology andinvitrodrug release behavior of 3 were investigated by SEM, TGA, DSC and LC-MS. The results indicated that 3 obtains “core-shell” structure. The Tgof PLGA50 decreased for the introduction of CA. Theinvitrodrug release process of 3 was a double-release process.
PLGA50; chlorogenic acid; hot melt extrusion method; electrospining method; core-shell structure; preparation; double-release
2016-07-08
辽宁省科学技术计划项目“热熔挤出法制备新型眼内植入缓释系统关键技术开发”(2013226064)
王连嵩(1982-),男,满族,辽宁抚顺人,博士,副教授,主要从事眼科生物材料的研究。
何伟,博士,教授, E-mail: hewei0111@163.com
O63; R944.9
A
10.15952/j.cnki.cjsc.1005-1511.2017.02.16175

