模拟干旱环境下伐桩注水对毛竹生理特性的影响
张 磊,谢锦忠*,张 玮,丁中文,冀琳珂,陈 胜
(1.中国林业科学研究院亚热带林业研究所,浙江 杭州 311400; 2.浙江省杭州市富阳区农业和林业局,浙江 杭州 311400)
模拟干旱环境下伐桩注水对毛竹生理特性的影响
张 磊1,谢锦忠1*,张 玮1,丁中文2,冀琳珂1,陈 胜1
(1.中国林业科学研究院亚热带林业研究所,浙江 杭州 311400; 2.浙江省杭州市富阳区农业和林业局,浙江 杭州 311400)
[目的]探究模拟干旱环境下注水伐桩对1、2和3年生毛竹生理特性的影响,为气候变化背景下毛竹的适应性经营管理及毛竹林节水灌溉措施的制定提供理论参考。[方法]在毛竹林中选取面积相同(10 m×20 m)的样地9块,以1、2和3年生毛竹为试验材料,采用覆盖薄膜模拟干旱环境,对各样地四周进行挖沟切鞭处理,以阻断周边土壤水分的运输,试验设置CK(0个伐桩注水)、T1(12个伐桩注水)和T2(18个伐桩注水)3个灌水量处理,每个处理均进行3次重复,研究不同数量注水伐桩下3个年龄毛竹的生理响应。[结果]试验表明,在模拟干旱环境下,随着注水伐桩数量的减少,3个年龄毛竹的净光合速率与蒸腾速率显著下降,1、2和3年生毛竹的净光合速率与蒸腾速率最大降幅分别达到74.35%和73.08%、59.14%和36.62%及60.47%和61.54%;毛竹叶片叶绿素a、叶绿素b和类胡萝卜素含量显著下降,1年生和3年生毛竹叶片叶绿素a、叶绿素b和类胡萝卜含量差异均达到显著水平(P<0.05),2年生毛竹叶片叶绿素a含量差异显著(P<0.05),但叶绿素b和类胡萝卜素含量差异不显著(P<0.05),3个年龄毛竹叶片叶绿素a/b差异均不显著(P<0.05);毛竹叶片丙二醛(MDA)含量及超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)活性显著上升,且均达到差异显著水平(P<0.05)。同时发现3个年龄毛竹的净光合速率、蒸腾速率和叶片光合色素含量与注水伐桩数量正相关,而叶片MDA含量及SOD、CAT和POD活性与注水伐桩数量负相关。[结论]模拟干旱环境下,增加注水伐桩可以使1、2和3年生毛竹光合蒸腾能力提高,光合产物积累增加,叶片光合色素含量升高,叶片MDA含量及SOD、CAT和POD活性降低。
毛竹;模拟干旱环境;光合蒸腾速率;叶绿素含量;保护酶
随着全球气候的变化,全球范围内已经出现了频繁性干旱。干旱是自然界中最为常见的逆境胁迫因素,其制约着植物的生长与发育,因此,植物对干旱胁迫的适应机制一直以来都是植物逆境适应策略研究中的一个热点问题[1]。光合作用是植物生长最重要的生理过程,对干旱胁迫特别敏感,受到干旱胁迫后,多数植物如苹果(MalusdomesticaBorkh.)[2]、葡萄(VitisviniferaL.)[3]和小青杨(Populuspseudo-simoniiKitag.)[4]等光合速率均会显著下降,严重的干旱胁迫甚至会导致植物叶绿体结构的破坏。保护酶系统是植物抗旱机制中非常重要的组成部分,关于植物在干旱胁迫下保护酶系统变化的研究相当多[5-6],保护酶能够避免或减轻由于干旱逆境导致的活性氧积累对植物细胞膜造成的氧化伤害,从而保证其它生理过程的正常进行[7-9],并且协同其它抗旱机制使得植物得以生存。目前,人类生存所需的资源、环境与林业可持续发展的矛盾已经日益突显,加强对植物干旱生理学方面的基础研究,深入了解干旱胁迫对植物的伤害机理和植物细胞对干旱胁迫的响应,开发优良的抗旱种质资源,具有重要的意义[10]。
毛竹(Phyllostachysedulis(Carr.) H. de Lehaie)又名楠竹,属禾本科(Gramineae)竹亚科(Bambusoideae)刚竹属(PhyllostachysSieb. et Zucc.)植物。它具有繁殖能力强、生长快、产量高、用途广和可持续经营等优点[11],是中国栽培历史最悠久、面积最广、经济价值也最高的竹种。目前有关毛竹的研究多集中在毛竹的克隆及其逆境胁迫响应表达分析[12]、毛竹林碳储量与碳汇[13]、毛竹叶片光合生理[14-15]以及毛竹林土壤有机碳[16]等方面,关于毛竹抗旱生理方面的研究主要以盆栽毛竹幼苗[17]为研究对象,对于大田中毛竹抗旱生理方面的研究较少。毛竹主要分布在南方的山地,灌溉条件非常有限,干旱天气频繁的发生,将对毛竹的稳产高产造成不利的影响。本文主要通过增加不同数量注水伐桩的方法,试图对不同年龄毛竹的光合作用、叶片光合色素及其组成、抗氧化保护酶系统及膜脂过氧化程度的变化进行分析研究,探讨模拟干旱环境下增加不同数量注水伐桩对不同年龄毛竹生长可能产生的影响,旨在为气候变化背景下毛竹的适应性经营管理及毛竹林节水灌溉措施的制定提供理论参考。
1 材料与方法
1.1 试验材料

1.2 试验设计

1.3 测定指标及方法
1.3.1 光合指标测定 使用便携式光合仪(Li-Cor 6400,美国Li-Cor 公司)对1、2和3年生标准竹叶片的净光合速率(Pn)与蒸腾速率(Tr)进行活体测定,光强设为900 μmol·m-2·s-1,并保持二氧化碳摩尔分数为400 μmol·mol-1。试验在天气晴朗的早上9:00-11:00进行,每块样地选取标准竹3株,分别在各标准竹上部、中部和下部各选取3个叶片进行测定。由于毛竹的叶片不能充满叶室,试验结束后摘下所测叶片,用拍照法计算所测部分叶面积[18],随后对每个叶片毛竹的光合测定值进行调整。
1.3.2 生理指标测定 酶液的提取:采用混合取样法取1、2和3年生标准竹新鲜成熟叶片0.2 g于预冷的研钵中,加入5 mL预冷的50 mmol·L-1磷酸缓冲液(pH=7.8)冰浴研磨,然后用磷酸缓冲液定容至10 mL。并于4℃下10 500 r·min-1离心15 min,取上清液(粗酶液)于4℃下保存。
叶绿素(Chl)和类胡萝卜素(Car)采用丙酮与乙醇混合液(1∶1)提取后用紫外可见分光光度计(UV-1 800 PC,上海美普达仪器有限公司)测定;丙二醛(MDA)含量用硫代巴比妥酸法测定。超氧化物歧化酶(SOD)活性用氮蓝四唑(NBT)光化还原法测定,以每单位时间内抑制NBT光化还原50%为1个酶活性单位U。过氧化氢酶(CAT)用紫外吸收法测定,以每分钟OD240减少0.01为1个酶活性单位U。过氧化物酶(POD)用愈创木酚氧化法测定,以每分钟OD470升高0.01为1个酶活性单位U[19]。
1.4 数据处理
试验数据用Excel 2003软件进行统计和制作图表,用SPSS 19.0软件进行One-Way ANOVA方差分析和LSD多重比较,设定P<0.05为显著性水平。本试验所有数据都采用均值±标准差表示。
2 结果与分析
2.1 模拟干旱环境下不同注水伐桩处理毛竹光合与蒸腾作用差异
由表1可知,在模拟干旱环境下,伐桩注水能显著提高毛竹的光合与蒸腾能力,并且随着注水伐桩数量的增加,各年龄毛竹的净光合速率(Pn)与蒸腾速率(Tr)均呈上升趋势,即T2>T1>CK。不同处理下1、2和3年生毛竹净光合速率与蒸腾速对干旱胁迫的响应存在差异,1年生毛竹在T1和T2处理下的净光合速率差异不显著,但均与CK处理下毛竹的净光合速率差异显著,T1和T2处理下毛竹的净光合速率分别比CK提高了63.91%和74.35%;2年生毛竹净光合速率在3种处理之间差异达到显著水平,T1和T2处理下毛竹的净光合速率相对于CK处理分别增加了36.86%和59.14%;3年生毛竹在CK和T1处理下其净光合速率差异不显著,但均与T2处理下毛竹的净光合速率差异显著,T1和T2处理下毛竹的净光合速率分别比CK处理提高了15.50%和60.47%,其中以1年生毛竹的净光合速率在增加注水伐桩后增幅最大,可见增加注水伐桩可以更加有效地提高1年生毛竹的净光合速率。各年龄毛竹蒸腾速率在CK和T1处理下差异均未达到显著水平,但都与T2处理下毛竹的蒸腾速率差异达到显著水平。其中1、2和3年生毛竹的蒸腾速率与CK处理相比最大增幅分别达到了73.08%、36.62%和61.54%,增加注水伐桩对1年生毛竹蒸腾速率的影响最大,3年生毛竹次之,2年生毛竹最小。
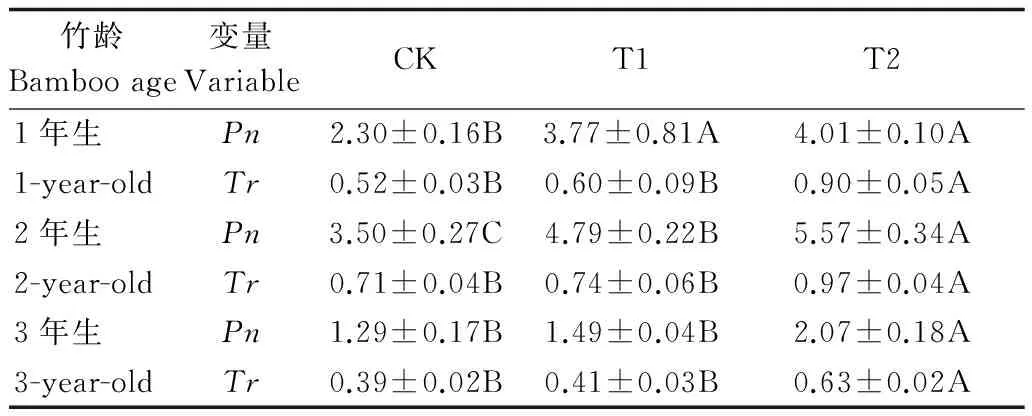
表1 模拟干旱环境下不同注水伐桩处理毛竹 光合与蒸腾作用Table 1 Photosynthesis and transpiration of moso bamboo with different number of water storage in stumps under simulated drought environment
注:不同大写字母表示同一年龄毛竹在不同处理下某个生理指标差异显著(P<0.05),下同。Pn单位为μmol· m-2·s-1,Tr单位为mmol·m-2·s-1。
Note: Different capital letters represent the physiological index of the same age of moso bamboo under different treatments had a significant difference (P<0.05), the same below. The unit ofPnis μmol· m-2·s-1, the unit ofTris mmol·m-2·s-1.
2.2 模拟干旱环境下不同注水伐桩处理毛竹叶片光合色素含量差异
由表2可知,不同处理之间1、2和3年生毛竹叶片光合色素含量均存在差异,且均表现为随着注水伐桩数量的增加,叶绿素a(Chl a)、叶绿素b(Chl b)以及类胡萝卜素(Car)含量均随之升高,即3个年龄毛竹叶片光合色素含量均表现为T2>T1>CK。模拟干旱环境下,不同处理间1年生毛竹叶片Chl a和Chl b含量均表现为CK和T1处理差异不显著,但均与T2处理差异显著,Car含量表现为T1和T2处理差异不显著,均与CK处理差异显著;2年生毛竹在CK和T2处理下叶片的Chl a含量差异显著,但均与T1处理差异不显著,不同处理之间2年生毛竹叶片的Chl b和Car含量均未达到差异显著水平;3年生毛竹叶片的Chl a含量在3种处理间差异达到显著水平,CK和T1处理下叶片Chl b含量差异不显著,均与T2处理下叶片的Chl b含量差异显著,而CK和T2处理下毛竹叶片Car含量差异显著,均与T1处理下毛竹叶片Car含量差异不显著。CK、T1和T2处理下1、2和3年生毛竹Chl a/b差异均未达到显著水平。其中1、2和3年生毛竹叶片Chl a、Chl b以及Car含量的最大增幅分别达到了17.05%、17.39%和23.64%,7.77%、9.68%和10.91%,26.02%、26.32%和12.50%,3个年龄毛竹叶片Chl a和Chl b含量增加幅度均表现为3年生>1年生>2年生,而叶片Car含量增幅则表现为1年生>3年生>2年生。

表2 模拟干旱环境下不同注水伐桩处理毛竹叶片 光合色素含量和叶绿素a/bTable 2 Contents of chlorophyll, carotenoid and Chl a/b in leaves of moso bamboo with different number of water storage in stumps under simulated drought environment
注:Chl a:叶绿素a Chlorophyll a;Chl b:叶绿素b Chlorophyll b;Car:类胡萝卜素 Carotenoid。Chl a、Chl b、Car单位为mg·g-1。
Note: Chl a: Chlorophyll a; Chl b: Chlorophyll b; Car: Carotenoid.The Unit of Chl a, Chl b and Car are mg·g-1.
2.3 模拟干旱环境下不同注水伐桩处理毛竹叶片MDA含量差异
通常植物器官受到干旱胁迫时往往会发生膜脂过氧化,丙二醛(MDA)是膜脂过氧化最终的分解产物,它的积累会对植物生长造成一定的伤害,因此其含量可以反映出植物遭受干旱伤害的程度[20]。由图1可以看出,1、2和3年生毛竹在各处理之间的变化趋势相同,都表现为叶片MDA含量与注水伐桩数量负相关。1年生毛竹叶片MDA含量,在3个处理间达到差异显著水平,并且T1和T2处理毛竹叶片MDA含量分别比CK处理下降了24.76%和39.03%;2年生和3年生毛竹叶片MDA含量均表现为T1和T2处理差异不显著,但都与CK处理差异显著,2年生和3年生毛竹叶片MDA含量在T1和T2处理下与CK处理相比降幅分别达到15.62%和26.97%,15.84%和25.50%。T1和T2处理下均以1年生毛竹叶片MDA含量下降幅度最大,说明增加注水伐桩对1年生毛竹的影响作用更大。

图1 模拟干旱环境下不同注水伐桩处理毛竹叶片MDA含量Fig.1 MDA content in leaves of moso bamboo with different number of water storage in stumps under simulated drought environment
2.4 模拟干旱环境下不同注水伐桩处理毛竹叶片SOD、CAT和POD活性差异
2.4.1 SOD活性差异分析 超氧化物歧化酶(SOD)是一种活性氧自由基清除剂,同时也是重要的活性氧清除酶,它能催化生物体内分子氧活化的第一个中间产物O2-发生歧化反应,生成O2和H2O,从而能够及时有效地清除自由基,保护细胞免受活性氧胁迫的伤害[21]。从图2可以看出,各年龄毛竹均表现为随着注水伐桩数量的增加,其叶片SOD活性都呈下降趋势,但不同年龄毛竹的变化幅度不同。3个年龄毛竹在不同处理之间叶片SOD活性差异均达到显著水平,T1和T2处理下1、2和3年生毛竹叶片SOD活性分别比CK处理下降12.83%和32.77%,18.17%和30.72%以及16.06%和31.28%。T1处理下,以2年生毛竹叶片SOD活性下降幅度最大,3年生毛竹次之,1年生毛竹叶片SOD活性下降最少,T2处理下3个年龄毛竹叶片SOD活性下降幅度基本相同,这些现象说明了增加注水伐桩对2年生毛竹叶片的SOD活性影响最大,1年生毛竹影响最小,并且随着注水伐桩数量的增加1、2和3年生毛竹叶片SOD活性下降幅度之间的差距在逐渐缩小。
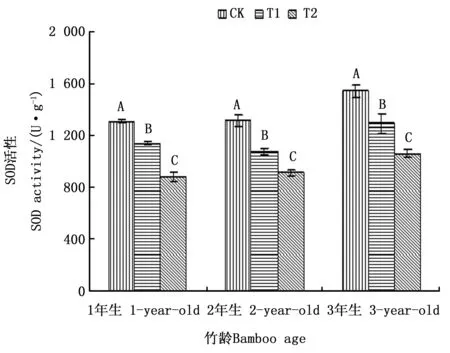
图2 模拟干旱环境下不同注水伐桩处理毛竹叶片SOD活性Fig.2 Activities of SOD in leaves of moso bamboo with different number of water storage in stumps under simulated drought environment
2.4.2 CAT活性差异分析 过氧化氢酶(CAT)是植物体内一种重要的保护酶,它能够清除植物细胞内过多的H2O2,使其维持在一个较低的水平,从而避免植物膜结构受到损伤[8]。由图3可以看出,1、2和3年生毛竹叶片CAT活性在不同处理之间的变化趋势基本相同,其均在CK处理下毛竹叶片CAT活性最大,T2处理下CAT活性最低。3个年龄毛竹叶片CAT活性对不同注水伐桩处理的生理响应又存在一定的差异,1年生毛竹叶片CAT活性在T1和T2处理下分别比CK处理下降4.23%和18.27%,CK和T1差异不显著,但均与T2差异显著;2年生毛竹叶片CAT活性在3种处理之间差异达到显著水平,T1和T2处理与CK处理相比降幅分别达到18.36%和33.89%;T1和T2处理下3年生毛竹叶片CAT活性分别比CK处理下降23.66%和32.09%,并且叶片CAT活性T1和T2处理差异不显著,均与CK处理差异显著。其中T1处理下,以3年生毛竹叶片CAT活性下降幅度最大,而在T2处理下,2年生和3年生毛竹叶片CAT活性下降幅度较大,从整个下降幅度来看,增加注水伐桩,对2年生和3年生毛竹叶片CAT活性的影响作用更大,随着注水伐桩数量的增加,其对3个年龄毛竹叶片CAT活性的影响程度也在发生变化。
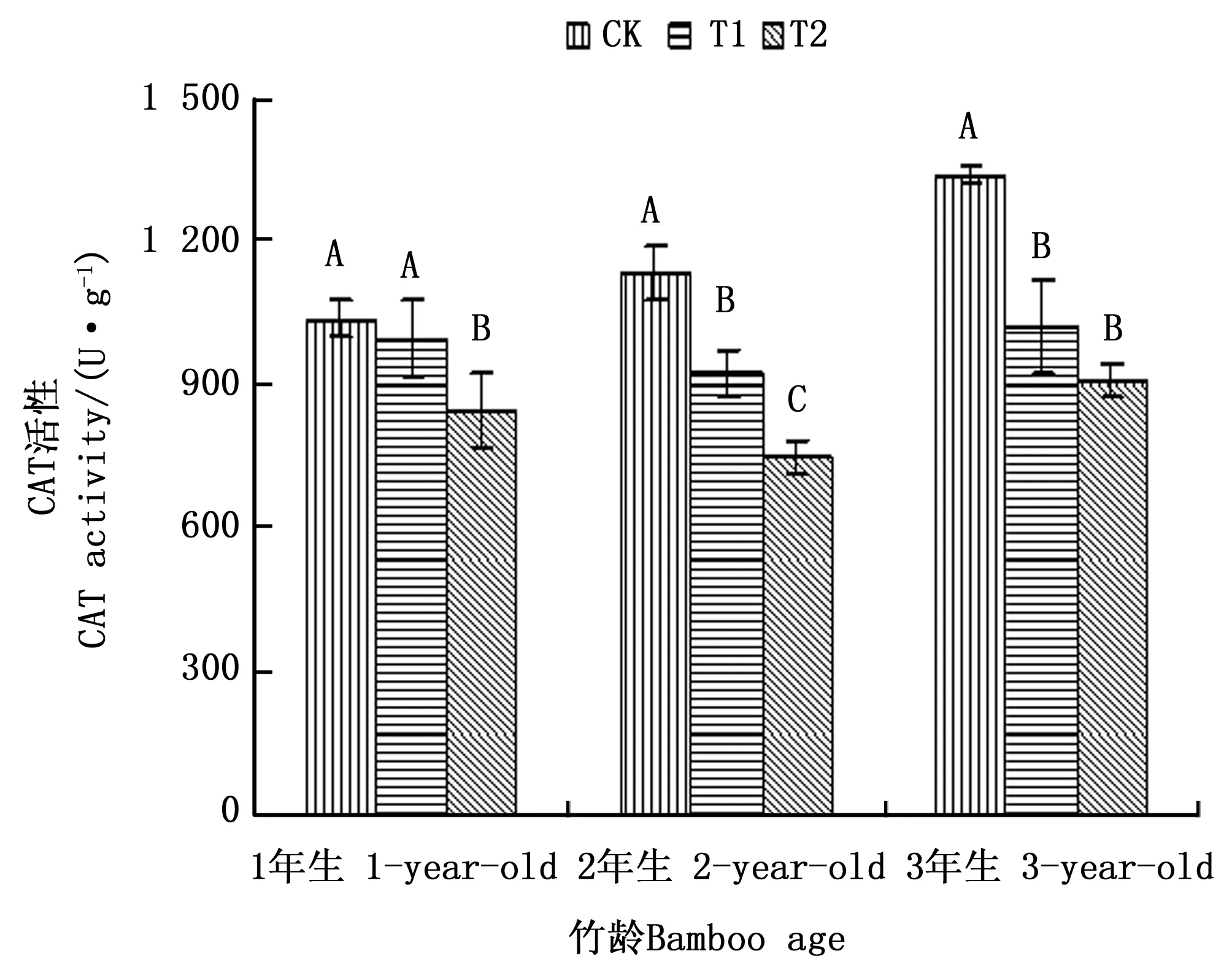
图3 模拟干旱环境下不同注水伐桩处理毛竹叶片CAT活性Fig.3 Activities of CAT in leaves of moso bamboo with different number of water storage in stumps under simulated drought environment
2.4.3 POD活性差异分析 过氧化物酶(POD)是植物体内清除H2O2的另一种主要的酶类,POD在一定程度上能催化H2O2,并在氧化其它底物后产生H2O[22]。同时POD具有双重的作用,一方面它可以在逆境初期表达,清除植物体内的H2O2,表现为一种保护效应;另一方面它也可以在逆境后期进行表达,参与叶绿素的降解和活性氧的生成,并且能引发膜脂过氧化作用,表现为一种伤害效应[7]。 由图4可以看出,3种处理下各年龄毛竹叶片POD活性的变化趋势相同,均表现为随着注水伐桩数量的增加,毛竹叶片POD活性下降。但3种处理下1、2和3年生毛竹叶片POD活性在不同注水伐桩处理下的变化幅度不同。1年生和3年生毛竹叶片POD活性,均表现为CK和T1处理差异不显著,但都与T2处理差异显著,T1和T2处理下1年生和3年生毛竹叶片的POD活性与CK处理相比降幅分别达到5.63%和23.99%,4.98%和20.99%;2年生毛竹叶片POD活性,在T1和T2处理下与CK处理相比分别下降28.58%和49.48%,且3种处理之间2年生毛竹叶片POD活性达到差异显著水平。T1和T2处理下,均表现为2年生毛竹POD活性下降幅度最大,1年和3年生毛竹POD活性下降幅度相对较小,说明增加储水伐桩对2年生毛竹叶片的POD活性的影响作用最大。
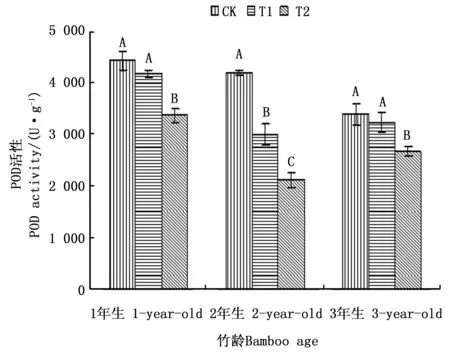
图4 模拟干旱环境下不同注水伐桩处理毛竹叶片POD活性Fig.4 Activities of POD in leaves of moso bamboo with different number of water storage in stumps under simulated drought environment
3 讨论
3.1 模拟干旱环境下毛竹光合与蒸腾作用的变化
全球气候的变化导致干旱现象频繁发生,在所有影响植物光合的环境因素中,干旱对植物光合的影响作用最为强烈,因此干旱环境下植物光合变化研究已经成为当今的一个研究热点[23]。光合作用不仅是植物的重要生命活动,同时也是植物生长的生理基础,植物在干旱胁迫条件下的光合生产力通常是鉴定植物耐旱能力的指标之一[4,24]。在干旱胁迫对毛竹幼苗生理特性的影响研究中发现水分胁迫能显著地影响毛竹幼苗的光合作用,对净光合速率和蒸腾速率的影响均达到极显著水平(P<0.01),随着干旱胁迫程度的加深,毛竹幼苗的净光合速率与蒸腾速率均显著下降[17]。本研究同样发现,在CK(0个伐桩注水)处理下,1、2和3年生毛竹净光合速率与蒸腾速率均最小,T1(12个伐桩注水)、T2(18个伐桩注水)处理随着毛竹注水伐桩数量的增加,模拟干旱胁迫逐渐减轻的情况下,1、2和3年生毛竹净光合速率与蒸腾速率均有了不同程度的升高,其中各年龄毛竹在不同处理之间净光合速率与蒸腾速率均表现为T2>T1>CK。增加注水伐桩后1、2和3年生毛竹之间净光合速率与蒸腾速率增加幅度存在一定的差异,这可能是不同年龄毛竹在受到干旱胁迫后自身生长状况和生理状况变化程度不同而综合作用的结果。随着毛竹注水伐桩数量的继续增加毛竹的净光合速率与蒸腾速率是否将进一步增加,还有待进一步深入的研究。
3.2 模拟干旱环境下毛竹叶绿素含量变化
在干旱环境下,高的叶绿素含量能够使植物有一个相对较高的光合作用,从而可以提高植物的抗旱能力[25]。在植物抗旱的相关研究中,植物叶片叶绿素含量一直被用来作为一种与植物抗旱性严格相关且非常重要的指标来看待[26-27]。本研究显示,随着模拟干旱程度的增加(注水伐桩数量的减少),1、2和3年生毛竹叶片的叶绿素a(Chl a)、叶绿素b(Chl b)以及类胡萝卜素(Car)含量都在降低,这与李芬等[28]的研究结果基本相同。相关研究显示,干旱胁迫下,叶绿素含量下降的主要原因一方面可能是叶绿体片层中捕光Chl a/b-Pro复合体合成受到抑制或受到损伤,从而阻止了叶绿素积累和原叶绿素酯的形成,进而引起叶绿素含量的下降,另一方面叶绿素自身氧化降解也可能是其含量降低的因素[29]。同时,脂质过氧化作用的诱导也可能导致叶绿素含量的降低[30]。植物Chl a/b值的大小通常用来反映了植物对水分胁迫的敏感性和植物抗旱性的强弱[31]。本研究中3种处理下1、2和3年生毛竹的Chl a/b差异均未达到显著水平,此结果表明3个年龄毛竹都具有一定的抗旱能力。
3.3 模拟干旱环境下毛竹的渗透调节作用
丙二醛(MDA)是植物在逆境下遭受伤害脂膜过氧化最重要的产物之一。它能与细胞内各种成分发生强烈地反应,引起酶和膜的严重损伤,从而引起膜电阻及膜的流动性降低,最终导致膜结构及生理完整性的破坏[32]。植物叶片过氧化产物MDA含量在干旱胁迫后会逐渐增高,并随着干旱胁迫的加强,MDA含量继续增加[17,33]。本研究显示了相似的结果,随着模拟干旱胁迫的增强(即随着注水伐桩的减少),1、2和3年生毛竹叶片MDA含量均在增加,但是各年龄毛竹叶片MDA含量增加的幅度并不相同,这表明膜脂过氧化反应持续加重,细胞原生质膜破坏程度增加,毛竹年龄不同,细胞质膜遭到的破坏程度也不尽相同。3个年龄毛竹叶片MDA含量CK处理与T1和T2处理均达到显著水平,T1和T2处理仅1年生毛竹叶片MDA含量达到差异显著水平,这说明轻度干旱胁迫对毛竹叶片细胞膜脂过氧化影响较小,而重度胁迫则影响较大,膜损伤也较重,且干旱环境对不同年龄毛竹叶片细胞膜脂过氧化的影响程度存在一定差异。通常在干旱胁迫下,植物叶片MDA含量降幅越小,说明其抗旱性越强;相反,植物叶片MDA含量降幅越大,说明其抗旱性越弱[34],T1和T2处理下2年生和3年生毛竹叶片MDA含量下降幅度相差不大且均较小,以1年生毛竹叶片MDA含量下降幅度最大,此现象说明2年生和3年生毛竹耐旱性相对较强,1年生毛竹的耐旱性相对较差。
3.4 模拟干旱环境下毛竹保护酶作用
植物体内为保护其自身免受氧化伤害而形成一套相应的抗氧化保护酶系统,如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)等,从而保护植物细胞膜和敏感分子免受活性氧的伤害[35]。植物对逆境的适应能力和抗性与保护酶的活性密切相关[36-37],这些保护酶在清除植物体内的超氧自由基、过氧化物、过氧化氢以及阻止或减少羟基自由基形成等方面起着重要的作用,且SOD和CAT对脂质过氧化引起的DNA损伤也有一定程度的保护作用。通常情况下植物酶活性越高,其抗逆性越强[22]。在干旱胁迫下植物叶片SOD、CAT和POD活性均随着干旱胁迫程度的增加有不同程度的升高[38],在本研究中CK处理下1、2和3年生毛竹叶片的SOD、CAT和POD活性最高,T1处理次之,T2处理最低,出现了相同的结果。1、2和3年生毛竹叶片CAT和POD活性均随着模拟干旱程度的增加,活性增大,说明CAT和POD两种酶在清除SOD转化的H2O2的能力还在增强,其在将H2O2转变成为H2O的过程中起到着重要作用,同时1、2和3年生毛竹叶SOD和CAT活性均呈现上升趋势,这可能和两者是协同保护酶的原因[37]。仍有相关研究显示,铺地竹(SasaargenteistriatusE. G. Camus)等4种地被竹叶片SOD、POD和CAT活性随着干旱胁迫程度的增加均呈现先升高后降低的趋势[39],而在本研究中,1、2和3年生毛竹叶片中保护酶对干旱胁迫的响应方式和上述结果均不一致,这可能是模拟干旱未达到重度干旱胁迫的原因,随着模拟干旱环境时间的持续增加,各年龄毛竹叶片保护酶活性也可能出现CK处理下毛竹叶片保护酶活性反而低于T1和T2处理的现象。
4 结论
模拟干旱环境下增加注水伐桩对1、2和3年生毛竹光合蒸腾能力、叶片光合色素含量、MDA含量及抗氧化酶系统(SOD、CAT和POD)的活性均产生了较大的影响。随着模拟干旱程度的增加(即注水伐桩数量的减少),1、2和3年生毛竹净光合速率、蒸腾速率及叶片叶绿素a、叶绿素b和类胡萝卜素含量均有不同程度的降低(P<0.05),叶片MDA含量和SOD、CAT、POD活性均有不同程度的升高(P<0.05)。毛竹的净光合速率、蒸腾速率和叶片光合色素含量与注水伐桩数量正相关,而叶片MDA含量及SOD、CAT和POD活性与注水伐桩数量负相关。在毛竹林中增加注水伐桩能够显著提高毛竹的光合与蒸腾能力,增加了毛竹光合产物的积累,同时改善了毛竹的生长状况,为毛竹的适应性经营管理及节水灌溉措施的制定提供了理论依据。注水伐桩为极端干旱天气条件下毛竹林的稳产高产提供了有力保障,也为高山地区毛竹林的灌溉创造了条件,大大降低了毛竹林的灌溉成本。在模拟干旱环境下,随着注水伐桩数量的继续增加不同年龄毛竹各生理指标的变化还需要进一步深入的研究。
[1] 杨 帆, 苗灵风, 胥 晓, 等. 植物对干旱胁迫的响应研究进展[J]. 应用与环境生物学报, 2007, 13(4): 586-591.
[2] 马怀宇, 吕德国, 刘国成, 等. 不同灌水方式对‘寒富’苹果叶片光合功能和抗氧化酶活性的影响[J]. 生态学杂志, 2012, 31(10): 2534-2540.
[3] Flexas J, Escalona J M, Medrano H. Water stress induces different levels of photosynthesis and electron transport rate regularion in grapevines[J]. Plant, Cell and Environment, 1999, 22(1): 39-48.
[4] 付士磊, 周永斌, 何兴元, 等. 干旱胁迫对杨树光合生理指标的影响[J]. 应用生态学报, 2006, 17(11): 2016-2019.
[5] Zeng D F, Luo X R. Physiological effects of chitosancoating on wheat growth and activities of protective enzyme with drought tolerance[J]. Open Journal of Soil Science, 2012, 3(2):282-288.
[6] Huseynova I M, Aliyeva D R, Mammadov Alamdar C,etal. Hydrogen peroxide generation and antioxidant enzyme activities in the leaves and roots of wheat cultivars subjected to long-term soil drought stress[J]. Photosynthesis Research, 2015, 125(2): 279-289.
[7] 韩 刚, 党 青, 赵 忠. 干旱胁迫下沙生灌木花棒的抗氧化保护响应研究[J]. 西北植物学报, 2008, 28(5): 1007-1013.
[8] 谢小玉, 马仲炼, 白 鹏, 等. 辣椒开花结果期对干旱胁迫的形态与生理响应[J]. 生态学报, 2014, 34(13): 3797-3805.
[9] 代松家,魏晶晶,兰小中, 等. 喜马拉雅紫茉莉对干旱的生理生态响应[J]. 北方园艺, 2015(8): 152-156.
[10] 时丽冉, 刘志华. 干旱胁迫对苣荬菜抗氧化酶和渗透调节物质的影响[J]. 草地学报, 2010, 18(5): 673-677.
[11] 邱尔发, 洪 伟, 郑郁善. 中国竹子多样性及其利用评述[J]. 竹子研究汇刊, 2001, 20(2):11-14.
[12] 王丽丽, 赵韩生, 孙化雨, 等. 毛竹miR397 和miR1432 的克隆及其逆境胁迫响应表达分析[J]. 林业科学, 2015, 51(6): 63-70.
[13] 张 蕊, 申贵仓, 张旭东, 等. 四川长宁毛竹林碳储量与碳汇能力估测[J]. 生态学报, 2014, 34(13): 3592-3599.
[14] 李迎春, 李 应, 陈双林, 等. 大气O3浓度升高对毛竹光合生理的影响[J]. 生态学杂志, 2013, 32(2):344-350.
[15] 陈建华, 毛 丹, 朱 凡, 等. 9个笋用竹种的光合特性[J]. 中南林业科技大学学报, 2008, 28(6): 9-14.
[16] 李 翀, 周国模, 施拥军, 等. 不同经营措施对毛竹林土壤有机碳的影响[J]. 林业科学, 2015, 51(4): 26-34.
[17] 应叶青, 郭 璟, 魏建芬, 等. 干旱胁迫对毛竹幼苗生理特性的影响[J]. 生态学杂志, 2011, 30(2): 262-266.
[18] 王忠芝, 张金瑞. 基于图像处理的叶面积测量方法[J]. 微计算机应用, 2010, 31(5): 68-72.
[19] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.
[20] 闫江艳, 张永清, 冯晓敏, 等. 干旱胁迫及复水对不同黍稷品种根系生理特性的影响[J]. 西北植物学报, 2012, 32(2): 348-354.
[21] Bencze S, Bamberger Z, Janda T,etal. Drought tolerance in cereals in terms of water retention, photosynthesis and antioxidant enzyme activities[J]. Central European Journal of Biology, 2011, 6(3): 376-387.
[22] Nikolaeva M K, Maevskaya S N, Shugaev A G,etal. Effect of drought on chlorophyll content and antioxidant enzyme activities in leaves of three wheat cultivars varying in productivity[J]. Russian Journal of Plant Physiology, 2010, 57(1): 87-95.
[23] Kebbas S, Lutts S, Aid F. Effect of drought stress on the photosynthesis of Acacia tortilis subsp. raddiana at the young seedling stage[J]. Photosynthetica, 2015, 53(2): 288-298.
[24] 张亚敏, 马克明, 李芳兰, 等. 干旱胁迫条件下AMF促进小马鞍羊蹄甲幼苗生长的机理研究[J]. 生态学报, 2016, 36(11): 3329-3337.
[25] 郑敏娜, 李向林, 万里强, 等. 水分胁迫对6种禾草叶绿体、线粒体超微结构及光合作用的影响[J]. 草地学报, 2009, 17(5): 643-649.
[26] Wallin G, Karlsson P E, Selldén G,etal. Impact of fouryears exposure to different levels of ozone, phosphorus and drought on chlorophyll, mineral nutrients, and stem volume of Noway spruce, Picea abies[J]. Physiol Plant, 2002, 114(2):192-206.
[27] Xiao Y A.The physiology responses and adjective adaptability of waters tress onClemespinosaL. seedlings[J]. Journal of Wuhan Botanical Research, 2001, 19(6): 524-528.
[28] 李 芬, 康志钰, 邢吉敏, 等. 水分胁迫对玉米杂交种叶绿素含量的影响[J]. 云南农业大学学报, 2014, 29(1): 32-36.
[29] 华北平原作物水分肋迫与干旱研究课题组. 作物水分胁迫与干旱研究[M]. 郑州: 河南科学技术出版社, 1991: 26-32.
[30] 刘晓建, 谢小玉, 薛兰兰. 辣椒开化结果期对干旱胁迫响应机制的研究[J]. 西北农业学报, 2009, 18(5): 246-249.
[31] 张卫星, 朱德峰, 朱智伟, 等.水分亏缺对超级稻叶片光合色素含量的影响[J]. 西南农业学报, 2011, 24(5): 1690-1701.
[32] Brito G, Costa A, Fonseca H M A C,etal. Response of Olea europaea ssp. Maderensis in vitro shoots exposed to osmotie stress[J]. Scientia Horticulturae, 2003, 97(s3-4): 411-417.
[33] 王 姗, 王竹承. 干旱胁迫对桔梗幼苗生长及生理特性的影响[J]. 西北农业科学, 2014, 23(7):160-165.
[34] 张 敏, 李静媛, 张占彪, 等. 干旱胁迫对‘夕阳红’幼苗生长和生理生化指标的影响[J]. 灌溉排水学报, 2015, 34(9): 99-104.
[35] 井大炜, 邢尚军, 杜振宇, 等. 干旱胁迫对杨树幼苗生长、光合特性及活性氧代谢的影 响[J]. 应用生态学报, 2013,24(7):1809-1816.
[36] Lima A L S, Damatta F M, Pinheiro H A,etal. Photochemical responses and oxidative stress in two clones ofCoffeacanephoraunder water deficit conditions[J]. Environmental and Experimental Botany, 2002, 47(3): 239-247.
[37] Sundar D, Perianayaguy B, Reddy A R. Localization of antioxidant enzymes in the cellular compartments of sorghum leaves[J]. Plant Growth Regulation, 2004,44(2):157-163.
[38] 赵丽丽, 吴佳海, 陈 莹, 等. 干旱对高羊茅生理特性的影响及抗旱性评价[J]. 中国草地学报, 2015, 37(4):15-20.
[39] 赵 兰, 邢新婷, 江泽慧, 等. 4种地被观赏竹的抗旱性研究[J]. 林业科学研究, 2010, 23(2): 221-226.
(责任编辑:金立新)
Effects of Water Storage in Bamboo Stumps on Physiological Characteristics ofPhyllostachysedulisunder Simulated Drought Environment
ZHANGLei1,XIEJin-zhong1,ZHANGWei1,DINGZhong-wen2,JILin-ke1,CHENSheng1
(1.Research Institute of Subtropical Forestry, Chinese Academy of Forestry, Hangzhou 311400, Zhejiang, China;2.Fuyang District Agriculture and Forestry Bureau of Hangzhou City, Hangzhou 311400, Zhejiang, China)
[Objective]To study the water stored in bamboo stump on the physiological characteristics of different agedPhyllostachysedulis(moso bamboo) under drought environment so as to lay a theoretical basis for the management and water-saving irrigation measures in the context of climate change. [Method]1-year-old, 2-year-old and 3-year-old moso bamboos were selected as the research object. Simulating drought environment by the method of covering film, 9 sample plots with same size in the moso bamboo forest (10 m×20 m) were set up. The plots were trenched and the rhizomes were cut to block moisture transport from the surrounding soil. 3 irrigation treatments were set, i.e. T1 (12 stump with water storage), T2 (18 stump with water storage) and the CK (0 stump with water storage). Each treatment was performed in triplicate to research the physiological responses of bamboo at three age levels with the different water amount stored in the stumps.[Result]The result showed that under simulated drought environment, the net photosynthetic rate (Pn) and transpiration rate (Tr) of 1-year-old, 2-year-old and 3-year-old moso bamboo decreased significantly with the water amount stored in the stumps decreased. The max decline ofPnandTrin 1-year-old, 2-year-old and 3-year-old moso bamboo reached 74.35% and 73.08%, 59.14% and 36.62%, 60.47% and 61.54%, respectively. The contents of Chlorophyll a (Chl a), Chlorophyll b (Chl b) and Carotenoid (Car) in moso bamboo leaves decreased significantly. The Chl a, Chl b and Car contents of 1-year-old and 3-year-old moso bamboo showed significant differences (P<0.05). The Chl a content of 2-year-old moso bamboo showed significant difference, but there was no significant difference in the content of Chl b and Car (P<0.05). And the Chl a/b in the three aged moso bamboo were not significantly different (P<0.05). The superoxide dismutase (SOD), catalase (CAT) and peroxidase (POD) activity as well as the malondialdehyde (MDA) content in moso bamboo leaves increased significantly (P<0.05). There was a positive relationship between the photosynthesis, the photosynthetic pigment content of moso bamboo and the quantity of moso bamboo stumps, while the MDA content and SOD, CAT and POD activity were negatively related to the quantity of moso bamboo stumps. [Conclusion]This study showed that increased water storage in moso bamboo stumps could significantly improve the photosynthesis of moso bamboo, increase the accumulation of photosynthetic products and leaf photosynthetic pigment content and decrease MDA content and SOD, CAT and POD activity in a drought environment.
Phyllostachysedulis; simulated drought environment; photosynthesis and transpiration rate; chlorophyll content; protective enzyme
10.13275/j.cnki.lykxyj.2017.01.020
2016-04-20
中央级公益性科研院所基本科研业务费专项资金项目(CAFYBB2016SY011);福建省林业科学研究项目(闽林科(2015)函2号);浙江省林业科技推广项目(2015B05);杭州市科技发展计划项目(20130432B75)。
张 磊(1989—),男,河南新乡人,硕士研究生,主要从事竹林生态研究.
* 通讯作者:谢锦忠(1966—),男,浙江诸暨人,副研究员,博士,主要从事竹林生态、竹类资源与利用研究. E-mail:jzhxie@163.net
S795.7
A
1001-1498(2017)01-0145-09

