寡核苷酸管芯片技术检测和鉴别我国不同组植原体*
王圣洁,林彩丽,严东辉,于少帅,李 永,汪来发,朴春根,郭民伟,淮稳霞,田国忠
(中国林业科学研究院森林生态环境与保护研究所,国家林业局森林保护学重点实验室,北京 100091)
寡核苷酸管芯片技术检测和鉴别我国不同组植原体*
王圣洁,林彩丽,严东辉**,于少帅,李 永,汪来发,朴春根,郭民伟,淮稳霞,田国忠**
(中国林业科学研究院森林生态环境与保护研究所,国家林业局森林保护学重点实验室,北京 100091)
[目的]不同组植原体检测和鉴别的特异性探针已有报道,为了筛选出适合于我国不同组植原体检测和鉴别的特异性探针,建立管芯片检测和鉴别植原体技术,并对我国发生的疑似植原体病害进行鉴别。[方法]通过PCR扩增结合管芯片杂交技术,对收集到的15种植原体侵染的植物样品及其健康对照进行检测和鉴别。[结果]建立了管芯片检测和鉴别植原体技术体系。15种病害样品中,13种获得显著的阳性杂交信号,并且所有的健康对照都呈现为阴性。13种植原体病害依16Sr DNA直接测序可分为16Sr Ⅰ、Ⅱ、Ⅴ、XIX四组植原体。在所有探针中,植原体的通用探针(Pp-502)可以检测到所有确定的植原体样品。16SrⅠ组特异性探针(PpⅠ-465)可以确定16SrⅠ组的泡桐丛枝、苦楝丛枝、桑树萎缩和莴苣黄化4种植原体样品。16SrII组特异性探针(PpⅡ-629)仅可以确定16Sr II组的花生丛枝、甘薯丛枝和臭矢菜丛枝3种植原体样品。但16SrV组的枣疯病、樱桃致死黄化和重阳木丛枝及16Sr XIX组的板栗黄化皱缩植原体与其他组专化性探针皆有明显的交叉杂交信号。相比于PCR扩增的凝胶电泳检测,管芯片检测的灵敏度提高了1 000倍。对疑似植原体病害的诊断结果显示河南濮阳的红花槐丛枝的病原应为16SrV组植原体,福建福州的长春花黄化丛枝应为16SrⅠ组植原体;而北京戒台寺牡丹黄化皱叶和内蒙古包头柳树丛枝未出现任何植原体专化的杂交信号。[结论]管芯片杂交技术作为一种检测和鉴别植原体的方法,可应用于我国植原体病害调查和诊断,并为植原体的鉴别和分类提供可靠的依据。
管芯片;植原体;病害鉴定与诊断;16Sr DNA基因
植原体(Phytoplasma,原称 Mycoplasma-like organism 简称MLO),是一类类似植物病原细菌但无细胞壁的原核生物。能引起许多重要的粮食作物、蔬菜、观赏植物和果树等经济林木的严重病害。目前,在国际上已经报道的植原体相关病害多达1 000余种,在我国发生的也有100多种[1]。由于植原体暂时还不能实现体外培养,针对该类病害的高度抗性品种又很难获得,实际生产中该类病害的防治措施主要是依靠清除染病的植株,杜绝侵染来源。因而及早的发现感病植物中植原体的存在,及时采取相应的措施,将带毒植物予以铲除,对该类病害的防治具有重要意义[2]。因此,建立快速、高效、准确的植原体鉴定检测体系变得尤为重要,这方面的研究经历了前期主要依靠生物学、电镜观察、抗生素试验相结合的传统方法进行检测,到后期随着生物技术的发展,基于酶联免疫反应、核酸杂交以及PCR技术的检测方法也相继建立,检测的灵敏度和准确性不断提高[3-6]。
基因芯片又称DNA芯片或DNA微阵列,是指固着在载体上的高密度DNA微点阵。其原理是根据核酸的分子杂交衍生而来,即应用已知序列的核酸作为探针,对未知序列的核酸序列进行杂交检测[7]。基因芯片根据不同的载体类型以及用途可以分为不同的类型,如基因表达芯片、测序芯片、诊断芯片等。同时针对不同的芯片类型,又建立了不同的芯片技术平台,比较成熟的有Affymentrix公司的Gene-Chip系列、Agilent公司的aCGH芯片系列、BioPrime公司的ArrayCGH系列、博奥生物的晶芯系列以及Alere公司的ArrayTube系列等。相比于传统的核酸杂交技术,基因芯片具有快速、平行、高效、高通量、高灵敏度、可自动化操作等特点,自被发明以来,在医学、生命科学、农业、林业及环境科学等领域得到了广泛的应用[8-10]。
生物芯片的核心是核酸杂交技术,早在20世纪末期,已经有不少学者将核酸杂交技术应用于植原体的研究中[11]。2004年Herdia等[12]对DNA芯片在植物病毒、类病毒及植原体病原检测上的应用潜力进行过报道。2007年Bertolini[13]将PCR与dot blot相结合成功的实现了16SrX组植原体的检测。同年,Nicolaisen等[14]针对植原体的16Sr DNA基因设计特异性引物,在BioPrime Array平台上建立了可以鉴别和检测大部分16Sr 亚组的植原体芯片检测方法。2011年Lenz 等[15]报道了用植原体16S-23S间区为靶标的寡核苷酸芯片区分不同植原体,获得了与上述16Sr DNA基因芯片类似的分辨效果;至2015年,Lenz等[16]又选取植原体核糖体蛋白基因rps3,rpl22和rps19作为靶标基因,设计特异性探针,同样实现了植原体不同亚组间的芯片鉴别和检测,并尝试对田间和混合感染样品的检测。其中,Nicolaisen所采用的方法,由于对PCR产物使用Cy3-dCTP进行标记、且需对标记反应产物进行纯化,而且杂交反应需过夜,导致检测过程和时间过长,操作较为繁琐。Lenz的方法,简化了杂交的过程,可以在2小时内完成检测,但是其所需设备比较庞大、昂贵。相比于Lenz所使用的芯片扫描平台Tyhoon 900,Alere公司的ATR 03 Reader芯片扫描平台,具有设备简单,方便携带、快速反应的特点,可以实现在2小时内完成杂交,非常适合野外和现场试验。
我国植原体病害发生严重,而且存在不同亚组的植原体共同危害的现象。为了调查分析我国植原体的分类情况,我们将Nicolaisen针对16Sr DNA所设计的探针结合Alere公司定制的管芯片对所收集到的植原体进行应用研究,以期筛选出适用于我国不同组植原体分类鉴定的特异性探针组,并在此基础上建立适合于野外使用的管芯片鉴定和检测植原体的方法。与此同时,我们也将此方法应用于我国一些疑似植原体病害的鉴别和分类研究。
1 材料与方法
1.1 材料
试验所使用的植原体材料及其健康对照,采集自我国不同的地区,其编号及分类信息详见表1。CTAB植物基因组DNA快速提取试剂盒(DN14)购自北京艾德莱生物科技有限公司。PCR产物纯化试剂盒、质粒提取试剂盒、以及感受态细胞E.coliDH5α、克隆载体 pMD18-T均购自宝生生物(大连)有限公司。管芯片杂交试剂盒购自德国Alere生物技术有限公司。

表1 植原体样品及来源Table 1 Origin and information of phytoplasma samples
1.2 方法
测序获得序列与NCBI上下载的植原体各组代表序列利用MEGA软件构建系统发育树,建树采用N-J法,Bootstrap 值为1 000,非固醇甾原体(Acholeplasmalaidlawii)和螺原体(Spiroplasmachrysopicola)作为外类群,确定所采集植原体的分类地位。1.2.2 特异性探针设计及管芯片定制 参考Nicolaise等[14]针对植原体的16Sr DNA设计的探针组,包含了一对通用引物Pp-fwd(5’-AGTGGCGAACGGGTGAGTAAC-3’)和Pp-rev (5’-CGTTTACGGCGTGGACTACCAG-3’)以及一组针对不同组植原体特异性的探针(见表2)。管芯片的制作委托德国Alere生物技术有限公司进行,将人工合成的探针序列,经点样机按设计的排布点在管芯片中。探针序列及阳性对照在载体上的分布情况(见图1)。

表2 探针序列Table 2 Probe sequences
1.2.3 靶标基因的生物素标记及管芯片杂交 本实验采用生物素标记靶标基因,方法是在合成设计的通用探针的引物Pp-fwd/Pp-rev时,在引物Pp-rev的5’端进行生物素修饰。并以此带有标记的引物组对样品进行PCR扩增,PCR扩增程序:25 μL扩增反应体系中含有制备的DNA模板1 μL,正反向引物各0.5 μL(10 μM),2 × PCR预混液(0.05 U/μL Taq DNA 聚合酶, 4 mM MgCl2和 0.4 mM dNTPs)12.5 μL,ddH2O补至25 μL。反应程序:94℃ 3 min;94℃ 15 s, 62℃ 30 s, 72℃ 1 min, 共35个循环;72℃延伸10 min。管芯片的杂交和洗涤过程,将PCR产物、纯水和杂交缓冲液C1按照1∶9∶90配制杂交混合液,其余参照Alere公司杂交试剂盒的操作说明进行。将芯片扫描的信号强弱按等级进行划分,并赋值。最强信号为Biotin-Marke赋值为10,无信号赋值为0,按照杂交信号的强弱借助软件Heml 1.0制作杂交结果的Heatmap图。
1.2.4 管芯片探针特异性验证和疑似植原体病害材料检测 按照管芯片检测步骤,分别对已经确立了分类地位的16SrⅠ组、16SrⅡ组、16SrⅤ组和16SrXIX组的植原体组织和对应的健康组织进行检测。同时对采集的疑似植原体病害的植物材料和健康对照进行检测验证。
1.2.5 管芯片鉴定和检测植原体灵敏度测定 将样品PaWB-HBBD用引物R16mF2/R16mR1进行PCR扩增,扩增产物经纯化试剂盒纯化后,与克隆载体 pMD18-T 16℃连接过夜,转化到感受态细胞E.coliDH5α中。在含有IPTG和X-gal的LB筛选平板上挑取白色菌落并摇菌培养。用质粒纯化试剂盒(Takara Mini BEST Ver.2.0)从上述培养液中提取重组质粒DNA,并送北京华大基因进行测序验证。
将上述提取的重组质粒DNA,10倍梯度稀释,并作为模板进行PCR扩增和管芯片检测。比较琼脂糖凝胶电泳和管芯片杂交的检测灵敏度。
2 结果与分析
2.1 植原体样品16S rDNA的扩增与测序
应用植原体16Sr DNA基因的通用引物R16mF2/R16mR1对15种植原体侵染植物样品及其健康对照的DNA进行PCR扩增,凝胶电泳检测结果显示所有的健康植物对照均未出现阳性扩增结果。一些疑似植原体病害的发病组织DNA也未扩增出阳性的结果。包括牡丹皱叶黄化(PsYC-BJMTG)和柳树丛枝(SaWB-NMBT)。剩下的13种具有典型症状的发病组织DNA,均获得阳性扩增结果。将具有阳性结果的PCR产物送北京六合华大基因测序,测序结果与GenBank中已报道的[18]植原体不同组的序列构建系统发育树(见图2)。结果显示所收集的植原体材料分布在四个组,分别是16SrⅠ组、16SrⅡ组、16SrⅤ组和16SrXIX组。
2.2 管芯片探针杂交结果和特异性验证
按照所建立的管芯片检测和鉴定植原体的方法对所收集到的我国发生的16Sr不同组植原体的DNA及其健康对照进行管芯片杂交,从杂交结果的Heatmap图(图4)可以看出,Nicolaisen等所设计的针对16Sr DNA基因的探针,与健康植物对照皆无杂交信号,而分别与不同组植原体有强弱不同的杂交信号。其中17号探针(Pp-502)作为植原体通用探针能与我国不同地区采集的、已系统鉴定的不同组的所有植原体都有很强的杂交信号,可以成为各种植原体病害初步诊断的理想探针。但另一通用探针16号(Pp-148)按现有的检测方法与条件,其所产生杂交信号较弱。15号探针(PpXIV-585),原是针对16S rXIV组所设计的组特异性探针,但是实验结果却显示其可以和16SrⅠ组、16SrⅤ组和16SrXIX组植原体产生相对较强的杂交信号。
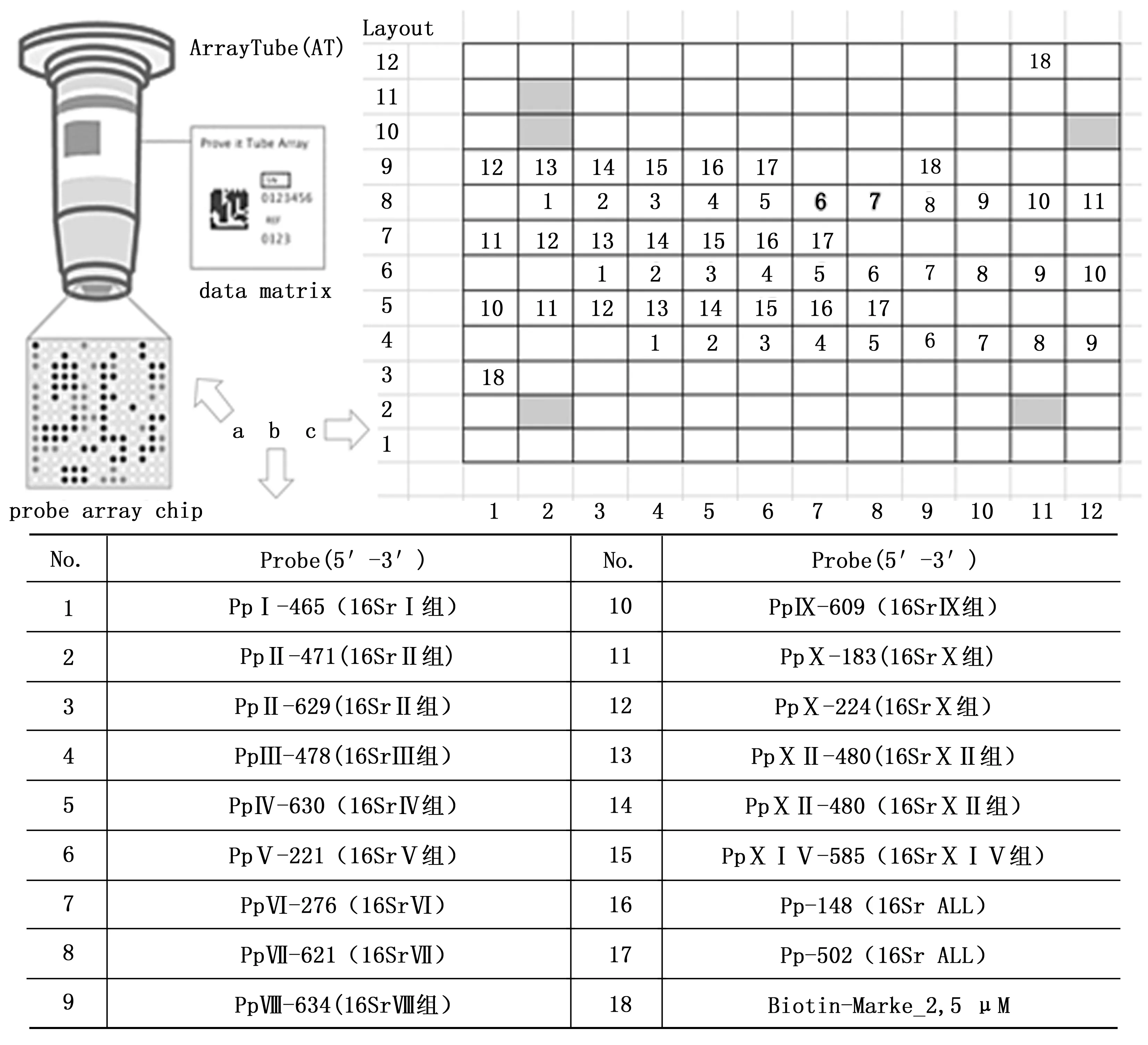
注:a:管芯片示意图;b:探针分布图;c:探针点代号Note: a: ArrayTube diagram; b: Probe distribution; c: Probe code.图1 管芯片示意及探针分布图Fig.1 Array diagram and probe distribution
16SrⅠ组的泡桐丛枝、苦楝丛枝、桑树萎缩和莴苣黄化四种已知分类地位的植原体材料的管芯片杂交结果来看,针对16SrⅠ组所设计的组特异性的1号探针(PpⅠ-465)有很好的特异性。4种16SrⅠ组的样品均出现较强的杂交信号,同时其他组的样品不出现杂交信号。同样,针对16SrⅡ组所设计的组特异性3号探针(PpⅡ-629)也表现出了良好的组间特异性,所有16SrⅡ组的花生丛枝、甘薯丛枝和臭矢菜丛枝3个植原体样品可产生较强的杂交信号,并且其他组的样品不出现杂交信号。但是同样针对16SrⅡ组设计的另外一个特异性探针2号(PpⅡ-471),却没能出现任何杂交信号。
16SrⅤ组的枣疯、樱桃致死黄化和重阳木丛枝三个植原体样品所产生的杂交信号谱较为复杂且相似,除了通用探针17号(Pp-502)外和15号探针(PpXIV-585)出现了较强的杂交信号外,6号探针(PpV-221)、8号探针(PpVII-621)、9号探针(PpVIII-634)以及16号探针(Pp-148)均出现了中等强度的杂交信号。其中只有6号探针是设计的16SrⅤ组特异性探针,与属于B亚组的枣疯病和樱桃致死黄化有中等强度的杂交信号,但属于H亚组的重阳木丛枝则未出现杂交信号,较难判断为阳性结果。

图2 基于植原体16Sr DNA 序列构建的系统进化树Fig.2 Phylogenetic tree constructed based on the 16s DNA of phytoplasm
类似的情况也出现在板栗黄化皱缩植原体样品中,即除与通用引物16和17号分别产生中等和很强的杂交信号外,也与16SrIV和16SrXIV探针有中等强度信号。根据Lin[19]的报道其属于16SrXIX组,但是Nicolaisen在设计探针时,并没有针对16SrXIX组设计特异性的探针,不过从系统发育上看16SrXIX组的植原体与16Sr IV组的植原体关系较近,因此在板栗黄化皱缩植原体样品的管芯片杂交结果中,16Sr IV组的特异性探针5号(PpIV-630)出现了较弱的信号。

A:泡桐丛枝; B:健康泡桐; C:花生丛枝; D:健康花生; E:枣疯病; F:健康枣树; G:板栗皱缩黄化; H:健康板栗A: Paulownia witches-broom; B: Health paulownia; C: Peanut witches-broom; D: Health peanut; E: Jujube witches-broom; F: Health jujube; G: chestnut yellows crinkle; H: Health chestnut图3 芯片杂交结果Fig.3 Results of ArrayTube hybridization
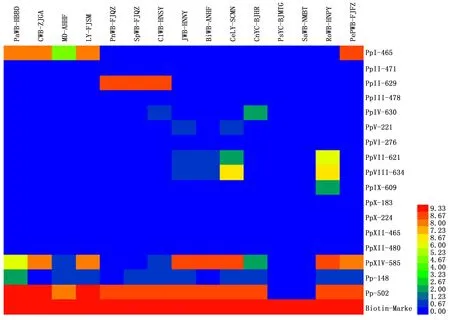
注:图中杂交信号越强,颜色越红,蓝色为没有杂交信号Note: The strong hybridization signal was red, blue repsented no signal图4 芯片杂交结果的Heatmap图Fig.4 Heatmap of ArrayTube Hybridization
另外,我国发生的4个组共13个植原体皆与所设计的针对与16SrIII、VI、X和XII四个组的所有探针无任何杂交信号,表明不存在于这些组的交叉反应问题,也意味着这些植原体样品不存在与这四个组植原体的混合感染。
2.3 不同组植原体序列与寡核苷酸探针序列比对
将通过测序获得的各个组的序列与所有具有杂交信号的探针序列进行比对,计算各组序列与探针序列的匹配率(见表3)。可以看出,通用探针Pp-148和Pp-502与测定的四个组植原体的对应序列几乎完全匹配,仅16SrII组样品序列与Pp-502探针有一个碱基的差别。16SrI组样品序列与PpⅠ-465探针序列完全匹配。16SrII组样品序列与PpⅡ-629探针序列完全匹配。从而确证了所设计的这几个探针鉴定植原体的特异性和准确性。然而也发现虽然16SrV组植原体样品的序列与所设计的组特异性探针PpV-221探针序列完全匹配,。但是从杂交的结果上来看,杂交信号的强弱并不跟其序列的匹配率成完全的正相关(参见图4);,如通用探针Pp-148与四个组样品的序列都完全匹配,但是其杂交的信号强度显著弱于通用探针Pp-502。而且同样,16SrV组样品序列与PpV-221探针序列完全匹配,与PpⅦ-621探针序列有3个碱基的错配,与PpⅧ-634探针序列有4个碱基的错配,与PpXIV-585探针序列有3个碱基的错配,但是该组植原体与PpⅦ-621、PpⅧ-634和PpXIV-585探针所对应的杂交信号却都明显强于PpV-221探针。甚至,16SrI组样品序列与PpXIV-585探针序列错配碱基达到了7个,但是也出现了较很强的杂交信号。因而,我们认为,在现行的Alere公司提供的试剂和杂交条件下,Nicolaisen等设计的针对16SrV、VIII、XIV等组的探针并非检测和鉴定相应组植原体的特异性理想探针。另外尚不清楚为什么虽然通用探针Pp-148与测定的四个组植原体样品的序列也都完全匹配,但是其杂交的信号强度总是显著弱于通用探针Pp-502。

表3 不同组样品序列与各探针的匹配率Table 3 Matching ratio between different sample sequences and probes
注:括号内为错配的碱基数,匹配率:(探针碱基总数-错配碱基数)/探针碱基总数
Note: The number of mispairing base was indicated in brackets, matching ratio: (total number of probe bases-the number of mispairing base)/Total number of probe bases
2.4 管芯片鉴定和检测植原体灵敏度
将泡桐丛枝样品PaWB-HBBD的16Sr DNA基因扩增后,连接到克隆载体pMD18-T上后组建重组质粒,提取重组的质粒,纯化后进行10倍梯度稀释,并作为模板分别进行PCR检测和管芯片检测。实验结果显示,以植原体通用引物R16mF2/R16mR1的传统PCR检测,在质粒浓度稀释到10-4倍时,达到凝胶电泳的检测限度(见图5)。但是管芯片检测在质粒稀释到10-7倍时,仍可出现较好的杂交信号(见图6)。因此可以表明相比于传统PCR检测,管芯片检测植原体的方法的灵敏度提高了1 000倍。并且采用管芯片检测的方法,不仅能实现灵敏度的提高,还能实现植原体不同组的鉴定。而且当稀释度达到10-7时,与16SrXIV组探针的交叉杂交信号也明显减弱,而16SrI专化性探针和通用探针的信号仍较强。

图5 PCR检测灵敏度Fig.5 PCR detection sensitivity

图6 管芯片检测灵敏度Fig.6 ArrayTube detection sensitivity
2.5 疑似植原体病害的检测与鉴定
近年来,我国不同地方出现了一些园林绿化树种的未知病害,如发生在北京市门头沟戒台寺的牡丹黄化皱叶病害,其具有典型的植原体病害特征,如皱叶、黄化、丛枝、巨芽等。发生在内蒙古包头市的柳树丛枝病害,同样出现小叶、丛枝等典型症状。以及河南濮阳发生的红花槐丛枝、福建福州出现的长春花黄化丛枝均为第一次发现。

图7 疑似植原体病害症状Fig.7 The symptom of suspected phytoplasma disease
我们将新建立的管芯片鉴定与检测植原体的方法应用于这些未知疑似植原体病害的检测与鉴定中。从实验结果看,牡丹黄化皱叶和柳树丛枝样品,均没能出现阳性杂交信号。红花槐丛枝产生了很好的杂交信号,并且杂交结果和16SrⅤ组的枣疯病、重阳木丛枝等结果相一致。因此可以判定引起河南濮阳红花槐丛枝的病原是属于16SrⅤ组的植原体。同样长春花黄化丛枝的杂交结果与16SrI组的泡桐丛枝病、苦楝丛枝病等相一致,因此判定出现在福建福州的长春花黄化丛枝的病原菌为16SrI组的植原体。
3 讨论
植物病害的准确快速诊断、病菌的检测与鉴别是病害防治的前提与基础。植原体的检测与鉴别目前主要依靠针对16Sr DNA的PCR扩增及测序来进行。生物芯片技术作为新兴的高度集成化的分析和研究手段,在植物病原检测与鉴定方面,因其无可比拟的高信息量、高通量、灵敏、快速和准确的特点显示出了巨大潜力。特别是针对一些混合感染的植物病害,生物芯片由于可以同时针对不同的病原设计检测探针,其检测的优势将更加明显。Lenz等对rp基因设计的探针芯片采用多引物PCR扩增产物进行芯片杂交,证明不同组植原体间的两两人工混样可以被同时检测,而且也能从田间采集的样品中检测出16SrI组和16SrX组植原体的混合感染。本研究将Nicolaisen所设计16Sr DNA探针整合到Alere公司的管芯片和ATR 03 Reader芯片扫描平台上,用生物素标记引物直接PCR,建立在管状芯片内进行植原体鉴定和检测的方法。首次利用植原体管芯片并结合序列分析技术,对我国植原体病原种类进行系统的比较鉴定和生态调查,进一步明确了我国不同地区、不同寄主植物上发生的重要植原体病原的分类地位。
3.1 管芯片探针的特异性对植原体检测的影响
在收集到的11种已确定分类地位的植原体以及4种疑似植原体病害材料的管芯片检测中,结果显示16Sr DNA基因的探针,与健康植物对照皆无杂交信号,而分别与不同组植原体有强弱不同的杂交信号。由此肯定所设计的17种探针都具植原体特异性,因而都具备植原体病害诊断和病原检测价值;特别是17号探针(Pp-502)作为植原体通用探针能与我国不同地区采集的、已系统鉴定的不同组的所有植原体都有很强的杂交信号,因而是确定各种植原体侵染和病害初步诊断的首选通用探针。组特异性的1号探针(PpⅠ-465)对4种不同寄主植物上的16SrⅠ组植原体均有很好的鉴定效果,且与其它组的样品不出现交叉杂交信号。3号探针(PpⅡ-629)对16SrⅡ组的分别来源于福建泉州的花生丛枝和甘薯丛枝及海南三亚的臭矢菜丛枝3个植原体专化性理想。所以1号探针和3号探针可以作为16SrⅠ组和16SrⅡ组植原体专化性鉴定的鉴定探针。

1:牡丹黄化皱缩; 2:健康牡丹; 3:柳树丛枝; 4:健康柳树; 5:红花槐丛枝; 6:健康槐树; 7:长春花黄化丛枝; 8:健康长春花1: Peony yellows crinkle; 2: Health peony; 3: Willow witch-broom; 4: Health willow; 5: Robinia hispida L. witches-broom; 6: Health Robinia hispida L.; 7: Periwinkle yellow and witches-broom; 8: Health periwinkle图8 疑似植原体病害管芯片杂交结果Fig.8 ArryayTube hybridization of suspected phytoplasma disease
16SrⅤ组的组特异性探针(PpV-221)与我国发生的该组B亚组的枣疯和樱桃致死黄化和H亚组的重阳木丛枝植原体的特异性较差,专化性杂交信号较弱,且与其他组的探针存在不同程度的交叉杂交现象。从我们所建立的系统发育树中可以看出16SrVII组的Erigeron witches’-broom[18]和16SrVIII组的Loofah witches’-broom[20]在进化上与16SrⅤ组的植物原体较近,因此其16Sr RNA相似度较高,探针的序列比对也显示,它们之间仅有几个碱基的差别,因此会出现交叉杂交反应。但对比这三个16SrV组植原体探针杂交结果可以发现三者具有相似阳性杂交点阵图,似乎可以作为该组植原体的特征性识别标签或指纹。比如,田间采集的福建福州的长春花黄化丛枝的芯片杂交点阵图与16SrI组的所有植原体芯片检测结果完全一致,因而应鉴定为该组植原体。而发生在河南濮阳的红花槐丛枝应是16SrV组植原体侵染所致。从常规PCR的测序验证上也印证了芯片杂交结果的准确性。
3.2 管芯片检测技术的影响因素
探针核酸分子与待检测样本中的目标核酸分子的结合紧密程度,决定了杂交反应的荧光信号强度。由于AT与GC结合的自由能有差别,不同的探针在杂交热力学性质上有差别。在杂交的过程中,杂交的温度,杂交溶液中的Na+、Mg2+离子浓度以及溶液的pH值都会影响双链DNA的稳定性。本研究中所采用的杂交体系,与Nicolaisen等所报道的并不完全相同,因此在结果上产生了不同组之间的交叉杂交信号。也可能正是由于杂交条件的不同,使得在匹配率上完全匹配的通用探针Pp-148并没有出现较好的杂交结果。
基于16Sr DNA和16S-23S间区序列设计的芯片目前也存在技术难点。由于扩增产生的片段不能过长,不同组之间16SrRNA的变异性不高,设计区分度很高的探针具有一定的难度。加之植原体大都具有两个核糖体操纵子,因而如果其中一个操纵子发生了变异,将直接影响鉴定结果的准确性。进一步选择单拷贝、且变异程度较高的靶标基因为rp基因仍具有一定的局限性,不能实现针对如16Sr VIII, XI, XIII, XIV, XV组的植原体的检测[16]。因此进一步的研究可以通过选择一些相对保守,又有一定变异性的、单拷贝基因作为探针设计的靶标基因,来实现不同组之间、组内不同亚组乃至不同植原体株系的的区分。利用管芯片技术对支原体[21]和其他细菌菌株[22-23]的基因分型已有成功的报道。
3.3 管芯片检测技术具有较高的灵敏度
芯片检测灵敏度的实验表明,相比于传统PCR的方法,管芯片的检测方法灵敏度提高了1 000倍。这可能是两个方面的原因:首先管芯片的检测技术是在PCR扩增的基础上,结合颜色反应实现对结果的判定,其中由酶促反应介导的生物素与底物的颜色反应是一个信号放大的过程,因此提高了灵敏度。其次管芯片检测在第一步扩增时,所使用的引物组为Pp-fwd/Pp-rev所扩增的片段远小于引物组R16mF2/R16mR1。因此在同样循环的情况下,短片段的扩增效率更高。
3.4 管芯片技术在植原体检测方面具有较大的应用潜力
植原体病害,具有一些典型的症状,如黄化、丛枝等。这些病害作为生产上急需解决的疑难问题,其检测与鉴定对开展相应的植物保护措施具有指导性的意义。1994年 KHADHAIR[24]首次报道了发生在加拿大埃德蒙顿地区的柳树丛枝病。2012年Zhang[25]报道了发生在我国内蒙古鄂尔多斯等地区的柳树丛枝病,并根据其16Sr DNA的RFLP分析,将其归类为16SrVI-A组。针对我国出现的一些疑似植原体的病害如牡丹黄化皱叶和柳树丛枝。我们也进行了管芯片的检测研究。但是根据我们管芯片的检测结果中,柳树丛枝和牡丹黄化皱叶的样品并没有明显的植原体信号产生。相比与采用的巢氏PCR的方法,管芯片的检测灵敏度较弱。但是考虑到巢氏PCR假阳性结果较高,因此柳树丛枝植原体的鉴定方面,需要其他方法相互验证。
4 结论
本研究基于管芯片技术平台建立了植原体病害检测与鉴定的新方法,筛选出一系列具有特异性的探针。所建立的新的检测方法,相较于普通PCR,其检测灵敏度提高,省去序列分析鉴定步骤,且具有结果稳定可靠、高通量和检测时间短等优点。因而,在植原体病原菌的诊断、检测、鉴定和系统分类及病害生态调查中会具有较大的应用潜力。
应用管芯片检测技术,对疑似植原体病害的诊断结果显示河南濮阳的红花槐丛枝的病原应为16SrV组植原体,福建福州的长春花黄化丛枝应为16SrⅠ组植原体;而北京戒台寺牡丹黄化皱叶和内蒙古包头柳树丛枝未出现任何植原体专化的杂交信号。同时在本次田间调查和采样过程中也发现一些植原体病害已分布范围广、危害严重,如泡桐丛枝、枣疯病等;而另一些病害,比如四川西昌的樱桃致死黄化、北京怀柔的板栗黄化皱缩、福建泉州的花生和甘薯丛枝、永安的莴苣黄化等。虽然为区域性病害,但危害和造成的经济损失严重,且存在进一步扩展蔓延的风险。
管芯片杂交技术作为一种检测和鉴别植原体的新方法,可应用于我国植原体病害调查和诊断,并为植原体病害更为科学有效的防控提供技术支撑。
[1] 赖 帆, 李 永, 徐启聪. 等. 植原体的最新分类研究动态[J]. 微生物通报, 2008, 35(2): 291-295.
[2] 刘仲健, 罗焕亮, 张景宁. 植原体病理学[M]. 中国林业出版社, 1999.
[3] 任争光, 王 合, 林彩丽, 等. 实时荧光定量PCR(SYBR Green I)检测不同抗枣疯病枣树品种嫁接接穗中的植原体浓度[J].植物病理学报, 2015, 45: 520-529.
[4] Davis RE, Lee I, Dally EL,etal. Cloned nucleic acid hybridization probes in detection and classification of mycoplasmalike organisms (MLOs) [J]. VII International Symposium on Virus Diseases of Ornamental Plants, 1988: 115-122.
[5] Loi N, Ermacora P, Carraro L,etal. Production of monoclonal antibodies against apple proliferation phytoplasma and their use in serological detection[J]. European Journal of Plant Pathology, 2002, 108:81-86.
[6] 朱 澂, 徐丽云, 金开璇,等. 用DAPI荧光显微术检测泡桐丛枝病[J]. Journal of Integrative Plant Biology, 1991,33(7):495-499.
[7] Campas M, Katakis I. DNA biochip arraying, detection and amplification strategies[J]. TrAC Trends in Analytical Chemistry,2004; 23:49-6.
[8] Yip T T, Kwong D L, Ngan R K,etal. Differential transcript expression in nasopharyngeal carcinoma by cDNA microarray analysis[J]. Cancer Research, 2015, 75:3903-3903.
[9] Myles S, Mahanil S, Harriman J,etal. Genetic mapping in grapevine using SNP microarray intensity values[J]. Molecular Breeding 2015, 35:1-12.
[10] Barba M, Hadidi A, Rao G,etal. DNA microarrays: technology, applications and potential applications for the detection of plant viruses and virus-like pathogens[J]. Techniques in Diagnosis of Plant Viruses, 2008:227-247.
[11] 田国忠. 核酸杂交技术在植物类菌质体病害研究中的应用进展[J]. 微生物学通报, 1991(5):295-298.
[12] Hadidi A, Czosnek H, Barba M. DNA microarrays and their potential applications for the detection of plant viruses, viroids, and phytoplasmas[J]. Journal of Plant Pathology, 2004:97-104.
[13] Bertolini E, Torres E, Olmos A,etal. Co-operational PCR coupled with dot blot hybridization for detection and 16SrX grouping of phytoplasmas[J]. Plant Pathology, 2007, 56:677-682.
[14] Nicolaisen M, Bertaccini A. An oligonucleotide microarray-based assay for identification of phytoplasma 16S ribosomal groups[J]. Plant Pathology, 2007, 56:332-336.
[15] Lenz O, Markova J, Sarkisova T,etal. Discriminating 16Sr groups of phytoplasmas by an oligonucleotide microarray targeting 16S-23S spacer region[J]. Bulletin of Insectology, 2011, 64:S31-S32.
[16] Lenz O, Marková J, Sarkisová T,etal. Discrimination of phytoplasmas using an oligonucleotide microarray targeting rps3, rpl22, and rps19 genes[J]. Crop Protection, 2015, 70:47-52.
[17] 李 永, 田国忠, 朴春根, 等. 我国几种植物植原体的快速分子鉴别与鉴定的研究[J]. 植物病理学报, 2005, 35(4):293-299.
[18] Firrao G, Andersen M, Bertaccini A,etal. Candidatus Phytoplasma’, a taxon for the wall-less, non-helical prokaryotes that colonize plant phloem and insects[J]. International Journal of Systematic and Evolutionary Microbiology,2004, 54:1243-1255.
[19] Lin C, Li H, Zhang G,etal. Molecular identification and characterization of a new phytoplasma strain associated with Chinese chestnut yellow crinkle disease in China[J]. Forest Pathology,2011, 41:233-236.
[20] Barros TS, Davis RE, Resende RO,etal. Erigeron witches’-broom phytoplasma in Brazil represents new subgroup VII-B in 16S rRNA gene group VII, the ash yellows phytoplasma group[J]. Plant Disease, 2002, 86:1142-1148.
[21] Schnee C, Schulsse S, Hotzel H,etal. A novel rapid DNA microarray assay enables identification of 37 Mycoplasma species and highlights multiple Mycoplasma infections[J]. PloS One, 2012, 7:e33237.
[22] Nitschke H, Slickers P, Müller E,etal. DNA-ARRAY-BASED TYPING OF STREPTOCOCCUS AGALACTIAE[J]. Journal of Clinical Microbiology, 2014,JCM. 02411-14.
[23] Gawlik D, Slickers P, Engelmann I,etal. DNA-Microarray-based Genotyping of Clostridium difficile[J]. BMC Microbiology, 2015, 15:1.
[24] KHADHAIR A-H, HIRUKI C. The Molecular Genetic Relatedness of Willow Witches’-Broom Phytoplasma to the Clover Proliferation Group[J]. Proceedings of the Japan Academy, Series B 1995, 71:145-147.
[25] Zhang L, Li Z, Du C,etal. Detection and identification of group 16SrVI phytoplasma in willows in China[J]. Journal of Phytopathology,2012, 160:755-757.
(责任编辑:崔 贝)
Diagnostics and Detection of Different Groups Phytoplasmas in China Using an Oligonucleotide Microarray on the Platform of ArrayTube
WANGSheng-jie,LINCai-li,YANDong-hui,YUShao-shuai,LIYong,WANGLai-faPIAOChun-gen,GUOMin-wei,HUAIWen-xia,TIANGuo-zhong
(Key Laboratory of Forest Protection of State Forestry Administration, Research Institute of Forest Ecology, Environment and Protection,Chinese Academy of Forestry, Beijing 100091, China)
[Objective]To find the optimal specific probe and develop the detection technique using oligonucleotide microarray on the platform of ArrayTube to detect and identify the phytoplasmas associated with plant disease in China. [Method]PCR amplification and microarray hybridization were used to detect 15 symptomatic plants probably infected with phytoplasma and asymptomatic plants as healthy controls collected from different regions in China. [Result] Phytoplasma 16S rDNA were detected in 13 of 15 symptomatic plants but not in all the healthy controls. Thirteen phytoplasmas were classified into 16Sr I, 16Sr II, 16Sr V and 16Sr XIX groups. Among 17 tested probes, the universal probe designated Pp-502 could be used to detect all phytoplasmas associated with plant disease. The specific probe designated Pp I-465 for 16Sr I group could be used to detect four phytoplasma strains of 16Sr I group associated with paulownia witches’-broom, chinaberry witches’-broom, mulberry dwarf and lettuce yellows. The probe Pp II-629 for 16Sr II could be used to detect three phytoplasma strains 16Sr II group associated with peanut witches’-broom, sweet potato witches’-broom and cleome witches’-broom. Three phytoplasma strains of 16Sr V associated with jujube witches’-broom, cherry lethal yellows andBischofiapolycarpawitches broom and chestnut yellows crinkle phytoplasma of 16Sr XIX could also be detected by specific probes, but they showed obvious cross hybridization with other group probes. Compared with PCR amplification, the sensitivity of microarray to detect phytoplasma in plant increased by 1000-fold. Phytoplasmas of 16SrI and 16SrV group respectively were detected in periwinkle with symptoms of phyllody and witches’-broom collected from Fujian province andRobiniahispidawith symptom of witches’-broom collected from Henan province. While no phytoplasma was detected in peony with symptom of yellowing collected from Beijing and willow with symptom of witches’ broom collected from Inner Mongolia Autonomous Region. [Conclusion]The oligonucleotide microarray on the platform of ArrayTube could be used as a method to investigate phytoplasmas in China, and could provide a sound basis for the phytoplasma identification and classification.
Phytoplasma; detection and identification; 16Sr DNA gene; ArrayTube
10.13275/j.cnki.lykxyj.2017.01.014
2016-02-01
“十二五”农村领域国家高技术研究发展科技计划(863)课题(2012AA101501)、林业微生物资源子平台运行与服务项目(NIMR2016-7)。
王圣洁(1989—),男,博士研究生。主要方向:分子植物病理。E-mail:wsjguoyang@126.com
* 致谢:德国Alere公司Regina Heinze博士、孙晓明硕士等提供的技术帮助;河南濮阳林科院谢守江、包头林科所王立清、北京戒台寺等提供病害样品;北京农学院任争光博士提取部分DNA样品
** 共同通讯作者:田国忠,研究员,博士生导师,从事分子植物病理研究。E-mail: tian3691@163.com;严东辉,研究员,硕士生导师,从事树木微生物及寄主-病原分子互作研究。E-mail: yandh@caf.ac.cn
S763.1
A
1001-1498(2017)01-0099-12

