Inhibitory effect of low intensity ultrasound combined with HSV1-TK/GCV gene carried by cationic microbubbles on high-intensity focused ultrasound incompleted ablation of hepatocellular carcinoma cells
, *, , , ,
(1.Department of Radiology, the Second Affiliated Hospital of Chongqing Medical University, Chongqing 400010,China; 2.Institute of Ultrasound Imaging, Chongqing Medical University, Chongqing 400010, China;3.Chongqing Key Laboratory of Ultrasound Medical Engineering, Chongqing 400010, China)
Inhibitory effect of low intensity ultrasound combined with HSV1-TK/GCV gene carried by cationic microbubbles on high-intensity focused ultrasound incompleted ablation of hepatocellular carcinoma cells
XIUYangyang1,ZENGYan1*,ZHAOJiannong1,GUODajing1,WANGZhigang2,LIFaqi3
(1.DepartmentofRadiology,theSecondAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400010,China; 2.InstituteofUltrasoundImaging,ChongqingMedicalUniversity,Chongqing400010,China;3.ChongqingKeyLaboratoryofUltrasoundMedicalEngineering,Chongqing400010,China)
Objective To investigate the inhibitory effect of cationic microbubbles loading herpes simplex virus type Ⅰ thymidine kinase/ganciclovir (HSV1-TK/GCV) suicide gene combine with low intensity ultrasound on the residual SMCC-7721 cancer cells after HIFU ablation. Methods SMCC-7721 cells were irradiated with HIFU to select the best residual hepatocellular carcinoma cell subline for stable preservation. Cationic liposomes microbubble loading TK gene were transfected by low intensity ultrasonic radiating. And then they were divided into control group (residual cancer), residual cancer+ultrasound (US)+TK/GCV group, residual cancer+microbubble+TK/GCV group and residual cancer+microbubbles+US+TK/GCV group. Transfection and expression were detected by Western Blot. Flow cytometry was used to observe and detect the gene transfection efficiency. The suitable concentration of GCV was selected, and the survival rate of cells in the same condition of each group was detected. Flow cytometry (FCM) experiments were used to detect cell viability. Results When the HIFU power was 5 W, the frequency was 10.20 MHz, irradiatied last for 40 s, the stable model of the residual cancer was obtained. The optimal concentration of GCV was 100 μg/ml. In the same conditions, the cell survival rate of residual cancer+microbubble+US+TK/GCV group was the lowest ([43.16±3.18]%), and the expression of TK protein was the hightest. The difference was statistically significant (allP<0.05). Conclusion HSV1-TK suicide gene carried by cationic microbubbles have significant inhibitory effect in residual cancer cells after HIFU ablation.
Ultrasonics; Microbubbles; Gene therapy; Carcinoma, hepatocellular
原发性肝癌是临床最常见的恶性肿瘤之一[1]。目前,手术切除癌灶和肝移植是治疗早期肝癌较为有效的方法,但多数患者就诊时已属中晚期,因此开辟新的治疗途径是当前肝癌研究的热点。HIFU可将低能超声准确聚焦于肿瘤靶区产生瞬时高温、空化效应,从而杀灭焦域内的癌细胞。HIFU疗效确切,但存在因消融不完全而术后易复发等问题[2]。探索新的辅助疗法是近年来的研究方向。单纯疱疹病毒Ⅰ型胸苷激酶/更昔洛韦(HSV1-TK/GCV)自杀基因对杀灭癌细胞具有良好效果[3]。本研究旨在探讨载HSV1-TK/GCV自杀基因阳离子微泡联合低强度超声对HIFU不完全消融后残余肝癌SMCC-7721细胞的抑制作用。
1 材料与方法
1.1材料与仪器 主要实验材料及试剂:肝癌SMCC-7721细胞株(重庆医科大学超声影像学研究所赠送),全氟丙烷,pIRES2-EGFP-TK质粒(本实验室构建并保存),二棕桐酞磷脂酞胆碱(dipalmitoyl phosphatidylcholine, DPPC;Avanti公司),碘化丙啶(Simga公司),二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(double solid phase epitaxy- polyethylene glycol 2000, DSPE-PEG2000;Avanti公司),PBS缓冲液,无内毒素质粒大抽试剂盒(Omega公司),甘油,DH5α感受态大肠杆菌(北京天恩泽生物技术公司),更昔洛韦(南京海辰药业有限公司),RPMI 1640培养液(Gibco公司),TK1单克隆抗体(Abcam 公司),澳洲小胎牛血清(Gibco公司),胰蛋白酶(上海碧云天公司),二甲基亚砜(dimethylsulfoxide, DMSO),3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴[3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide, MTT],Western Blot试剂提取盒(碧云天公司),内参照肌动蛋白(碧云天公司),辣根过氧化物酶(horseradish peroxidase, HRP)标记的羊抗兔IgG抗体(中衫金桥公司)。主要仪器:海扶CZF型超声波治疗仪,NANODROP 2000超微量分光光度计,Nikon A1R共聚焦显微镜,Malvern激光粒径检测仪,EXL800酶标仪,CGZZ超声基因转染仪。
1.2 SMCC-7721细胞培养与处理 应用含一定比例灭活胎牛血清、双抗的RPMI 1640培养液在37℃、含5%的CO2孵箱中常规培养SMCC-7721细胞,48 h更换培养液。待细胞生长至60%~80%时倾净培养液,以PBS漂洗2次、0.25%胰蛋白酶消化至细胞皱缩变圆,加入少量培养液终止消化,经离心后加入适量培养液吹打均匀后放入孵箱稳定传代培养。
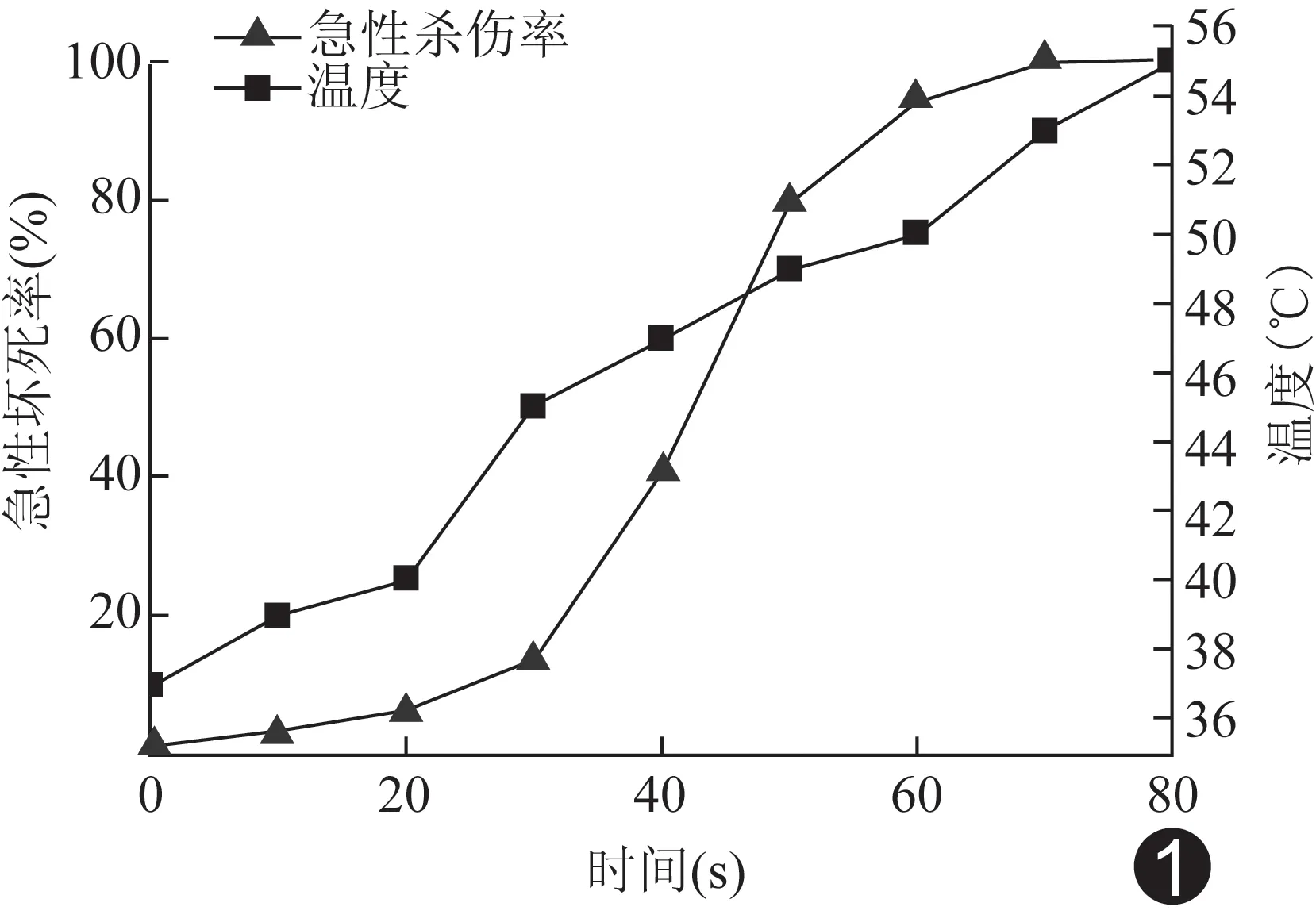
1.3 建立HIFU辐照残癌细胞模型 取对数期生长的细胞经消化、吹打充分后调整浓度为1×106/ml的细胞悬液。每管2 ml分装至无菌聚乙烯试管,低功率HIFU辐照前将试管置于37℃恒温水浴箱预热10 min。试管下缘与探头接触处涂抹少许耦合剂,固定HIFU功率为5 W,频率10.20 Hz,分别辐照0、10、20、30、40、50、60、70、80 s,并采用热电耦温度计实时监测其温度变化,每组重复3次,辐照结束1 h后以台盼蓝染色计数,检测急性杀伤率。依据时间-温度-急性杀伤率曲线,选择合适的残存细胞作为残余癌模型进行细胞生物学研究。
1.4质粒DNA提取及阳离子微泡制取 将质粒(pIRES2-EGFP-TK)在琼脂培养基中振荡、过夜。通过OMEGA试剂盒提取并扩增质粒,以紫外微量分光光度计测其浓度>500 ng/μl、1.8 参照文献[4]的方法,采用薄膜水化联合机械振荡法制备阳离子微泡。检测平均粒径及Zate电位。血球计数板光镜下计数微泡浓度,将制作好的微泡于60Coγ射线灭菌后,-20℃保存、备用。微泡与质粒按4∶1体积比混合于EP管中,常温孵育15 min后低速离心5 min。上层即载基因微泡,下层是游离DNA。重复操作3次。基因结合率=[(加入质粒量-游离质粒量)/加入质粒量]×100%;载基因量=(加入质粒量-游离质粒量)/微泡数。将上层载基因阳离子微泡重悬于适量的PBS缓冲液中,加入碘化丙啶(propidium iodide, PI),染液孵育20 min。低速离心、漂洗2次,以去除未结合的PI荧光,后于荧光及共聚焦显微镜下观察荧光分布情况。通过流式细胞术检测微泡与质粒结合比例,分析其结合率。 1.5不同浓度前药GCV细胞毒性检测 收集HIFU辐照后残存细胞,行常规培养,待细胞生长稳定后,获得细胞悬液,并按照每孔5 000个接种于96孔板。24 h后加入终浓度为0、10、100、1 000、10 000、100 000 μg/ml的前药GCV,每种浓度6复孔。放入孵箱继续培养48 h后加入MTT 50 μl(工作浓度5 mg/ml),4 h后吸净培养基并加入DMSO 150 μl,轻微振荡10 min后于自动酶标仪490 nm波长处测定各孔的吸光值,并评估不同浓度前药GCV对细胞生存率的影响,确定最适GCV浓度。 1.6 超声介导载基因阳离子微泡转染细胞及杀伤效应观察 设置4个实验分组,分别为A组(残余癌)、B组(残余癌+超声+TK/GCV)、C组(残余癌+微泡+TK/GCV)、D组(残余癌+微泡+超声+TK/GCV),其中A组为对照组。将转染前所提取的质粒按1∶4的体积比与微泡混合,于4℃冰箱静置30 min。使其相互吸附后加入适量不完全培养基。调整残余癌细胞2×105/ml接种于24孔板,每组6复孔(n=3),微泡浓度1×108/ml。超声辐照强度0.5 W/cm2,辐照30 s,微泡与TK体积比为4∶1,其余条件各组间均保持一致。通过低频超声击破载基因的阳离子微泡使目的基因定向释放入细胞,转染孵育4~6 h后更换完全培养基继续培养,转染24 h后加入适宜浓度的前药GCV,共孵育48 h后,MTT法检测吸光值,观察细胞抑制率。以流式细胞术分析细胞周期变化。 1.7Western Blot检测各组TK蛋白表达 基因转染72 h后收集各组细胞总蛋白,-20℃暂时保存,行Western Blot检测,经电泳-转膜-封闭等步骤后,加入抗TK1单抗,4℃下摇床摇动,封闭、过夜,Tris缓冲盐溶液冲洗4次、每次冲洗10 min。而后加入二抗(1∶5000,辣根过氧化物酶标记)室温摇动,孵育2 h,再经室温洗膜、显影、曝光等步骤,采用灰度分析软件Quantity One对目的条带和内参照β-肌动蛋白的灰度值进行分析。 2.1 HIFU辐照细胞悬液的时间与温度、急性杀伤率 在HIFU辐照强度一定的条件下,SMCC-7721细胞悬液随着辐照时间延长,温度升高,对细胞的急性杀伤作用增强,其时间-温度-急性杀伤率曲线见图1。辐照时间为40 s时细胞出现明显的生存界限。 图1 肝癌SMCC-7721细胞HIFU辐照时间-温度-急性杀伤率曲线 2.2载基因微泡 制备的微泡粒径较为均一,形态、分散度良好。微泡粒径(542.80±24.00)nm,电荷(40.13±1.50)mV。制备的纳米级阳离子微泡可与带微弱负电荷的质粒相结合(图2)。载基因量为3.6 μg/108微泡,基因结合率为(32.18±4.26)%。 2.3 不同浓度前药GCV的细胞毒性 浓度为10、100、1 000、10 000、100 000 μg/ml时细胞抑制率分别为(3.23±0.13)%、(8.42±1.57)%、(11.80±0.58)%、(43.10±1.38)%、(72.10±1.08)%。前药GCV浓度≥1 000 μg/ml时对癌细胞具有明显毒性作用(图3),当浓度≤100 μg/ml时细胞生存率大于90%对细胞无明显影响。为发挥GCV最大生物学效应同时对细胞生存率无明显影响,择取最适浓度为100 μg/ml。 2.4 低强度超声联合载HSV1-TK/GCV阳离子微泡对残癌细胞的杀伤效应 MTT法检测各组细胞的存活率结果为:A组细胞存活率100%,B组存活率为(93.38±1.32)%,C组细胞存活率(82.03±1.40)%,D组细胞存活率仅为(43.16±3.18)%,且细胞被抑制于S期。4组细胞存活率总体差异有统计学意义(F=245.5,P<0.05),组间两两比较D组细胞存活率显著低于其他3组(P<0.05);C组与A组间差异有统计学意义(P<0.05),B组与A组间差异无统计学意义(P>0.05)。 图2 共聚焦显微镜下的质粒与微泡的连接情况 A.红光显示; B.红白光显示 图3 不同浓度前药GCV孵育48 h后细胞抑制率 (对照组、浓度1、浓度2、浓度3、浓度4、浓度5分别表示浓度为0、10、100、1 000、10 000、100 000 μg/ml) 图4 各组TK蛋白的表达情况 2.5TK蛋白表达 质粒转染72 h后,各组TK蛋白的表达情况见图4。各处理组TK蛋白与β-肌动蛋白灰度值的相对比值分别为:A组0.18±0.12,B组0.38±0.16,C组0.54±0.06,D组0.84±0.10。4组间TK蛋白表达的总体差异有统计学意义(F=5.954,P<0.05),D组TK蛋白表达量显著高于其他3组,差异有统计意义(P<0.05)。C组与A组间差异有统计学意义(P<0.05),B组与A组间无统计学差异(P>0.05)。 HIFU辐照对癌细胞的杀伤作用应得到广泛认同[5-6],但因存在治疗盲区、呼吸运动影响导致消融不完全等问题[7-8]。有研究[5]报道,热处理后肝癌细胞可表现出更强的增殖能力及热耐受能力,可能是促进HIFU术后恶性进展或复发因素之一。HSV1-TK/GCV自杀基因系统通过被转染该基因的细胞表达胸苷激酶,催化胸苷的磷酸化,并将无毒性的丙氧鸟苷转化为具有细胞毒性的三磷酸丙氧鸟苷,从而阻断DNA复制,达到治疗肿瘤的目的[9]。即使肿瘤组织中仅有少量TK基因成功转染,亦可使多数瘤组织消退。基因转染载体种类繁多,生物安全性和转染效率是其能否应用于临床的首要虑因素。阳离子脂质体表面被修饰后带有微弱正电荷,通过静电吸附于带有负电荷的质粒DNA,因无免疫原性、易制备且转染效率较高[10]被认为是一种安全高效的基因载体,但其靶向性欠佳。为解决这一难题,超声靶向微泡破裂(ultrasound targeted microbubble destruction, UTMD)法应运而生。UTMD是利用低强度超声定向破坏携带基因或药物的脂质微泡,使被携带的治疗基因或药物可以定位释放于低强度超声辐照范围内,实现靶区的高效基因转染或释药[11-12],因其靶向性强且安全性高而备受青睐[13]。 本研究成功将纳米级阳离子微泡与带荧光标签的TK基因通过静电吸附作用相结合,以低强度超声定向破碎载基因微泡,达到释放基因的目的,辅助前药GCV作用于HIFU后不完全消融的SMCC-7721细胞,实现治疗作用,基因转染效率较高,对细胞无毒副作用。本研究显示,残余癌+微泡+超声+TK/GCV组TK蛋白的表达明显高于其他各组(P<0.05),且肿瘤残余细胞被大量杀伤,被明显抑制于S期,提示单独超声及微泡处理均可稍提高TK蛋白表达量,而超声与微泡的联合则可进一步增加TK蛋白表达量。且阳离子微泡载HSV1-TK/GCV联合低强度超声较单独超声处理组和单独微泡处理组均有更强的杀伤力,两者存在一定的协同效应。采用低强度超声辐照载HSV1-TK基因纳米级阳离子微泡,定向释放TK基因联合HIFU技术,既可提高基因转染效率,又可通过微泡的空化效应增敏HIFU治疗[14]。此外,整个治疗过程微创,安全性高、可行性强。 本实验初步证实低强度超声联合载HSV1-TK/GCV基因的纳米级阳离子微泡对HIFU不完全消融SMCC-7721细胞后残余癌有良好的杀伤作用。在后续的动物模型实验中,本课题组将在阳离子微泡表面连接特异性抗体,对载基因微泡主动识别肿瘤组织进一步研究。 [1] Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013.CA Cancer J Clin, 2013,63(1):11-30. [2] Leslie TA, Kennedy JE. High intensity focused ultrasound in the treatment of abdominal and gynaecological diseases. Int J Hyperthermia, 2007,23(2):173-182. [3] 杨六成,吴凯,黄宗海,等.KDR启动子驱动的CD/TK双自杀基因联合survivin基因干扰抑制肝癌细胞生长的体内研究.中国普通外科杂志,2015,24(1):57-61. [4] 杨未晓,王翔,杨丹,等.一种载基因阳离子微泡的制备及与SonoVue的对比研究.中国超声医学杂志,2013,29(4):371-374. [5] 张映林,陈蛟,吴涯昆,等.高强度聚焦超声不完全消融对体外培养肝癌细胞的影响.第三军医大学学报,2015,37(3):261-266. [6] 王琨,刘鲁明,孟志强,等.HIFU治疗肝脏恶性肿瘤的临床观察.肿瘤,2008,28(10):885-888. [7] Zhu H, Zhou K, Zhang L, et al. High intensity focused ultrasound (HIFU) therapy for local treatment of heaatocellular carcinoma: Role of partial rib resection. Eur J Radiol, 2009,72(1):160-166. [8] Marquet F, Aubry JF, Pernot M, et al. Optimal transcostal high-intensity focused ultrasound with combined real-time 3D movement tracking and correction. Phy Med Biol, 2011,56(22):7061-7080. [9] Matuskova M, Hlubinova K, Pastorakova A, et al. HSV-TK expressing mesenchymal stem cells exert bystander effect off human glioblastoma cells. Cancer Lett, 2010,290(1):58-67. [10] Yang SY, Zheng Y, Chen JY, et al. Comprehensive study of cationic liposomes composed of DC-Chol and cholesterol with different mole ratios for gene transfection. Colloids Surf B Biointerfaces, 2013,101:6-13. [11] 杨丹,陈礼波,张莉,等.诊断超声介导微泡提高肝纤维化通透性及促进基因传递.中国医学影像技术,2016,32(6):824-828. [12] 杨世艳,何兵,李明星. 载药超声微泡研究进展.中国中西医结合影像学杂志,2015,13(1):92-95. [13] 沈宇宙,刘俐.超声微泡造影剂介导基因转染的研究进展.中国介入影像与治疗学,2016,13(6):382-386. [14] 姚元志,王志刚,杨珂,等.对比观察脂质纳泡与微泡在高强度聚焦超声消融兔肝中的增效作用.中国介入影像与治疗学,2015,12(8):493-498. 重庆市卫生局重点项目(20131021)。 修阳阳(1990—),女,河南平顶山人,在读硕士。研究方向:影像医学与核医学。E-mail: 1083602799@qq.com 曾燕,重庆医科大学附属第二医院放射科,400010。E-mail: 1294583212@qq.com 2016-06-30 2016-08-15 低强度超声联合载HSV1-TK/GCV自杀基因阳离子微泡对高强度聚焦超声不完全消融后残余肝癌细胞的抑制作用 修阳阳1,曾 燕1*,赵建农1,郭大静1,王志刚2,李发琪3 (1.重庆医科大学附属第二医院放射科,重庆 400010;2.重庆医科大学超声分子影像学研究所,重庆 400010;3.超声医学工程重庆市市级重点实验室,重庆 400010) 超声学;微泡;基因治疗;癌,肝细胞 R735; R445.1 A 1672-8475(2017)01-0045-05 目的 探讨载单纯疱疹病毒Ⅰ型胸苷激酶/更昔洛韦(HSV1-TK/GCV)自杀基因的阳离子微泡联合低强度超声对高强度聚焦超声(HIFU)辐照后残留肝癌SMCC-7721细胞的抑制作用。方法 以低功率HIFU辐照肝癌SMCC-7721细胞,选取最佳残存细胞亚系并稳定培养。通过低强度超声辐照载TK基因的阳离子微泡转染细胞。分为对照组(残余癌)、残余癌+超声+TK/GCV组、残余癌+微泡+TK/GCV组及残余癌+微泡+超声+TK/GCV组。以Western Blot法检测TK基因是否成功转入并稳定表达。采用流式细胞仪观察并检测基因转染效率。筛选适宜前药GCV浓度,并检测各组别相同条件下细胞存活率。以流式细胞仪检测细胞周期及凋亡率。结果 HIFU功率为5 W,频率为10.20 MHz,持续辐照40 s,可获得残癌稳定模型。前药GCV的最适浓度为100 μg/ml。相同条件下残余癌+微泡+超声+TK/GCV组癌细胞存活率最低(P<0.05),仅为(43.16±3.18)%,且TK蛋白的表达明显高于其他各组(P均<0.05)。结论 低强度超声联合载HSV1-TK/GCV自杀基因阳离子微泡对高强度聚焦超声不完全消融肝癌细胞有明显抑制作用。 10.13929/j.1672-8475.201606030
2 结果

3 讨论
- 中国介入影像与治疗学的其它文章
- Measurement of thymus in normal fetuses using two- and three-dimensional ultrasound
- Ultrasound in diagnosis of hydatidiform mole coexisting with live fetuses
- Conservative treatment of graft infection after endovascular repair of aortoiliac aneurysm
- Efficacy of uterine artery chemoembolization in treatment of cesarean scar pregnancy
- Ultrasonography in diagnosis of right hand deficiency and right upper limb most deficiency in fetuses: Two cases report 超声诊断胎儿右手缺如及右上肢大部分缺如2例
- Short-term and long-term efficacy of HIFU ablation for diffuse and focal adenomyosis