胰腺导管内乳头状肿瘤37例诊治分析
罗振国 杨萍 何晓璞 周逸婵 朱国琴 孙为豪 邵耘
胰腺导管内乳头状肿瘤37例诊治分析
罗振国 杨萍 何晓璞 周逸婵 朱国琴 孙为豪 邵耘
目的 分析胰腺导管内乳头状黏液瘤(IPMN)的临床及病理特征,提高其临床诊治水平。 方法 回顾性分析南京医科大学第一附属医院2010年8月至2015年9月收治的37例IPMN病人的临床资料,分析其临床病理特征。 结果 37例IPMN病人中,男24例,女13例,平均年龄(64.13±11.62)岁;最常见的临床表现是上腹部疼痛,共22例(59.5%);其中主胰管型16例(43.2%),分支胰管型13例(35.1%),混合型8例(21.6%);胰腺磁共振/磁共振胆胰管造影(MR/MRCP)的诊断符合率最高,为68.7%(11/16),计算机断层扫描(CT)和超声内镜(EUS)的诊断符合率均为50.0%(15/30,2/4);病理诊断轻度不典型增生9例(24.3%),中度不典型增生20例(54.1%),重度不典型增生6例(16.2%),浸润癌2例(5.4%)。不同恶性程度IPMN病人血清糖类抗原19-9(CA19-9)水平差异有统计学意义(P=0.019)。所有病人均接受手术治疗,术后中位随访时间33月(3~72月),死亡2例,失访13例,5年生存率达94.6%。 结论 IPMN在老年人多见,主要表现为非特异性消化道症状,影像学检查阳性率有待提高,手术治疗有效,预后良好。
胰腺; 导管内乳头状黏液瘤; 诊断; 治疗
随着对胰腺囊性肿瘤(PCNs)认识的加深及影像学技术的进步,PCNs越来越引起人们的关注。其中,胰腺导管内乳头状黏液瘤(IPMN)占PCNs 21%~33%,近年来发病率呈上升趋势[1]。IPMN也称为黏液性导管扩张,是具有潜在恶性的导管上皮源性肿瘤,病灶一般>1 cm,由分泌黏液的柱状上皮组成,主要病变为乳头状增生、囊肿形成和不同程度的细胞异型性改变[2]。本研究回顾性分析南京医科大学第一附属医院近5年收治的经手术确诊的IPMN的临床资料,旨在加深对IPMN的认识,提高临床诊治水平。
1 资料及方法
1.1 研究对象 全部病例来自2010年8月至2015年9月在南京医科大学第一附属医院经手术治疗并确诊的IPMN病人共37例,其中男24例,女13例,男女比例1.8∶1,年龄27~82岁,平均(64.13±11.62)岁。>60岁者23例。
1.2 研究内容 回顾性分析所有病例的住院病史、影像学资料及手术病理资料。影像学检查包括以下3项中至少1项:上腹部CT(平扫+增强),磁共振(MR)或磁共振胆胰管造影(MRCP),经内镜逆行性胰胆管造影术(ERCP)。其中,CT检查30例(81%),MR或MRCP检查16例(43%),ERCP检查4例(11%)。术前实验室检查包括白细胞(WBC)、血红蛋白(Hb)、血小板(Plt)、中性粒细胞与淋巴细胞比值(NLR)、血型(BG)、甲胎蛋白(AFP)、癌胚抗原(CEA)、糖类抗原19-9(CA19-9)。所有病人均行手术治疗。术后病理由2位病理专家审阅确认,并按照WHO分级标准分型。
1.3 随访 出院后采用电话随访3~72月。生存时间定义为从手术后到病人死亡或研究结束的时间。随访起始事件为开始手术治疗,终点事件为病人因该病死亡。中位随访时间为33月,共随访37例,其中失访13例,随访率为64.9%。
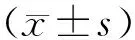
2 结果
2.1 IPMN解剖学分布 37例病人中胰头23例(62.2%),胰头-体3例(8.1%),胰体8例(21.6%),胰体-尾2例(5.4%),胰尾1例(2.7%);主胰管型16例(43.2%),分支胰管型13例(35.1%),混合型8例(21.6%)。
2.2 临床症状及病史 37例病人中,最常见的临床症状为上腹部疼痛,共22例(59.5%),其次为体质量减轻9例(24.3%),黄疸、腰背痛4例(10.8%),无明显症状者12例(32.4%),为体检或其他原因行腹部CT检查偶然发现。
合并高血压占35.1%(13/37),合并糖尿病的占13.5%(5/37),胆囊切除术占10.8%(4/37),慢性阻塞性肺疾病及前列腺增生各占5.4%(2/37)。有急性胰腺炎病史者占21.6%(8/37),有胃癌家族史和糖尿病家族史者各2例(5.4%),有吸烟史9例(24.3%),饮酒史4例(10.8%)。
2.3 实验室检查 WBC<4×109/L者6例(16.2%),Hb<120 g/L者8例(21.6%),Plt<125×109/L 者4例(10.8%),NLR>2.07 者20例(54.5%),非O型血病人11例(29.7%),CEA>4.7 ng/ml者4例(10.8%),CA19-9>37 U/ml 者7例(18.9%)。
2.4 影像学检查 所有病人至少做过1项影像学检查,与病理确诊的IPMN比较,CT诊断符合率为50.0%(15/30),MRI或MRCP诊断符合率为68.7%(11/16),EUS诊断符合率为50.0%(2/4)。见表1。
2.5 手术及病理 所有病人均经手术治疗,病理明确诊断,其中伴轻度不典型增生9例(24.3%),中度不典型增生20例(54.1%),重度不典型增生6例(16.2%),浸润癌2例(5.4%),所有手术标本切缘均阴性,非浸润癌病人均无淋巴结转移。
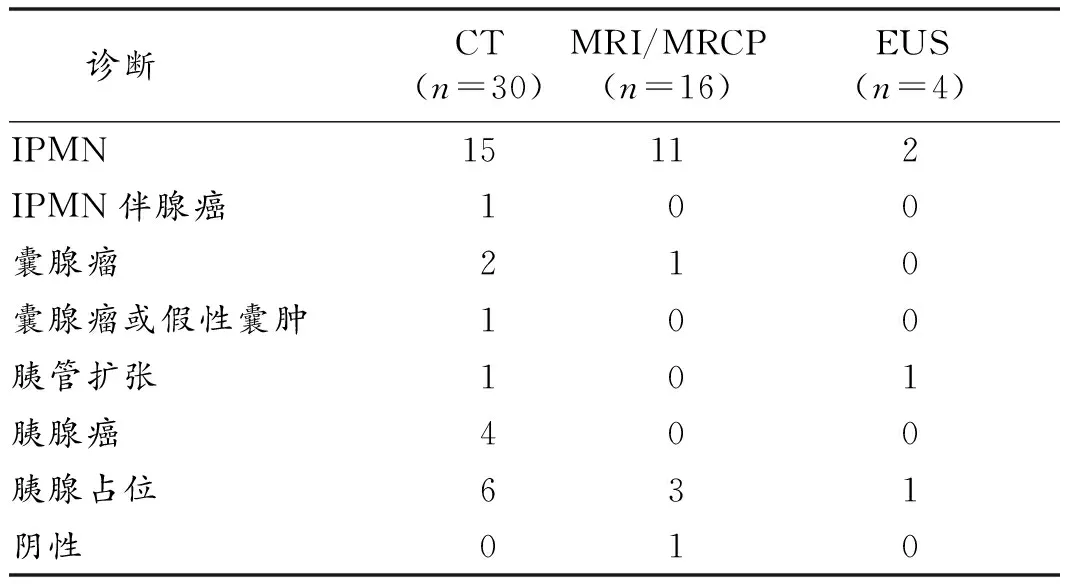
表1 病人影像学诊断符合率比较(例)
2.6 随访 术后随访24例,1例轻度不典型增生因术后2月多脏器功能衰竭死亡,1例浸润癌在术后33月因肿瘤全身转移死亡,余病人无转移或复发。所有病人1年生存率为97.3%,3年生存率为94.6%,5年生存率为94.6%。见图1。

图1 IPMN生存曲线图
3 讨论
IPMN由Ohashi K在1982年首次报道,此后,由于诊断水平的提高及影像学技术的进步,IPMN的检出率逐渐增高[3]。但许多IPMN病灶较小且无症状,故目前IPMN的准确发病率尚未知晓。本研究显示,IPMN的高发年龄在50~70岁,且以男性高发,与日韩等亚洲国家报道一致[4],而欧美等地女性发病率高[5],提示亚洲和欧美地区IPMN的发病率可能存在性别差异。
IPMN病人主要表现为上腹部不适、恶心、呕吐、腹痛、背痛、厌食、体质量减轻等非特异性症状,部分病人可因黏液堵塞主胰管,症状类似胰腺炎,甚至可导致胰腺内外分泌功能不全及消化不良[6]。本研究中有8例病人既往有急性胰腺炎病史,超过一半病人因非特异性上腹痛就诊,与既往报道结果相符,故对于有急性胰腺炎病史,出现不明原因上腹痛的老年病人,需考虑IPMN可能。
本组资料显示有近1/3病人无明显症状,多因其他疾病行影像学检查偶然发现,提示IPMN的诊断需结合临床表现、影像学检查和手术病理等综合判断。建议疑似病人先行CT或MRCP检查,仍无法确定时可进行EUS检查。本研究结果显示,影像学诊断阳性率为50%~68.7%,与其他报道类似[7],影像学诊断的敏感性尚待提高。
IPMN起源于胰腺导管干细胞,遵循由非浸润性肿瘤到浸润性癌的连续变化过程,因此尽早治疗高危病人对于疾病的预后至关重要[8]。IPMN病理上表现为不同程度的胰管扩张,以胰头部多见,胰尾部罕见,本组资料显示,37例病人中62.2%位于胰头。临床上将IPMN分为主胰管型、分支胰管型及混合型。Tanaka等[8]报道主胰管型及混合胰管型IPMN进展成原位癌或浸润癌的风险高,而多数分支胰管型IPMN进展为恶性肿瘤的过程缓慢。本研究发现的2例浸润癌分别为主胰管型及混合型,因样本量较小无法进一步分析浸润癌的临床特点。既往报道老年、女性、CA19-9升高、肿瘤直径≥3 cm、主胰管型或混合胰管型为肿瘤恶性程度的预测因素[9-10],本研究由于样本量限制,不同病理类型病人的临床资料比较差异无统计学意义。虽然不同程度IPMN组间CA19-9表达水平不同(P=0.019),但CA19-9水平与IPMN恶性程度无相关关系,考虑与样本量小有关;Fritz等[11]发现CEA与恶性程度无关,本研究发现,CEA升高的4例病人全部为中度不典型增生。
近年有学者发现血型和胰腺癌相关,非O型血病人罹患胰腺肿瘤风险高于O型血病人[12],本组资料也发现2例浸润癌病人均为非O型血。另外炎症在肿瘤的发生发展过程中可能起着重要作用[13],NLR被认为是系统炎症的指标,与肿瘤的预后密切相关[14]。Kota等[15]发现在IPMN病人中,NLR>2.074为浸润癌的独立危险因素。本组资料中的2例浸润癌病人NLR均>2.074。由于样本量的限制,本研究未发现血型及NLR与IPMN的相关性。
手术是治疗IPMN的重要手段,包括胰腺切除术、胰十二指肠切除术、节段肿瘤切除术等[16]。需要注意的是,IPMN术后仍有复发可能,本研究中有1例病人出现术后肿瘤多处转移。有报道称对于非浸润性IPMN,剩余胰腺组织仍有≥5%的再发风险[17];而对于浸润性IPMN,复发风险高达25%~50%[18]。因此,对IPMN病人术后需密切随访。
本组资料术后病人随访结果提示不同病理类型病人生存率存在差异(P=0.016),但与病理严重程度无相关关系,考虑与样本量较小有关。IPMN手术后总体预后良好。
[1] Machado NO, Al Qadhi H, Al Wahibi K. Intraductal papillary mucinous neoplasm of pancreas[J]. N Am J Med Sci, 2015,7(5):160-175.
[2] Longnecker DS, Adsay NV, Fernandez-del CC, et al. Histopathological diagnosis of pancreatic intraepithelial neoplasia and intraductal papillary-mucinous neoplasms: interobserver agreement[J]. Pancreas, 2005, 31(4):344-349.
[3] Klibansky DA, Reid-Lombardo KM, Gordon SR, et al. The clinical relevance of the increasing incidence of intraductal papillary mucinous neoplasm[J]. Clin Gastroenterol Hepatol, 2012, 10(5):555-558.
[4] Khalid A, Brugge W. ACG practice guidelines for the diagnosis and management of neoplastic pancreatic cysts[J]. Am J Gastroenterlogy, 2007, 102(10):2339-2349.
[5] Ingkakul T, Warshaw AL, Fernandez-Del Castillo C. Epidemiology of intraductal papillary mucinous neoplasms of the pancreas: sex differences between 3 geographic regions[J]. Pancreas, 2011,40(5):779-780.
[6] Konstantinou F, Syrigos KN, Saif MW. Intraductal papillary mucinous neoplasms of the pancreas (IPMNs): epidemiology, diagnosis and future aspects[J]. JOP, 2013,14(2):141-144.
[7] Kim JH, Eun HW, Kim KW,et al. Intraductal papillary mucinous neoplasms with associated invasive carcinoma of the pancreas: imaging findings and diagnostic performance of MDCT for prediction of prognostic factors[J]. AJR Am J Roentgenol, 2013,201(3):565-572.
[8] Tanaka M, Fernandez-del Castillo C, Adsay V,et al. International consensus guidelines 2012 for the management of IPMN and MCN of the pancreas[J]. Pancreatology, 2012,12(3):183-197.
[9] Salvia R, Partelli S, Crippa S,et al. Intraductal papillary mucinous neoplasms of the pancreas with multifocal involvement of branch ducts[J]. A J Surg, 2009,198(5):709-714.
[10]Kang MJ, Jang JY, Kim SJ,et al. Cyst growth rate predicts malignancy in patients with branch duct intraductal papillary mucinous neoplasms[J]. Clin Gastroenterol Hepatol, 2011,9(1):87-93.
[11]Fritz S, Hackert T, Hinz U,et al. Role of serum carbohydrate antigen 19-9 and carcinoembryonic antigen in distinguishing between benign and invasive intraductal papillary mucinous neoplasm of the pancreas[J]. Br J Surg,2011,98(1):104-110.
[12]Handra-Luca A. Blood group type antigens in pancreatic intraductal papillary mucinous neoplasms[J]. Hepatobiliary Pancreat Dis Int, 2014,13(1):74-80.
[13]聂超,刘嘉,孙磊,等. 炎症在前列腺癌发生发展中的作用[J]. 实用老年医学,2015,29(4): 337-339.
[14]Mantovani A, Allavena P, Sica A,et al. Cancer-related inflammation[J]. Nature, 2008,454(7203): 436-444.
[15]Arima K, Okabe H, Hashimoto D,et al. The neutrophil-to-lymphocyte ratio predicts malignant potential in intraductal papillary mucinous neoplasms[J]. J Gastrointest Surg, 2015,19(12):2171-2177.
[16]Sohn TA, Yeo CJ, Cameron JL,et al. Intraductal papillary mucinous neoplasms of the pancreas: an updated experience[J]. Ann Surg, 2004,239(6):788-797.
[17]Kang MJ, Jang JY, Lee KB,et al. Long-term prospective cohort study of patients undergoing pancreatectomy for intraductal papillary mucinous neoplasm of the pancreas: implications for postoperative surveillance[J]. Ann Surg, 2014,260(2):356-363.
[18]Niedergethmann M, Grutzmann R, Hildenbrand R,et al. Outcome of invasive and noninvasive intraductal papillary-mucinous neoplasms of the pancreas (IPMN): a 10-year experience[J]. World J Surg, 2008,32(10):2253-2260.
Clinical analysis of 37 cases with intraductal papillary mucinous neoplasm of pancreas
LUOZhen-guo,YANGPing,HEXiao-pu,ZHOUYi-chan,ZHUGuo-qin,SUNWei-hao,SHAOYun.
DepartmentofGeriatricGastroenterology,theFirstAffiliatedHospitalofNanjingMedicalUniversity,Nanjing210029,China
Objective To analyze the clinical and pathological features of intraductal papillary mucinous neoplasm of pancreas (IPMNs), so as to improve the effect of clinical diagnosis and treatment. Methods Clinicopathological data of 37 cases with IPMN were collected in the First Affiliated Hospital of Nanjing Medical University from August 2010 to September 2015. Results Thirty-seven cases of IPMN included 24 males and 13 females, with an average age of 64.13±11.62 years old. The most common symptom was abdominal pain, with a total of 22 cases (59.5%). The main clinic type was main duct type(16 cases,43.2%), followed by branch duct type(13 cases,35.1%), and mixed duct type(8 cases,21.6%). The sensitivity for the detection of IPMN was 68.7% by magnetic resonance/magnetic resonance cholangiopancreatography (MR/MRCP), 50.0% by computed tomography(CT), and 50.0% by endoscopic ultrasonography(EUS). Pathological detection showed 9 cases of mild dysplasia, 20 cases of moderate dysplasia, 6 cases of severe dysplasia and 2 cases of invasive carcinomas. The serum level of CA19-9 in cases with different pathological types was significantly different (P=0.019). During an median of 33 months of follow-up period (3-72 months), 2 cases died and 13 cases were lost. The survival rate of five years was 94.6%. Conclusions IPMN is more common in the elderly, and is characterized by non-specific gastrointestinal symptoms. The sensitivity for the detection of IPMN by image needs to be raised. The prognosis of IPMN after the surgery is good.
pancreas; intraductal papillary mucinous neoplasm; diagnosis; therapy
江苏省干部保健局课题资助(2013年NO.51)
210029江苏省南京市,南京医科大学第一附属医院老年消化科
邵耘,Email:yun77166@163.com
R 736.7
A
10.3969/j.issn.1003-9198.2017.01.008
2016-01-27)

