面筋食品中微生物群落分析及优势菌分离鉴定
侯爱香,刘静,李珂,李宗军,王佐,吴根梁
(湖南农业大学食品科学技术学院 湖南 长沙410128)
面筋食品中微生物群落分析及优势菌分离鉴定
侯爱香,刘静,李珂,李宗军*,王佐,吴根梁
(湖南农业大学食品科学技术学院 湖南 长沙410128)
为探明面筋食品腐败变质的主要污染途径和微生物群落,从生产线、大型超市和零售小卖部多地取样,用平板计数法检测菌落总数、霉菌酵母数、耐热菌和大肠菌群数,用划线法和点接法将优势菌分离,通过形态观察和理化试验,结合16S rDNA序列和18S rDNA的ITS区域序列进行优势菌鉴定。结果显示:小卖部样品的细菌总数达8×104CFU/g,酵母霉菌数达1.20×103CFU/g,都大大超过地方标准上限的数倍,其他样品的微生物数量均在地方标准之内,说明挤压熟化工艺有较好的杀菌效果,后期生产销售是造成污染的主要途径;分离优势菌得 2类细菌 12株,3类霉菌 8株;2类细菌的代表菌为粪嗜冷杆菌(Psychrobacter faecalis)、黄褐假单胞菌(Pseudomonas fulva),3类霉菌的代表菌为溜曲霉(Asperqillus tamarii)、灰黄青霉(penicilium griseofulvum)和黑曲霉(Asperqillus niger)。
面筋食品;细菌;霉菌;微生物群落
面筋食品是以小麦粉为主要原料,辅以食盐、食糖、水等混合而成的松散面团,经专用食品机械挤压熟化、成型、调味、包装后制成的一种即食食品。因早期的产品多为条状,所以俗称辣条;也因起源于湖南平江县,所以,又称“湘式面筋”[1]。目前,市面上有条状、掌状、方块状、领结状和螺旋状的面筋食品。面筋食品香味浓郁,滋味丰满,口感劲道,食用方便,很受青少年欢迎,并已销售到欧美国家,产值每年以 10% 的速率增长,发展前景十分广阔。据统计,国内生产这类产品的生产企业达数千家,年消化面粉320万t,食用油180万t,辣椒24万t,安排就业人员20多万人次,该行业总体规模已达千亿。尽管如此,但仍因部分企业生产环境差、技术投入少、管理滞后等原因使得面筋食品的质量参差不齐,难以形成品牌效应,甚至导致面筋食品被误认为是 “垃圾食品”[2]。据国家食药监总局2015年发布的“辣条”食用安全提示披露,面筋食品除了食品添加剂超标外,菌落总数超标也是存在的突出问题[3]。面筋食品菌落总数超标一般由生产工艺不规范和生产环境不达标等因素引起。条状面筋产品是湘式面筋起源的代表产品(俗名“辣条”)。本研究中以通过了 GMP认证的湖南平江县某加工厂生产的面筋食品为样品,对各样品的微生物群落进行检测分析,并对产品的优势微生物进行分离鉴定,旨在为面筋食品的标准化生产加工提供指导,也为产品的防霉防腐提供参考依据。
1 材料与方法
1.1 材料
采用随机抽样方式[4],参照 DBS43002—2012进行取样。在湖南平江县某加工厂生产线中取样品A1(通过高温挤压熟化后拉条切条的产品),A2(传送运输到滚揉槽调味后的产品)和A3(滚揉调味后已手工装袋封口的产品,即包装成品),在大型超市取样品A4(在5个大型超市购买的条状面筋食品的混合样),在小卖部取样品A5(5所小学门口小卖部条状面筋食品的混合样)。
平板计数琼脂(plate count agar,PCA)培养基参照GB/T4789.2—2010 配制;月桂基硫酸盐胰蛋白胨(lauryl sulfate tryptose,LST)肉汤、煌绿乳糖胆盐(brilliant green lactose bile,BGLB)肉汤、VRBA琼脂平板均参照GB4789.3—2010 配制;孟加拉红培养基参照 GB4789.15—2010 配制。察氏培养基[5]中含硝酸钠3.0 g/L,磷酸氢二钾1.0 g/L,氯化钾0.5 g/L,硫酸镁0.5 g/L,硫酸亚铁0.01 g/L,蔗糖20.0 g/L。将所有培养基于121 ℃ 灭菌20 min。
1.2 主要仪器设备和试剂
主要仪器设备:电热恒温水浴锅HH–8(上海浦东物理光学仪器厂);分析天平TP–213(北京赛多利斯仪器系统有限公司);光学显微镜 CX系列(日本Olympus);电热鼓风干燥箱 101–2AB(天津市泰斯特仪器有限公司);高压蒸气灭菌锅 SP500(日本YAMATO);超净工作台SW–CJ–2D(苏州净化设备有限公司);恒温生化培养箱SPX–250BS–Ⅱ和霉菌培养箱MJ– 250BS–Ⅱ(上海新苗医疗器械制造有限公司);穗凌冰箱 LG4–882M2F(广东穗凌电器有限公司); pH计 Testo205(Testo AG);PCRMJMini PTC–1148(BIO– RAD);Imaging System Gel Logic 212(Kodak);台式冷冻离心机TGL20(长沙英泰仪器有限公司);稳压稳流电泳仪 DYY–Ⅲ–4(北京市六一仪器厂)。
主要试剂:药品和试剂均为分析纯。类胡萝卜素、精氨酸双水解酶、明胶、淀粉、葡萄糖、海藻糖、间–肌醇、Β–苯丙氨酸、L–脯氨酸、脓青素等细菌生理生化鉴定试剂盒购于广东环凯微生物科技有限公司。细菌引物和真菌引物购于北京鼎国昌盛生物技术有限责任公司。细菌引物[6]: F16S–27 (AGAGTTTGATCCTGGCTCAG),R16S–1492(CGG TTACCTTGTTACGACTTC)。真菌引物[7]:ITS1(TC CGTAGGTGAACCTGCGG),ITS4(TCCTCCGCTTA TTGATATGC)。细菌直接PCR试剂盒、真菌DNA提取试剂盒、PCR扩增试剂盒、PCR回收试剂盒等均购于北京鼎国昌盛生物技术有限责任公司。
1.3 方法
1.3.1 各样品微生物群落的测定
菌落总数、大肠菌群数分别按 GB/T4789.2—2010、GB4789.3— 2010进行测定;霉菌、酵母菌计数按GB4789.15— 2010进行测定;耐热菌计数参照菌落总数的计数方法进行测定,计数前将样品置于80 ℃的水浴锅中加热15 min。
1.3.2 优势菌种的分离
通过平板计数,以相同外观的菌落生长数量判断优势菌群[8],然后观察菌落生长特征,不断点接或划线,直至镜检无其他杂菌。操作流程:培养基配置—样品处理—平板计数— 点接法[9]或划线法分离— 纯菌落—斜面试管保存 。
1.3.3 优势菌种的鉴定
采用平板培养特征、个体形态特征、生理生化反应和分子生物学的方法进行优势菌鉴定。操作流程:斜面菌种—培养特征观察[10]—显微镜观察—生理生化特征鉴定—总DNA提取[11]—琼脂糖电泳[12]—PCR扩增[13]—琼脂糖电泳—回收PCR产物[14]—送检测序—序列分析—构建系统发育树[15]。具体操作步骤如下:
1) 形态学观察。观察细菌和霉菌在平板和斜面上的培养特征,同时对细菌进行革兰氏染色,用光学显微镜放大100 倍观察;用插片法培养霉菌,用光学显微镜放大40 倍观察[16]。
2) 生理生化特征鉴定。细菌生理生化特征鉴定以《伯杰氏细菌鉴定手册》(第8版)为依据,选取14项特征进行试验。霉菌不做生理、生化特征鉴定试验。
3) 总DNA的提取。细菌不提取总DNA,直接用菌体进行PCR扩增。霉菌总DNA提取步骤如下:挑霉菌至碾钵;在碾钵中加200 μL植物lysis Buffer,研磨至粉状;继续加600 μL植物lysis Buffer,0.8 μL β巯基乙醇,混匀,将碾钵中的菌体转移至离心管,65 ℃水浴40 min,12 000 r/min离心10 min;去上清液,加等体积氯仿抽提,12 000 r/min离心5 min;取上清水相,加 700 μL植物Binding Buffer,上柱静置5 min,之后12 000 r/min离心2 min;取沉淀,用80%的乙醇500 μL清洗 2 次,12 000 r/min离心1 min;室温静置10 min晾干,加40 μL H2O,静置5~10 min;将悬液换置到新的EP管,13 000 r/min离心2 min,得管底沉淀。该沉淀即为基因组DNA。
4) 目的片段的PCR扩增。细菌目的片段扩增反应体系50 μL,其中,冻干PCR 2X MIX为25 μL,引物27F、1492R和模板各1 μL;ddH2O为22 μL。反应条件:94 ℃预变性5 min,94 ℃变性30 s,54℃退火30 s,72 ℃延伸90 s,循环35次,72 ℃延伸10 min。霉菌目的片段扩增反应体系50 μL,其中,冻干PCR 2X MIX为25 μL,引物ITS1、ITS4各1 μL,模板2 μL,ddH2O为21 μL。反应条件为94 ℃预变性5 min,94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸50 s,循环35次,72 ℃延伸10 min。
5) PCR产物回收。在2.0%琼脂糖凝胶电泳胶片上切取目的片断,加入300 μL/(100 mg)回收试剂液A,在60 ℃水浴至胶片完全溶化,加入50 μL回收试剂液B混匀,将溶液置于离心柱中,静置5 min,12 000 r/min离心1 min,弃液体,在沉淀中加入80%乙醇500 μL,12 000 r/min离心1 min,弃液体。重复1次。将沉淀于12 000 r/min离心5 min,甩干余液,晾5~8 min,将离心柱置于新的离心管中,加入30 μL 的ddH2O,静置10 min,13 000 r/min离心3 min,得管底沉淀。将该沉淀置于-18 ℃冰箱冻藏,随后送至北京鼎国昌盛生物技术有限责任公司进行测序。
6) 序列分析。将测得的碱基序列上传至网站(http://www.ncbi.nlm.nih.gov),将序列在 GenBank中进行比对,利用 Lasergene软件构建样品中优势菌的系统发育树。
2 结果与分析
2.1 各样品微生物群落的测定结果
关于面筋食品的国家标准还未制定。湖南厂家采用的是湖南地方标准《湘式挤压糕点》DBS43002— 2012。此标准要求菌落总数(CFU/g)≤1.0×104,大肠菌群数(MPN/(100 g))≤9.0×10,酵母和霉菌数(CFU/g)≤1.5×102。本研究中采用本标准。由表1可见,A1的菌落总数、霉菌和酵母数、耐热菌数、大肠菌群数都很少,说明挤压熟化能起到商业杀菌效果。A2的大肠菌群数和耐热菌数很少,但菌落总数、霉菌酵母数分别为 4.2×102、2.2×10 CFU/g,说明产品在冷却传送过程中已受到了传送带、空气、滚揉槽、调味料或操作人员的污染;A3的大肠菌群数和耐热菌数分别为3 MPN/(100 g)和2.5×10 CFU/g,菌落总数、霉菌酵母数分别为9.5×102、6.8×10 CFU/g,比A1和A2的菌落总数、霉菌酵母数多,说明运送槽、工作人员、空气、包装台面的微生物残留导致微生物数量增加。市售成品A4和A5的各项微生物指标均在地方标准之内,A5的细菌总数、霉菌酵母数超过了地方标准,说明小卖部零售面筋食品存在一定的微生物超标现象,其细菌总数高达地方标准上限的8倍,霉菌酵母数比地方标准上限高10倍以上。对5个样品进行巴士杀菌处理后,用平板计数法测样品的耐热菌数量,在 A1中基本未发现耐热菌,说明挤压熟化工艺对耐热菌的杀菌效果好;在 A2、A3中有少量耐热菌,说明产品暴露于空气中冷却、调味、包装时会受到轻度污染,但耐热菌数量不到菌落总数的3%,不是生产中的主要污染微生物;A4、A5样品中耐热菌的含量都很少,说明贮运销售过程中引起面筋食品腐败变质的主要微生物不是耐热菌。综合分析5个样品的微生物数量,发现面筋食品的优势微生物是细菌和霉菌,挤压熟化工艺的杀菌效果良好,后期运输、调味和销售过程是主要的污染途径。

表1 各样品的菌落总数、霉菌酵母数、大肠菌群数和耐热菌数Table 1 Total aerobic plate count, number of moulds and yeasts, coliforms and the heat-resistance bacteria in gluten foods
2.2 优势菌种的分离结果
选取优势菌菌落进行分离纯化,得到优势细菌12株,霉菌8株。12株优势细菌可以根据斜面培养特征分为2类:一类呈灰白色,有7株,编号为1A,1B,1C,…,1G,称灰白类;一类呈微黄色,有5株,编号为5A,5B,5C,…,5E,称微黄类。以培养2 d后的斜面菌落特征为依据,8株霉菌可分为3类:a类有3株,着生黄绿色孢子,菌株编号为2–1、2–2、2–3;b类有3株,着生黑色孢子,菌株编号为3–1、3–2、3–5; c类有2株,着生青灰色孢子,菌株编号为3–3和3–4。
2.3 优势微生物的鉴定结果与分析
2.3.1 形态学观察结果
观察2类细菌和3类霉菌在平板上的培养特征,同类菌株的菌落大小和培养特征一致,选各类优势菌的代表菌株1D、5D、2–1、3–4、3–5拍照,记录培养特征如图1和图2所示。

图1 细菌菌落形态Fig.1 Colony morphology of bacteria
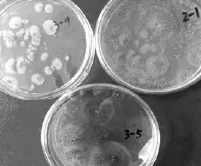
图2 霉菌菌落形态Fig.2 Colony morphology of moulds
由图1、图2可见,1D菌落呈灰白色,表面湿润光泽,呈规则露滴状,边缘整齐;5D菌落呈微黄色,表面湿润光泽,半透明,呈较小的圆点状,边缘整齐。2–1在培养基中出现大量褐黄色孢子和菌丝;3–4在培养基中出现大量中央凸起的灰黄色辐射状菌落,菌落表面呈短绒状,四周灰青色;3–5在培养基中有众多黑色孢子和菌丝。
观察2类细菌和3类霉菌的个体形态,发现同类菌在显微镜下的个体大小和形态特征基本一致;选各类代表菌株 1D、5D、2–1、3–4、3–5拍照,记录其个体形态特征。对细菌进行革兰氏染色,用光学显微镜放大1 000倍观察(图3和图4),发现1D和5D均为革兰氏阴性和无芽孢的小杆菌。对霉菌进行插片培养,用光学显微镜放大 400倍观察(图5~7),2–1菌丝有隔膜和足细胞,分生孢子梗无隔膜,顶端膨大;3–4菌丝有隔膜,分子孢子梗有隔膜,无顶囊,分生孢子呈扫帚状分布;3–5菌丝有隔膜和足细胞,分生孢子梗无横隔膜,顶端膨大。

图3 1D的显微形态(10×100)Fig.3 Micromorphology of 1D
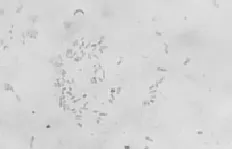
图4 5D 的显微形态(10×100)Fig.4 Micromorphology of 5D

图5 2–1的显微形态(10×40)Fig.5 Micromorphology of 2–1

图6 3–4的显微形态(10×40)Fig.6 Micromorphology of 3–4

图7 3–5的显微形态(10×40)Fig.7 Micromorphology of 3–5
由图1~7可见,2类细菌表面光滑,菌落湿润,且均为革兰氏阴性的小杆菌(但凭此还不能得出 2类细菌具体的种属信息。2类细菌种属信息的确定还需要结合生理、生化反应试验结果和分子生物学鉴定试验结果来判断)。根据《真菌鉴定手册》中对各菌特征的描述,由各类霉菌优势菌的菌落形态和菌丝结构特点可以得出:3株a类霉菌着生黄绿色孢子,菌丝有隔膜和足细胞,可初步判断其为曲霉(选取其中的代表菌株 2–1进行分子生物学鉴定试验);3株b类霉菌着生黑色孢子,菌丝有隔膜和足细胞,可初步判断其为曲霉(选取其中的代表菌株3–5进行分子生物学鉴定试验);2株c类霉菌着生青灰色孢子,菌丝有隔膜,分生孢子呈扫帚状,可初步判断其为青霉(选取其中的代表菌株 3–4进行分子生物学鉴定试验)。
2.3.2 生理生化特征鉴定结果
由表2可见,7 株灰白色类的细菌生理生化反应特征完全一致,结合培养特征、显微形态,对照《伯杰氏系统细菌学手册》第八版各菌的特征描述,该7株细菌的生理生化特征符合恶臭假单胞菌(Pseudomonas putida)的特征。5株微黄色的细菌的生理生化反应特征也完全一致,但与《伯杰氏系统细菌学手册》第八版中记载的恶臭假单胞菌特征比对,这5株菌能在41~42 ℃生化培养箱中生长,能够水解明胶,与恶臭假单胞菌的生理生化特征不符;与记载的产碱假单胞菌对比,这5株菌L–脯氨酸反应为阳性,与产碱假单胞菌的生理生化特征也不符。可见,参考《伯杰氏系统细菌学手册》第八版,不能确定5株微黄色细菌具体的分类地位。分别选这两类细菌的代表菌株1D和5D进行分子生物学鉴定试验。

表2 所分离的12株细菌的生理生化反应结果Table 2 Physiological & biochemical experiment results of 12 strains of bacteria
2.3.3 分子生物学鉴定结果与分析
1) 目的片段的PCR扩增结果与分析。由图 8可见,产物条带清晰,两细菌目的片段的大小均约为1 600 bp。
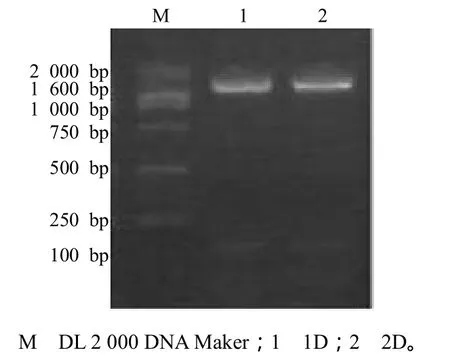
图8 细菌16S rDNA的电泳结果Fig.8 16S rDNA electrophoretogram of bacteria
由图9可见,扩增产物的条带清晰,3株霉菌目的片段的大小约500~750 bp。

图9 霉菌ITS rDNA的电泳结果Fig.9 ITS rDNA electrophoretogram of moulds
2) 送检测序结果与分析。检测基因序列,测出细菌1D碱基序列1 432个,细菌5D碱基序列1 427个。将这两序列在网站http: //www.ncbi.nlm.nih.gov/上进行BLAST比对,发现1D与登录号LK391545.1粪嗜冷杆菌(Psychrobacter faecalis)序列的相似度为99%,细菌5D与登录号JQ229296.1黄褐假单胞菌(Pseudomonas fulva)序列、登录号KM079616.1恶臭假单胞菌(Pseudomonas putida)序列的相似度均为99%。从基因库中调出这3种细菌的基因序列,构建细菌1D和5D的系统发育树如图10所示。

图10 2株细菌的16S rDNA区域序列系统发育树Fig.10 Phylogenic tree of 2 strains of bacteria based on 16S rDNA
检测基因序列,测出霉菌2–1碱基序列601个,霉菌3–4碱基序列526个,霉菌3–5碱基序列603个。将3株霉菌的序列在网站http://www.ncbi.nlm.nih.gov/上进行 BLAST比对,发现 2–1与登录号KP165434.1溜曲霉(Asperqillus tamarii)序列的相似度为 99%,3–4与登录号 KF811439.1灰黄青霉(Penicilium griseofulvum)序列的相似度为99%,3–5与登录号HQ285563.1黑曲霉(Asperqillus niger) 序列的相似度为100%。从基因库中调出这3种霉菌的基因序列,构建其系统发育树如图11所示。
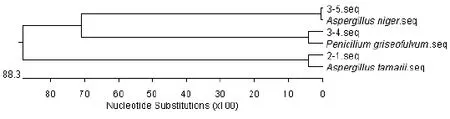
图11 3株霉菌的ITS rDNA区域序列系统发育树Fig.11 Phylogenic tree of 3 strains of moulds based on ITS rDNA
观察图10所示的系统发育树,发现1D为粪嗜冷杆菌(P.faecalis),5D为黄褐假单胞菌(P.fulva)。这两菌都为革兰氏阴性小杆菌。该结果与形态学观察结果一致。菌株1D的生理生化特征与恶臭假单胞菌(P.putida)的相符,而分子生物学鉴定结果为粪嗜冷杆菌(P.faecalis)。根据系统发育树比较两者的亲缘关系,粪嗜冷杆菌(P.faecalis)是恶臭假单胞菌的分支,因此以分子生物学鉴定结果为准,判断1D为粪嗜冷杆菌(P.faecalis)。综合5D 的培养特征、个体形态、生理生化反应与分子生物学鉴定结果,判断5D为黄褐假单胞菌(P.fulva)。
观察图11所示系统发育树,得出霉菌2–1为溜曲霉(A.tamarii),3–4为灰黄青霉(P.griseofulvum),3–5为黑曲霉(A.niger)。3株霉菌的分子生物学鉴定结果均与形态学观察结果一致。
3 结论与讨论
研究发现,从面筋食品生产线上所取样品(A1、A2、A3)和在大型超市购买样品(A4)的各项微生物指标均符合地方标准;在小卖部购买样品(A5)的细菌总数与霉菌酵母数都超过地方标准,说明挤压熟化工艺的杀菌效果良好,后期运输、调味和销售过程是主要的污染途径。依据微生物指标进行评价,大型超市面筋食品的质量优于小卖部的。面筋食品微生物超标现象可以通过规范工艺和改善生产、销售环境卫生状况等方式进行控制和预防。面筋食品的优势细菌为粪嗜冷杆菌(P.faecalis)和黄褐假单胞菌(P.fulva)。这2种细菌均为革兰氏阴性和无芽孢的小杆菌,经过挤压熟化工艺可将其杀灭。优势霉菌为溜曲霉(A.tamarii)、灰黄青霉(P.griseofulvum)和黑曲霉(A.niger)。这3种霉菌主要来自于香辛调味料和空气。对生产环境、调味辅料进行杀菌消毒,即可避免霉菌对产品的污染。
面筋食品生产为中国新兴的地方产业,国外对其的了解和研究都还处于空白阶段。食品添加剂和微生物数量超标是面筋食品存在的两大主要问题[6,17]。本研究中探明了造成面筋食品污染的微生物及其污染来源,开启了面筋食品研究的新领域。若要全面了解面筋食品微生物的构成和多样性,需要对研究方法进行改进,如采用样品中可培养和不可培养微生物的常用检测技术 PCR–DGGE或 PCR–TGGE[18–19]、通过16SV4区引物(515F和806R)鉴定细菌的多样性、通过ITS1–5F/ITS2区引物鉴定真菌的多样性[20–21]等等。
粪嗜冷杆菌(P.faecalis)和黄褐假单胞菌(P.fulva)通常是通过人为感染的[22]。面筋食品生产中一般采用人工分装,因此,要对与产品接触的工作台面、器皿和操作人员等人为感染途径进行严格消毒。大部分企业采用紫外线、臭氧和 75%的乙醇杀菌消毒,其消毒效果良好。进一步改进生产工艺,实现自动化调味、运输和分装,减少人员接触,能从根本上减少污染途径。面筋食品中的优势霉菌溜曲霉(A.tamarii)、灰黄青霉(P.griseofulvum)和黑曲霉(A.niger)存在于香辛调味料和空气中,因此有必要对香辛调味料和空气进行杀菌消毒。常采用紫外线和臭氧技术对空气进行杀菌处理。面筋食品使用的香辛调味料种类繁多,对辣椒、孜然等干燥原料的杀菌可以参考文献[23–27]中的方法。此外,改变生产工艺,如在原工艺的基础上增加成品杀菌工序,或将拌料调味操作工序调至挤压熟化工艺之前,等等,这样既不增加成本,又可杀菌,减少后期污染。
[1]陈赛.千亿麻辣面制食品行业进入发展新阶段[N].中国食品安全报,2014–10–11(A03).
[2]刘少伟,阮赞林.疯狂的“辣条”——有关“辣条”的食品安全隐患[J].质量与标准化,2015(5):35–36.
[3]HE T T,UNG C O L,HU H,et al.Good manufacturing practice(GMP) regulation of herbal medicine in comparative research:China GMP,cGMP,WHO–GMP,PIC/S and EU–GMP[J].European Journal of Integrative Medicine,2015,7(1):55–66.DOI:10.1016/j.eujim.2014.11.007.
[4]PITOLLI F,POCCI C.Neuroelectric source localization by random spatial sampling[J].Journal of Computational and Applied Mathematics,2016,296:237–246.DOI:10.1016/j.cam.2015.09.028.
[5]HOPPENAU Clara E,TRAN Van–Tuan,KUSCH Harald,et al.Verticillium dahliae VdTHI4,involved in thiazole biosynthesis,stress response and DNA repair functions,is required for vascular disease induction in tomato[J].Environmental and Experimental Botany,2014,108:14–22.DOI:10.1016/j.envexpbot.2013.12.015.
[6]KLEVENHUSEN F,MEILE L,KREUZER M,et al.Effects of monolaurin on ruminal methanogens and selected bacterial species from cattle,as determined with the rumen simulation technique[J].Anaerobe,2011,17(5):232–238.DOI:10.1016/j.anaerobe.2011.07.003.
[7]KIM S H,BREUIL C.Common nuclear ribosomal internal transcribed spacer sequences occur in the sibling species Ophiostoma piceae and O.quercus[J].Mycological Research,2001,105(3):331–337.DOI:10.1017/s095375 6201003422.
[8]徐睿烜,侯爱香,王非,等.菜籽粕中优势微生物分析及保藏技术研究[J].食品与机械,2012,28(5):169–172,188.DOI:10.3969/j.issn.1003–5788.2012.05.045.
[9]黄丹莲,曾光明,黄国和,等.微生物接种技术应用于堆肥化中的研究进展[J].微生物学杂志,2005,25(2):60–64.DOI:10.3969/j.issn.1005–7021.2005.02.015.
[10]ZHANG S,LIU P H,YANG X,et al.Isolation and identification by 18S rDNA sequence of high lipid potential microalgal species for fuel production in Hainan Dao[J].Biomass and Bioenergy,2014,66:197–203.DOI:10.1016/j.biombioe.2014.01.015.
[11]DUONG V T,LI Y,NOWAK E,et al.Microalgae isolation and selection for prospective biodiesel production[J].Energies,2012,5(12):1835–1849.DOI:10.3390/en 5061835.
[12]DOAN T T Y,SIVALOGANATHAN B,OBBARD J P.Screening of marine microalgae for biodiesel feedstock[J].Biomass and Bioenergy,2011(7):2534–2544.DOI: 10.1016/j.biombioe.2011.02.021.
[13]刘石泉,胡治远,赵运林.基于DGGE技术的茯砖茶发花过程细菌群变化分析[J].生态学报,2014,34(11):3007–3015.
[14]许爱清.茯砖茶的真菌菌群特性及其整肠功能研究[D].长沙:湖南农业大学,2011.
[15]王琳,邵宗泽.4株苯系物降解菌菌株的筛选鉴定、降解特性及其降解基因研究[J].微生物学报,2006,46(5):753–757.DOI:10.3321/j.issn:0001–6209.2006.05.014.
[16]王蔚瑜.面筋腐败微生物的分离与控制研究[D].广州:华南理工大学,2013.
[17]陈海波.食药监总局发布《“辣条”食用安全消费提示》[N].光明日报,2015–04–07(A06).
[18]LONGA C M,LA PORTA N.Rapid identification of Armillaria species by PCR–DGGE[J].J Microbiol Methods,2014,107:63–65.DOI:10.1016/j.mimet.2014.09.002.
[19]DING X,WU C,HUANG J,et al.Eubacterial and archaeal community characteristics in the man–made pit mud revealed by combined PCR–DGGE and FISH analyses[J].Food Research International,2014,62:1047–1053.DOI:10.1016/j.foodres.2014.05.045.
[20]OROS–SICHLER M,SMALLA K.Semi–Nested PCR approach to amplify large 18S rRNA gene fragments for PCR–DGGE analysis of soil fungal communities[J].Laboratory Protocols in Fungal Biology,2012:289–298.DOI:10.1007/978–1–4614–2356–0_23.
[21]史云峰,禹利君,刘仲华,等.皱边石杉内生真菌ISSR–PCR反应条件的优化[J].湖南农业大学学报(自然科学版),2012,38(4):398–403.
[22]秦娟秀,杨海慧,马硝惟,等.血培养检出嗜冷杆菌属亚种 Psychrobacter sanguinis一例[J].检验医学,2014,29(12):1275–1276.DOI:10.3969/j.issn.1673–8640.2014.12.021.
[23]SONG B S,PARK J N,KIM J H,et al.Quality changes of kongnamul muchim (cooked soybean spouts) stored with gamma–Irradiated red pepper powder[J].Korean Food Preserv,2008,15(1):642–647.
[24]周容,戴亚,李东亮,等.辐照处理对货架期卷烟品质及微生物数量的影响[J].核农学报,2012,26(5):764–769.
[25]白艳红,李全顺,毛多斌,等.电子束辐照对冷却猪肉杀菌保鲜效果的研究[J].辐射研究与辐射工艺学报,2009,27(2):89–94.DOI:10.3969/j.issn.1000–3436.2009.02.006.
[26]杨文鸽,徐大伦,楼乔明,等.电子束辐照对鲜牡蛎杀菌保鲜效果的影响[J].中国食品学报,2015,15(7):80–85.DOI:10.16429/j.1009–7848.2015.07.012.
[27]HAN J,GOMES–FEITOSA C L,CASTELL–Perez E,et al.Quality of packaged romaine lettuce hearts exposed to low–dose electron beam irradiation[J].LWT–Food Science and Technology,2004,37(7):705–715.DOI:10.1016/j.lwt.2004.02.007.
责任编辑:王赛群
英文编辑:王 库
Analysis of microbial community and isolation and identification of their dominant microorganism in gluten food
HOU Aixiang, LIU Jing, LI Ke, LI Zongjun*, WANG Zuo, WU Genliang
(College of Food Science and Technology, Hunan Agricultural University, Changsha 410128, China)
To understand the dominant decaying microorganism, microfora composition and pollution pathways that causing gluten food deterioration, multiple samples of gluten foods were collected from various approaches, such as the factory production lines, large supermarket and small store.The total aerobic bacterial count, number of moulds and yeasts, coliforms and heat–resistance bacteria were tested using plate count method; the dominant microorganism were jointly isolated using plate streak method and point planting method, and their identification were based on the microscopic examination, physiological & biochemical test and the 16S rDNA gene sequence (the ITS sequence of 18S rDNA).The results showed that the total aerobic plate count from small store was 8×104CFU/g, the number of moulds and yeasts reached to 1.20×103CFU/g, which exceeded several times more than the limitation of local standard, while, the microbial populations from other sources of samples were in the scope of local standard.These results indicated that the extrusion technology was good for sterilization, but the later production and sale process was the main pathway leading to gluten food pollution.There 12 strains of bacteria which were subdivided into two categories and 8 strains of moulds which were subdivided into three categories were isolated in the test.The 2 dominant strains of bacteria were Psychrobacter faecalis, Pseudomonas fulva, and the 3 dominant strains of moulds were Asperqillus tamarii, Penicilium griseofulvum and Asperqillus niger.
gluten food; bacteria; mold; identification
TS201.3
:A
:1007-1032(2017)01-0079-08
2016–05–01
2016–09–27
湖南农业大学大学生创新性实验计划项目(2015XCX1517)
侯爱香( 1982—),女,湖南临湘人,博士研究生,讲师,主要从事食品微生物技术和食品文化研究,aixianghou@163.com;*通信作者,李宗军,教授,主要从事食品生物技术研究,hnlizongjun@163.com

