Ipilimumab联合化疗治疗晚期肺鳞癌的单中心安全性观察
上海交通大学附属胸科医院呼吸内科,上海 200030
Ipilimumab联合化疗治疗晚期肺鳞癌的单中心安全性观察
胡章国,周 严,刘显勋,韩宝惠,钟 华
上海交通大学附属胸科医院呼吸内科,上海 200030
背景与目的:以检查点(checkpiont)为靶点的免疫治疗在实体瘤治疗领域有巨大的应用价值,引发了免疫靶向药物的研究热潮。一项研究结果为ipilimumab联合化疗治疗非小细胞肺癌(non-small cell lung cancer,NSCLC)患者的后续研究提供了依据。该研究统计ipilimumab或安慰剂与紫杉醇和卡铂联合作为一线治疗方案治疗Ⅳ期或复发性、组织学为肺鳞状细胞癌的不良事件(adverse events,AEs),评价ipilimumab联合化疗治疗晚期肺鳞癌的安全性。方法:共入组13例经上海交通大学附属胸科医院收治的ⅣA期或ⅣB期ECOG评分标准均小于等于1的肺鳞癌患者。采用随机对照双盲试验,试验组方案为ipilimumab联合紫杉醇与卡铂,对照组方案为安慰剂联合紫杉醇与卡铂。统计治疗过程中发生的AEs。结果:最常见的AEs主要是1级和2级AEs。Ipilimumab单抗组出现的免疫相关AEs(immune-related AEs,irAEs)包括Ⅰ级的腹泻及皮肤瘙痒,Ⅱ级的皮疹及皮肤瘙痒和Ⅲ级的垂体炎。结论:Ipilimumab单抗的不良反应轻微,可耐受,可处理。
肺鳞癌;Ipilimumab;紫杉醇和卡铂;不良事件
肺癌是世界范围内男性的癌症相关死亡因素的最主要原因,并且已经超过乳腺癌成为发达国家女性的癌症相关死亡的最主要原因[1]。中国肺癌患者中组织学类型为鳞癌的比例为35% ~40%[2]。美国国家癌症综合网络(National Comprehensive Cancer Network,NCCN)制定了非小细胞肺癌(non-small cell lung cancer,NSCLC)临床实践指南,对于晚期或转移性疾病的全身治疗,与最佳支持治疗相比,基于铂类的化疗方案可以延长患者的生存期,改善生活质量[3]。
研究发现,肿瘤细胞通过使免疫系统丧失部分能力来逃避肿瘤免疫[4]。免疫检查点(checkpiont)是表达于包括T淋巴免疫细胞表面上的分子,通过抑制或者刺激信号来调节对抗原的免疫反应。肺癌中研究最广泛的两个免疫检查点是细胞毒T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen-4,CTLA-4)和程序性死亡受体1(programmed death 1,PD-1)。两种受体的激活都会引起免疫反应的下调和抑制[5]。以检查点为靶点的免疫治疗在实体瘤治疗领域有巨大的研究前景,引发了免疫靶向药物的研究热潮[6]。
Ipilimumab是针对CTLA-4的全人源化单克隆抗体,其半衰期为15.4 d。CTLA-4是一种T淋巴细胞的负调节器,可抑制其活化。Ipilimumab与CTLA-4结合并阻碍后者与其配体(CD80/ CD86)的相互作用。阻断CTLA-4可增加T细胞的活化和增殖。一项随机、双盲、多中心的Ⅱ期临床试验评估了ipilimumab与紫杉醇和卡铂联合作为一线治疗方案用于ⅢB/Ⅳ期NSCLC的疗效。该项研究结果为ipilimumab联合化疗治疗NSCLC患者的后续研究提供了依据[7]。
本研究旨在分析肺鳞癌患者接受ipilimumab的不良反应情况,为ipilimumab进一步的临床研究提供依据。
1 资料和方法
1.1 入组条件
年龄大于等于18岁的男性和女性,组织学或细胞学确诊为Ⅳ期或复发性NSCLC,组织学鳞状细胞,ECOG小于等于1,符合筛选要求且既往未接受过针对局部晚期或转移性肺癌的化疗。
1.2 排除条件
排除条件为患有潜在的特异性自身免疫性疾病(尤其是胃肠道疾病)者,有运动神经病变或中毒性表皮细胞坏死松解症病史者,以及有脑转移者。
1.3 患者资料
选取2014年12月—2015年7月在上海交通大学附属胸科医院住院的肺癌患者。根据国际肺癌研究学会(International Association for the Study of Lung Cancer, IASLC)第8版分类,ⅣA期6例和ⅣB期7例,病理类型均为肺鳞癌。其中男性11例,女性2例。患者的中位年龄为60岁。将13例患者随机分为两组,分别为试验组(experimental group)和对照组(control group)(表1)。化疗方案均为紫杉醇联合卡铂方案(TC:紫杉醇175 mg/m2+卡铂AUC=6),ipilimumab为10 mg/kg。入选患者均签署知情同意书;体力评价采用美国东部协作肿瘤组(Eastern Cooperative Oncology Group,ECOG)评分标准均小于等于1。
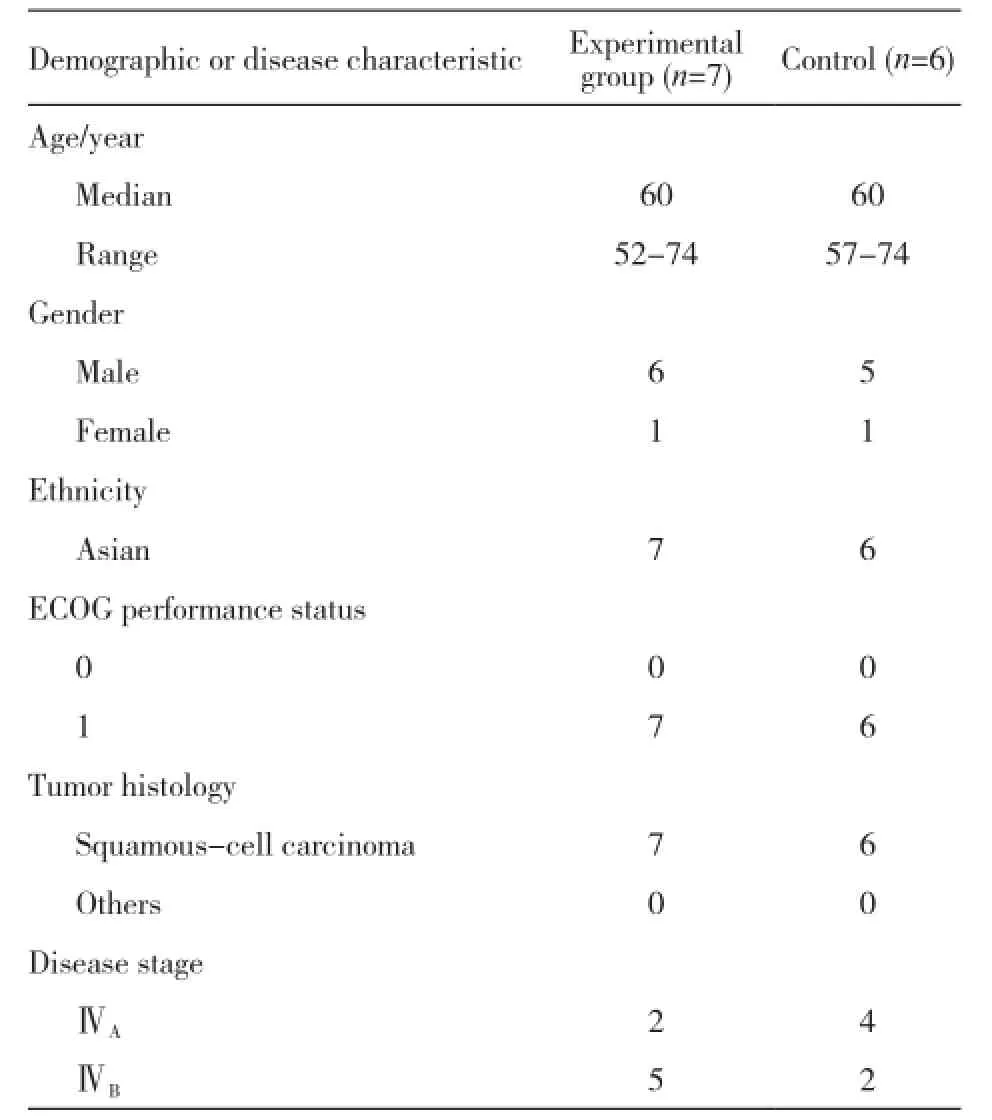
表 1 入组患者一般资料Tab. 1 Characterisitic of patients
1.4 随机对照双盲试验
试验组(ipilimumab单抗组):紫杉醇175 mg/m2和卡铂AUC=6,静脉输液,从随机分组开始,每3周1次,最多6次剂量。Ipilimumab10 mg/kg,静脉输液,从化疗的第3周期开始每3周1次,最高4次剂量。符合条件的受试者从末次ipilimumab诱导剂量后9周开始,每12周1次。最长治疗期间为首次ipilimumab给药后3年。
对照组:紫杉醇175 mg/m2和卡铂AUC=6,静脉输液,从随机分组开始,每3周1次,最多6次剂量。安慰剂从第3周期开始每3周1次,最高4次剂量,安慰剂维持:符合条件的受试者从末次安慰剂诱导剂量后9周开始,每12周1次。最长治疗期间为首次ipilimumab给药后2年。
统计并分析肺鳞癌患者接受ipilimumab的不良事件(adverse events,AEs)情况。
2 结果
2.1 患者的AEs情况
Ipilimumab单抗组和对照组最常见的非血液学AEs(大于等于15%,任何级别)(CTCAE 3.0版)一般与紫杉醇和卡铂有关,包括乏力、脱发、恶心、呕吐及周围感觉神经异常。其他常见的AEs,例如皮疹、瘙痒和腹泻,只出现于ipilimumab单抗组,根据ipilimumab的作用机制预先规定,这些AEs也被定义为免疫相关AEs(immune-related AEs,irAEs),包括:胃肠道irAE、肝脏irAE、内分泌irAE、皮肤irAE、神经irAE和其他。血液学异常也很常见,主要有血小板减少症、白细胞减少症、中性粒细胞减少症和贫血,两组的血液学异常基本相似(表2)。
最常见的AEs主要是1级和2级AEs,ipilimumab单抗组和对照组分别有4例患者和3例患者出现4级AEs,而且都是中性粒细胞减少症。Ipilimumab单抗组有2例患者出现了1级的谷草转氨酶(AST)升高,可能与化疗相关,1例患者出现了1级的谷丙转氨酶(ALT)升高,与化疗有关。
单抗组共7例患者,3例患者应用ipilimumab单抗2次,2例患者应用ipilimumab单抗3次,2例患者应用ipilimumab单抗5次。报告的irAEs包括了1级、2级和3级AEs,并且都出现于ipilimumab单抗组,1级、2级和3级irAEs发生率分别为28.6%和14.3%。1例患者出现了Ⅰ级的腹泻及皮肤瘙痒,应用ipilimumab单抗2次;1例患者出现了Ⅱ级的皮疹及皮肤瘙痒,应用ipilimumab单抗2次;1例患者出现了Ⅲ级的内分泌系统AEs (垂体炎),应用ipilimumab单抗5次,该患者接受ipilimumab盲态药维持治疗1次后,乏力症状较明显,伴视物模糊,实验室检查提示内分泌紊乱。考虑TSH型甲亢、垂体炎,予激素替代治疗:左甲状腺素钠12.5 mg每日口服1次,共服用7天;醋酸可的松25 mg每日早上口服1次,12.5 mg每日中午口服一次以维持治疗,经治疗后症状好转(表3)。

表 2 不良事件Tab. 2 Adverse events
全部病例未发生过敏反应、肺栓塞、呼吸困难。
2.2 死亡及终止试验
有4例患者因疾病进展而死亡,其中3例是ipilimumab单抗组患者,1例是对照组患者。有4例患者由于疾病进展终止了试验,2例是ipilimumab单抗组患者,2例是对照组的。1例ipilimumab单抗组患者因垂体炎终止了该临床试验。

表 3 垂体炎的治疗前后Tab. 3 Before and after the treatment of hypophysitis
3 讨论
肺癌已成为世界癌症相关死亡因素的首因,免疫治疗的出现,为该疾病的治疗带来了曙光[6]。CTLA-4和PD-1是两个最广泛研究的肺癌免疫检查点。CTLA-4抑制了肿瘤特异性效应T细胞的活化,有利于肿瘤细胞的免疫逃逸。CTLA-4阻滞消除了其引起的负性免疫调节作用,但是也可以消除CTLA-4介导的针对自身免疫的保护,导致irAEs[8]。
针对转移性黑色素瘤的研究及Ⅱ期肺癌的研究CA184041结果显示,ipilimumab 10 mg/kg剂量单药治疗安全、有效[7,9-11]。通过对NSCLC受试者和小细胞肺癌受试者使用ipilimumab联合紫杉醇和卡铂进行治疗,也取得了安全可靠的效果[7,12]。
上海交通大学附属胸科医院参与了这项随机、双盲、国际多中心的Ⅲ期试验研究,评估了ipilimumab与紫杉醇和卡铂联合作为一线治疗方案用于Ⅳ期、复发性鳞状细胞癌的安全性与疗效。研究结果显示,最常见的AEs主要是1级和2级,最常见的非血液学和血液学AEs与之前的研究结果相似,试验组和对照组的最常见的非血液学和血液学AEs一般相似,通常与紫杉醇和卡铂有关[7,11]。在这些研究中,大多数irAEs累及皮肤(例如瘙痒和皮疹)和胃肠道(例如腹泻和结肠炎),irAEs在ipilimumab单抗组出现更频繁,主要为是1级和2级AEs。本研究ipilimumab组irAEs中,1例患者累及皮肤(瘙痒和皮疹),1例累及胃肠道(腹泻),1例累及内分泌系统(垂体炎),与ipilimumab单抗的应用次数可能无关。
Araujo等[13]收集了71例ipilimumab诱发垂体炎(ipilimumab-induced hypophysitis,IIH)的病例,记录了这些病例的临床、影像学和实验室特征。IIH在老年和男性患者中更常见,乏力和头痛是最常见和最初的临床表现,并且大多数患者的MRI检查结果提示垂体增大,多数患者需要类固醇激素治疗和激素替代治疗。本研究中发生的垂体炎与之相似。但是垂体功能的恢复是罕见的,仍需要更多的研究来提高筛查和干预治疗的水平以降低IIH相关的死亡率。本研究ipilimumab单抗联合化疗的疗效及生存数据在进一步整理中。
综上所述,本文描述了ipilimumab单抗的AEs情况,与单纯应用紫杉醇和卡铂相比,联合ipilimumab治疗,患者的不良反应轻微,可耐受,可处理。本研究结果与之前的相关研究结果相似[7,11]。正在进行和以后将进行的大规模前瞻性对照临床试验将进一步证实ipilimumab联合化疗治疗晚期肺鳞癌的疗效。
[1] TORRE L A, BRAY F, SIEGEL R L, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108.
[2] 李 芳, 黄 瓅, 胡成平, 等. 1997年和2007年湖南地区908例原发性肺癌临床流行病学及病理特征的比较分析[J]. 中国肺癌杂志, 2010, 13(4): 326-330.
[3] ETTINGER D S, WOOD D E, AKERLEY W, et al. Non-small cell lung cancer, version 6.2015[J]. J Natl Compr Canc Netw, 2015, 13(5): 515-524.
[4] HANAHAN D, WEINBERG R A. Hallmarks of cancer: the next generation[J]. Cell, 2011, 144(5): 646-674.
[5] THOMAS A, JAKOPOVIC M. Immunotherapy for non-small cell lung cancer[J]. Expert Opin Biol Ther, 2014, 14(8): 1061-1064.
[6] CARBONE D P, CANDARA D R, ANTONIA S J, et al. Non-small cell lung cancer: Role of the immune system and potential for immunotherapy[J]. J Thorac Oncol, 2015, 10(7): 974-984.
[7] LYNCH T J, BONDARENKO I, LUFT A, et al. Ipilimumab in combination with paclitaxel and carboplatin first-line treatment in stage ⅢB/Ⅳ non-small cell lung cancer: results from a randomized, double-blind, multicenter phase Ⅱ study[J]. J Clin Oncol, 2012, 30(17): 2046-2054.
[8] DELLA VITTORIA SCARPATI G, FUSCIELLO C, PERRI F, et al. Ipilimumab in the treatment of metastatic melanoma: management of adverse events[J]. Onco Targets Ther, 2014, 7: 203-209.
[9] WEBER J, THOMPSON J A, HAMID O, et al. A randomized, double-blind, placebo-controlled, phase Ⅱ study comparing the tolerability and efficacy of ipilimumab administered with or without prophylactic budesonide in patients with unresectable stage Ⅲ or Ⅳ melanoma[J]. Clin Cancer Res, 2009, 15(17): 5591-5598.
[10] WOLCHOK J D, NEVNS B, LINETTE G, et al. Ipilimumab monotherapy in patients with pretreated advanced melanoma: a randomized, double-blind, multicentre, phase 2, doseranging study[J]. Lancet Oncol, 2010, 11(2): 155-164.
[11] O’DAY S J, MAIO M, CHIARION-SILENI V, et al. Efficacy and safety of ipilimumab monotherapy in patients with previously treated, advanced melanoma: a multicenter, singlearm phase Ⅱ study[J]. Ann Oncol, 2010, 21(8): 1712-1717.
[12] RECK M, BONDARENKO I, LUFT A, et al. Ipilimumab in combination with paclitaxel and carboplatin as first-line therapy in extensive-disease-small-cell lung cancer: results from a randomized, double-blind, multicenter phase 2 trial[J]. Ann Oncol, 2013, 24(1): 75-83.
[13] ARAUJO P B, COELHO M C, ARRUDA M A, et al. Ipilimumab-induced hypophysitis: review of the literature[J]. J Endocrinol Invest, 2015, 38(11): 1159-1166.
The single-center safety observation of ipilimumab combined with chemotherapy in the treatment
of advanced squamous cell carcinomaHU Zhangguo, ZHOU Yan, LIU Xianxun, HAN Baohui,ZHONG Hua
(Department of Pulmonary Disease, Shanghai Chest Hospital, Shanghai Jiao Tong University, Shanghai 200032, China)
ZHONG Hua E-mail: eddiedong8@hotmail.com
Background and purpose:Checkpiont targeted immunotherapy in the field of solid tumor therapy has huge potential, triggering a boom in the study of immune targeted drugs. A study has provided a basis for the follow-up study of ipilimumab combined with chemotherapy in the treatment of non-small cell lung cancer (NSCLC) patients. This study counted the adverse event statistics that ipilimumab or placebo combined with paclitaxel and carboplatin as first-line therapy for the treatment of stage Ⅳ or recurrent squamous cell carcinoma to evaluate the safety of ipilimumab combined with chemotherapy in the treatment of advanced squamous cell carcinoma.Methods:This study selected 13 patients with ECOG scores≤1 and stage ⅣAor ⅣBsquamous cell carcinoma in the Shanghai Chest Hospital, Shanghai Jiao Tong University. Randomized controlled double blind trial was used in this study. The patients of experimental group were treated with ipilimumab combined with paclitaxel and carboplatin, while the patients of control group were treated with the placebo combined with paclitaxel and carboplatin. Adverse events (AEs) were counted in the process of treatment.Results:The most common AEs were the 1/2 grade AEs. Immune-related AEs (irAEs) reported in the ipilimumab group included levelⅠ of diarrhea and pruritus, level Ⅱ of rash and pruritus and level Ⅲ of hypophysitis.Conclusion:The side effects of ipilimumab were mild, tolerable and manageable.
Lung squamous cell carcinoma; Ipilimumab; Paclitaxel and carboplatin; Adverse events
10.19401/j.cnki.1007-3639.2017.01.006
R734.2
A
1007-3639(2017)01-0031-05
2016-07-10
2016-11-15)
钟 华 E-mail: eddiedong8@hotmail.com

