我国部分地区鲜食辣椒及其加工品中辣椒轻斑驳病毒的调查
张 蔚, 张志想, 李世访
(中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193)
我国部分地区鲜食辣椒及其加工品中辣椒轻斑驳病毒的调查
张 蔚, 张志想, 李世访*
(中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193)
本研究利用RT-PCR技术对我国部分地区鲜食辣椒和辣椒加工品中的辣椒轻斑驳病毒Peppermildmottlevirus(PMMoV)进行了调查。其中,鲜食辣椒样品(249份)中PMMoV检出率为75.5%;147份辣椒加工品中有97份检测到PMMoV,且所采集的每一类别的辣椒制品中都有阳性样品。调查结果表明:PMMoV不仅广泛分布于我国辣椒种植区,而且在多种辣椒加工品中的检出率也较高。该研究进一步明确了PMMoV的来源及可能的传播途径,为该病毒的防控提供了理论依据。
辣椒轻斑驳病毒; RT-PCR; 鲜食辣椒; 辣椒加工品
辣椒轻斑驳病毒Peppermildmottlevirus(PMMoV)属于烟草花叶病毒属Tobamovirus,能够侵染茄科植物,可引起辣椒果实褪绿斑驳、畸形,造成产量和品质的下降。该病毒最早在美国发现,现在已在世界范围内广泛存在[1]。PMMoV可以种传和汁液摩擦传毒,在干燥的植物病残体上病毒可以存活25年,介体不易传毒,带毒种子、感病植株和病土是重要的侵染源[2]。值得注意的是,PMMoV可能会危及人类的健康,因为它在人体内的存在可能与发烧、腹痛及瘙痒等临床病症有关[3]。因此,有必要查清PMMoV的来源及进入人体的途径。目前,已经从辣椒酱中检测到了PMMoV[3-4],这暗示PMMoV可能存在于各种辣椒加工品中。为此,本试验对我国部分辣椒主产区的鲜食辣椒及辣椒丝、辣椒粉、酱菜等加工品进行了PMMoV的检测,进一步明确了PMMoV的来源及可能的新的传播途径,为该病毒的有效防控提供理论依据。
1 材料和方法
1.1 材料
鲜食辣椒采自山东、湖南、四川、山西、河南以及贵州的辣椒种植区及集贸市场,部分样品表现变色、斑驳、畸形、或出现褐色坏死条纹。辣椒加工品购自大型超市,包括酱菜类、剁辣椒、精制辣椒、辣椒酱、辣椒粉、辣椒丝、泡菜。
TRIzol试剂购自天根生物技术(北京)有限公司;dNTPs、RNAse抑制剂、2×TaqMix购自宝生物工程(大连)有限公司;M-MLV RTase购自普洛麦格(北京)生物技术有限公司。
引物由北京六合华大基因科技股份有限公司合成;测序由金唯智生物科技有限公司完成。
1.2 方法
1.2.1 总RNA提取
鲜食辣椒总RNA提取采用TRIzol法,详见产品使用说明书;辣椒加工品总RNA提取参考Callahan等[5]和Morgens等[6]有关果实中RNA的提取方法。
1.2.2 RT-PCR、克隆与测序
利用PMMoV的特异性引物PMMoV-CP1/CP2[7]对提取的总RNA进行RT-PCR。反转录体系如下:RNA 1 μL、下游引物(10 μmol/L)1 μL,95℃变性7 min,立即置于冰上冷却5 min;随后加入M-MLV RTase 0.5 μL、5×M-MLV buffer 2.5 μL、dNTPs 0.5 μL、RNase抑制剂(40 U/μL)0.5 μL,补充ddH2O至12.5 μL,37℃孵育60 min。PCR反应体系为25 μL:反转录产物2 μL,上游引物(10 μmol/L)和下游引物(10 μmol/L)各1 μL,2×TaqMix 12.5 μL,ddH2O 8.5 μL。反应条件:94℃变性5 min;94℃变性30 s,52℃退火30 s,72℃延伸35 s,30个循环;72℃延伸10 min。用1.5%琼脂糖凝胶电泳对PCR产物进行检测,切胶回收条带,并进行克隆测序。
2 结果与分析
2.1 鲜食辣椒中PMMoV的检测
本研究利用RT-PCR技术检测鲜食辣椒中的PMMoV,其中阳性样品可扩增出一条大小约576 bp的片段(图1)。鲜食辣椒样品中PMMoV的RT-PCR检测结果表明:249份辣椒样品中有188份呈PMMoV阳性,检出率为75.5%。不同地区的PMMoV的检出率均高于69.1%,但无明显差异(表1)。这说明PMMoV广泛分布于我国辣椒种植区且侵染率较高。
2.2 辣椒加工品中PMMoV的检测
除鲜食辣椒外,本研究还利用RT-PCR技术对辣椒加工品进行了检测,PMMoV阳性样品可以扩增到576 bp大小的目的条带(图2),检测结果表明,辣椒加工品中PMMoV的检出率也较高。147份样品中有97份检测到PMMoV,检出率为66.0%。所采集的每一类别的辣椒制品中均有阳性样品。其中,辣椒粉和辣椒丝中PMMoV的阳性率甚至高于80%。即使经过传统的发酵、腌制等加工过程后,含有辣椒的泡菜和酱菜中PMMoV的检出率仍大于41.7%(表2)。
3 讨论
我国于1994年首次在新疆辣椒上发现PMMoV[8],后来山东青岛、河北保定、北京、广东、海南等地区先后有该病毒发生的报道,其发生分布范围在不断地发展蔓延[7-11]。本研究从湖南、贵州、山西、四川、河南及山东6个省份的鲜食辣椒中检测到PMMoV,进一步明确了该病毒在我国的发生分布情况。除此之外,我们从7份辣椒酱中检测到PMMoV,这一结果与Peng等[3]和Colson等[4]的发现相一致;另外,还从初级加工品辣椒丝、辣椒粉、手工精制辣椒以及辣椒深加工制品酱菜和泡菜中检测到PMMoV,且具有较高的检出率。这表明PMMoV通过食用辣椒制品进入人体的几率很高。考虑到PMMoV可能与一些临床病症的发生有关[3],需对此足够重视,以保障食品安全及人类健康。
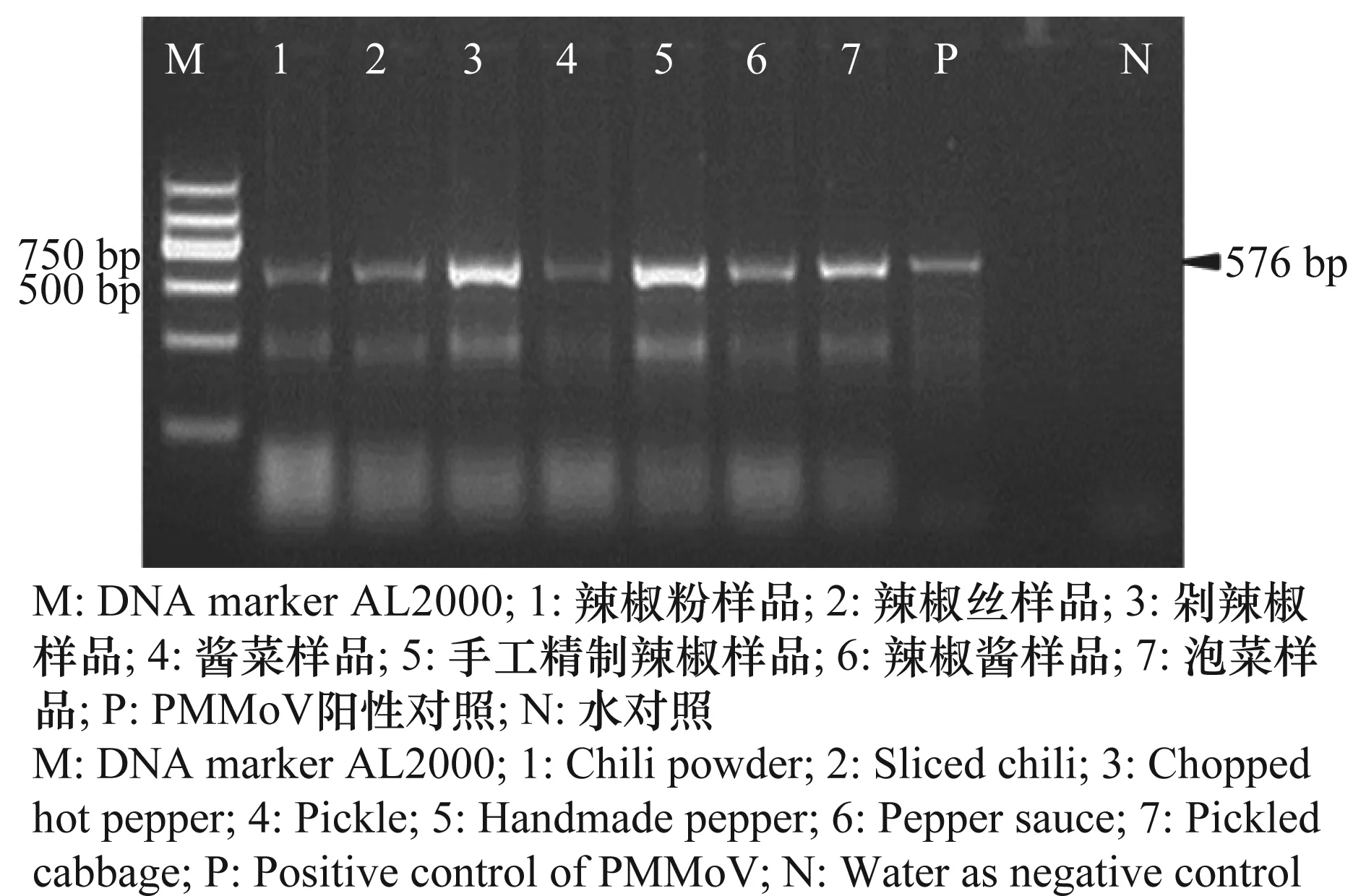
图2 辣椒加工品中部分阳性样品RT-PCR检测结果Fig.2 RT-PCR result of PMMoV in some positive pepper processed products
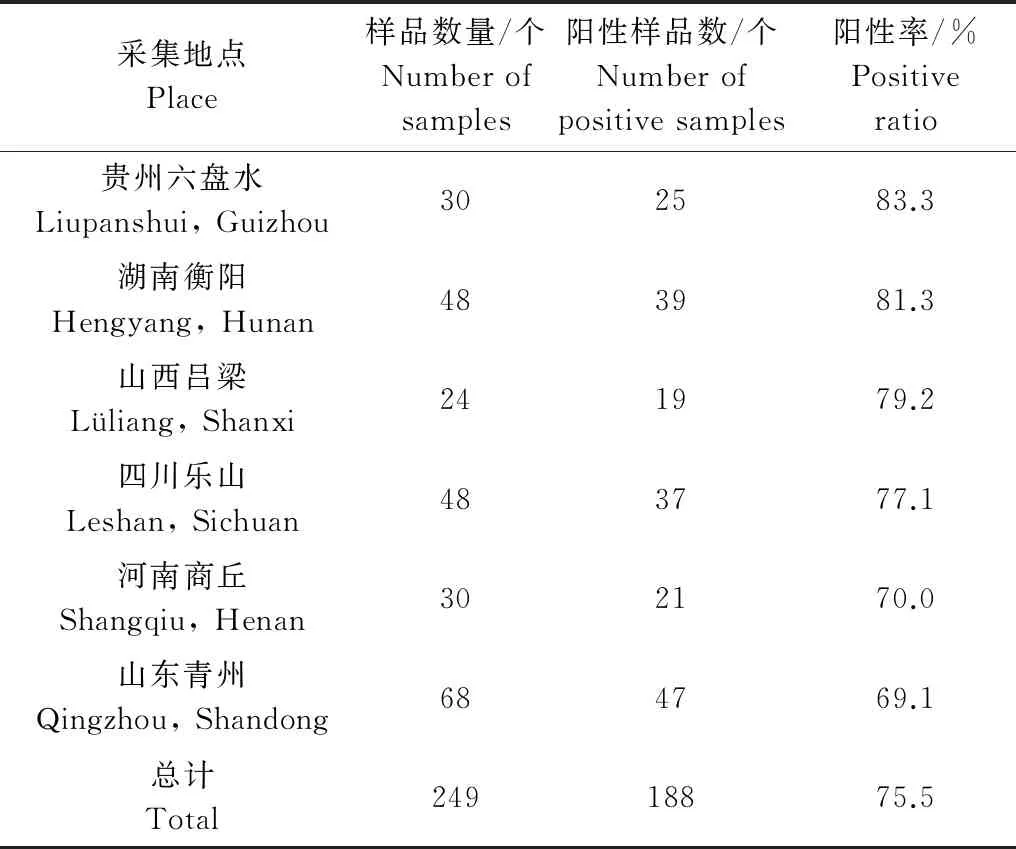
采集地点Place样品数量/个Numberofsamples阳性样品数/个Numberofpositivesamples阳性率/%Positiveratio贵州六盘水Liupanshui,Guizhou302583.3湖南衡阳Hengyang,Hunan483981.3山西吕梁Lüliang,Shanxi241979.2四川乐山Leshan,Sichuan483777.1河南商丘Shangqiu,Henan302170.0山东青州Qingzhou,Shandong684769.1总计Total24918875.5
一般认为,PMMoV的主要侵染源为带毒种子、感病植株和病土,但随着科学研究的不断深入,一些新的侵染源和传播途径被人们所认识。近些年有研究发现在人体排泄物中也能够检测到PMMoV,且具有侵染活性[12],由此可以推测出PMMoV通过人体进行传播的新途径。农家肥、灌溉水等可能是PMMoV的新侵染源,在农事操作的过程中,再次侵染寄主植物。
表2 辣椒加工品中PMMoV的检测结果
Table 2 Detection of PMMoV in pepper processed products
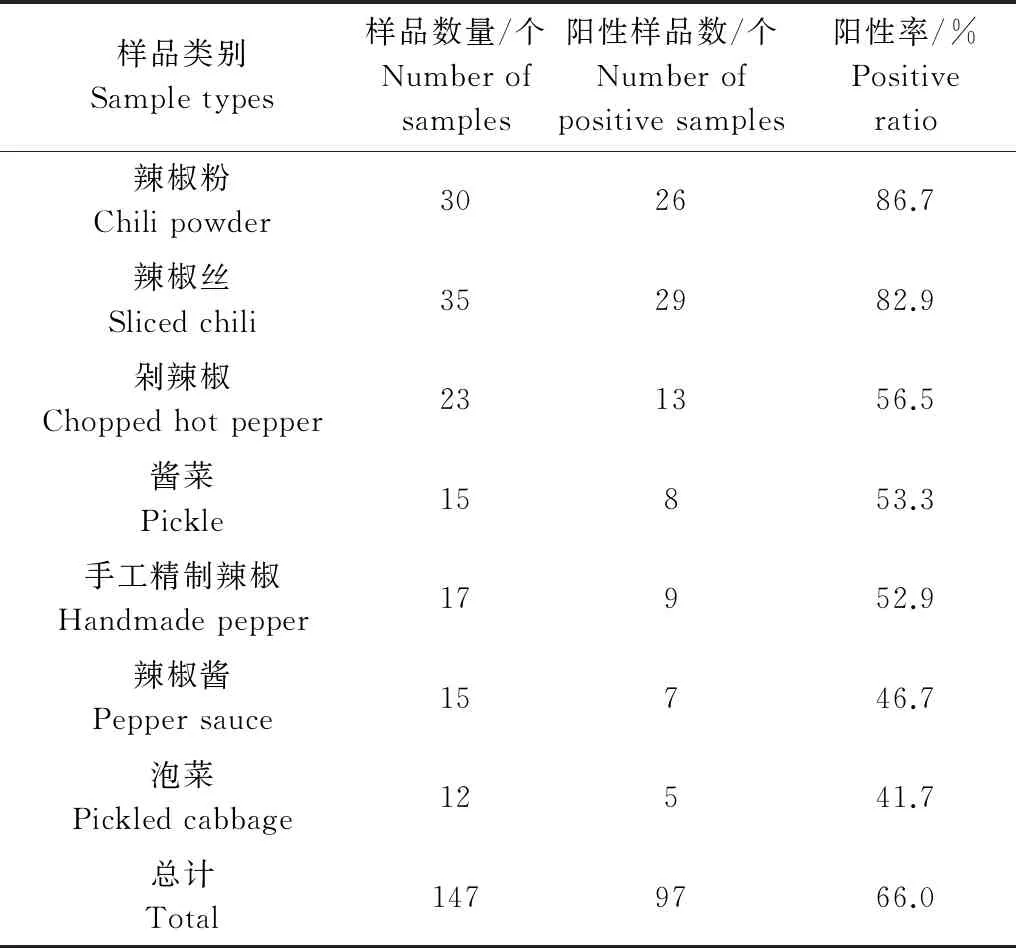
样品类别Sampletypes样品数量/个Numberofsamples阳性样品数/个Numberofpositivesamples阳性率/%Positiveratio辣椒粉Chilipowder302686.7辣椒丝Slicedchili352982.9剁辣椒Choppedhotpepper231356.5酱菜Pickle15853.3手工精制辣椒Handmadepepper17952.9辣椒酱Peppersauce15746.7泡菜Pickledcabbage12541.7总计Total1479766.0
[1] Antignus Y, Lachman O, Pearlsman M, et al. A new pathotype ofPeppermildmottlevirus(PMMoV) overcomes theL4resistance genotype of pepper cultivars [J]. Plant Disease,2008, 92(7): 1033-1037.
[2] Ikegashira Y, Ohki T, Ichiki U T, et al. An immunological system forthe detection ofPeppermildmottlevirusin soil from green pepper fields [J]. Plant Disease, 2004, 88 (6):650-656.
[3] Colson P, Herve R, Christelle D, et al.Peppermildmottlevirus, a plant virus associated with specific immune responses, fever, abdominal pains, and pruritus in humans[J]. PLoS ONE, 2010, 5(4): e10041.
[4] Peng Jiejun, Shi Bingbin, Zheng Hongying, et al. Detection ofPeppermildmottevirusin pepper sauce in China [J]. Archives of Virology, 2015, 160(8): 2079-2082.
[5] Callahan A M, Morgens P H, Walton E.Isolation andinvitrotranslation of RNAs from developing peach fruit [J]. HortScience, 1989, 24: 356-358.
[6] Morgens P H, Callahan A M, Dunn L J, et al. Isolation and sequencing of cDNA clones encoding ethylene-induced putative peroxidases from cucumber cotyledons [J]. Plant Molecular Biology, 1990, 14(5): 715-725.
[7] 夏惠娟, 李志勇, 郭京泽. 保定地区一种新辣椒病毒病的鉴定[J]. 河北农业大学学报, 2006, 29(6): 65-67.
[8] 向本春,谢浩,崔星明,等. 新疆辣椒轻微斑驳病毒的分离鉴定[J]. 病毒学报, 1994,10(3):240-245.
[9] 姚玉荣,陈国华,冯兰香,等.北运蔬菜基地辣椒病毒病病原种类的分子检测[J]. 中国蔬菜, 2013(10): 84-89.
[10]Wang X F, Liu F, Zhou G, et al. Detection and molecular characterization ofPeppermildmottlevirusin China[J]. Journal of Phytopathology, 2006, 154(11/12): 755-757.
[11]黄粤, 马荣群, 翟晓灵. 辣椒温和斑点病毒PMMV外壳蛋白基因的克隆和序列测定[C]∥蔬菜分子育种研讨会论文集, 2004.
[12]Zhang Tao, Mya B, Lee W H, et al. RNA viral community in human feces: prevalence of plant pathogenic viruses [J]. PLoS Biology, 2006, 4(1): 108-118.
(责任编辑:杨明丽)
The survey ofPeppermildmottlevirusin pepper and processed products in China
Zhang Wei, Zhang Zhixiang, Li Shifang
(StateKeyLaboratoryforBiologyofPlantDiseasesandInsectPests,InstituteofPlantProtection,ChineseAcademyofAgriculturalSciences,Beijing100193,China)
The survey ofPeppermildmottlevirus(PMMoV) in pepper and processed products in China was conducted using RT-PCR.The results showed that the occurrence of PMMoV was 75.5% in 249 pepper fruits, and there were 97 positive samples in 147 pepper processed products. Moreover, positive samples were able to be found in each kind of collected pepper processed product. These results suggested that PMMoV was widely distributed in pepper production areas in China, and its detection rate was relatively high in many pepper processed products. Therefore, this study further clarifies the origin and possible routes of transmission of PMMoV, and provides a theoretical basis for the effective control of this virus.
Peppermildmottlevirus(PMMoV); RT-PCR; pepper fruit; pepper processed products
2016-03-04
2016-03-15
国家农产品质量安全风险评估项目(GJFP2015014);公益性行业(农业)科研专项 (201303028)
S436.418.12
A
10.3969/j.issn.0529-1542.2017.01.027
* 通信作者 E-mail: sfli@ippcaas.cn

