PKC介导的自噬在肝纤维化中的作用
尹瑞梨,时佳宏,潘奇正,周德山*
(1.首都医科大学 人体解剖与组织胚胎学系,北京100069;2.吉林大学公共卫生学院;3.吉林大学中日联谊医院)
PKC介导的自噬在肝纤维化中的作用
尹瑞梨1,时佳宏2,潘奇正3,周德山1*
(1.首都医科大学 人体解剖与组织胚胎学系,北京100069;2.吉林大学公共卫生学院;3.吉林大学中日联谊医院)
目的 探讨在PKC信号通路介导的自噬在肝纤维化小鼠肝组织中的变化及意义。方法 本研究将C57BL/6小鼠随机分为两组:模型组和假手术对照组,其中模型组采用胆管结扎方法诱导小鼠肝纤维化,手术4周后取材。HE染色、Masson染色显示小鼠肝组织纤维化程度;免疫组化检测肝组织内LC3蛋白的表达;Western Blot法检测肝组织中α-SMA、PKCα、p-PKCα和LC3蛋白的表达,最后将人正常肝细胞L02细胞转染PKCα siRNA后检测LC3蛋白的表达变化并分析二者之间的关系。结果 HE和Masson染色结果显示胆管结扎诱导的肝纤维化模型组有明显的纤维增生。Western Blot结果显示模型组肝组织中α-SMA、PKCα和p-PKCα蛋白表达明显高于对照组(P<0.01),而Western Blot和免疫组化结果均显示LC3蛋白的表达则明显降低(P<0.05)。最后,L02细胞在转染PKCα siRNA后显示LC3蛋白表达上调(P<0.01)。结论 PKCα信号通路的激活可以抑制自噬的发生,二者的相互作用可能与肝纤维化的发生和发展密切相关。
胆管结扎诱导的肝纤维化;PKCα蛋白;LC3蛋白;自噬
(ChinJLabDiagn,2017,21:0135)
肝纤维化是各种急慢性致病因素持续或反复刺激肝脏,使其纤维组织增生、细胞外基质过度沉积的病理过程[1]。若致病因素持续存在,肝纤维化程度逐渐加重,正常的肝小叶结构破坏,在汇管区出现纤维间隔以及假小叶的形成,进展成为肝硬化,还可继续发展成为肝癌[2]。已有文献报道,肝硬化5年后约有5%发展成肝癌,而10年后约有40%发展成肝癌[3]。因此,早期干预治疗肝纤维化对预防肝硬化及肝癌的发生十分重要。自噬(Autophagy)是细胞在缺氧、饥饿、高温等应激状态时,通过上调自噬水平,降解细胞中多余的成分从而维持细胞的能量代谢。这是真核细胞特有的一种相对保守的分解代谢过程,还能降解细胞内错误折叠的蛋白,保护细胞不受病原微生物的破坏,因此自噬在维持细胞稳态中发挥很重要的作用[4]。而自噬分为巨自噬、微自噬和分子伴侣介导的自噬三种类型,通常所研究的主要是巨自噬,负责降解细胞内稳定存在并永久存在的蛋白质并产生氨基酸用以维持细胞在缺乏营养时的生存[5]。因此,为了治疗肝纤维化,应首先阐明其发生发展机制,而近些年的研究表明自噬在肝脏疾病中发挥重要的作用,如非酒精性脂肪性肝病[6]、病毒性肝炎[7,8]、肝癌[9]以及肝纤维化等。为了进一步阐明自噬在肝纤维化发生发展中的作用,本研究检测了胆管结扎诱导的肝纤维化小鼠模型中蛋白激酶C(protein kinase C,PKC)和细胞自噬标志性蛋白-微管相关蛋白1轻链3(microtubule-associated protein Ιlight chain,LC3)的表达水平变化,探讨其之间的关系和意义,从而为深入研究肝纤维化的发病机制及干预治疗提供依据。
1 材料与方法
1.1 实验材料
1)动物:C57BL/6小鼠(动物许可证号:SCXK20120001),雄性,体重18-22g,SPF级,6-8周龄,标准化动物房饲养,于首都医科大学实验动物部购置。
2)主要试剂:Masson试剂盒(南京建成生物工程研究所);即用型免疫组化试剂盒(迈新试剂);转染试剂Lipo2000(Invitrogen);BCA 试剂盒(Thermo);ECL 超敏发光液(Bio-Rad)兔抗PKCα、p-PKCα多克隆抗体(Cell Signaling);鼠抗α-SMA单克隆抗体和兔抗 LC3 多克隆抗体(Sigma);羊抗兔IgG-HRP,羊抗鼠IgG-HRP(Cell Signaling);PKCα siRNA和Negative Control由北京欧林格生物科技有限公司合成。
1.2 实验方法
1) 细胞培养及PKCα siRNA转染:在37℃,5% CO2的条件下用低糖培养基中加入20% FBS培养人肝细胞系L02细胞(ATCC)。将L02细胞经胰酶消化接种于六孔板中,然后采用Lipo2000介导的方法将PKCα siRNA转染细胞,最后收集细胞,提取蛋白用于Western Blot检测。
2) 动物模型制作:20只C57BL/6小鼠(北京维通利华实验动物有限公司),雄性,20只小鼠随机分为假手术组和胆管结扎模型组,每组各10只。模型组采用腹腔注射4%水合氯醛200ul将其麻醉,仰卧位固定于手术台,沿腹中线打开腹腔,沿十二指肠起始端找到胆总管并将其分离结扎,缝合关腹;假手术组:麻醉后打开腹腔,游离胆总管,缝合关腹[10]。术后正常饮食喂养。手术4周后处死小鼠,取肝组织用于免疫组织化学染色和Western Blot检测。
3) 肝脏病理学检测:肝组织用10%福尔马林固定,常规脱水、透明、浸蜡包埋制作石蜡切片后进行HE染色和Masson染色,并于光镜下观察其病理变化。
4) 肝脏LC3免疫组织化学染色:石蜡切片常规脱蜡、入水,微波修复3 min后,晾至室温后用试剂盒中的3%H2O2甲醇封闭其过氧化物酶,正常羊血清封闭30 min后,滴加稀释后的一抗LC3(1∶200),其中对照用PBS代替一抗,4℃过夜后,滴加二抗以及ABC复合物后用DAB显色,苏木精复染核,脱水透明后树胶封片。显微镜下观察并照相。
5) Western Blot检测PKCα、p-PKCα以及LC3的表达:提取肝组织总蛋白,并用BCA试剂盒测定其浓度。取5μg总蛋白进行12%SDS-PAGE电泳,然后转印至PVDF膜,5%脱脂奶粉室温下封闭1h后分别加入α-SMA、PKCα、p-PKCα以及LC3抗体(均为1:2000稀释),4℃孵育过夜,次日用TBST洗3次,然后分别加入二抗(1:3000稀释),室温下孵育1h,TBST洗3次,采用Fusion Fx7曝光机器(法国Vilber Lourmat公司)扫膜并采集图像,并用Image-J软件分析其灰度值。
6) 统计学分析:实验数据采用SPSS 17.0软件进行统计分析,P<0.05为差异具有统计学意义。
2 结果
2.1 两组小鼠肝脏病理学比较
HE染色显示假手术组的小鼠肝脏表面光滑,边缘整齐,未见纤维增生、肝细胞变性、炎性反应,肝小叶和汇管区的形态结构完整(图1A),而模型组可见肝细胞排列紊乱,有炎性细胞浸润,肝细胞散在变性、坏死,小叶周边出现小胆管样上皮细胞并增生(图1B)。Masson染色显示假手术组没有或仅有少量纤维组织(图1C),而模型组中则纤维增生明显(图1D)。
2.2 小鼠肝组织中α-SMA、PKCα、p-PKCα以LC3的表达情况
Western blot 结果显示:模型组α-SMA的表达增加(P<0.05),表明胆管结扎诱导的肝纤维化模型制作成功。在纤维化模型组中发现PKCα、p-PKCα的表达量均较假手术组高(P<0.01),而LC3的表达则显著降低,差异具有统计学意义(P<0.05)。见图2。
2.3 两组小鼠LC3免疫组织化学染色结果比较
胆管结扎手术4周后,分别取两组的肝组织进行染色。免疫组织化学染色显示模型组中LC3蛋白的阳性面积明显少于假手术组,见图3。
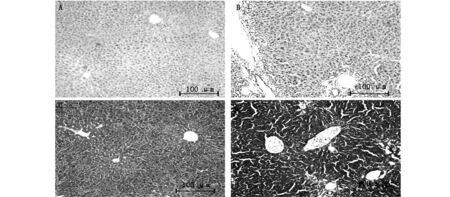
A,HE staining of sham-operated group;B,HE staining of model group;C,Masson staining of sham-operated group;D,Masson staining of mode group (HE,×100;MASSON,×100)
图1 肝组织病理学检查
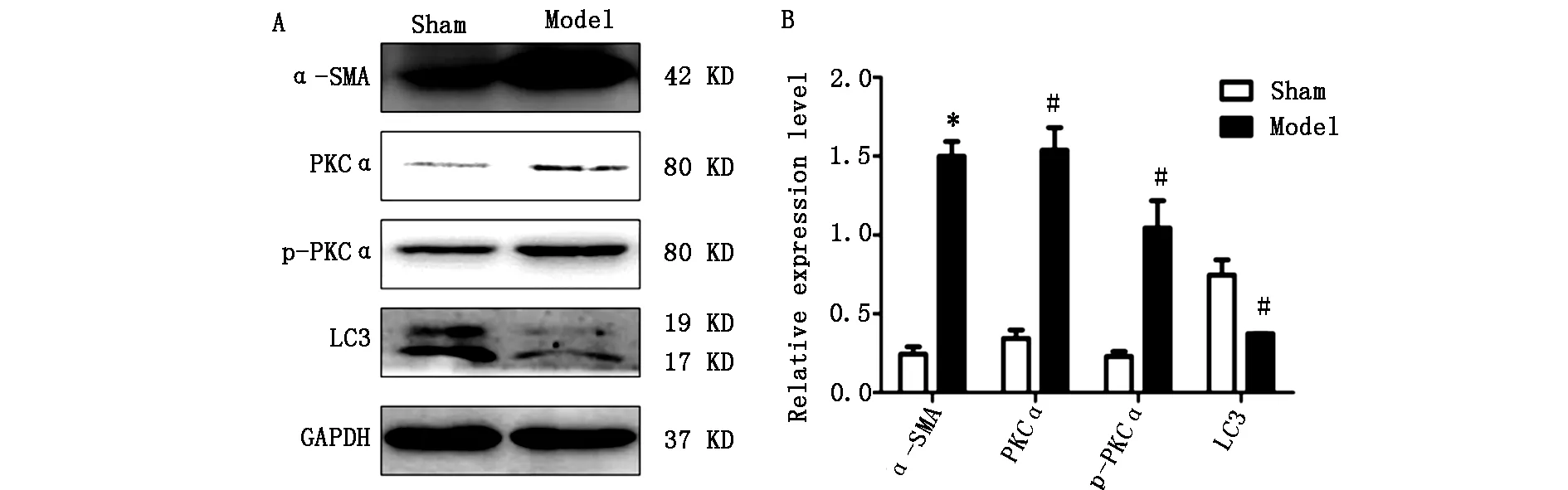
图2 免疫印迹检测两组小鼠肝组织中α-SMA、PKCα、p-PKCα以LC3蛋白的表达
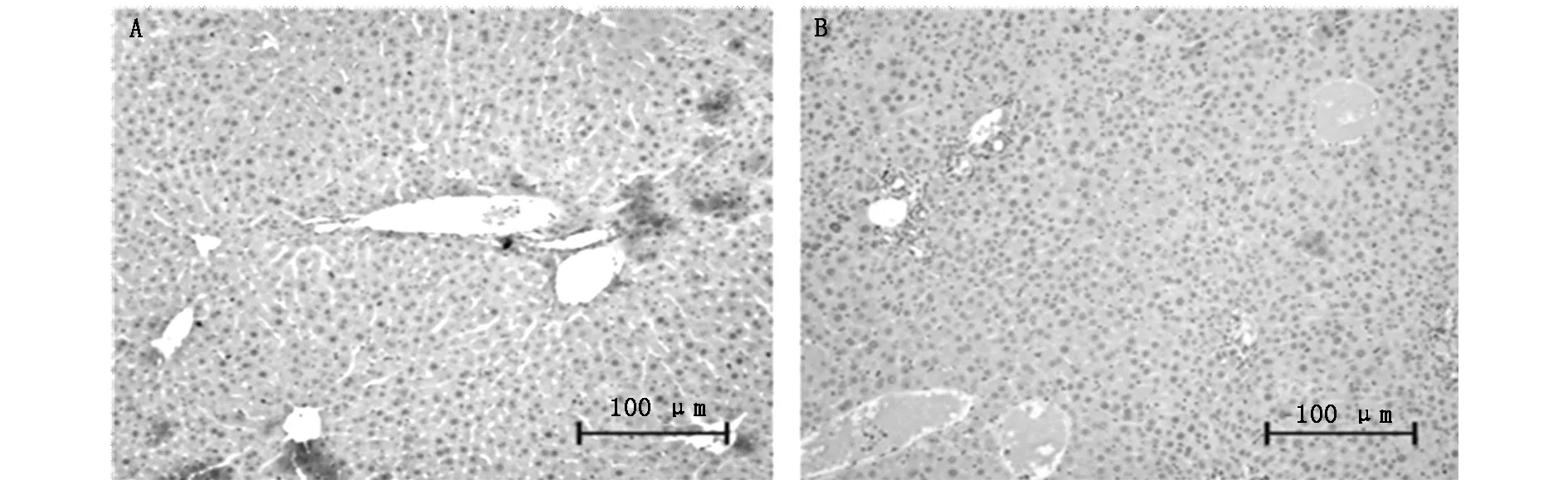
A:sham-operated group;B:model group(×100)
图3 LC3 蛋白在小鼠肝组织中的免疫组织化学染色
2.4 肝细胞中转染PKCα siRNA后,LC3蛋白的表达情况
以上结果显示(图2和图3),PKCα和P-PKCα在纤维化模型组表达增加,而LC3则表达减少,提示PKC信号通路的激活可能抑制自噬。因此,在体外培养的L02细胞内,利用siRNA将PKCα敲降之后(P<0.01),发现LC3的表达明显上调(P<0.01)。见图4。

图4 免疫印迹检测L02细胞转染PKCα siRNA后,PKCα和LC3蛋白的表达情况(A)及其灰度值分析统计图(B)。*P<0.01
3 讨论
肝纤维化是一个复杂的病理过程,其中包含多个细胞因子和信号通路共同参与其发生发展过程[11]。研究的较为清楚的主要有TGFβ-Smad[12]、MAPK、PI3K[13]及PKC信号通路。其中PKC是一种磷脂依赖性丝氨酸/苏氨酸蛋白激酶,存在于细胞质内,是细胞内传递信号的重要介质。根据其激活方式的不同,主要分为三大类:经典型PKC、新型PKC、非典型PKC[14]。而已有研究证明经典型PKC中的PKCα在促进肝纤维化发生发展过程中发挥重要的作用[15]。
在生理情况下自噬主要维持细胞功能的稳定,细胞自噬是个程序化的动态过程,首先形成双层膜的囊泡结构,将要消化的物质包裹起来后,溶酶体与其外层膜融合成为自噬溶酶体。在自噬体形成过程中,构成囊泡膜结构的蛋白-微管相关蛋白1轻链3会不断地由Ι型转化为Ⅱ型,因此LC3Ⅱ与LC3Ⅰ的比例是反映自噬流量的重要指标[16]。
肝纤维化过程中,肝星状细胞(Hepatic stellate cell,HSC)的激活居于主要地位,同时胶原蛋白合成增加降解减少造成ECM的积累增加,使得部分肝细胞缺氧、供给不足。因此可以通过提高HSC细胞的自噬水平,减少纤维蛋白原的产生,从而保护肝细胞减少其损伤[17]。有研究证明自噬自噬增强剂Carbamazepine(CBZ)通过促进α1-抗胰蛋白酶Z(α1 Antitrypsin Z,ATZ)的降解,从而缓解肝纤维化[18]。并且造血因子IL-3、TGFβ激酶1(TAK1)能抑制自噬,而在我们的研究中发现发现PKCα信号通路的激活可能抑制自噬的发生。既往研究表明PKC的激活使LC3 Thr6和Thr29位点的磷酸化,同时LC3Ⅰ向LC3Ⅱ蛋白的转化减少,使得自噬小体形成减少,从而抑制自噬[19]。而PKCα信号通路如何调控自噬的机制尚不明确,仍需进一步研究,以便为肝纤维化的进一步治疗提供理论依据。
[1]舒泳翔,谭诗云,吴鹏波.非酒精性脂肪肝病自噬机制的研究进展[J].医学研究杂志,2016,1:4.
[2]白启轩,贾继东.肝纤维化发生机制及治疗进展[J].中国医学前沿杂志(电子版),2008,2:15.
[3]Friedman SL.Molecular regulation of hepatic fibrosis,an integrated cellular response to tissue injury[J].J Biol Chem,2000,275(4):2247.
[4]涂芊茜.自噬在脂肪酸诱导肝损伤中的作用及机制的初步研究[D].第二军医大学,2011.
[5]舒泳翔,谭诗云,吴鹏波.非酒精性脂肪肝病自噬机制的研究进展[J].医学研究杂志,2016,1: 4.
[6]Singh R,Kaushik S,Wang Y,et al.Autophagy regulates lipid metabolism[J].Nature,2009,458(7242):1131.
[7]Sir D,Tian Y,Chen WL,et al.The early autophagic pathway is activated by hepatitis B virus and required for viral DNA replication[J].Proc Natl Acad Sci USA,2010,107(9):4383.
[8]Dreux M,Gastaminza P,Wieland S F,et al.The autophagy machinery is required to initiate hepatitis C virus replication[J].Proc Natl Acad Sci USA,2009,106(33):14046.
[9]Mizushima N,Levine B,Cuervo AM,et al.Autophagy fights disease through cellular self-digestion[J].Nature,2008,451(7182):1069.
[10]Kanda T,Ishibashi O,Kawahigashi Y,et al.Identification of obstructive jaundice-related microRNAs in mouse liver[J].Hepatogastroenterology,2010,57(102-103):1013.
[11]吴晓玲,曾维政,蒋明德,等.肝纤维化的信号转导通路[J].世界华人消化杂志,2006(22):2223.
[12]Li J,Li X,Xu W,et al.Antifibrotic effects of luteolin on hepatic stellate cells and liver fibrosis by targeting AKT/mTOR/p70S6K and TGFbeta/Smad signalling pathways[J].Liver Int,2015,35(4):1222.
[13]Shu M,Huang DD,Hung ZA,et al.Inhibition of MAPK and NF-kappaB signaling pathways alleviate carbon tetrachloride (CCl4)-induced liver fibrosis in Toll-like receptor 5 (TLR5) deficiency mice[J].Biochem Biophys Res Commun,2016,471(1):233.
[14]李 礼,李 静,耿美玉.蛋白激酶C在肿瘤中的作用及其抑制剂研究进展[J].中国药理学通报,2009(06): 708.
[15]Takekoshi S,Kitatani K,Yamamoto Y.Roles of Oxidized Diacylglycerol for Carbon Tetrachloride-induced Liver Injury and Fibrosis in Mouse[J].Acta Histochem Cytochem,2014,47(5):185.
[16]Levine B,Kroemer G.Autophagy in the pathogenesis of disease[J].Cell,2008,132(1):27.
[17]翟孟贺,周 雄,李杰克,等.细胞自噬对肝纤维化的影响[J].肝胆胰外科杂志,2015(05): 434.
[18]Hidvegi T,Ewing M,Hale P,et al.An autophagy-enhancing drug promotes degradation of mutant alpha1-antitrypsin Z and reduces hepatic fibrosis[J].Science,2010,329(5988):229.
[19]Jiang H,Cheng D,Liu W,et al.Protein kinase C inhibits autophagy and phosphorylates LC3[J].Biochem Biophys Res Commun,2010,395(4):471.
The role of PKC-mediated autophagy in liver fibrosis
YINRui-li,SHIJia-hong,ZHOUDe-shan*.
(DepartmentofHistologyandEmbryology,CapitalMedicalUniversity,Beijing100069,China)
Objective To explore the change and importance of PKC-mediated autophagy in mice liver fibrosis tissue.Methods The C57BL/6 mice were randomly divided into two groups:the bile duct ligation model and sham-operated groups.Mice in the model group were treated with bile duct ligation for induced liver fibrosis.After 4 weeks of operation,the degree of hepatic fibrosis was evaluated by HE and Masson staining,firstly.Subsequently,the expression of LC3 in liver tissues was detected by immunohistochemistry assay,and expressions of α-SMA,PKCα,p-PKCα and LC3 in liver tissues were also determined by Western Blot.Finally,the expression of LC3 was detected in L02 cells transfected with PKCα siRNA and the relationship between PKCα and LC3 was assessed.Results More fibrotic liver tissues were found in model group according to HE and Masson staining.As a result,the expression of α-SMA,PKCα and p-PKCα were significantly increased (P<0.01),while that of LC3 was decreased (P<0.01) in liver tissues from model group as compared with those from the sham-operated group by Western Blot and Immunohistochemistry assay.After transfection of PKCα siRNA in L02 cells,the level of LC3 was upregulated (P<0.01).Conclusion The inhibition of autophage by PKCα pathway may contribute to the occurrence and development of liver fibrosis.
Bile duct ligation-induced liver fibrosis;PKCα;LC3;autophagy
1007-4287(2017)01-0135-05
R575.2
A
2016-03-16)
*通讯作者

