循环microRNA对非小细胞肺癌诊断和化疗效果评价的研究
王丹丹,刘牟林,李士军*
(1.辽宁省人民医院,辽宁 沈阳110016;2.大连医科大学附属第一医院 检验科)
循环microRNA对非小细胞肺癌诊断和化疗效果评价的研究
王丹丹1,刘牟林2,李士军2*
(1.辽宁省人民医院,辽宁 沈阳110016;2.大连医科大学附属第一医院 检验科)
目的 探讨血清中miR-19b,miR-125b,miR-34a,miR-200b的表达与非小细胞肺癌发生发展的相关性,以及这4种microRNAs在化疗过程中表达水平的变化和对患者化疗的监测效果。方法 采用实时荧光定量PCR(Real-time PCR)技术检测43例健康体检者和非小细胞肺癌患者血清中miR-19,miR-125b,miR-34a,miR-200b的表达水平,以及化疗过程中的表达变化,比较第二次、第六次化疗后microRNAs的表达差异。结果 与健康对照组相比,非小细胞肺癌患者血清中miR-19b,miR-125b和miR-200b表达上调,与淋巴结转移相关;miR-34a表达下调,与淋巴结转移无关。在化疗期间,miR-19b、miR-125b的表达随着化疗的进行而降低,第六次化疗后与第二次化疗后相比表达下降(P<0.05)。结论 血清miR-19b,miR-125b,miR-34a和miR-200b可作为NSCLC的辅助诊断指标;miR-19b,miR-125b可作为NSCLC患者化疗效果评价的潜在标志物。
非小细胞肺癌;miR-19b;miR-125b;化疗
(ChinJLabDiagn,2017,21:0036)
肺癌是目前世界上最常见的恶性肿瘤之一,也是肿瘤致死原因中的第一位,治疗效果欠佳,预后较差[1],寻找与肺癌发生发展相关的标志物,对于提高肺癌的诊断和治疗效果极其重要。
循环microRNA是一类以游离形式存在于血清、血浆等机体体液中的microRNA[2],当机体发生病变时,可通过某些机制直接或间接地破坏机体内循环microRNAs的稳定状态,出现差异性表达。
当机体发生肿瘤时,很多循环microRNA会发生表达上调或下调,表现出相应的促癌或抑癌作用[3]。本研究通过Real-time PCR的方法检测健康体检者和非小细胞肺癌患者血清中miR-19b,miR-125b,miR-34a和miR-200b的表达变化,以及化疗过程中这4种microRNA的特征性表达,探讨血清miR-19b,miR-125b,miR-34a和miR-200b与非小细胞肺癌发生发展的关系以及对非小细胞肺癌患者化疗的监测效果。
1 材料与方法
1.1 样本获取 选取2014年3月到2015年1月期间在大连医科大学附属第一医院入院并确诊的43例原发性非小细胞肺癌。平均年龄64.28岁,男性29例,女性14例;腺癌19例,鳞癌16例,大细胞癌8例;TNM分期:IIIA期11例,IIIB期7例,IV期25例。在非小细胞肺癌患者第一次化疗前1-3日,以及第二、四、六次化疗用药结束后1-3日采集静脉血,取血清备用。同时选取健康体检者43例作为对照组。本研究涉及的被测试者都已告知了研究目的,并签署了知情同意书。
1.2 试剂 血清RNA的提取试剂miRNeasy Serum/Plasma Kit(Qiagen),组织RNA提取试剂RNAiso Plus(Takara),逆转录试剂盒(Takara),SYBR green qRT-PCR assay(Takara)。
1.3 血清RNA的提取 将血清样品用QIAzol Lysis Reagent裂解,加入miRNeasy Serum Spike-In Control,氯仿等混匀,离心取上清层,加入无水乙醇洗涤,过RNeasy MinElute spin column浓集RNA,将RNA纯化后,-80℃保存备用。
1.4 Real-time PCR 测定RNA的浓度和纯度后,利用microRNA reverse transcription kit反转录试剂盒和microRNA的特异性引物将RNA反转录生成cDNA。反应条件为:25℃,30 min;42℃,30 min;85℃,5 min;4℃保存。然后在实时荧光定量PCR仪上,按照程序进行PCR扩增反应。反应条件为:95℃,3 min;95℃,12 s;62℃,40 s;40个循环。PCR反应以U6作为内参,采用ΔΔct相对定量法测定血清中microRNA的表达水平。
1.5 统计学方法 所有数据都采用SPSS 17.0统计软件进行分析,以均数±标准差的形式表示。组间microRNA的表达差异采用Wilcoxon tests方法检验;χ2test用来比较microRNAs与NSCLC患者临床病理因素的相关性;ANOVA test用于检验microRNAs与TNM分期的关系,以P<0.05为差异有统计学意义。
2 结果
2.1 RNA的提取 本实验采用miRNeasy Serum/Plasma Kit提取血清RNA,提取的RNA经微量核酸测定仪NanoDrop 2000测定浓度及纯度,其OD260/280在1.8-2.0范围内。
2.2 循环microRNAs在非小细胞肺癌患者血清中的表达 与健康对照组相比,血清中4种microRNAs的表达存在差异,miR-125b的表达明显高于健康对照组,P<0.01;miR-19b与miR-200b也高于健康对照组,P<0.05;miR-34a表达下降,P<0.05(图1)。
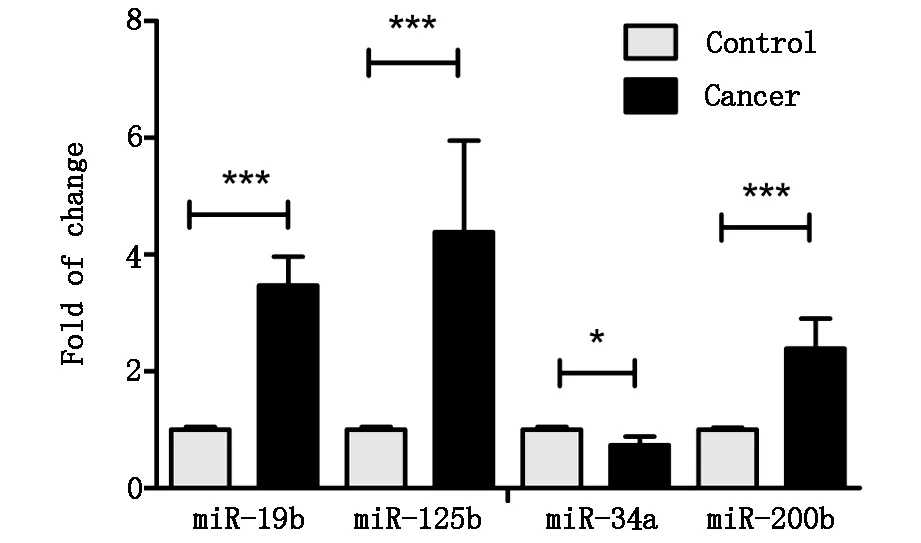
图1 血清中4种microRNAs的表达
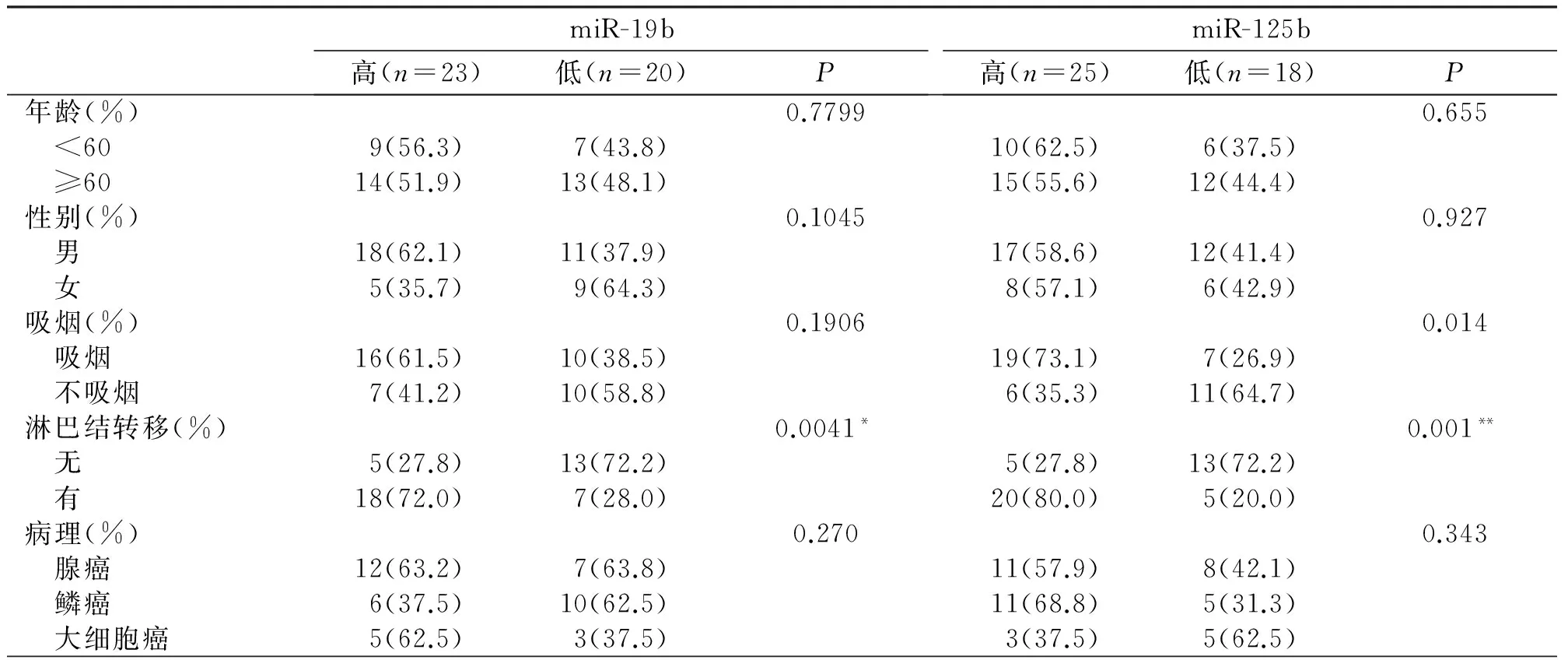
2.3 循环microRNAs对非小细胞肺癌诊断的评价 miR-19b、miR-125b、miR-34a和miR-200b的ROC曲线下面积分别是0.873,0.826,0.730和0.870。根据统计学标准,当AUC=0.5时,表示完全无诊断价值;当0.5 2.4 循环microRNAs与非小细胞肺癌患者临床病理特征的相关性 miR-19b、miR-125b、miR-34a和miR-200b在非小细胞肺癌患者血清中的表达与其年龄、性别、吸烟、病理类型等无相关性。但miR-19b,miR-125b,miR-200b的表达与淋巴结转移相关(P<0.05);miR-34a的表达与淋巴结转移没有相关性(P>0.05)(表1)。 2.5 循环microRNAs对非小细胞肺癌患者化疗效果的监测 根据RECIST标准、CT结果和肿瘤标志物对化疗效果的评价,将患者分为完全缓解(CR),部分缓解(PR),病变稳定期(SD)及病变进展期(PD),其中化疗有效组(CR+PR)25例,化疗无效组(SD+PD)18例。在化疗有效组(CR+PR),患者血清中miR-19b,miR-125b的表达逐渐下降,第六次化疗后与第二次化疗相比表达降低(P<0.05)。在化疗无效组(SD+PD)中结果正好相反,患者血清中miR-19b和miR-125b表达持续升高,在末次化疗和第二次化疗相比存在差异(P<0.05)。miR-34a无论是在化疗有效组还是化疗无效组,各化疗阶段的表达均没有统计学差异(P>0.05)。在化疗有效组和化疗无效组中,患者在各化疗阶段血清中miR-200b的表达都下降,且第二次化疗与第六次化疗相比,miR-200b的表达存在统计学差异(P<0.05)(表2)。 图2 A.miR-19b ROC曲线 B.miR-125b ROC曲线 C.miR-34a ROC曲线 D.miR-200b ROC曲线 miR-19b高(n=23)低(n=20)PmiR-125b高(n=25)低(n=18)P年龄(%)0.77990.655 <609(56.3)7(43.8)10(62.5)6(37.5) ≥6014(51.9)13(48.1)15(55.6)12(44.4)性别(%)0.10450.927 男18(62.1)11(37.9)17(58.6)12(41.4) 女5(35.7)9(64.3)8(57.1)6(42.9)吸烟(%)0.19060.014 吸烟16(61.5)10(38.5)19(73.1)7(26.9) 不吸烟7(41.2)10(58.8)6(35.3)11(64.7)淋巴结转移(%)0.0041*0.001** 无5(27.8)13(72.2)5(27.8)13(72.2) 有18(72.0)7(28.0)20(80.0)5(20.0)病理(%)0.2700.343 腺癌12(63.2)7(63.8)11(57.9)8(42.1) 鳞癌6(37.5)10(62.5)11(68.8)5(31.3) 大细胞癌5(62.5)3(37.5)3(37.5)5(62.5) 表2 4种microRNAs在化疗期间的相对表达量 肺癌是全世界范围内发病率、死亡率最高的肿瘤之一,2009年,中国肺癌患者的发病率和死亡率居恶性肿瘤首位[4]。非小细胞肺癌患者的发病率占肺癌发病率的80%,因NSCLC起病隐匿,多数患者发现时已处于晚期阶段,目前对NSCLC的治疗主要是化疗。虽然肺癌的诊断、治疗技术不断提高,患者的5年生存率也有所上升,但肺癌依然是预后最差的恶性肿瘤之一[5],虽然对NSCLC的研究和治疗已经有了一定的进展,仍然缺乏对NSCLC诊断、治疗指导、疗效评估的有效生物学指标。 大量研究已表明,microRNAs在肿瘤诊断、疗效判断等方面具有一定的优势:①microRNAs可参与肿瘤的发生发展过程,在不同的肿瘤组织中,其表达呈现出特征性的改变[6];②microRNAs的表达具有组织特异性,可作为一种新的标志物准确判断肿瘤组织的来源[7];③microRNAs的表达具有阶段特异性,在肿瘤的不同分期,microRNAs呈现出不同的表达谱[8];④microRNAs是一种小分子,比mRNA更为稳定,检测更为准确[9];⑤人体体液如血浆或血清中的循环microRNAs与肿瘤密切相关,并能被稳定的检测出来,使循环microRNAs作为一种新的反映肿瘤状态的标志物,拥有良好的临床应用前景[10]。另外,循环microRNAs在血清中稳定性好,与肿瘤发生发展相关,且血清标本容易获得,可对健康人群进行早期的肿瘤筛查,还可对肿瘤患者的治疗效果和预后进行动态评估,奠定了循环microRNAs成为理想肿瘤标志物的基础。 本研究发现,与健康体检者相比,非小细胞肺癌患者血清中miR-19b,miR-125b,miR-200b表达升高,miR-34a表达降低,说明在非小细胞肺癌的发生发展过程中,这4种microRNAs呈现出特征性的表达,可能参与了NSCLC的发生发展过程,通过ROC曲线分析发现,miR-19b,miR-125b,miR-200b对NSCLC的诊断准确性较好,且与淋巴结转移相关,可作为NSCLC诊断的辅助诊断指标,同时也可作为判断患者是否出现淋巴结转移的辅助标志物。在NSCLC患者接受化疗过程中,miR-19b,miR-125b也呈现出特异性表达。在化疗有效组(完全缓解CR+部分缓解PR)中,miR-19b,miR-125b表达逐渐下降,第六次化疗后与第二次化疗后相比,表达明显降低,在化疗无效组(病情稳定期SD+病变进展期PD)中结果正好相反,说明血清miR-19b,miR-125b的表达水平可以反映患者的化疗效果,可以作为患者化疗效果评价的辅助标志物,当化疗过程中血清miR-19b,miR-125b表达降低时,说明化疗有效,当其表达升高时,说明该化疗方案对患者效果欠佳,应及时改变化疗方案,以确保患者的治疗效果。因此,我们推测miR-19b,miR-125b与NSCLC的发生发展相关,在化疗过程中可表现出相应的变化,可作为NSCLC的辅助诊断标志物和化疗效果评价标志物。 [1] Meng J,Xie W,Cao L,et al.shRNA targeting HDGF suppressed cell growth and invasion of squamous cell lung cancer[J].Acta Bioc Biop Sin,2010,42(1):52. [2]Wozniak MB,Scelo G,Brennan P,et al.Circulating MicroRNAs as Non-Invasive Biomarkers for Early Detection of Non-Small-Cell Lung Cancer[J].PLoS One,2015,10(5):e0125026. [3]Lawrie CH,Gal S,Pulford K,et al.Detection of elevated levels of tumour-associated microRNAs in serum of patients with diffuse large B-cell lymphoma[J].Br J Haematol,2008.141(5):672. [4]Chen W,Zheng R,Zhang S,et al.The incidences and mortalities of major cancers in China[J].Chin J Cancer,2013,32(3):106. [5]Rebecca S,Deepa N,Ahmedin J,et al.Cancer Statistics[J].CA Cancer J Clin,2013,34(4):24. [6]Mar-Aguilar F,Mendoza-Ramírez JA,Reséndez-Pérez D,et al.Serum circulating microRNA profiling for identification of potential breast cancer biomarkers[J].Dis Markers,2013,34(3):163. [7]Rosenfeld N,Aharonov R,Meiri E,et al.MicroRNAs accurately identify cancer tissue origin[J].Nat Biotechnol,2008,26(4):462. [8]Malumbres R,Sarosiek KA,Cubedo E,et al.Differentiation stage-specific expression of microRNAs in B lymphocytes and diffuse large B-cell lymphomas[J].Blood,2009,113(16):3754. [9]Liu A,Tetzlaff MT,Vanbelle P,et al.MicroRNA expression profiling outperforms mRNA expression profiling in formalin-fixed paraffin-embedded tissues[J].Int J Clin Exp Pathol,2009,2(6):519. [10]Brase JC,Wuttig D,Kuner R,et al.Serum microRNAs as non-invasive biomarkers for cancer[J].Mol Cancer,2010,9:306. The Study of circulating microRNA on Diagnosis and Evaluation of Chemotherapy for Non-small Cell Lung ancer WANGDan-dan,LIUMu-lin,LiShi-jun. (People’sHospitalofLiaoningProvince,Shenyang110016,China) Objective To explore the correlation between serum expression of miR-19b,miR-125b,miR-34a,miR-200b with the development of non-small cell lung cancer,the expression changes of these four microRNAs during chemotherapy and the function of chemotherapy monitoring.Methods Real-time PCR was used to detect the expression change of serum miR-19b,miR-125b,miR-34a and miR-200b of 43 cases healthy volunteers and non-small cell lung cancer patients.And also detected the expression changes of these four microRNAs during chemotherapy.To observe the differential expression between the second and sixth chemotherapy.Results Compared with the healthy control group,serum miR-19b,miR-125b,miR-34a and miR-200b expressed differentially in patients of non-small cell lung cancer (P<0.05 ).The expression of miR-19b,miR-125b,miR-200b was up-regulated and related with lymph node metastasis.miR-34a was down-regulated but not related with lymph node metastasis.The expression of miR-19b,miR-125b were decreased when the patients received chemotherapy,and the expression were lower after the sixth cycle of chemotherapy than the second (P<0.05).Conclusion The serum expression of miR-19b,miR-125b,miR-34a and miR-200b could be applied diagnostic markers for NSCLC;miR-19b,miR-125b could act as potential biomarkers of chemotherapy evaluation for NSCLC patients. Non-small cell lung cancer;miR-19b;miR-125b;Chemotherapy 1007-4287(2017)01-0036-05 R734.2 A 2015-09-18) *通讯作者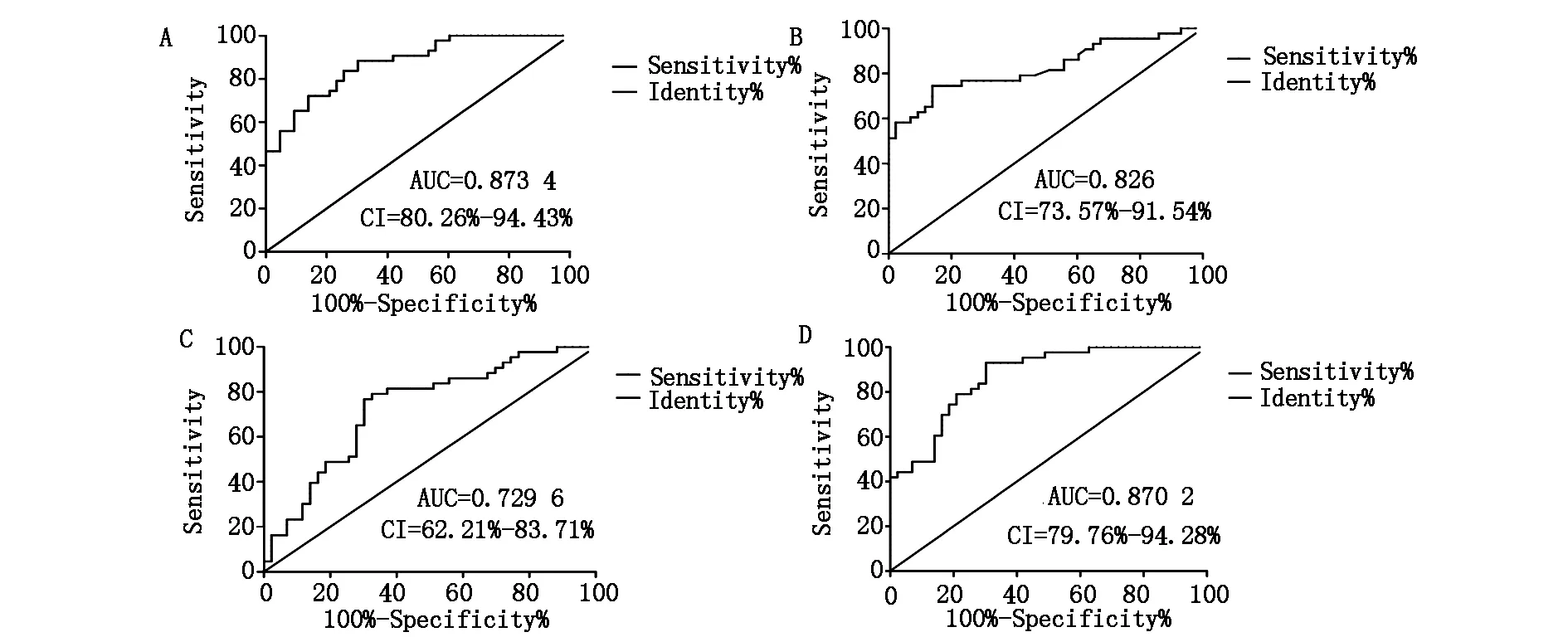

3 讨论

