高同型半胱氨酸血症诱导血管病变的机制及干预*
吕航吉 周广海 孙莎莎 文今福
(1.泰山医学院基础医学院; 2.泰山医学院动脉粥样硬化研究所,山东 泰安 271000)
高同型半胱氨酸血症诱导血管病变的机制及干预*
吕航吉1周广海2孙莎莎2文今福2
(1.泰山医学院基础医学院; 2.泰山医学院动脉粥样硬化研究所,山东 泰安 271000)
高同型半胱氨酸血症;血管病变;血管内皮;氧化应激;内质网应激
同型半胱氨酸(homocysteine, Hcy)是一种蛋氨酸(methionine, Met)代谢产物。当Hcy代谢相关信号通路受损时,使血浆中Hcy水平升高可导致高同型半胱氨酸血症(hyperhomocysteinaemia, HHcy)。HHcy与心血管疾病的发生、发展息息相关,被视为心血管疾病新的独立危险因素,其诱导的血管病变与动脉粥样硬化、高血压和冠心病密切相关。本文将针对HHcy诱导血管病变的机制及干预措施进行综述。
1 Hcy合成及代谢途径
同型半胱氨酸(homocysteine, Hcy)是一种人类不能直接从食物中获得的含硫氨基酸(结构式见图1),是蛋氨酸的中间代谢产物。正常生理状态下,空腹血浆水平为5~15 μmol/L。当遗传或获得性因素使得Hcy浓度持续高于正常值高限即空腹血浆Hcy水平高于15 μmol/L时则出现HHcy[1]。
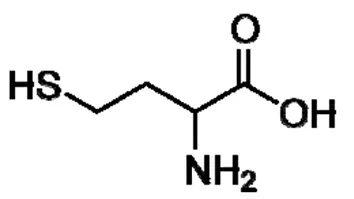
图1 同型半胱氨酸(Hcy)结构式
在Hcy合成的过程中,Met作为参与合成过程的底物首先被激活,形成S-腺苷蛋氨酸(S-adenosylmethionine, SAM),SAM是一个活泼的甲基供体,能够为至少115种物质提供甲基化反应过程中所需要的甲基。SAM去甲基后,生成S-腺苷高半胱氨酸(S-adenosylhomocysteine, SAH),SAH通过水解反应,生成Hcy。

图2 Hcy合成及代谢途径示意图
Hcy的代谢途径主要有两个:①重甲基化途径(remethylation pathway):以维生素B12作为辅助因子,由5-甲基四氢叶酸(5-CH3-THF)作为甲基供体,经过蛋氨酸合成酶(methionine synthetase, MS)催化,生成Met,再次进行甲基化循环。②转硫化途径(transulfuration pathway):以维生素B6作为辅助因子,在胱硫醚β-合酶催化(cystathionine β-synthase, CBS)下,丝氨酸(serine, ser)与Hcy进行不可逆的结合,生成胱硫醚(cystathionine),进而在γ-胱硫醚裂解酶(cystathionine γ-lyase, CSE)的作用下生成谷胱甘肽的前体物质-半胱氨酸(cysteine, Cys),随后在谷胱甘肽合酶的作用下生成的谷胱甘肽。此途径主要在肝、肾、胰腺及小肠等处进行。Hcy的代谢途径决定于Met的摄入量与消耗量。当Met缺乏时,Hcy主要通过重甲基化途径,生成Met。而当Met充足时,Hcy主要通过转硫化途径,合成半胱氨酸[2]。
血浆中Hcy的水平与多种因素有关,肾脏是清除Hcy的主要器官,慢性肾病病人的血浆Hcy的水平相比动脉粥样硬化血管疾病病人有显著的升高。营养代谢过程中叶酸、维生素B6、维生素B12的缺乏以及氨甲喋呤等药物的使用会引起Hcy代谢障碍,升高血浆Hcy水平。此外,吸烟、咖啡、缺乏锻炼和饮酒以及Hcy代谢相关酶CBS、亚甲基四氢叶酸还原酶(methylene tetrahydrofolate reductase, MTHFR)基因的突变、乳腺癌和卵巢癌等因素也是引起Hcy升高的因素[1]。
2 HHcy诱导血管病变的相关机制
血管内皮的损伤是高血压及动脉粥样硬化等心血管疾病发生的首要条件。HHcy能够造成血管内皮的损伤,此观点在动物及临床实验研究中得到了双重证实,是其诱导血管病变的基础。除内皮损伤外,HHcy还能够诱导血管平滑肌细胞增生钙化,细胞外基质的降解重塑,血管内皮细胞释放的舒缩因子平衡破坏及乙酰胆碱舒血管反应的敏感性减低[3]。更为重要的是,由于内皮功能及完整性的丧失,血小板易黏附于血管内腔面,引起动脉粥样硬化和血栓形成[2]。临床研究表明[4],在基础治疗的前提下,通过补充叶酸和维生素B12能够降低高血压合并HHcy患者血清Hcy水平和血压,提高血清NO水平,稳定颈动脉粥样硬化斑块,改善内皮及自主神经功能。氧化应激与内质网应激参与血管内皮损伤和炎症反应,在某些心血管疾病中如动脉粥样硬化发生发展中起着关键的作用,HHcy被认为是诱发应激反应的因素。
2.1 HHcy与氧化应激
Hu等[5]研究表明,Hcy呈浓度依赖性地促进人主动脉平滑肌细胞内活性氧(reactive oxygen species, ROS)的生成, 同时显著抑制谷胱甘肽、超氧化物歧化酶的水平,降低抗氧化物质的活性,导致氧化应激。Hcy有一个高活性巯基,容易自我氧化,通过二硫键与其他游离的硫醇结合,产生过氧化氢、羟自由基等ROS物质;此外,Hcy还能够增加NADPH氧化酶的表达,产生大量ROS促进氧化应激。
2.1.1 HHcy通过氧化应激抑制NO活性
一氧化氮(nitric oxide,NO)是来源于内皮细胞的舒张血管的物质,主要由内皮型一氧化氮合酶(endothelial nitric oxide synthase, eNOS)合成。NO能够跨膜扩散至血管平滑肌细胞,通过激活NO-GC-cGMP途径对大动脉和小血管舒张刺激进行应答,在血管腔内,NO还能有效抑制血小板和白细胞的黏附和聚集。此外,NO还能够抑制DNA合成,减弱有丝分裂,抑制血管平滑肌细胞增殖[6]。高水平的Hcy能够显著提高ROS水平,降低NO的生物活性,造成内皮依赖性血管舒张功能紊乱,引发血管病变。
内皮细胞内的NO是由eNOS以L-精氨酸作为底物下合成的。Hcy可通过氧化应激抑制精氨酸转运体对精氨酸的转运,造成L-精氨酸缺乏。L-精氨酸的缺乏不仅能够减少NO的合成,还会造成eNOS的解偶联,加剧对NO生成的抑制[3]。eNOS以异质二聚体的形式存在,由其中一个单体的还原酶结构域与另外一个单体的氧结构域结合形成。在还原酶结构域,来自NADPH的电子,作为一种辅助因子,促进血红素与氧的结合,生成的亚铁-双氧复合物随后在氧结构域氧化L-精氨酸产生NO[7]。
当缺乏充足的L-精氨酸,氧结构域产生的NO减少,但氧化酶结构域继续消耗氧分子,生成超氧化合物。因此,eNOS的解偶联使其失去对机体的保护作用,产生ROS自身由一种保护性酶转变为一种产生ROS的酶,促进氧化应激。四氢生物蝶呤(tetrahydrobiopterin, BH4)是eNOS重要的辅助因子,来自于eNOS解偶联和NADPH氧化酶等途径的ROS与NO结合形成过氧化亚硝酸盐。BH4对过氧化亚硝酸盐极为敏感,能够显著被氧化,形成BH3,而BH3不是eNOS的辅助因子,因此氧化应激能够通过消耗BH4,加重eNOS的解偶联,形成恶性循环[8]。
在培养的人脐静脉内皮细胞中,使用eNOS抑制剂L-NAME能够抑制Hcy诱导ROS的产生,证实解偶联的eNOS确实能促进氧化应激[8]。值得注意的是Hcy能够抑制细胞内谷胱甘肽等抗氧化物质的生成,间接说明Hcy不仅能通过增加ROS的生成促进氧化应激,还能通过抑制内皮细胞抗氧化能力促进氧化应激。
此外,Hcy代谢过程中,由于转换酶或辅酶的缺少,在氨基酞-tRNA合酶的催化下,导致Hcy的巯基与羧基通过硫酯结合在一起,形成的同型半胱氨酸硫内酯也能促进ROS的产生[1, 9]。上述途径产生的ROS能与NO结合,生成过氧化亚硝酸盐,从而加重NO活性的丧失,导致内皮功能紊乱。
Hcy诱导的NO减少的另一个机制可能是由于不对称性二甲基精氨酸(asymmetric dimethylarginine, ADMA)的产生。在蛋白质翻译后修饰过程中,多肽中的精氨酸残基被蛋白质-精氨酸甲基转移酶甲基化水解后,形成ADMA[10]。临床研究发现,冠心病患者体内的ADMA能够显著降低NOS活力减少NO的生成,加重血管损伤[11]。由于其结构与L-精氨酸相似,ADMA可以作为内源性的eNOS竞争抑制剂,减少NO的产生。ADMA除经肾脏排除以外,大多被二甲基精氨酸二甲基氨基水解酶(dimethylarginine dimethylaminohydrodrolase, DDAH)降解。Hcy可能是作为DDAH的抑制剂,导致DDAH催化能力的丧失,ADMA集聚,从而抑制NO的生成,促进Hcy对细胞的损伤[10]。
Hcy引起的NO的减少不仅能够导致内皮损伤,使血管平滑肌持续性收缩,引起缺氧,促进平滑肌损伤,同时激活炎症因子引起黏附分子表达增多,使细胞膜上的不饱和脂肪酸过氧化,造成细胞死亡脱落,加重血管病变。
2.1.2 HHcy通过氧化应激激活基质金属蛋白酶
基质金属蛋白酶(matrix metalloproteinase, MMP)是一类锌离子依赖的蛋白水解酶,能够水解胶原蛋白、弹性蛋白等,是细胞外基质降解和重建的关键酶系,ROS能够激活MMP造成血管重塑。MMP-2是一种重要的参与动脉粥样硬化斑块形成的蛋白酶,与正常组织相比,发现其在粥样硬化斑块处高表达,Hcy能通过氧化应激增强大鼠血管内皮中MMP-2 mRNA和蛋白的表达,促进动脉粥样硬化的发生发展[12],且Hcy诱导MMP-2的表达,能够增加细胞内钙离子含量,参与血管平滑肌细胞的钙化[13]。一项临床研究表明[4],MMP-9是H型高血压动脉弹性的独立性影响因素,能够引起血管平滑肌细胞的增殖和迁移,造成血管重塑。由于MMP表达升高造成细胞外基质降解、重分布和钙化,导致血管管腔狭窄而促进动脉粥样硬化的发生。
2.1.3 HHcy通过氧化应激激活MAPK相关通路促进血管平滑肌增殖
平滑肌细胞的增殖与迁移引起的血管重塑是动脉粥样硬化发生发展过程中关键步骤之一。与平滑肌细胞的增殖有关的通路有很多,其中MAPK在平滑肌细胞的增殖与迁移过程中起着重要的作用。MAPK家族主要由p38、ERK1/2和JNK组成。Hcy能够随时间依赖性和剂量依赖性促进p38MAPK磷酸化,其机制可能是由于Hcy能够促进NADPH氧化酶的Nox1亚基磷酸化,激活NADPH氧化酶,诱导血管平滑肌细胞中ROS的增加[14]。已证实Hcy通过氧化应激可激活ERK1/2信号通路。于曼丽等[15]人研究发现,Hcy能够激活ERK1/2信号通路促进大鼠血管平滑肌血管紧张素Ⅱ受体1的表达。血管紧张素Ⅱ是一种重要的血管活性肽,可以通过自分泌和旁分泌作用于平滑肌细胞,刺激血管平滑肌细胞的增殖。提示HHcy通过氧化应激而激活MAPK相关通路,进而促进血管平滑肌增殖。
2.1.4 HHcy通过氧化应激刺激炎症因子形成
Hcy能通过激活NF-кB导致TNF-ɑ和ICAM-1(intercellular adhesion molecule 1) 生成增多,诱发炎症反应,其发生机制可能与氧化应激有关[16]。NF-кB是普遍存在于真核细胞胞浆中的一种核转录因子,是由P50和P65两种亚基组成的异源二聚体。正常情况下NF-KB的P65亚基与其抑制蛋白IKB结合,以无活性的三聚体形式存在于胞浆中。当一系列原因诱导IKB发生磷酸化,NF-кB与IKB解离进入细胞核内与DNA上的KB序列结合,调控TNF-ɑ和ICAM等炎症因子的表达进而调节细胞生长与凋亡。TNF-ɑ主要是由单核细胞和巨噬细胞产生,但是在某些情况下内皮细胞也能表达。过表达的TNF-ɑ能够破坏内皮细胞和血管壁,促进动脉粥样硬化的发展。生理状态下ICAM-1在血管内皮细胞低表达,而受到Hcy等刺激时,其表达量则升高,白细胞黏附于血管壁,导致血管壁损伤[16]。HHcy能够激活NF-КB信号途径,诱导单核趋化蛋白-1(monocyte chemoattractant protein-1, MCP-1)的生成增多,促进巨噬细胞向血管内膜迁移,还能通过激活NF-КB途径促进VEGF的生成,致血管重塑[17]。此外,氧化应激能激活NMDAr-ROS-MAPK-NF-kB通路,使C反应蛋白(C- reactive protein, CRP)表达升高。CRP作为一种炎性因子,能够刺激内皮细胞释放ET-1和IL-6的释放,增加黏附分子、MCP-1表达,上调LDL的含量。更为重要的是,CRP能够促进血管平滑肌细胞的迁移与增殖,加速心血管疾病的发生发展[18]。
近年来,有学者提出了巨噬细胞亚型学说,巨噬细胞有两种极端表型,分别为M1型与M2型。M1型能够通过促进诱导型一氧化氮合酶生成分泌促炎细胞因子、ROS和NO加强对靶组织或靶器官的破坏。当各种原因导致巨噬细胞在血管内聚集时,M1型巨噬细胞分泌的化学因子会造成内皮及血管壁的损伤,被认为是某些血管疾病的始动因素。相反的,M2型能够促进血管的存活与再生,主要与其释放的抗炎因子及生长因子有关。已证实,M2型能够释放IL-10、PPAR-γ及血管内皮生长因子(vascular endothelial growth factor, VEGF),从而发挥抗炎、抗氧化和促进血管内皮细胞增殖的作用[17]。IL-10能够抑制促炎因子的表达。PPAR-γ是一种抗氧化剂,能够提高胰岛素敏感性。
蛋氨酸诱导的HHcy能够引起巨噬细胞相关的组织因子释放。体外实验表明,Hcy能够促进MCP-1和IL-8的分泌,但这一现象被自由基清除剂所阻断,提示Hcy诱导生成的ROS是造成巨噬细胞释放炎症因子的原因[19]。此外,HHcy可能对巨噬细胞亚型的反应程度不同,与M2型相比,M1型更容易受HHcy的影响,因此,运动能够调节M1/M2,使比值减小,从而减轻炎症反应[17]。不难看出,HHcy导致巨噬细胞向血管壁迁移,可促进动脉粥样斑块的发生发展。
2.2 HHcy与内质网应激
HHcy导致的血管损伤不仅起源于氧化应激。病理剂量的Hcy能够通过未折叠蛋白反应(unfolded protein response, UPR)引起内质网应激诱导细胞凋亡[20]。内质网是新生蛋白质翻译后修饰折叠的场所。为了防止折叠混乱的发生,这个进程由折叠酶和分子伴侣共同参与。只有正确的折叠物质才能被运送到高尔基体,错误折叠的蛋白质保留在内质网中进行重新的折叠或降解。任何未折叠和聚合的蛋白质的积聚都会导致内质网应激级联信号通路的激活,称为UPR。
UPR通过促进分子伴侣的产生,上调内质网蛋白折叠能力,减少蛋白的错误折叠,还能通过抑制蛋白质的转录和翻译,减少内质网蛋白负载。UPR主要有三种转导通路:IRE1(抑制物阻抗性酯酶1)、双链RNA依赖的蛋白激酶样内质网类激酶(PERK)和活化转录因子6(ATF6)。当出现过强或者持久刺激时,内质网的功能紊乱得不到修正,造成UPR过载,启动细胞凋亡程序,最终导致细胞坏死和组织损伤。
Hcy是内质网应激的激活剂,蛋白质印迹法测定分析表明Hcy能够剂量依赖性提高内皮细胞UPR效应分子GRP78、ATF4、IRE1和ATF6水平,说明UPR是Hcy引起内质网应激的一个途径[5]。
Hcy通过增强CHOP/GADD153的表达激活内质网应激造成内皮细胞凋亡[21]。CHOP/GADD153属于CCAAT增强子结合蛋白家族。在休眠细胞,CHOP/GADD153的表达量很低,过度的CHOP/GADD153表达将造成细胞周期停滞和细胞凋亡。此外,Hcy能够通过内质网应激抑制内皮细胞膜上的钙离子激活性钾通道(calcium-activated potassium, KCa)激活,在血管张力调节方面有着重要的意义。KCa激活引起的超级化已经被证实能够提高内皮细胞钙离子入胞驱动力,引起钙离子依赖性的eNOS激活,随后NO产生增多,舒张血管平滑肌[22]。侯跃龙等[23]研究表明,Hcy能剂量依赖性地促进大鼠血管平滑肌细胞钙化,升高内质网应激分子p-PERK、p-IRE1和ATF6表达,提示Hcy通过内质网应激途径促进血管平滑肌细胞钙化。
3 HHcy血管病变干预
3.1 运动干预
运动能够降低体内氧化应激水平,抗炎,稳定动脉粥样硬化斑块,减轻HHcy所致的毒性反应,加之没有药物的毒副作用,相比药物疗法,运动疗法对HHcy有着更重要意义。在叶酸缺乏所致的HHcy模型中,运动能够提高肾脏甜菜碱高半胱氨酸甲基转移酶水平,促进Hcy通过重甲基化途径转变为蛋氨酸,降低Hcy水平。此外,运动能够通过增加PON1,降低HHcy氧化应激所致的脂质过氧化,从而抑制动脉粥样硬化的发展[24]。
3.2 药物干预
3.2.1 西药干预
西药的研究目前主要以抑制氧化应激和抗炎为主,阿托伐他汀能够抑制Hcy诱导的Nox1依赖性的活性氧的生成和p38MAPK通路的激活,抑制血管平滑肌细胞的迁移,抑制动脉粥样硬化和高血压的发生发展[14]。罗格列酮上调过氧化物酶体增殖物激活受体 (peroxisome proliferator-activated receptor, PPAR)γ表达,降低氧化应激,能保护Hcy诱导的内皮损伤[9]。
3.2.2 中药干预
丹参素能够抑制Hcy诱导的炎症介质ICAM-1和TNF-α的表达,起到抗炎的作用[16]。大蒜素能抑制高Hcy血症诱导的脂质过氧化,调节NO与内皮素(ET)的分泌与平衡,保护血管内皮[25]。大黄素能降低Hcy诱导的CRP和ROS生成,干预ROS-ERK1/2/p38信号通路,上调PPARγ表达而降低内质网应激,起到抗炎、抗动脉粥样硬化的作用[18]。旱莲草提取物能显著降低HHcy大鼠血清Hcy、总胆固醇和三酰甘油水平,调节血脂,同时能降低ET水平,升高NO水平,调节NO/ET 比例,从而抑制HHcy对心血管的损害作用[26]。高浓度红景天苷(300μmol/L)能够显著抑制内质网应激凋亡信号CHOP的表达,降低未折叠蛋白反应中PERK和IRE1α 的磷酸化水平,从而保护内皮细胞[27]。番茄红素能够调节HHcy引起的炎症反应,改善纤溶功能,延缓动脉粥样硬化的产生[28]。
4 展 望
HHcy是动脉粥样硬化等血管疾病的独立危险因素,其诱导的应激反应造成的内皮损伤和炎症反应是血管病变的重要机制。近年来的基础研究显示,一些中药单体对HHcy血管病变有良好的保护作用,但目前并未应用于临床,还在处于临床试验阶段。希望在未来的几年中,中药单体在临床防治HHcy血管病变中得以重视及发展。
[1] Ganguly P, Alam SF. Role of homocysteine in the development of cardiovascular disease [J]. Nutrition Journal, 2015, 14: 6.
[2] Perla-Kajan J, Twardowski T, Jakubowski H. Mechanisms of homocysteine toxicity in humans [J]. Amino Acids, 2007, 32(4): 561-572.
[3] Jin L, Caldwell RB, Li-Masters T, et al. Homocysteine induces endothelial dysfunction via inhibition of arginine transport [J]. Journal of Physiology and Pharmacology, 2007, 58(2): 191-206.
[4] 李刚. 叶酸联合维生素B12对高血压伴高同型半胱氨酸血症患者颈动脉硬化的影响[J]. 中华高血压杂志, 2015, 23(2): 182-184.
[5] Hu H, Wang C, Jin Y, et al. Alpha-lipoic acid defends homocysteine-induced endoplasmic reticulum and oxidative stress in HAECs [J]. Biomedicine Pharmacother, 2016, 80: 63-72.
[6] Forstermann U, Munzel T. Endothelial nitric oxide synthase in vascular disease: from marvel to menace [J]. Circulation, 2006, 113(13): 1708-1714.
[7] 赵艳霞, 格日力. 内皮型一氧化氮合酶脱偶联在心血管疾病中的致病作用[J]. 中国循环杂志, 2014, 29(4): 315-318.
[8] Lai WK, Kan MY. Homocysteine-Induced Endothelial Dysfunction [J]. Annals of Nutrition & Metabolism, 2015, 67(1): 1-12.
[9] 杨旭红, 李鹏, 戴文, 等. 罗格列酮对同型半胱氨酸硫内酯所致内皮细胞损伤的保护作用与PPARγ介导的抗氧化相关[J]. 中国动脉硬化杂志, 2015, 23(6): 549-555.
[10] Stuhlinger MC, Tsao PS, Her JH, et al. Homocysteine impairs the nitric oxide synthase pathway: role of asymmetric dimethylarginine [J]. Circulation, 2001, 104(21): 2569-2575.
[11] 陈景开, 王霄, 陈满清, 等. 冠心病患者不对称二甲基精氨酸和同型半胱氨酸对一氧化氮合酶和一氧化氮的影响[J]. 中国微循环, 2007, 50(2): 125-127.
[12] 季政, 郭航远, 池菊芳, 等. 同型半胱氨酸对大鼠血管内皮细胞MMP-2表达的影响和黄酒、红葡萄酒的逆转效应及其机制[J]. 西安交通大学学报:医学版, 2013, 34(3): 313-319.
[13] Liu T, Lin J, Ju T, et al. Vascular smooth muscle cell differentiation to an osteogenic phenotype involves matrix metalloproteinase-2 modulation by homocysteine [J]. Molecular and Cellular Biochemistry, 2015, 406(1-2): 139-149.
[14] Bao XM, Zheng H. Atorvastatin attenuates homocysteine-induced migration of smooth muscle cells through mevalonate pathway involving reactive oxygen species and p38 MAPK [J]. Clinical and Experimental Pharmacology & Amp; Physiology, 2015, 42(8): 865-873.
[15] 姜衡, 于曼丽, 魏勇, 等. 同型半胱氨酸在大鼠血管平滑肌细胞上通过激活ERK1/2信号通路促进血管紧张素Ⅱ受体1表达[J]. 第二军医大学学报, 2014, 35 (9): 968-973.
[16] Yang RX, Huang SY, Yan FF, et al. Danshensu protects vascular endothelia in a rat model of hyperhomocysteinemia [J]. Acta Pharmacologica Sinica, 2010, 31(10): 1395-1400.
[17] Winchester L, Veeranki S, Givvimani S, et al. Exercise mitigates the adverse effects of hyperhomocysteinemia on macrophages, MMP-9, skeletal muscle, and white adipocytes [J]. Canadian Journal of Physiology and Pharmacology, 2014, 92(7): 575-582.
[18] Pang X, Liu J, Li Y, et al. Emodin Inhibits Homocysteine-Induced C-Reactive Protein Generation in Vascular Smooth Muscle Cells by Regulating PPARgamma Expression and ROS-ERK1/2/p38 Signal Pathway [J]. PloS One, 2015, 10(7): e0131295.
[19] Zeng X, Dai J, Remick DG, et al. Homocysteine mediated expression and secretion of monocyte chemoattractant protein-1 and interleukin-8 in human monocytes [J]. Circulation Research, 2003, 93(4): 311-320.
[20] Schroder M, Kaufman RJ. ER stress and the unfolded protein response [J]. Mutation Research, 2005, 569(1-2): 29-63.
[21] Skurk C, Walsh K. Death receptor induced apoptosis: a new mechanism of homocysteine-mediated endothelial cell cytotoxicity [J]. Hypertension, 2004, 43(6): 1168-1170.
[22] Wang XC, Sun WT, Yu CM, et al. ER stress mediates homocysteine-induced endothelial dysfunction: Modulation of IKCa and SKCa channels [J]. Atherosclerosis, 2015, 242(1): 191-198.
[23] 侯跃龙, 陆薇薇, 张金胜, 等. 同型半胱氨酸通过内质网应激反应促进大鼠血管平滑肌细胞钙化[J]. 中国动脉硬化杂志, 2015, 23(5): 437-442.
[24] Chernyavskiy I, Veeranki S, Sen U, et al. Atherogenesis: hyperhomocysteinemia interactions with LDL, macrophage function, paraoxonase 1, and exercise [J]. Annals of the New York Academy of Sciences, 2016, 1363(1): 138-154.
[25] Liu DS, Gao W, Liang ES, et al. Effects of allicin on hyperhomocysteinemia-induced experimental vascular endothelial dysfunction [J]. European Journal of Pharmacology, 2013, 714(1-3): 163-169.
[26] 黄川锋, 秦玖刚, 王爱梅, 等. 旱莲草水提取物对高同型半胱氨酸血症大鼠血脂及血管内膜的影响[J]. 中国临床药理学杂志, 2015, 31(10): 882-885.
[27] 朱琳, 王彦军, 俞天虹,等. 红景天苷通过抑制内质网应激减少高同型半胱氨酸诱导的人脐静脉内皮细胞损伤[J]. 中国动脉硬化杂志, 2015, 23(1): 5-10.
[28] 郭娴, 李亮, 曹建民, 等. 番茄红素对高同型半胱氨酸血症大鼠血管内皮舒缩功能和纤溶功能的影响[J]. 天然产物研究与开发, 2015, 27(1): 41-44, 98.
国家自然科学基金项目(31571175),国家级大学生创新创业训练项目(201510439103)。
吕航吉(1993—),男,临床医学与英语六年制本科。
文今福(1965—),女,博士,教授,研究方向:心血管药理学,E-mail:jfwen@tsmc.edu.cn。
R543
A
1004-7115(2017)01-0112-05
10.3969/j.issn.1004-7115.2017.01.045
2016-05-15)

