梓醇外泌体对低血清培养致人神经母细胞瘤(SH-SY5Y)细胞损伤的保护作用
张小艺 郑宏 王永强 王蕾
·论著·
梓醇外泌体对低血清培养致人神经母细胞瘤(SH-SY5Y)细胞损伤的保护作用
张小艺 郑宏 王永强 王蕾
目的 探讨梓醇外泌体对低血清培养致人神经母细胞瘤(SH-SY5Y)细胞损伤的保护作用。方法梓醇80 μmol/L预处理SH-SY5Y细胞72小时后,收集细胞上清液,聚合物沉淀法提取细胞上清液外泌体;乙酰胆碱酯酶法测定外泌体含量;将提取出的外泌体加入低血清培养的SH-SY5Y细胞中,24小时后,CCK-8法测定其细胞存活率。结果与空白对照组比较,梓醇给药组细胞外泌体分泌量明显增多(P<0.05);与空白外泌体组比较,梓醇外泌体能明显升高细胞存活率(P<0.05)。结论梓醇可以促进SH-SY5Y细胞分泌外泌体,梓醇外泌体对低血清致SH-SY5Y细胞损伤有明显的神经保护作用。
梓醇; 外泌体; SH-SY5Y细胞
梓醇是来自于地黄中一种环烯醚萜苷的小分子量天然化合物,分子式为C15H22O10,分子量362.45。研究发现,梓醇可通过抗氧化、调节细胞免疫、升高神经营养因子表达等作用促进神经的修复和重塑[1-3],是治疗中枢神经退行性病变的潜在药物,但对于梓醇是如何发挥上述作用的目前研究较少。
最近研究发现,外泌体是一类纳米单位(小于200 nm)的膜性囊泡,由多种活体细胞释放到细胞外,随体液流至全身,外泌体具有无毒、无免疫原性等特性,并具有透过血脑屏障的能力[4-5]。外泌体携带了来自原细胞的生物遗传信息,如mRNAs、蛋白质等。研究发现,外泌体广泛参与细胞之间的交流,作用于靶细胞,调节生理过程,外泌体还传递疾病信息,如内皮细胞外泌体促使单核和淋巴细胞透过血脑屏障,扩散炎症反应,造成脱髓鞘[6]。但经过某些良性外源性因素修饰的外泌体可递送相关信息,减少细胞损伤,促进组织修复[7]如干扰素刺激树突状细胞释放的外泌体能促进MS大鼠髓鞘再生[8];经miR-150*修饰的骨髓间充质干细胞来源的外泌体能够对胶质瘤细胞发挥抑癌作用[9]。
笔者推测梓醇通过修饰外泌体发挥对神经细胞的保护作用。因此,本实验观察梓醇对SH-SY5Y细胞外泌体分泌的影响,并进一步采用低血清致SH-SY5Y神经细胞损伤模型,观察梓醇修饰过的外泌体对神经细胞的保护作用。
1 材料与方法
1.1 药物及试剂
人胚胎来源的神经母细胞瘤细胞株(SH-SY5Y)细胞由北京脑重大疾病研究院王晓民教授惠赠。梓醇标准品(购于中国食品药品鉴定研究所,批号:110808-201210,纯度>98%);RPMI 1640培养基(Corning公司);胎牛血清、青霉素-链霉素和0.25%胰酶(Gibco公司);CCK-8试剂盒(日本株式会社同仁化学研究所);Exosome Isolation kit试剂盒(美国101Bio公司);EXOCET试剂盒(美国SBI公司)。
1.2 实验仪器
正置相差显微镜(日本Nikon公司);CO2培养箱(美国Thermo公司);生物安全柜(新加坡艺思高科技有限公司);台式离心机(上海安亭科学仪器厂);酶标分析仪(美国Molecular Devices公司);-80℃低温冰箱(美国Thermo公司);4℃冰箱(中国海尔公司);VG3S25型涡旋震荡器(IKA公司);低温生物离心机(德国Eppendorf AG公司);超速离心机(日本Hitachi Koki Co公司)。
1.3 SH-SY5Y细胞培养
细胞培养在RPMI 1640培养基中(含体积分数10% FBS、100 U/mL青霉素和100 μg/mL链霉素),接种在75 cm2培养瓶中。在5% CO2、37℃培养箱中孵育。每4~5天传代一次。
1.4 细胞计数试剂盒CCK-8测定SH-SY5Y细胞存活率
取对数生长期的SH-SY5Y细胞,调其密度为3×105/mL,接种于96孔板中,每孔100 μL,并分别加入各组不含细胞的空白溶液。经过处理后,每孔加入10 μL CCK-8溶液,培养箱中孵育1.5~2小时。用酶标仪在450 nm波长检测各孔的吸光度值(optical density,OD)。细胞存活率=(实验组OD值-实验组空白溶液OD值)/(空白对照组OD值-空白对照组空白溶液OD值)×100%。
1.5 低血清致SH-SY5Y细胞损伤模型的建立
细胞正常培养2~3天后,接种在96孔培养板中,分为空白对照组和模型组。模型组分别用低血清(2.5%、1%、0.5% FBS)培养基培养细胞48小时,空白对照用正常10% FBS培养。48小时后用CCK-8测定细胞存活率,确定低血清致SH-SY5Y细胞损伤的血清浓度。
1.6 梓醇给药浓度的确定
细胞接种在96孔培养板中,每孔100 μL,分为空白对照组、模型组和梓醇组。模型组和梓醇组用低血清(2.5%FBS)培养基培养细胞24小时,梓醇组分别用不同浓度的梓醇(60、80、100 μM)进行干预,继续培养24小时,24小时后用CCK-8测定细胞存活率,选择梓醇给药浓度。
1.7 聚合物沉淀法提取梓醇外泌体
细胞接种在75 cm2培养瓶中,加入梓醇(80 μM)后培养3天,弃去含血清培养基,用PBS冲洗3~5遍,加入无血清RPMI 1640培养基适量,孵育24小时,收集上清液,按美国101Bio公司生产的Exosome Isolation kit说明书提取细胞上清液中的外泌体。
1.8 透射电子显微镜观察外泌体形态
将提取的外泌体载于直径为2 mm的铜网上,用滤纸将多余液体从铜网边缘轻轻吸去。将2%磷钨酸盐溶液滴于铜网上,室温环境下进行负染,时间为5分钟。蒸馏水轻柔冲洗两次,用滤纸将多余液体吸出。将此铜网置于透射电镜下,于80 KV下观察外泌体形态。
1.9 外泌体含量的测定
用EXOCET试剂盒的乙酰胆碱酯酶(acetylcholinesterase, AChE)活性测定法检测细胞分泌的外泌体含量,用酶标仪在405 nm测定OD值。
1.10 梓醇修饰的外泌体对低血清致SH-SY5Y神经细胞损伤模型的保护作用
细胞接种在96孔培养板中,每孔100 μL。分为空白对照组、模型组、空白外泌体组和梓醇外泌体组。模型组、空白外泌体组和醇外泌体组均用低血清(2.5% FBS)培养基培养细胞24小时,再分别加入空白低血清、空白外泌体、梓醇外泌体10 μL,空白对照组加正常血清(10% FBS)培养基10 μL,继续培养24小时,用CCK-8测定细胞存活率。
1.11 统计学处理
2 结果
2.1 不同浓度血清对SH-SY5Y细胞存活率的影响
不同浓度血清(2.5%~0.5%)培养细胞48小时后,细胞数量明显减少,存活率降低,模型组1组(2.5%)存活率为66.67%,下降约33.00%,差异有统计学意义(P<0.05),因此选择2.5% FBS血清作为细胞损伤模型的浓度。见表1。
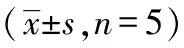
表1 不同浓度血清对SH-SY5Y细胞存活率的影响
2.2 不同梓醇浓度对SH-SY5Y细胞存活率的影响
随着梓醇给药浓度的增加,细胞存活率逐渐升高,当梓醇的给药浓度为80和100 μM时,细胞存活率较模型组明显升高至86.14%和88.44%,差异有统计学意义(P<0.05)。因此,选用80 μM为作为后续实验梓醇给药的浓度。见表2。
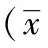
表2 不同浓度梓醇对低血清致SH-SY5Y细胞损伤模型细胞存活率的影响±s,n=3)
注: 与空白对照组相比,aP<0.05;与模型组相比,bP<0.05。
2.3 梓醇对细胞外泌体分泌的影响
梓醇(80 μM)干预细胞后,梓醇组每1×106个细胞分泌外泌体4.349×108个,高出正常组3倍具有统计学意义(P<0.05)。透射电镜下观察到外泌体呈大小均匀的圆形或椭圆形的囊泡,直径为30~100 nm,染色后可见膜状结构。见表3、图1。
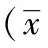
表3 梓醇干预细胞后分泌外泌体含量变化±s,n=2)

图1 透射电子显微镜下的外泌体
2.4 梓醇外泌体对低血清致SH-SY5Y神经细胞损伤模型的保护作用
外泌体浓度为4.0×106时,梓醇外泌体组与空白外泌体组相比细胞存活率升高约17%,存在显著性差异(P<0.05)。见表4。
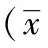
表4 梓醇外泌体干预细胞后存活率变化±s,n=3)
注: 与空白对照组比较,aP<0.05;与模型组比较,bP<0.05;与空白外泌体组比较,cP<0.05。
3 讨论
大量研究发现梓醇有保护神经细胞作用,如梓醇可显著提高APP/PS1转基因阿尔兹海默病(Alzheimer's disease,AD)小鼠的空间学习记忆能力[10];梓醇可以明显升高衰老CHOm2细胞M2受体密度,改善海马组织结构萎缩引起的认知和记忆障碍进而治疗AD[11];梓醇可下调脑缺血大鼠感觉运动皮质和勿动蛋白(Nogo)-A及其Nogo受体蛋白表达,有助于改善轴突再生限制性微环境[12];梓醇对局灶性脑缺血SD大鼠的神经血管单元病变有明显的保护作用,且能促进脑缺血后神经功能的恢复[13];梓醇能够改善MPP+损伤小胶质细胞BV2胞内20S蛋白酶体含量和功能的药物可以选择作为帕金森综合征治疗的潜在药物[14];但其作用机制尚需进一步明确。本实验结合外泌体的最新研究进展,观察梓醇对SH-SY5Y细胞外泌体分泌的影响,并进一步采用低血清致SH-SY5Y神经细胞损伤模型,观察梓醇修饰过的外泌体对神经细胞的保护作用。
外泌体可以参与细胞间信息交流,包括膜表面信号分子的直接作用,膜融合时内容物的胞内调节以及生物活性成分的释放调节。在中枢系统疾病中神经元轴索损伤后,外泌体充当运载体的角色促进自身核糖体富集而起到神经保护作用[15]。外泌体作为药物投递的内源纳米级运载体,具有向细胞转运效率高、有靶向性、减轻免疫反应及降低药物毒副作用等特点[16-17]。如姜黄素外泌体通过减轻氧化应激、减少紧密连接蛋白和黏附连接蛋白表达以恢复巯基丁氨酸损伤的内皮细胞通透性[18]。在本实验研究中,梓醇预处理过的SH-SY5Y神经细胞,其外泌体分泌量明显增高;并且,梓醇外泌体使细胞存活率也明显升高,表明梓醇修饰的外泌体可以起到神经保护作用,通过对存活率升高幅度的观察,梓醇外泌体的保护作用和梓醇直接给药的保护作用相似,提示外泌体携带了梓醇的药物信息对神经细胞发挥保护作用,但梓醇改变了外泌体哪些信号分子发挥神经保护作用还有待深入研究。
[1] 蔡其燕,姚忠祥.梓醇在神经系统作用的研究进展[J].现代生物医学进展,2010,10(18):3589-3597.
[2] 张秀杰,尹安春,刘晶,等.中西医结合角度谈地黄活性成分梓醇的神经保护作用及治疗前景[J].辽宁中医杂志,2013,40(6):1273-1276.
[3] 祝慧凤,万东,张芬,等.地黄梓醇脑保护的药理作用及机制研究进展[J].中国中药杂志,2009,34(23):2983-2986.
[4] Kalani A,Tyagi A,Tyagi N.Exosomes:mediators of neurodegeneration,neuroprotection and therapeutics[J].Molecular neurobiology,2014,49(1):590-600.
[5] Yang T,Martin P,Fogarty B,et al.Exosome delivered anticancer drugs across the blood-brain barrier for brain cancer therapy in Danio Rerio[J].Pharm Res,2015,32(6):2003-2014.
[6] Minagar A, Maghzi AH, McGee JC,et al.Emerging roles of endothelial cells in multiple sclerosis pathophysiology and therapy[J].Neurol Res,2012,34(8):738-745.
[7] Pusic AD,Pusic KM,Kraig RP.What are exosomes and how can they be used in multiple sclerosis therapy?[J].Expert Rev Neurother,2014,14(4):353-355.
[8] Pusic AD,Pusic KM,Clayton BL,et al.IFNγ-stimulated dendritic cell exosomes as a potential therapeutic for remyelination[J].J Neuroimmunol,2014,266(1-2):12-23.
[9] 廖克曼,季卫阳,鲁晓杰.miR-150*修饰骨髓间充质干细胞来源的exosome对胶质瘤细胞的影响[J].临床神经外科杂志,2015,12(4):273-277.
[10] 宋冲.梓醇对阿尔兹海默病的保护作用研究[D].重庆:重庆医科大学,2013.
[11] 王金红,孙启祥,夏宗勤.地黄活性成分梓醇对转基因CHO细胞M2受体的调节作用[J].中国药理学通报,2006,22(12):1462-1466.
[12] 万东,祝慧凤,罗勇.梓醇对局灶性脑缺血大鼠感觉运动皮质轴突再生限制性微环境的影响[J].中国药理学通报,2012,28(10):1370-1375.
[13] 谭灵莉,崔丹丹,祝慧凤.梓醇对脑缺血后神经血管单元构筑的影响[J].中国药理学通报,2014,30(1):44-48.
[14] 温强,杜红梅,汤姝.梓醇活性成分对MPP+诱导的BV2细胞损伤的神经保护作用[J].中国民族民间医药,2013,22(15):36.
[15] 刘儒涛,王世伟,刘晶,等.细胞间信息交流的新载体—外泌体[J].生物化学与生物物理进展,2013,40(8):719-727.
[16] 李思迪,侯信,元洪昭,等.外泌体:为高效药物投递策略提供天然的内源性纳米载体[J].化学进展,2016,28(23):353-362.
[17] 刘佳凡,杨莉,洪岸,等.外泌体在疾病诊断和药物递送系统中的应用研究进展[J].药学进展,2015,39(9):676-682.
[18] Kalani A,Kamat PK,Chaturvedi P,et al.Curcumin-primed exosomes mitigate endothelial cell dysfunction during hyperhomocysteinemia[J].Life Sci,2014,107(1-2):1-7.
(本文编辑:禹佳)
Protective effects of catalpol exosomes on damaged SH-SY5Y cells induced by low serum medium
ZHANGXiaoyi,ZHENGHong,WANGYongqiang,etal.
SchoolofTraditionalChineseMedicine,CapitalMedicalUniversity,Beijing100069,ChinaCorrespondingauthor:WANGLei,E-mail:tmwangl@ccmu.edu.cn
Objective To explore the protective effects of catalpol exosomes (C-Exos) on damaged SH-SY5Y cells induced by low serum medium. Methods Catalpol was pretreated with SH-SY5Y cells for 72 hours, and then the supernatants of the cells were collected. The polymer precipitation method was used to extract exosomes, acetylcholinesterase (AChE) method was used to detect the content of exosomes. The C-Exos were added in the cells induced by low serum medium for 24 hours, the cells viability was determined by CCK-8 method. Results Compared with the control blank, the contents of exosomes in catalpol group were significantly increased (P<0.05). Compared with the cells in blank exosomes group, the cell viability was significantly increased in the catalpol group (P<0.05).Conclusion Catalpol can promote the SH-SY5Y cells to secrete exosomes, C-Exos have protective effects on damaged cells induced by low serum medium.
Catalpol; Exosomes; SH-SY5Y cells
国家自然科学基金(81273742、81573898);北京市属高等学校高层次人才引进与培养计划-长城学者项目(CIT&TCD20140329)
100069 北京,首都医科大学中医药学院[张小艺(本科生)、郑宏、王永强(硕士研究生)、王蕾];中医络病研究北京市重点实验室[张小艺(本科生)、郑宏、王永强(硕士研究生)、王蕾]
张小艺(1994- ),女,2012级在读本科生。研究方向:中医药防治脑病的基础研究。E-mail:872781176@qq.com
王蕾(1967- ),女,博士,博士生导师。研究方向:中医药防治脑病的基础研究。E-mail:tmwangl@ccmu.edu.cn
R361+.3
A
10.3969/j.issn.1674-1749.2017.02.006
2016-10-30)

