MicroRNA-21和microRNA-664减轻肾缺血再灌注损伤的研究*
胡红林,习小庆,唐伟伟,叶真逢,黄雅为,林双泉,项明峰
(南昌大学第二附属医院泌尿外科,江西南昌330006)
论著
MicroRNA-21和microRNA-664减轻肾缺血再灌注损伤的研究*
胡红林,习小庆,唐伟伟,叶真逢,黄雅为,林双泉,项明峰
(南昌大学第二附属医院泌尿外科,江西南昌330006)
目的探讨microRNA-21和microRNA-664对肾缺血再灌注损伤(IRI)的影响。方法应用agomir-21和agomir-664预处理BALB/c小鼠,采用双侧肾蒂阻断法复制小鼠肾IRI模型,小鼠肾缺血再灌注后24 h,采用实时荧光定量聚合酶链反应(qRT-PCR)法和Western blot检测缺血后肾组织中microRNA-21和microRNA-664及其靶基因、靶蛋白的表达,观察肾脏病理组织学的变化。结果agomir-21和agomir-664预处理BALB/c小鼠经肾IRI后,肾脏损伤减轻,表现为肾小管上皮细胞坏死降低,进一步检测发现microRNA-21和microRNA-664的靶基因PTEN、PDCD4和MAPK表达降低,靶蛋白Caspase-3和ERK1/2表达受抑制。结论MicroRNA-21和microRNA-664可以通过调控其靶基因、靶蛋白的表达,从而减轻肾缺血再灌注损伤。
肾缺血再灌注损伤;microRNA-21;microRNA-664
笔者前期研究采用microRNA基因芯片技术检测雌雄小鼠肾缺血再灌注损伤后肾组织中microRNA-21(miR-21)和microRNA-664(miR-664)的表达存在明显性别差异表达[7]。基于此,本研究进一步探讨miR-21和miR-664对肾缺血再灌注损伤的调控作用。
1 材料与方法
1.1 实验动物与试剂
雄性BALB/c小鼠,年龄8~10周,体重20~25g,购自南昌大学实验动物学科部。agomir-21、agomir-664、miRNA引物、U6及miRNA相关调控基因购自广东锐博有限公司,蛋白提纯试剂盒购自湖北武汉博士德生物工程有限公司,兔抗鼠半胱氨酸天冬氨酸蛋白酶3(Caspase-3)抗体、兔抗鼠细胞外信号调节激酶1/2(extracellular-signal-regulated kinase1/2,ERK1/2)抗体购自湖北武汉博士德生物工程有限公司,辣根过氧化物酶标记的二抗购自美国TRANS公司,ECL免疫检测试剂盒购自美国Pierce公司
1.2 实验分组
雄性BALB/c小鼠按以下方案分组。Ⅰ组:agomir-21+IRI 0 min组(n=10);Ⅱ组:磷酸缓盐冲溶液(phosphate buffer saline,PBS)+IRI 0 min组(n= 10);Ⅲ组:agomir-664+IRI 0 min组(n=10);Ⅳ组:agomir-21+IRI 45min组(n=10);Ⅴ组:PBS+IRI 45 min组(n=10);Ⅵ组:agomir-664+IRI 45 min组(n=10)。agomir-21和agomir-664,经腹腔注射,5 nmol/次,隔天1次,持续1周。
1.3 肾缺血再灌注损伤模型复制
随着社会的不断发展以及信息技术的不断普及,将信息技术应用到教学中,已经成为当前教育界发展的必然趋势。在开展小学语文教学的过程中,应用信息技术开展教学,能够帮助教师营造合适的教学环境,激发学生的学习兴趣。同时,通过信息技术,教师也能够为学生提供充足的课外资源,丰富学生的知识储备,在提升学生学习质量的同时,推动学生的综合化发展。
动物术前禁食12 h后,10%水合氯醛溶液麻醉(9 ml/kg,腹腔注射)。取腹正中切口约2 cm,逐层分离进入腹腔,找到肾蒂,无损伤微型动脉夹阻断双侧肾蒂,阻断肾蒂45 min后去除动脉夹,恢复血流灌注(前期实验表明:肾脏由鲜红变紫黑色,表示肾缺血成功,恢复血供后,肾脏迅速由紫黑色变为鲜红,恢复原来颜色[3]),术毕分层缝合关闭腹腔。假手术组找到肾蒂后不阻断肾蒂血流,等待45 min后分层缝合关闭腹腔。术中应用生理盐水使小鼠保持充分的水化。术后小鼠于24~29℃的环境保暖,补充水与饲料,术后小鼠存活24 h表示建模成功。
1.4 肾脏组织病理学检查
手术后24 h,采用引颈法处死小鼠,取出肾脏,其中1个肾脏置于10%福尔马林溶液中固定,石蜡包埋,制作4μm切片,常规苏木精-伊红染色法(hematoxylin-eosin staining,HE)染色,进行Rabb半定量病理评估法评分(最高4分)[8]:正常肾脏形态为0分;最少坏死(<5%的肾小管坏死)为1分;轻度坏死(5%~25%的肾小管坏死)为2分;中度坏死(25%~75%的肾小管坏死)为3分;重度坏死(>75%的肾小管坏死)为4分。另一肾脏迅速冷冻保存于液氮,再转移至-80℃冰箱冷冻保存做后续相关检测。
1.5 总RNA提取和质量检测
肾组织约100 mg放入匀浆器中,并加入1 ml Trizol液,充分匀浆,进行样品量及质量检测,包含OD260、OD280、OD230、AgaroseElectrophoresis及Agilent Bioanalyzer等测试,检验RNA样品的浓度、纯度及完整性。
1.6 实时荧光定量聚合酶链反应(qRT-PCR)检测
取一定量的肾组织,依据TRANS公司产品说明书用Trizol液裂解,氯仿抽提总RNA,miRNA、内参U6及miRNA相关调控基因逆转录反应合成模板cDNA,置入-20℃冰箱冷冻保存。聚合酶链反应(PCR)循环次数为40次,提供的数据采用2-△△CT法分析。以20μl反应体系进行PCR,取2μl逆转录反应产物分别与miR-21引物、miR-664引物、内参照U6引物、第10号染色体缺失的磷酸酶和张力蛋白(phosphatase and tensin homolog deleted on chromosome ten,PTEN)引物、程序性细胞凋亡因子4(programmed cell death protein 4,PDCD4)引物、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)引物、β-肌动蛋白引物进行反应,反应条件按miRNA qRT-PCR使用说明书在ABI PRISM 7300 Real time PCR System上操作。
1.7 Western blot检测Caspase-3及ERK1/2蛋白表达水平
按蛋白提纯试剂盒说明书进行细胞裂解液中的蛋白提纯,应用考马斯亮兰法测定蛋白浓度。蛋白质孔上样后,经10%SDS聚丙烯酰胺凝胶电泳,电转移至硝酸纤维素膜。硝酸纤维素膜经5%脱脂牛奶封闭过夜,分别用兔抗鼠半胱氨酸天冬氨酸蛋白酶3(Caspase-3)抗体、兔抗鼠细胞外信号调节激酶1/2(ERK1/2)抗体(1∶400),4℃孵育过夜。加入相应的辣根过氧化物酶标记的二抗。按照ECL免疫检测试剂盒操作说明书进行显色、曝光、X光片冲洗,扫描后采用Image Pro Plus测量条带灰度值。
1.8 统计学方法
采用Graph Pad 5.0统计软件进行数据分析,计量资料用均数±标准差(±s)表示,计量资料组间比较用t检验或Mann-WhitneyU非参数检验,计数资料用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 注射agomir试剂后各组肾脏病理组织学评估
各组肾脏经HE染色后在显微镜下病理组织学评估,随机选取10个视野采用Rabb病理评估方法显示:Ⅰ、Ⅱ、Ⅲ组肾组织基本正常,仅见部分肾小管上皮细胞水肿。Ⅴ组肾小管上皮细胞坏死、崩解脱落以及细胞核浓缩、碎裂、核溶解,部分肾小管管腔扩张、管腔轮廓模糊,病理损伤范围>75%;而Ⅳ组和Ⅵ组可见肾小管上皮坏死明显减轻。见图1A。
Ⅰ组与Ⅱ组、Ⅱ组与Ⅲ组,肾小管病理损伤评分比较,差异无统计学意义(P=0.591和0.557);但Ⅳ组(3.112±0.151)与Ⅴ组(3.860±0.131)比较,肾小管病理损伤评分降低,差异有统计学意义(P= 0.010);同样,Ⅵ组(3.230±0.163)与Ⅴ组(3.860± 0.131)比较,肾小管病理损伤评分也降低,差异有统计学意义(P=0.013)。见图1B。
2.2 注射agomir试剂后各组肾脏组织中miR-664及miR-21相对表达量
为了检测注射药物干预前后miR-21、miR-664的表达,采用qRT-PCR检测肾脏中miR-664及miR-21表达,结果显示,miR-664的表达量Ⅲ组(1.63±0.123)与Ⅱ组(1.0)相比上调,差异有统计学意义(P=0.012);Ⅵ组(2.53±0.066)与Ⅴ组(2.07± 0.159)miR-664的表达量相比上调,其表达量差异有统计学意义(P=0.035)。见图2A。miR-21的表达量Ⅰ组(1.63±0.087)与Ⅱ(1.0)相比上调,差异有统计学意义(P=0.011);Ⅳ组(2.09±0.100)与Ⅴ组(1.56±0.122)miR-21的表达量相比上调,差异有统计学意义(P=0.021)。见图2B。
2.3 注射agomir试剂后各组肾脏组织中PTEN、PDCD-4以及MAPK mRNA的表达
为了检测miR-21的靶基因PTEN、PDCD-4和miR-664的靶基因MAPK的表达量,采用RT-qPCR检测各组肾脏中PTEN、PDCD-4以及MAPK的mRNA表达。结果显示,PTEN、PDCD-4的表达量Ⅰ组[(0.91±0.067)、(0.93±0.051)]与Ⅱ组(1.0)比较,差异无统计学意义(P=0.136和0.251),见图3A、B;MAPK的表达量Ⅲ组(0.92±0.079)与Ⅱ组(1.0)比较,差异无统计学意义(P=0.223),见图3C。PTEN、PDCD-4的表达量Ⅳ组[(0.33±0.075)、(0.30± 0.051)]与Ⅴ组[(0.53±0.066)、(0.50±0.061)]比较,差异有统计学意义(P=0.036和0.034),见图3A、B;MAPK的表达量Ⅵ组(0.28±0.066)与Ⅴ组(0.50±0.060)比较,差异有统计学意义(P=0.032),见图3C。
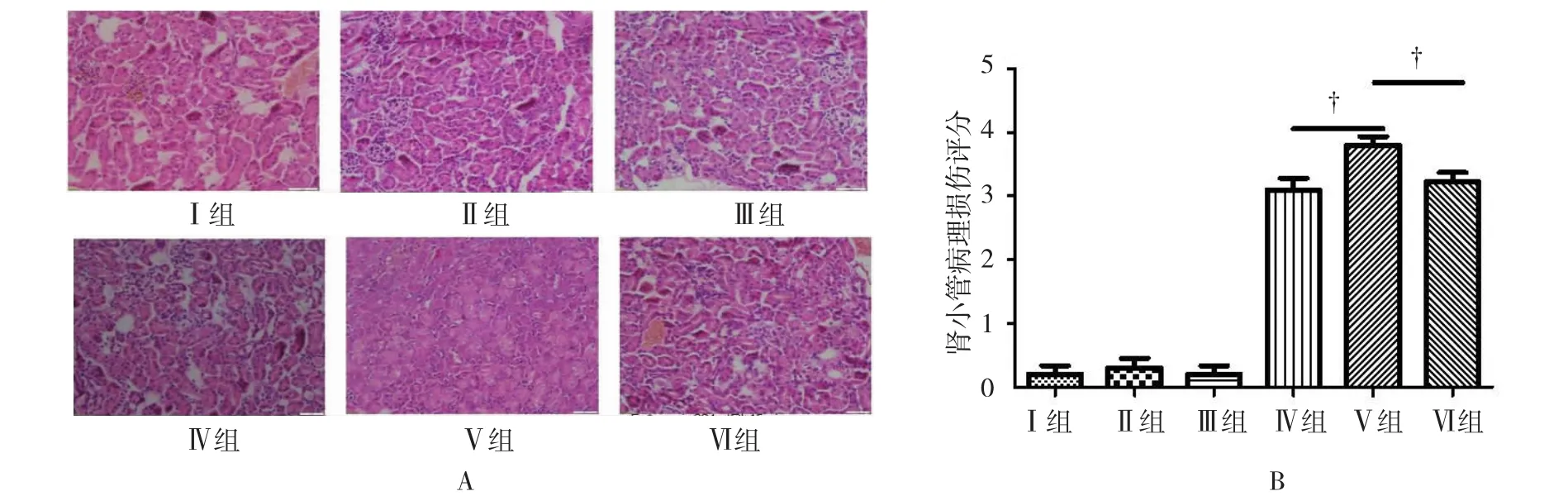
图1 BALB/c小鼠双侧肾蒂阻断45 min,恢复血流灌注后24 h肾脏病理组织学评估

图2 BALB/c小鼠双侧肾蒂阻断45 min,恢复血流灌注后24 h

图3 BALB/c小鼠双侧肾蒂阻断45 min,恢复血流灌注后24 h
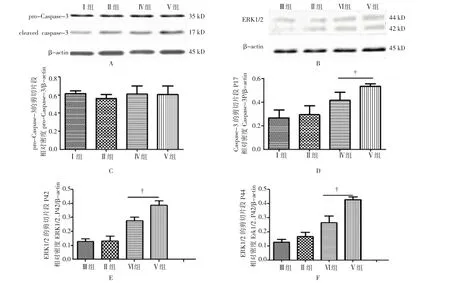
图4 BALB/c小鼠双侧肾蒂阻断45 min,恢复血流灌注后24 h肾脏中Caspase-3、ERK1/2蛋白的表达
2.4 注射agomir试剂后各组肾脏组织中Caspase-3以及ERK1/2蛋白的表达
采用Western blot法检测各组肾脏组织中Caspase-3以及ERK1/2蛋白的表达,结果显示,各组肾组织中pro-Caspase-3蛋白的表达量差异无统计学意义;而与Ⅴ组比较,Caspase-3剪切片段P17的表达量在Ⅳ组受抑制(P=0.039),ERK1/2蛋白的剪切片段P42、P44的表达量在Ⅵ组也降低(P=0.031和0.026)。见图4。
3 讨论
心、脑、肺等多种器官IRI研究中均存在性别差异,大量的临床案例及动物实验也证实肾IRI存在明显性别差异,雌性对IRI的耐受性明显强于雄性;而且笔者前期实验证实雌性和雄性小鼠肾缺血45 min是复制动物模型理想的肾缺血时间[3]。
何种机制导致肾IRI存在性别差异呢?文献报道等[9]通过构建雌雄小鼠肾缺血55 min再灌注2 h和16 h模型发现,雌雄鼠肾脏组织中Na+K+ATP酶(以下简称NKA)的mRNA存在差异,但在肾缺血再灌注后该差异更加明显,而NKAα1蛋白在肾缺血再灌注前表达相似,但在缺血再灌注损伤后雌性表达明显升高,这说明NKAα1蛋白和mRNA的更高表达有助于改善雌鼠肾缺血后肾功能。另一方面,雌激素可能通过维持Na+Ca2+交换器从而对肾缺血再灌注损伤起保护作用[10-11]。KANG等[12]研究表明,去势的雄性大鼠可以减轻大鼠肾缺血后的炎症反应和肾小管损伤,补充睾酮可以逆转此保护作用;而切除卵巢后的雌性大鼠肾缺血后炎症反应和肾小管损伤均明显加重,同样补充雌激素可以逆转此损伤,他们认为雄性大鼠对肾缺血更敏感是由于缺血后肾脏增强了炎症反应。PARK等[1]通过研究认为,体内睾酮出现而不是雌激素缺乏使小鼠对肾缺血再灌注损伤更敏感,睾酮可以通过非雄激素受体介导的机制减少肾缺血诱导的一氧化氮合酶、磷酸化蛋白激酶(protein kinase B,Akt)激活和缺血后ERK/JNK磷酸化比率的上升引起的炎症反应而增加肾脏缺血损伤。所以,肾缺血再灌注损伤性别差异的具体机制仍有待于进一步阐明。
miRNA的研究已经成为近年来生命科学领域中的一个重要方向,miRNA广泛存在于动物、植物、病毒等多种有机体中[13-14]。miRNA参与维持机体多种器官功能、细胞分化、增殖以及免疫系统的发展[15-16]。为进一步研究肾缺血再灌注损伤性别差异的机制,笔者前期研究从miRNA着手,对不同性别的小鼠肾组织中miRNA表达谱进行对比研究,在阈值为1.5时,发现miR-21和miR-664在各组肾脏组织中的表达差异有统计学意义,其中雄性假手术组与雌性假手术组相比miR-21和miR-664表达相近,雄性IRI 45 min组与雄性假手术组相比上调约1.5倍和1.3倍,而雌性IRI 45 min组与雄性假手术组相比miR-21和miR-664表达倍数约2和2.2倍,进一步采用定量PCR验证结果跟基因芯片结果基本一致[7]。所以本实验将进一步着重研究miR-21和miR-664对肾缺血再灌注损伤的影响。
miR-21及miR-664在肾缺血再灌注损伤中如何发挥其作用机制呢?目前,文献资料表明miR-21是一个强大的抗凋亡因子[17-18],可以通过负向调控其靶基因PTEN和PDCD4。最近研究表明,miR-21在小鼠肾小管上皮细胞[17]和小鼠肾组织[19]中主要通过下调PDCD4表达而抑制细胞凋亡。PTEN主要是负向调控磷脂酰肌醇3-激酶PI3K/AKT信号通路抑制细胞凋亡[20]。SAYED等[21]研究发现,转基因小鼠心肌组织中miR-21过表达可以抑制缺血诱导的PTEN和Fas配体(FasL)上调以及Akt磷酸化,从而起到抑制细胞凋亡的作用。JIA等[22]应用anti-miR-21敲除小鼠肾脏中miR-21,发现缺血肾组织中PDCD4和PTEN表达明显下调,而使肾脏中肾小管细胞凋亡加重。随着PDCD4及PTEN的下调,程序性凋亡因子Caspase-3表达会明显降低,而另一方面Caspase-3处于凋亡有序级联反应的下游,是最重要的效应型Caspase,是Caspase家族中细胞凋亡的关键执行者,是细胞凋亡过程中的主要效应因子[23]。WANG等[24]研究表明,miR-664可以通过负向调控其靶基因MAPK从而调控葡萄糖的代谢,进一步研究发现MAPK基因通过调控ERK蛋白可进一步调控肾脏对缺血再灌注损伤的敏感性及耐受性,然而miR-664在肾缺血再灌注损伤中的作用的相关报道甚少。
在本研究中,笔者通过注射agomir分子诱导雄性BALB/c小鼠肾组织中缺血前过表达miR-21及miR-664。结果发现:与相应对照组比较,应用agomir-21或agomir-664后肾组织中miR-21或miR-664表达量升高,差异有统计学意义,表明agomir分子的作用是明确有效的。各组肾组织病理组织学评分表明,Ⅰ、Ⅱ、Ⅲ组肾组织基本正常,仅见部分肾小管上皮细胞水肿,Ⅳ组和Ⅵ组可见肾小管上皮细胞坏死、空泡变性以及细胞核浓缩、碎裂、核溶解,病理损伤范围在25%~75%;Ⅴ组肾小管上皮细胞坏死、崩解脱落以及细胞核浓缩、碎裂、核溶解,部分肾小管管腔扩张、管腔轮廓模糊,病理损伤范围>75%,进一步证明使用agomir-21及agomir-664能有效上调肾组织中miR-21、miR-664的表达,而且上调miR-21及miR-664后,小鼠肾对缺血再灌注损伤的耐受性明显提高。同时Ⅰ组PTEN、PDCD4和Ⅲ组MAPK的表达量与Ⅱ组比较,差异无统计学意义;Ⅳ组PTEN、PDCD4的表达量低于Ⅴ组,差异有统计学意义;Ⅵ组MAPK的表达量低于Ⅴ组,差异有统计学意义。Westren blot结果显示,Ⅳ组Pro-Caspase-3的表达量与Ⅴ组比较,差异无统计学意义,而cleaved Caspase-3 P17的表达量比较,差异有统计学意义;Ⅵ组cleaved ERK1/2 P42、P44的表达量与Ⅴ组比较,差异有统计学意义。由此笔者推断:①miR-21通过负向调控其靶基因PDCD4及PTEN,从而影响Caspase-3的表达,进一步影响肾缺血再灌注损伤的程度;②miR-664通过负向调控其靶基因MAPK,进一步调控凋亡蛋白ERK蛋白表达,进而影响肾缺血再灌注损伤的程度。
综上所述,miR-21及miR-664可能在肾缺血再灌注损伤过程中扮演着重要角色。可以通过调控miR-21或miR-664,从而逆向调控其靶基因和靶蛋白,进而改变肾脏对缺血再灌注损伤的敏感性,其有望为肾缺血再灌注损伤的防治提供新的靶标。
[1]PARK K M,KIM J I,AHN Y,et al.Testosterone is responsible for enhanced susceptibility of males to ischemic renal injury[J].J Biol Chem,2004,279(50):52282-52292.
[2]WEI Q,WANG M H,DONG Z,et al.Differential gender differences in ischemic and nephrotoxic acute renal failure[J].Am J Nephrol,2005,25(5):491-499.
[3]HU H,WANG G,BATTEUX F,et al.Gender differences in the susceptibilitytorenalischemia-reperfusioninjuryinBALB/c mice[J].Tohoku J Exp Med,2009,218(4):325-329.
[4]SHAN Z X,LIN Q X,FU Y H,et al.Upregulated expression of miR-1/miR-206inaratmodelofmyocardialinfarction[J]. Biochem Biophys Res Commun,2009,381(4):597-601.
[5]BONAUER A,CARMONA G,IWASAKI M,et al.MicroRNA-92a controls angiogenesis and functional recovery of ischemic tissues in mice[J].Science,2009,324(5935):1710-1713.
[6]YU C H,XU C F,LI Y M.Association of MicroRNA-223 expression with hepatic ischemia/reperfusion injury in mice[J].Dig Dis Sci,2009,54(11):2362-2366.
[7]唐伟伟,习小庆,胡红林,等.不同性别肾缺血再灌注损伤模型小鼠MicroRNA的表达谱[J].中国组织工程研究,2015,19(5):772-777.
[8]RABB H,MENDIOLA C C,DIETZ J,et al.Role of CD11a and CD11b in ischemic acute renal failure in rats[J].Am J Physiol, 1994,267(6 Pt 2):F1052-F1058.
[9]FEKETE A,VANNA Y A,VER A,et al.Sex differences in the alterations of Na(+),K(+)-ATPase following ischaemia-reperfusion injury in the rat kidney[J].J Physiol,2004,555(2):471-480.
[10]OGATA M,IWAMOTO T,TAZAWA N,et al.Anovelands electiveNa+/Ca2+exchangeinhibitor,SEA0400,improvesischemia/reperfusion-inducedrenalinjury[J].EurJPharmacol, 2003,478(2/3):187-198.
[11]WEI Q,WANG M H,DONG Z.Differential gender differences inischemicandnephrotoxicacuterenalfailure[J].AmJ Nephrol,2005,25(5):491-499.
[12]KANG K P,LEE J E,LEE A S,et al.Effect of gender differences on the regulation of renal ischemia-reperfusion-induced inflammation in mice[J].Mol Med Rep,2014,9(6):2061-2068.
[13]BARTEL B,BARTEL D P.MicroRNAs:at the root of plant development[J].Plant Physiol,2003,132(2):709-717.
[14]LIM L P,GLASNER M E,YEKTA S,et al.Vertebrate microRNA genes[J].Science,2003,299(5612):1540.
[15]SAIKUMAR J,HOFFMANN D,KIM T M,et al.Expression, circulation,and excretion profile of microRNA-21,-155,and -18a following acute kidney injury[J].Toxicol Sci,2012,129(2): 256-267.
[16]OHRLING K,EDLER D,HALLSTRM M,et al.Detection of thymidylatesynthase expression in lymph node metastases of colorectal cancercan improve the prognostic information[J].J Clin Oncol,2005,23(24):5628-5634.
[17]GODWIN J G,GE X,STEPHAN K,et al.Identification of a microRNA signature of renal ischemia reperfusion injury[J].Proc Natl Acad Sci USA,2010,107(32):14339-14344.
[18]CHENG Y,ZHU P,YANG J,et al.Ischaemic preconditioning-regulated miR-21 protects heart against ischaemia/reperfusion injury viaanti-apoptosis through its target PDCD4[J].Cardiovasc Res,2010,87(3):431-439.
[19]XU X,KRIEGEL A J,LIU Y,et al.Delayed ischemic preconditioningcontributestorenalprotectionbyupregulationof miR-21[J].Kidney Int,2012,82(11):1167-1175.
[20]ZHANG Q,XIAO X,LI M,et al.Acarbose reduces blood glucose by activating miR-10a-5p and miR-664 in diabeticrats[J].PLoS One,2013,8(11):DOI:10.1371/journal.pone. 0079697.
[21]SAYED D,HE M,HONG C,et al.MicroRNA-21 is a downstream effector of AKT that mediates its antiapoptotic effects viasuppression of Fas ligand[J].J Biol Chem,2010,285(26): 20281-20290.
[22]JIA P,TENG J,ZOU J,et al.miR-21 contributes to xenonconferred amelioration of renal ischemia-reperfusion injury in mice[J].Anesthesiology,2013,119(3):621-630.
[23]CRYNS V,YUAN J.Protease to die for[J].Genes Dev,1998, 12(11):1551-1570.
[24]WANG J F,ZHA Y F,LI H W,et al.Screening plasma miRNAs as biomarkers for renal ischemia-reperfusion injury in rats[J]. Med Sci Monit,2014,20:283-289.
(张蕾 编辑)
MicroRNA-21 and microRNA-664 relieve renal ischemia-reperfusion injury*
Hong-lin Hu,Xiao-qing Xi,Wei-wei Tang,Zhen-feng Ye, Ya-wei Huang,Shuang-quan Lin,Ming-feng Xiang
(Department of Urology,the Second Affiliated Hospital of Nanchang University, Nanchang,Jiangxi 330006,China)
ObjectiveTo explore the effect of microRNA-21 and microRNA-664 on renal ischemia-reperfusion injury(IRI).MethodsAgomir-21 and agomir-664 were used to pretreat BALB/c mice.The method of bilateral renal pedicle occlusion was adopted to establish the renal IRI model in mice.At the 24th h after renal IRI,the expressions of microRNA-21 and microRNA-664,and their target genes and proteins in the kidneys were detected by real-time fluorescent quantitative PCR and Western blot.The histopathological changes of the kidneys were observed.ResultsRenal damage was significantly reduced in mice pretreated with agomir-21 and agomir-664,characterized by reduced necrosis of renal tubular epithelial cells.Further study showed that the expressions of microRNA-21 and microRNA-664 and their target genesPTEN,PDCD4andMAPKwere decreased,the expressions of their target proteins Caspase-3 and ERK1/2 were suppressed.ConclusionsMicroRNA-21 and microRNA-664 can reduce renal ischemia-reperfusion injury through regulation of the expressions of their target genes and proteins.
renal ischemia-reperfusion injury;microRNA-21;microRNA-664
R-332
:A
10.3969/j.issn.1005-8982.2017.02.003
1005-8982(2017)02-0019-07
2016-08-18
江西省自然科学基金(No:20132BAB205009)
习小庆,E-mail:xixiaoqing500@sina.com

