二甲双胍联合化疗药物对人胃癌AGS细胞的作用*
吴诗文,张自森,刘 谦,王世超,司远方,赵胜男,夏兴洲#
1)郑州大学第五附属医院消化内科 郑州 450052 2)郑州大学第五附属医院肿瘤科 郑州 450052
二甲双胍联合化疗药物对人胃癌AGS细胞的作用*
吴诗文1),张自森2),刘 谦1),王世超1),司远方1),赵胜男1),夏兴洲1)#
1)郑州大学第五附属医院消化内科 郑州 450052 2)郑州大学第五附属医院肿瘤科 郑州 450052
#通信作者,男,1964年9月生,硕士,主任医师,研究方向:胃癌的临床基础研究,E-mail:Zhougxia@163.com
二甲双胍;胃癌;顺铂;阿霉素;紫杉醇
目的:探讨二甲双胍(Met)联合化疗药物对人胃癌AGS细胞的影响。方法:应用Met及其分别联合顺铂(DDP)、阿霉素(ADM)、紫杉醇(PTX)处理人胃癌AGS细胞,应用CCK-8、Transwell模型、流式细胞术检测细胞增殖、迁移能力、侵袭能力及细胞凋亡。结果:Met可呈时间-剂量依赖性抑制AGS细胞增殖(P均<0.001),IC50为10 mmol/L。10 mmol/L Met、2 mg/L的DDP、0.02 mg/L的ADM、0.02 mg/L的PTX单用均可降低AGS细胞的迁移、侵袭能力,促其凋亡(P均<0.05),Met可协同3种化疗药物促进AGS细胞凋亡(P<0.05)。结论:Met有望用于胃癌的辅助化疗。
近年来研究[1-4]发现二甲双胍(metformin,Met)能够抑制多种肿瘤细胞的生长,其抗肿瘤作用得到了广泛关注。胃癌是我国最常见的消化道恶性肿瘤之一,发病率及病死率均较高,目前氟尿嘧啶类、铂类联合蒽环类或紫杉醇类仍是胃癌化疗的基础用药。该研究观察了Met联合化疗药物顺铂(cisplatin,DDP)、阿霉素(doxorubicin,ADM)、紫杉醇(paclitaxel,PTX)对人胃癌AGS细胞增殖、迁移、侵袭及凋亡的影响,初步探讨Met联合化疗药物对人胃癌的治疗作用。
1 材料与方法
1.1 材料 人胃癌AGS细胞购自上海细胞库。Met购自Sigma公司,ADM购自辉瑞制药公司,DDP购自山东齐鲁制药公司,PTX购自FH科鼎有限公司,F-12K培养基购自吉诺生物医药公司,Met、DDP、ADM、PTX用F-12K培养基配成1 g/L的储存液,-20 ℃保存备用。胎牛血清(FBS)购自杭州四季青生物公司,胰酶购自碧云天公司,牛血清白蛋白(BSA)购自Solarbio公司,磷酸盐缓冲液(PBS)购自Hyclone公司。CCK-8试剂盒购自日本同仁公司,Transwell小室购自Coming Costor公司,Matrigel基质膜购自Corning公司,Annexin V-FITC/PI双染试剂盒、PI细胞周期检测试剂盒、流式细胞仪为BD公司产品。
1.2 实验分组 AGS细胞用含体积分数10% FBS、100 U/mL青霉素和100 mg/L链霉素的F-12K培养基于37 ℃、体积分数5% CO2培养箱中培养。Met单用组:选用不同浓度Met处理细胞;化疗药物单用组:分别应用DDP(2 mg/L)、ADM(0.02 mg/L)、PTX(0.02 mg/L)单独处理细胞;联合用药组:DDP、ADM、PTX分别与Met联合处理细胞。DDP、ADM、PTX对AGS细胞的IC50分别为2、0.02和0.02 mg/L。所有实验均重复3次。
1.3 观测指标
1.3.1 细胞增殖抑制率 取对数生长期的AGS细胞,调整细胞密度为1×104mL-1,200 μL/孔接种于96孔板,待细胞贴壁,按1.2 Met单用组处理细胞,Met浓度分别为0.0(空白对照)、5.0、10.0、12.5、15.0、17.5和20.0 mmol/L,每个浓度设6个复孔。培养24、48、72 h后,每孔加入20 μL CCK-8,37 ℃孵育2 h,用酶联免疫检测仪测450 nm处的吸光度(A)。增殖抑制率=(对照A-实验A)/对照A×100%。
1.3.2 细胞迁移能力 AGS细胞饥饿培养24 h后,用含1 g/L BSA的无血清培养基重悬计数,将200 μL浓度为1×105mL-1细胞悬液种植于Transwell小室(24孔板),分组处理细胞,下室加500 μL体积分数10%FBS的培养液。待细胞迁移20 h后,擦去上层细胞,体积分数40%甲醛固定20 min,1 g/L结晶紫染色15~20 min。倒置显微镜(×200)下随机取6~8个视野,计数穿膜细胞数,计算平均值。

1.3.4 细胞凋亡 细胞分组处理48 h后,用含20 g/L BSA的胰酶消化,2 000 r/min离心5 min,PBS洗涤细胞2次,用1×Binding Buffer液制成1×106mL-1的悬液,取500 μL,加入5 μL AnnexinV-FITC室温避光孵育15 min,加入5 μL PI室温避光孵育15 min,上流式细胞仪检测,结果用Novo Express软件分析。
1.4 统计学处理 应用SPSS 21.0进行统计学分析。Met对AGS细胞增殖抑制率的影响、Met单用及与化疗药物联用对AGS细胞迁移能力、侵袭能力、凋亡影响的比较采用析因设计的方差分析,检验水准α=0.05。
2 结果
2.1 Met对AGS细胞增殖的影响 Met对AGS细胞的增殖有抑制作用,且呈时间和剂量依赖性(表1)。Met作用72 h对AGS细胞增殖抑制的IC50为10 mmol/L,故后续实验均在此浓度进行。
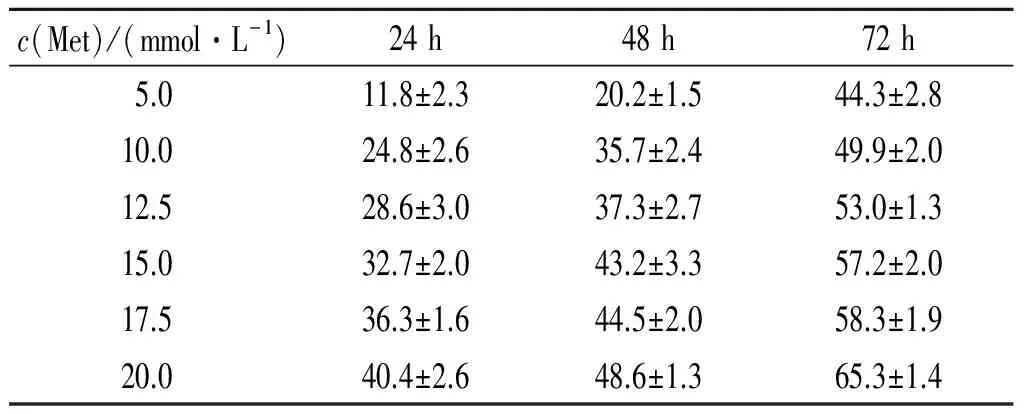
表1 Met对AGS细胞的增殖抑制率测定结果(n=3) %
F剂量=517.930,F时间=488.541,F交互=15.930,P均<0.001。
2.2 Met单独和联合化疗药物对AGS细胞迁移能力的影响 Transwell迁移实验结果见图1、表2。由表2可以看出,Met、DDP、ADM、PTX单独应用均可降低AGS细胞的迁移能力,但Met与化疗药物联用对AGS细胞迁移能力的影响并无协同作用。
2.3 Met单独及联合化疗药物对AGS细胞侵袭能力的影响 Transwell侵袭实验结果见图2、表3。从表3可以看出,Met、DDP、ADM、PTX单独应用均可降低AGS细胞的侵袭能力,但Met与化疗药物联用对AGS细胞侵袭能力的影响并无协同作用。
2.4 Met单独及联合化疗药物对AGS细胞凋亡的影响 凋亡结果见图3、表4。从表4可以看出,Met、DDP、ADM、PTX单独应用均可增加AGS细胞的总凋亡细胞比例,且Met与DDP、ADM、PTX联用时均存在协同效应。

A:空白对照组;B、C、D、E:分别为DDP、ADM、PTX、Met单用组;F、G、H:分别为Met与DDP、ADM、PTX联合用药组。图1 Met单独及联合化疗药物对AGS细胞迁移能力的影响(结晶紫染色,×200)
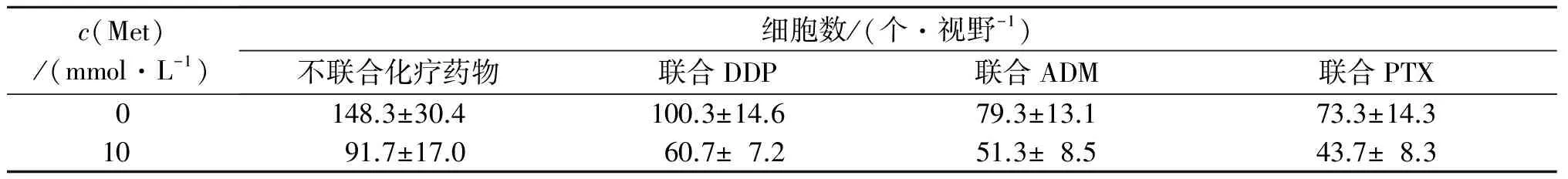
c(Met)/(mmol·L-1)细胞数/(个·视野-1)不联合化疗药物联合DDP联合ADM联合PTX0148.3±30.4100.3±14.679.3±13.173.3±14.31091.7±17.060.7±7.251.3±8.543.7±8.3
DDP:FMet=18.845,P=0.002,FDDP=12.674,P=0.007,F交互=0.587,P=0.466;ADM:FMet=14.797,P=0.005,FADM=24.675,P=0.001,F交互=1.696,P=0.229;PTX:FMet=15.064,P=0.005,FPTX=30.577,P=0.001,F交互=1.473,P=0.259。
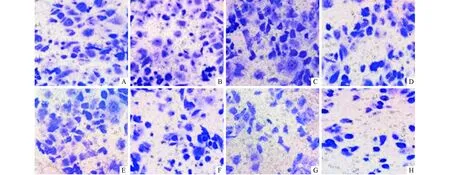
A:空白对照组;B、C、D、E:分别为DDP、ADM、PTX、Met单用组;F、G、H:分别为Met与DDP、ADM、PTX联合用药组。图2 Met单独及联合化疗药物对AGS细胞侵袭能力的影响(结晶紫染色,×200)

c(Met)/(mmol·L-1)细胞数/(个·视野-1)不联合化疗药物联合DDP联合ADM联合PTX0105.7±11.070.0±7.067.0±9.556.0±8.91062.0±6.642.7±4.040.7±6.732.3±5.0
DDP:FMet=65.848、FDDP=39.514,P均<0.001,F交互=3.485,P=0.099;ADM:FMet=49.055、FADM=36.040,P均<0.001,F交互=3.008,P=0.121;PTX:FMet=50.625、FPTX=70.278,P均<0.001,F交互=4.467,P=0.068。

上图从左至右:空白对照组,DDP、ADM、PTX单用组;下图从左至右:Met单用组,Met与DDP、ADM、PTX联合用药组。图3 流式细胞术检测Met单独及联合化疗药物对AGS细胞凋亡的影响

c(Met)/(mmol·L-1)总凋亡细胞比例/%不联合联合DDP联合ADM联合PTX04.4±1.336.3±3.023.1±2.232.7±2.61030.3±3.748.0±2.041.6±1.748.4±2.0
DDP:FMet=151.170、FDDP=261.409,P均<0.001,F交互=21.212,P=0.002;ADM:FMet=260.774、FADM=118.152,P均<0.001,F交互=7.017,P=0.029;PTX:FMet=202.444、FPTX=251.014,P均<0.001,F交互=12.119,P=0.008。
3 讨论
Met作为一种2型糖尿病治疗的一线和基础用药,具有稳定的疗效及良好的安全性[5-6]。Met是一种腺苷酸活化蛋白激酶激动剂,可调节AMPK信号通路[7]。大量研究[8-11]发现Met能降低癌症发生的风险,抑制肿瘤细胞的生长,但在不同类型的肿瘤细胞中分子机制可能不同。胃癌是我国常见的恶性肿瘤,化疗仍是胃癌的重要治疗手段。临床上抗肿瘤治疗中为了达到理想的效果,不得不加大化疗药物的用量,然而在加大药量的同时必然会加重化疗药物的毒副作用。该研究发现Met可以有效抑制AGS细胞的增殖,抑制其迁移、侵袭能力,促进其凋亡;Met还可协同DDP、ADM、PTX促进AGS细胞的凋亡。Met仅在促凋亡作用中呈现出与化疗药物的协同效应,可能是因为Met与DDP、ADM、PTX存在相同的促凋亡机制,同时也提示Met即使对同一类型胃癌细胞的作用机制也不尽相同,对AGS细胞迁移和侵袭的影响与促进凋亡的分子机制不同,而这些机制可能与Met复杂的作用特性有关[12-15]。
然而尽管在该实验中Met显示了良好的抗癌效力,甚至与3种化疗药物都存在一定程度的协同作用,但亦有研究[16]显示在某些癌细胞中Met并不能提高化疗药物的抗癌效力。国内研究[17-18]也发现Met联合5-FU对AGS细胞的抑制作用呈协同效应,但在MNK-45细胞系中却无此作用,甚至有报道[19]显示Met与DDP存在拮抗作用,Uehara等[20]还发现Met与DDP联用时在缺氧与含氧量正常两种情况下作用效果不同。这也进一步说明Met与化疗药物联用的机制十分复杂,可能与化疗药物的种类、肿瘤细胞的类型都有关系,有待进一步研究。
综上所述,Met联合化疗药物可以协同发挥促AGS细胞凋亡的作用,但其作用机制尚不十分明确;Met有望成为一种新型的胃癌辅助化疗药物。
[1]ALIMOVA IN,LIU B,FAN Z,et al.Metformin inhibits breast cancer cell growth, colony formation and induces cell cycle arrest in vitro[J].Cell Cycle,2009,8(6):909
[2]CHEN HP,SHIEH JJ,CHANG CC,et al.Metformin decreases hepatocellular carcinoma risk in a dose-dependent manner: population-based and in vitro studies[J].Gut,2013,62(4):606
[3]朱智峰,梁琳琅.二甲双胍对结肠癌细胞增殖、周期及凋亡的影响[J].中国医科大学学报,2012,41(2):115
[4]王涛,王峰,何炜,等.二甲双胍对人食管癌 KYSE450 细胞系增殖和凋亡的影响[J].郑州大学学报(医学版),2015,50(3):305
[5]American Diabetes Association.Standards of medical care in diabetes:2014[J].Diabetes Care,2014,37(Suppl 1):s14
[6]SENIOR A.Type 2 diabetes, metformin and lactic acidosis-defining the risk and promoting safe practice[J].Diabet Med,2012,29(2):161
[7]田园如画,周中和,陈会生.腺苷酸活化蛋白激酶在缺血预处理诱导的神经保护中的作用[J].解放军医学杂志,2015,40(5):366
[8]BEN SAHRA I,LAURENT K,GIULIANO S,et al.Targeting cancer cell metabolism: the combination of metformin and 2-deoxyglucose induces p53-dependent apoptosis in prostate cancer cells[J].Cancer Res,2010,70(6):2465
[9]李长岭,蔺迪,邢思宁,等.二甲双胍对巨核细胞白血病细胞株Dami细胞增殖的抑制作用及其机制[J].吉林大学学报(医学版),2015,40(3):534
[10]ZAKIKHANI M,DOWLING R,FANTUS G,et al.Metformin is an AMP kinase-dependent growth inhibitor for breast cancer cells[J].Cancer Res,2006,66(21):10269
[11]KATO K,GONG J,IWAMA H,et al.The antidiabetic drug metformin inhibits gastric cancer cell proliferation in vitro and in vivo[J].Mol Cancer Ther,2012,11(3):549
[12]HADAD SM,HARDIE DG,APPLEYARD V,et al.Effects of metformin on breast cancer cell proliferation,the AMPK pathway and the cell cycle[J].Clin Transl Oncol,2014,16(8):746
[13]YASMEEN A,BEAUCHAMP C,PIURA E,et al.Induction of apoptosis by metformin in epithelial ovarian cancer: involvement of the Bcl-2 family proteins[J].Gynecol Oncol,2011,121(3):492
[14]CHENG GJ,LANZA-JACOGY S.Metformin decreases growth of pancreatic cancer cells by decreasing reactive oxygen species:role of NOX4[J].Biochem Bioph Res Commun,2015,465(1):41
[15]MALKI A,YOUSSEF A.Antidiabetic drug metformin induces apoptosis in human MCF breast cancer via targeting ERK signaling[J].Oncol Res,2011,19(6):275
[16]MATSUZAKI T,YASHIRO M,KAIZAKI R,et al.Synergistic antiproliferative effect of mTOR inhibitors in combination with 5-fluorouracil in scirrhous gastric cancer[J].Cancer Sci,2009,100(12):2402
[17]薛知新,钟捷,赵丹瑜,等.二甲双胍对 AGS 胃癌细胞生长侵袭的抑制作用[J].世界华人消化杂志,2010,18(19):1974
[18]薛知新,赵丹瑜,许慈,等.二甲双胍对人胃癌细胞株 MKN45 增殖和迁徙的影响[J].胃肠病学,2010,15(5):280
[19]LESAN V,GHAFFARI SH,SAKARAMOLI J,et al.Evaluation of antagonistic effects of metformin with cisplatin in gastric cancer cells.[J].Int J Hematol Oncol Stem Cell Res,2014,8(3):12
[20]UEHARA T,MITSUHASHI A,TSURUOKA N,et al.Metform in potentiates the anticancer effects of cisplatin under normoxic conditions in vitro[J].Oncol Rep,2015,33(2):744
(2016-06-04收稿 责任编辑王 曼)
Effect of metformin combined with chemotherapeutic agents on gastric cancer cell line AGS
WUShiwen1),ZHANGZisen2),LIUQian1),WANGShichao1),SIYuanfang1),ZHAOShengnan1),XIAXingzhou1)
1)DepartmentofGastroenterology,theFifthAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052 2)DepartmentofOncology,theFifthAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052
metformin;gastric cancer;cisplatin;doxorubicin;paclitaxel
Aim: To investigate the effect of metformin(Met) combined with chemotherapeutic agents on human gastric cancer cell line AGS. Methods: AGS cells were treated with Met alone or in combination of cisplatin(DDP), doxorubicin(ADM) or paclitaxel(PTX).CCK-8, Transwell, and flow cytometry were used to detect cell proliferation, migration, invasion and apoptosis. Results: Met could inhibit cell proliferation in a dose- and time-dependent manner(P<0.001), andIC50was 10 mmol/L. 10 mmol/L Met,2 mg/L DDP,0.02 mg/L ADM,0.02 mg/L PTX separate application could decrease the migration, invasion capabilities and prompt apoptosis of AGS cells(P<0.05), and Met had synergistic effected when being used with DDP, ADM or PTX in cell apoptosis(P<0.05). Conclusion: Met might be used for adjuvant chemotherapy for gastric cancer.
10.13705/j.issn.1671-6825.2017.01.010
*河南省医学科技攻关计划项目 201403126
R735.2

